Se presenta el caso de un varón de 30 años con fiebre, cefalea y malestar general que, como dato de interés, había regresado recientemente de África. En la actualidad, cada vez son más frecuentes los viajes al extranjero y la aparición al regreso de enfermedades menos habituales en nuestro medio. Por esta razón, realizamos a continuación una breve revisión de los posibles diagnósticos diferenciales del síndrome febril sin foco en viajeros, así como del manejo de la patología que presentó nuestro paciente (síndrome de Katayama).
We report the case of a 30-year-old man with fever, headache and general malaise who, as an antecedent of interest, had recently returned from Africa. Nowadays, travelling abroad and the development of illnesses uncommon in our society upon the traveller's return are increasingly frequent. We provide a brief review of the differential diagnosis of fever without source in travellers and the treatment of our patient's disease (Katayama syndrome).
Sukarra, buruko mina eta egonezina duen 30 urteko gizon baten kasua aurkeztuko dugu. Datu aipagarri moduan, Afrikatik egindako bidaiatik itzuli da orain dela gutxi. Gaur egun, gero eta bidaia gehiago egiten dugu atzerrira, eta, itzultzean, gure gizartean ohizkoak ez diren gaixotasunen maiztasuna igotzen ari da. Horregatik, jarraian bidaiarien foku gabeko sukarraren diagnostiko diferentzialei eta gure pazienteak behar izan zuen tratamenduari buruzko berrikusketa egingo dugu (Katayama sindromea).
Los viajes, ya sea por turismo, cooperación o negocios, junto con la inmigración y el desplazamiento de los inmigrantes a sus países de origen para visitar a sus familiares, han contribuido a un aumento significativo del riesgo de presentar enfermedades importadas. A continuación, se presenta una muestra de ello.
Observación clínicaVarón de 30 años, fumador de 10 cigarrillos al día, sin hábitos tóxicos, sin alergias conocidas ni hábitos sexuales de riesgo u otros antecedentes patológicos de interés; acudió por fiebre de 39,5 °C de 3 días de evolución, junto con cefalea y malestar general. Al realizarle la historia clínica refirió que 3 días antes había regresado de un viaje por África (Senegal, Burkina Faso, Mali, Ghana y Costa de Marfil) de un mes de duración. Como dato de interés, recordaba que 15 días antes de acudir al servicio de urgencias presentó prurito y rash cutáneo tras un baño en agua dulce en Mali. La anamnesis subjetiva por aparatos tras un interrogatorio minucioso no registró otros datos de interés.
La exploración física objetivó una presión arterial de 130/60 mmHg, frecuencia cardíaca de 70 latidos/min y temperatura de 37,3 °C. El paciente se encontraba consciente y orientado, bien nutrido e hidratado, normocoloreado, eupneico, sin edemas, lesiones cutáneas ni adenopatías generalizadas, con exploración de cabeza y cuello normal, auscultación cardíaca rítmica, sin soplos y auscultación pulmonar normal; en el abdomen destacaba una hepatomegalia de 2 cm sin esplenomegalia y en las extremidades no se observaron alteraciones.
Inicialmente, la hematimetría, el recuento y la fórmula, el estudio de coagulación, la función renal, los electrolitos, la función hepática y el sedimento urinario fueron normales, incluida la serología negativa para Plasmodium. Las radiografías de tórax y abdomen no presentaron hallazgos relevantes. En la ecografía abdominopélvica se apreció un hígado discretamente aumentado de tamaño, con aumento de la ecogenicidad rodeando los espacios porta y un bazo con diámetro longitudinal máximo de 15 cm; el resto de las eran estructuras normales.
En cuanto a la evolución, al cuarto día de ingreso hospitalario el paciente continuaba con mal estado general, picos febriles superiores a 38 °C y alteración de los siguientes parámetros analíticos: hiperbilirrubinemia directa 2,7 mg/dl, GPT 437 U/l, LDH 684 U/l, eosinofilia 500 mm3 (8,5 %); el resto de la analítica era normal, incluida la negatividad de una nueva serología frente a Plasmodium, además de las serología frente los virus de las hepatitis A y C, virus de la inmunodeficiencia humana, virus de Epstein-Barr, citomegalovirus, lúes, Schistosoma y Rickettsias, mantoux, hemocultivos, urocultivos, coprocultivos y estudio de parásitos en heces. Nos encontramos pues ante un síndrome febril sin foco en un viajero, con un diagnóstico diferencial amplio que incluye enfermedades que pueden ser graves e incluso mortales, si no se diagnostican y se tratan a tiempo. Tras el tratamiento con praziquantel el paciente evolucionó satisfactoriamente y presentó seroconversión a las 6 semanas, con técnica de ELISA positiva para Schistosoma.
DiscusiónLa mayoría de los pacientes (60-70 %) en situaciones similares presentarán alguna enfermedad dentro del mes de regreso del viaje y un 5-15 % necesitará ingreso hospitalario. Entre el 25-30 % presentará un proceso febril, un 10-15 % patología respiratoria y otro 10-15 %, diarreas. En África subsahariana los síndromes febriles se producen por paludismo en un 60 % de los casos, en Asia se deben al dengue (32 %), seguido de la malaria (13 %), y en Latinoamérica el dengue y la malaria representan, cada uno de ellos, el 13 %1.
Por tanto, para realizar una correcta aproximación diagnóstica es necesario tener en cuenta los siguientes aspectos:
- 1.
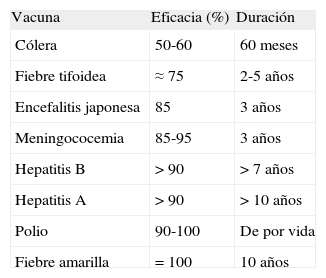
Valorar las medidas preventivas, incluidas las diferentes vacunas (tabla 1) y profilaxis palúdica ya que, hasta que no se demuestre lo contrario, un paciente con fiebre procedente de una zona de riesgo tiene una infección por Plasmodium.
- 2.
Realizar una exhaustiva cronología del viaje, incluidos los países visitados, el motivo del mismo (turismo en hoteles modernos en grandes ciudades o mochileros en zonas rurales con alojamientos de peor calidad) y las actividades de riesgo realizadas (senderismo, caza, ex-posición a agua dulce, tipo y preparación de los alimentos).
- 3.
Existencia de enfermedades más prevalentes en épocas húmedas, como la malaria y el dengue, y otras en época seca, como la meningococemia en África. Aunque muchas enfermedades poseen una distribución mundial, otras como la malaria y la tripanosomiasis africana son endémicas de ciertos lugares.
- 4.
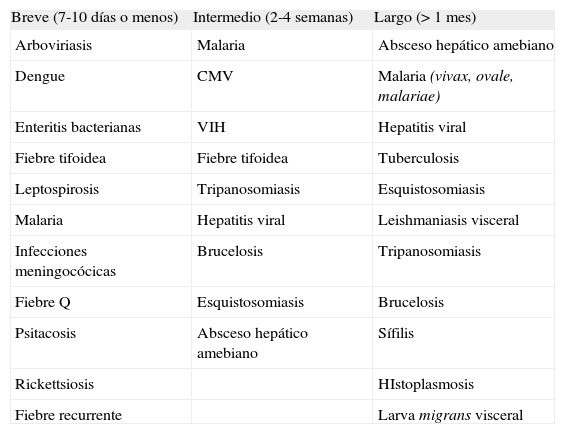
El período de incubación resulta clave a la hora de limitar el diagnóstico diferencial (tabla 2), ya que en no pocas ocasiones la sintomatología puede aparecer en varios cuadros2 y las pruebas diagnósticas no ser útiles.
Eficacia y duración de algunas vacunas del viajero2
| Vacuna | Eficacia (%) | Duración |
| Cólera | 50-60 | 60 meses |
| Fiebre tifoidea | ≈ 75 | 2-5 años |
| Encefalitis japonesa | 85 | 3 años |
| Meningococemia | 85-95 | 3 años |
| Hepatitis B | > 90 | > 7 años |
| Hepatitis A | > 90 | > 10 años |
| Polio | 90-100 | De por vida |
| Fiebre amarilla | = 100 | 10 años |
Períodos de incubación de algunos patógenos2
| Breve (7-10 días o menos) | Intermedio (2-4 semanas) | Largo (> 1 mes) |
| Arboviriasis | Malaria | Absceso hepático amebiano |
| Dengue | CMV | Malaria (vivax, ovale, malariae) |
| Enteritis bacterianas | VIH | Hepatitis viral |
| Fiebre tifoidea | Fiebre tifoidea | Tuberculosis |
| Leptospirosis | Tripanosomiasis | Esquistosomiasis |
| Malaria | Hepatitis viral | Leishmaniasis visceral |
| Infecciones meningocócicas | Brucelosis | Tripanosomiasis |
| Fiebre Q | Esquistosomiasis | Brucelosis |
| Psitacosis | Absceso hepático amebiano | Sífilis |
| Rickettsiosis | HIstoplasmosis | |
| Fiebre recurrente | Larva migrans visceral |
CMV: citomegalovirus; VIH: virus de la inmunodeficiencia humana.
En este paciente, dado el cuadro clínico, los datos epidemiológicos previos y los parámetros analíticos, la sospecha clínica es de síndrome de Katayama (esquistosomiasis aguda), a pesar de los resultados iniciales negativos de la serología y de la investigación de parásitos, como sucedió en este caso. El síndrome de Katayama consiste en un cuadro agudo de fiebre autolimitada, astenia, tos irritativa, hepatomegalia y eosinofilia. La infección se adquiere en contacto con agua dulce. La detección de parásitos en heces y orina, y la positivización de la serología pueden tardar meses3–6. El tratamiento con praziquantel 40 mg/kg a dosis única o 20 mg/kg en 2 ciclos es satisfactorio5–7.
Existen diferencias en la forma de presentación clínica de la esquistosomiasis entre personas no inmunes (en su mayoría viajeros) respecto a poblaciones de zonas endémicas. Así, se observan pocos casos en Brasil, Kenia y Egipto6, ya que los viajes organizados en circuitos turísticos suelen evitar las zonas contaminadas; la frecuencia aumenta en países como Mali, donde no se toman medidas preventivas suficientes y los turistas realizan senderismo vadeando ríos o se bañan en zonas de agua dulce. La presentación aguda se observa fundamentalmente en viajeros, así como las presentaciones ectópicas (piel y genitales)6; en cambio, las presentaciones típicas como la hematuria o la diarrea, que traducen afectación crónica, aparecen en pacientes autóctonos8–11. Las determinaciones serológicas y la respuesta a praziquantel resultan de mayor utilidad en los viajeros4–5.
Para finalizar, conviene destacar que, al evaluar un síndrome febril sin foco tras un viaje a países exóticos, inicialmente los procesos leves pueden ser indistinguibles de los graves. Por ello, es necesario integrar los datos de la anamnesis y exploración física con el período de incubación de los distintos procesos para alcanzar un correcto diagnóstico.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interese en relación con este artículo.
AgradecimientosA la Dra. Zuriñe Zubero, del Servicio de Enfermedades Infecciosas del Hospital de Basurto, por sus conocimientos y disponibilidad.