El radio de incidencia del cáncer de endometrio (CE) es de 0 a 25 casos por 100 000 mujeres, pero este porcentaje varía dependiendo de la distribución geográfica. La mediana de edad de las pacientes en el momento del diagnóstico es de 63 años, sin embargo, el 25% son posmenopáusicas y el 5%, menores de 40 años. Aproximadamente 50% de las pacientes con CE tienen factores de riesgo específicos, tales como excesiva estimulación estrogénica u obesidad. Estas pacientes en forma típica, desarrollan cáncer de endometrio a partir de una hiperplasia endometrial. Dos diferentes abordajes pueden usarse para diagnosticar las lesiones precancerosas endometriales. La clasificación de la Organización Mundial de la Salud, combina la complejidad glandular con la atipia citológica. Sin embargo, recientemente se ha propuesto un sistema denominado Neoplasia Endometrial Intraepitelial como un método alternativo, éste se basa en las características moleculares (PTEN) y morfométricas de la proliferación endometrial. Es necesario definir el papel de otros biomarcadores específicos para determinar en forma más precisa, el riesgo real de las lesiones preneoplásicas.
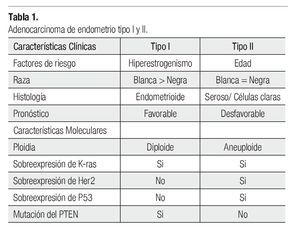
El CE se ha dividido en dos principales categorías clínico-patológicas. El carcinoma endometrioide (tipo I), que ocurre en mujeres pre o perimenopaúsicas y se asocia con hiperestrogenismo, esta neoplasia está precedida por lesiones endometriales precancerosas. De manera contraria, los carcinomas no endometrioides (tipo II) ocurren en mujeres mayores y en un contexto de atrofia.
The incidence ratio of endometrial cancer (EC) is between 10 and 25 cases per 100 000 women, but this percentage varies depending on geographic distribution. The median age of patients at time of diagnosis is 63 years; however, 25% are postmenopausal and 5% are younger than 40 years. Approximately 50% of patients with endometrial carcinoma have specific risk factors, such as extensive estrogenic stimulation or obesity. These patients typically develop endometrial endometrioid carcinoma from endometrial hyperplasia. The World Health Organization (WHO) classification is based on the classic criteria combining glandular complexity and cytologic atypia. However, recently, the Endometrial Intraepithelial Neoplasia approach has been proposed as an alternative system, it is based on molecular (PTEN) and morphometric characteristics. It is necessary to assess the possible role of other specific biomarkers to better define the real preneoplastic risk for each type of lesion.
EC have been divided into two main clinicopathologic categories. EC type I occur in pre or perimenopausal women and it is associated with unopposed estrogen exposure. They are tipically preceded by precancerous endometrial lesions. In contrast, nonendometrioid carcinomas (type II) occur in older women in a background of atrophic endometrium.
EPIDEMIOLOGÍA Y FACTORES DE RIESGO
Existen dos grandes categorías de cáncer endometrial (CE), los carcinomas tipo I o endometrioides, que se asocian con niveles elevados de estrógenos y los tipo II, (serosos o de células claras), que por lo general no se relacionan con eventos hormonales.
Los carcinomas tipo I por lo general ocurren en mujeres más jóvenes y son menos agresivos, la diabetes, la hipertensión arterial, alguna vez considerados como factores de riesgo para el desarrollo de CE, ahora se considera que son factores derivados de la obesidad, y por lo tanto, no son factores de riesgo independientes. La obesidad y una historia familiar, permanecen como dos de los factores de riesgo más importantes.
Las alteraciones moleculares asociadas con el CE se estratifican entre los carcinomas tipo I y II. Los tipo I con frecuencia se asocian con mutaciones del PTEN, KRAS y PIK3CA, ello varía con la raza, sin embargo, los carcinomas tipo II se asocian con mutaciones en el TP53.
Las pacientes que pertenecen a familias con el síndrome autosómico dominante de cáncer colorrectal sin poliposis, tienen un riesgo de padecer CE del 40% al 60%.
El tamoxifeno es un medicamento clave en el tratamiento y prevención del cáncer de mama, puede aumentar el riesgo de CE, ya que tiene propiedades agonistas en el útero y antagonistas en la mama. Sin embargo, es importante señalar que los beneficios de la paciente con el tamoxifen de reducir el riesgo de recurrencia del cáncer de mama o de una nueva neoplasia contralateral, sobrepasa el riesgo que esta droga confiere para desarrollar CE.
LESIONES PRECURSORASN DE CE4-9
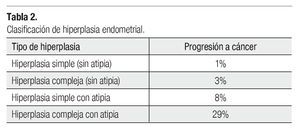
La clasificación actualmente aceptada para las hiperplasias endometriales tanto por la Sociedad Internacional de Ginecopatólogos, como por la Organización Mundial de la Salud (OMS) se basa en el esquema de Kurman y colaboradores, el cual divide a las hiperplasias tomando en cuenta las características celulares, típicas o atípicas. Como resultado, tenemos una clasificación con cuatro categorías: hiperplasia simple (HS), hiperplasia compleja (HC), hiperplasia simple con atipia (HSA) e hiperplasia compleja con atipia (HCA). Cuando en un legrado uterino se encuentra HCA, la coexistencia con adeno-carcinoma en el espécimen de histerectomía puede ser hasta del 40%.
Resulta importante señalar que en la evaluación de las lesiones endometriales precursoras hay gran variabilidad intra e interobservador, por lo que nuevas formas de clasificación han sido propuestas, como la encabezada por Mutter y colaboradores, en la cual se propone el concepto de Neoplasia Endometrial Intraepitelial, que se define como una proliferación clonal de glándulas endometriales premalignas con alteración en su arquitectura y citología. Estas difieren del resto de glándulas endometriales, cuyo diámetro lineal excede 1 mm, de acuerdo con estos autores, esta lesión tiene una posibilidad del 27% de asociarse con CE, y se eleva 46 veces el riesgo de la paciente para desarrollar dicha enfermedad.
La otra clasificación propuesta es la del grupo europeo que propone tres categorías, hasta ahora corren varios estudios que tratan de validar cuál es el mejor método para evaluar las lesiones precursoras de CE, mientras tanto, como se mencionó en un inicio se debe seguir utilizando el propuesto por la OMS (Tablas 1 y 2).
ESTADIFICACIÓN DEL CE1,3,9,10
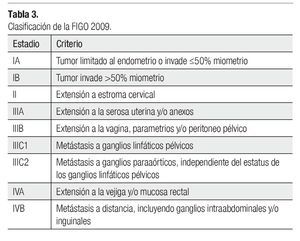
Los CE se estadifican quirúrgicamente mediante un sistema propuesto por la FIGO, el sistema TNM de la American Joint Comittee onCancer se correlaciona con el sistema FIGO, pero este último se utiliza con mayor frecuencia por los cirujanos.
El sistema FIGO se desarrolló en 1988 y se revisó por segunda vez en 2009, los cambios principales fueron:
* Los estadios IA y IB del sistema 1988, se convierten en estadio IA.
* Se descartan como criterios de afección a la mucosa cervical y la citología peritoneal.
* Se toma en cuenta la invasión parametrial y pélvica como nuevos criterios.
* El sistema 2009 subdivide el estadio IIC, de acuerdo si hay metástasis en ganglios pélvicos o paraaórticos (Tabla 3).
ADENOCARCINOMA DE ENDOMETRIO DE BAJO GRADO11,12
Afecta con mayor frecuencia a mujeres posmenopáusicas (mediana: 60 años), se asocia típicamente con hiperplasia endometrial preexistente o concomitante. Las mujeres premenopáusicas también pueden desarrollar CE, sin embargo, la mayoría de ellas tienen evidencia de estimulación estrogénica excesiva (obesidad, diabetes, síndrome de ovario poliquístico). La mayoría de las pacientes presentan hemorragia transvaginal. El diagnóstico se sospecha debido al aumento de tamaño del útero en el examen clínico o por engrosamiento del endometrio, descubierto por estudios de imagenología.
CARACTERÍSTICAS MACROSCÓPICAS
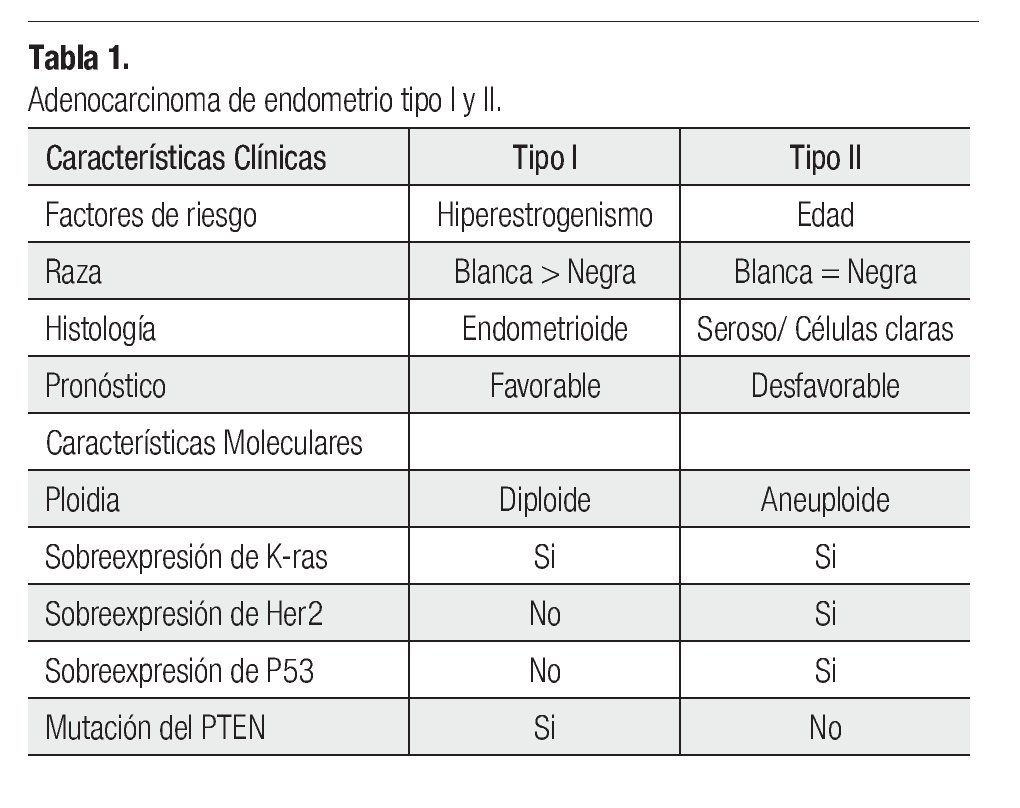
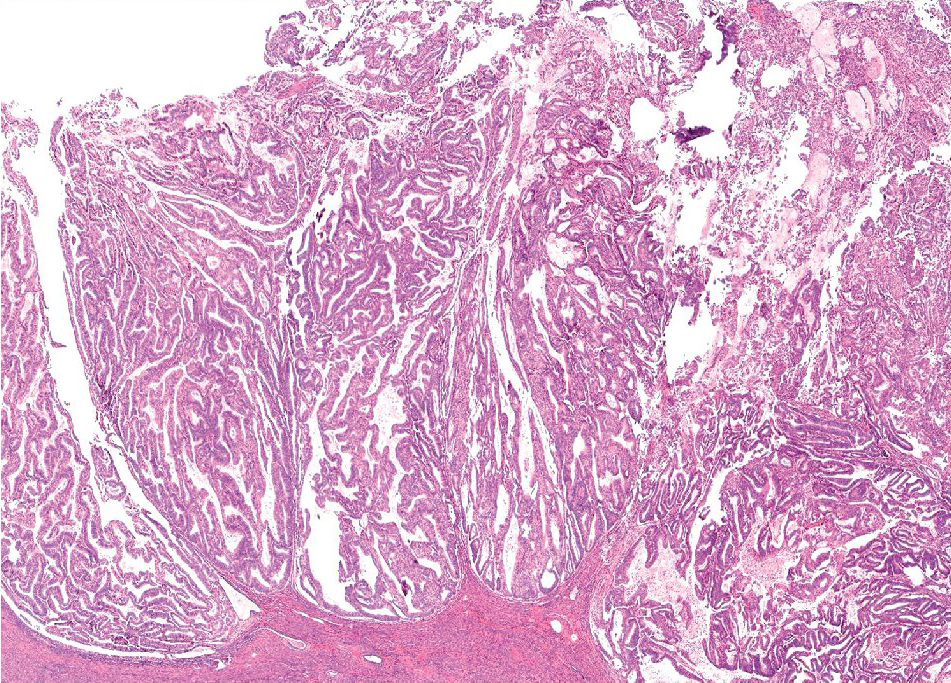
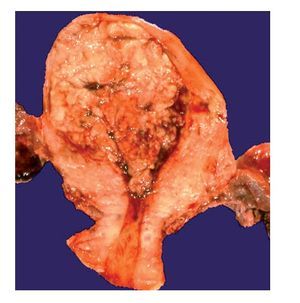
El útero está aumentado en tamaño y la cavidad uterina está distendida por la presencia del carcinoma. El revestimiento endometrial está engrosado y se observan proyecciones polipoides hacia la cavidad uterina (Figura 1), sólo en raras ocasiones el CE invade el miometrio sin tener un componente intracavitario
Figura 1. Útero, aspecto macroscópico de un adenocarcinoma endometriode con crecimiento polipoide.
CARACTERÍSTICAS MICROSCÓPICAS
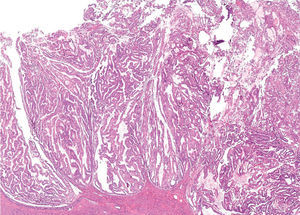
En el análisis del adenocarcinoma endometrial, el aspecto clínico más relevante es el evaluar la invasión al miometrio en el útero correspondiente. Sólo dos criterios histopatológicos adquieren relevancia en esta evaluación: la complejidad de la arquitectura papilar y la atipia citológica marcada. El aspecto de complejidad arquitectural que se observa en las proliferaciones glandulares de bajo grado (espectro hiperplasia-carcinoma), puede dividirse en tres grupos de riesgo, si se toma en cuenta tres patrones arquitecturales básicos:
1. Glándulas pequeñas "empaquetadas".
2. Macroglándulas (cinco veces o más el tamaño de una glándula normal).
3. Papilas exofíticas (Figura 2).
Figura 2. Adenocarcinoma endometrioide bien diferenciado, con patrón de crecimiento exofítico
(características microscópicas).
En los dos últimos patrones, su grado de complejidad predice la posibilidad de invasión a miometrio.
Criterio citológico. En algunos casos, la arquitectura glandular no es suficiente para llegar a un diagnóstico de CE, de manera que podemos apoyarnos en las características citológicas, el pleomorfismo nuclear marcado y un núcleo prominente identificados a bajo aumento, nos ayudarán en este dilema diagnóstico.
VARIANTES HISTOLÓGICAS
El adenocarcinoma de endometrio de bajo grado puede mostrar variantes histológicas, cada una de las cuales presentan sus propios problemas de diagnóstico diferencial. Dichas variantes son:
A. Carcinoma epidermoide.
B. Carcinoma villoglandular.
C. Carcinoma secretor.
D. Carcinoma ciliado.
E. Carcinoma microglandular.
F. Carcinoma sertoliforme.
G. Carcinoma fusocelular.
H. Carcinoma mucinoso.
GRADO HISTOLÓGICO (GH)
La evaluación del GH de acuerdo con el sistema FIGO de 1988, toma en cuenta de manera primaria el patrón arquitectural y en segundo término, la atipia citológica. La atipia citológica puede ser subjetiva, pero generalmente requiere de la presencia de marcado pleomorfismo nuclear y nucléolo prominente. El grado de atipia citológica aumenta el grado de la neoplasia.
A los carcinomas serosos y de células claras de endometrio no se les asigna grado histológico, ya que por definición son de alto grado.
CARCINOMAS ENDOMETRIALES DE ALTO GRADO13-19
Este grupo de neoplasias es heterogéneo y tiene una conducta clínica agresiva. Incluye carcinomas endometriales grado 3 de la FIGO, carcinoma seroso, carcinoma de células claras, carcinoma indiferenciado y el tumor mixto maligno mulleriano (carcinosarcoma). Las diferencias epidemiológicas, genéticas, biológicas y morfológicas pueden ser muy diferentes en los casos prototípicos, sin embargo, puede ocurrir una gran sobreposición entre dichas entidades, de igual forma sucede con su abordaje diagnóstico y terapéutico.
El adenocarcinoma endometrioide grado 3 de la FIGO presenta un patrón de crecimiento sólido, trabecular, en nidos que pueden asemejar un carcinoma epidermoide poco diferenciado, la diferenciación glandular es focal.
El carcinoma seroso muestra una morfología papilar, pero los patrones que predominan son el glandular y sólido, las células muestran atipia acentuada.
El carcinoma de células claras muestra patrón papilar o túbulo-quístico, con células cuboidales con núcleos atípicos pero uniformes. Las células con citoplasma claro se presenta con frecuencia, pero no siempre.
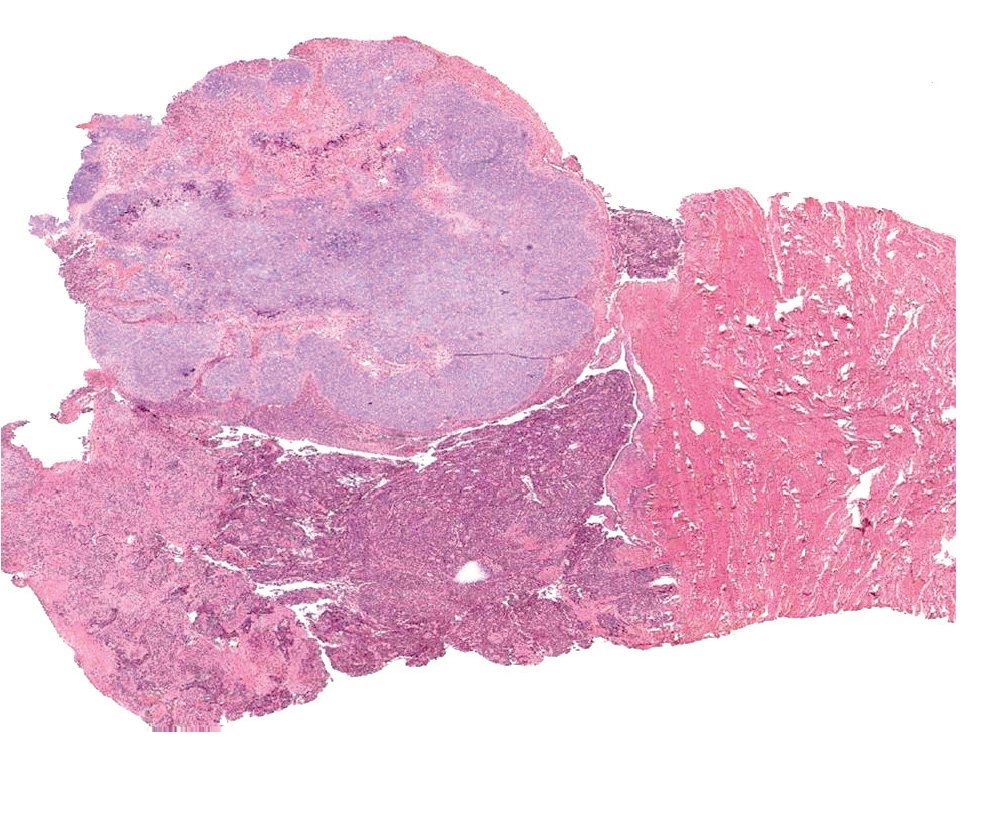
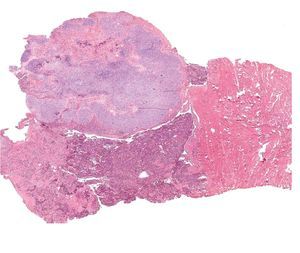
Los tumores malignos mixtos müllerianos o carcinosarcomas (Figura 3), éste último es el término propuesto por la OMS, aun cuando se conoce que estas neoplasias tienen más características en común con los carcinomas que con los sarcomas.
Figura 3. Carcinosarcoma uterino, con adenocarcinoma de alto grado y condrosarcoma (características microscópicas).
La mayoría de los TMMM son monoclonales y por lo general están compuestos por un carcinoma, a partir de los cuales se desarrolla un sarcoma. Ocurren casi en forma exclusiva en las mujeres posmenopáusicas, sólo raros casos se han reportado en mujeres menores de 40 años e incluso en niñas.
Los factores de riesgo son similares a aquellos que se presentan en mujeres con adenocarcinoma endometrial. Una historia de irradiación pélvica o tratamiento con tamoxifen se presenta en algunos casos.
El CA-125 se encuentra elevado en la mayoría de los casos. La diseminación extrauterina (estadio III/IV) se presenta en alrededor del 40% de los casos.
ASPECTO MACROSCÓPICO
Por lo general, se presentan como grandes masas polipoides que llenan la cavidad uterina y pueden protruir a través del cérvix.
En raras ocasiones, este tipo de neoplasias se originan en el cérvix, en un pólipo endometrial o en el contexto de un adenocarcinoma.
CARACTERÍSTICAS MICROSCÓPICAS
El componente de carcinoma se encuentra en íntimo contacto con el sarcomatoso, uno de los componentes puede predominar sobre el otro y puede ser el único que aparezca en un legrado.
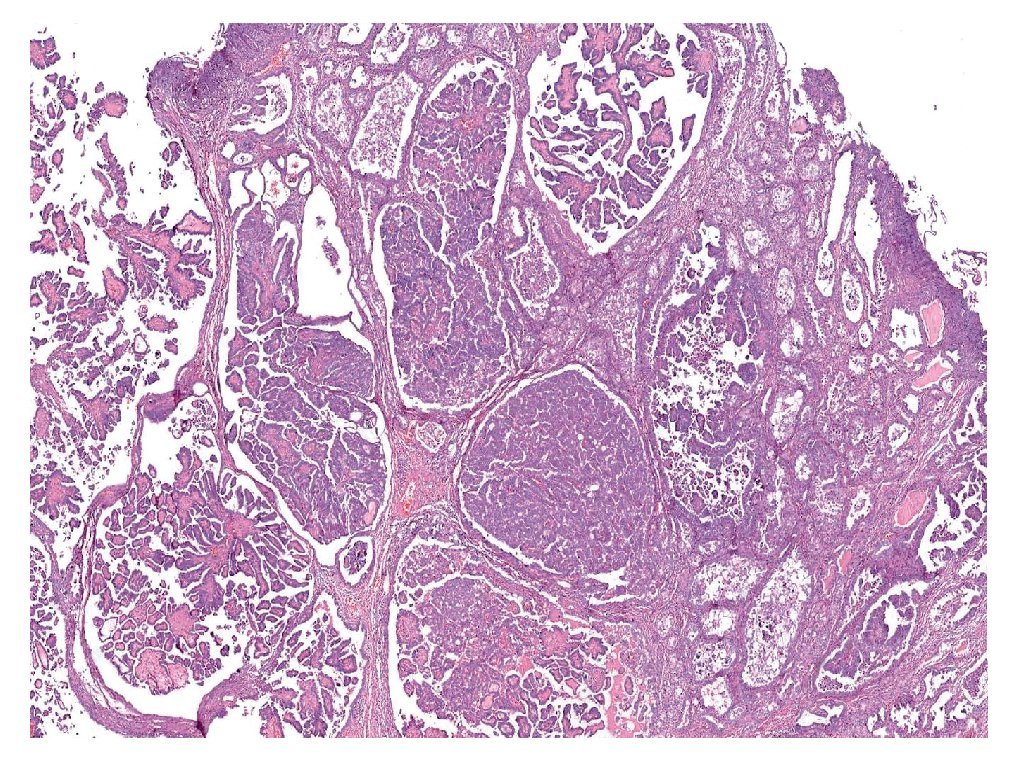
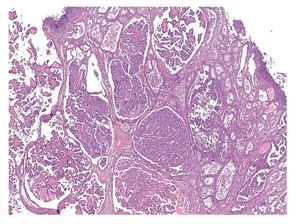
El componente de carcinoma es por lo general de alto grado, endometrioide, seroso (Figura 4) o no específico, con menor frecuencia muestra una diferenciación escamosa, de células claras o mucinosa, o bien es indiferenciado, rara vez de células pequeñas.
Figura 4. Carcinoma seroso de ovario, compuesto por numerosas papilas revestidas por células con núcleos de alto grado (características microscópicas).
Los TMMM del cérvix, por lo general muestran elementos carcinomatosos no glandulares, por lo general escamosos o bien, carcinoma adenoideo quístico.
El componente de sarcoma es de alto grado y puede ser homólogo o heterólogo. El componente homólogo es por lo general, un sarcoma de alto grado no específico y los componentes heterólogos se presentan en el 50% a 70% de los casos, en orden descendente de frecuencia: rabdomiosarcoma, condrosarcoma, osteosarcoma y liposarcoma.
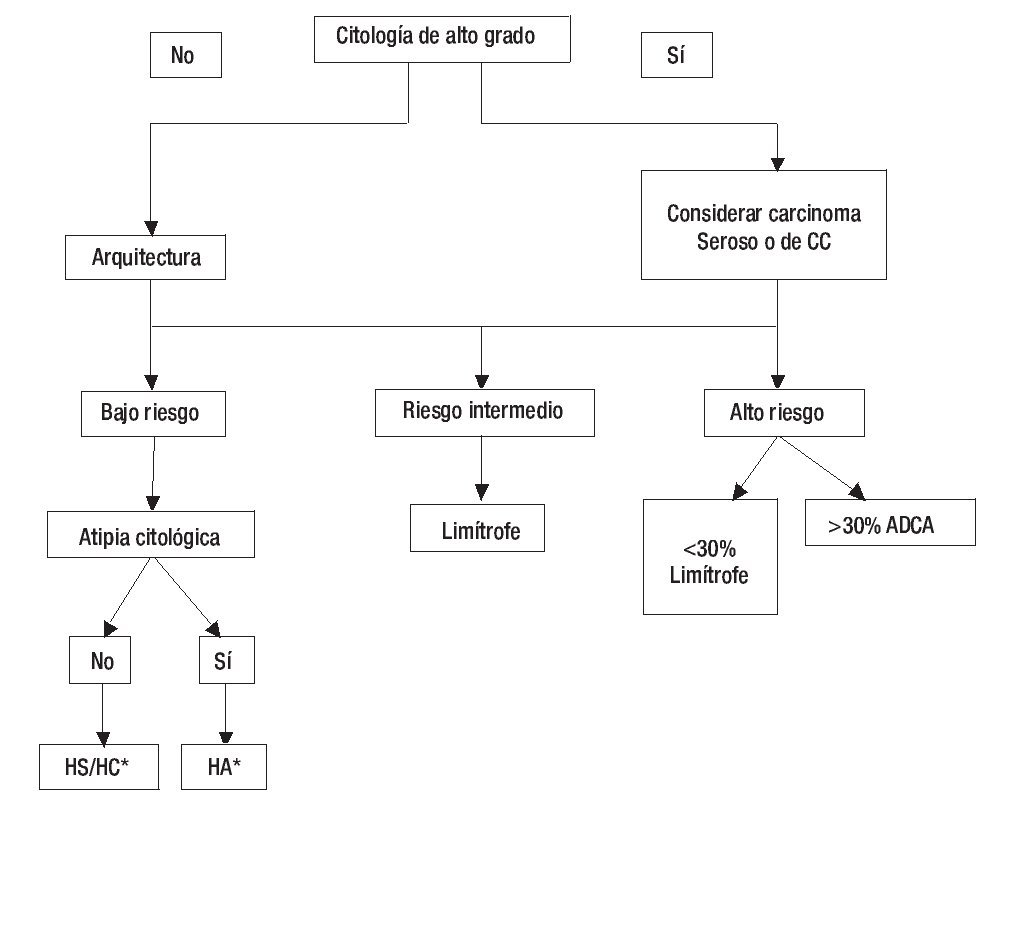
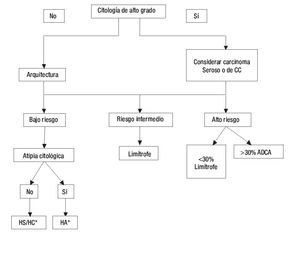
En términos generales, cuando analizamos una lesión endometrial, primero tendremos que decidir si se trata de una hiperplasia con o sin atipia, una lesión limítrofe o un adenocarcinoma de bajo o alto grado (Figura 5).
Figura 5. Guía diagnóstica en el Cáncer Endometrial.
MARCADORES DE IMMUNOHISTOQUÍMICA20,21
La inmunohistoquímica puede ayudarnos en el diagnóstico diferencial de adenocarcinoma seroso con otro tipo de adenocarcinoma de endometrio, la gran mayoría de carcinomas serosos (90%) muestran sobreexpresión de P53, la cual es intensa y se manifiesta en más del 50% al 75% de los núcleos tumorales.
La actividad del Ki-67 es muy alta, mayor al 75% de las células tumorales, independiente de la sobreexpresión de p53.
La sobreexpresión difusa de P16 es característica de los carcinomas serosos, y puede ser más sensible en este tipo de neoplasias que el p53. Este hallazgo no está relacionado con la presencia o ausencia del virus de papiloma humano (VPH), sino a una alteración de ciclo celular, que genera altos índices de proliferación. La expresión de los receptores de estrógenos (RE) y receptores de progesterona (RP) es sólo focal y débil.
El WT-1 se expresa en 20% a 30% de los casos. En ocasiones el Her2-neu se sobreexpresa, y ello, se relaciona con resistencia a la quimioterapia y mal pronóstico.
Por otro lado, la mayoría de los carcinomas de células claras expresan citoqueratina 7 (CK7), CAM 5.2, 34βE12, antígeno carcinoembironario (ACE), Leu-M1, vimentina y CA-125.
La expresión de RE y RP es más común que en los carcinomas endometrioides, pero menos frecuente que en los carcinomas serosos.
ADENOCARCINOMA ENDOMETRIOIDE DE ALTO GRADO
Típicamente expresan pancitoqueratinas, antígeno de membrana epitelial, CA-125, BerEP4, B72.3, CK7 y vimentina. RE y RP se expresan en el 50% de los casos, aproximadamente 20% de estos tumores sobreexpresan P53 y, algunos positividad para P16, no en la misma extensión e intensidad que los carcinomas serosos.
FACTORES PRONÓSTICOS22,23
La importancia de los factores de riesgo uterino y extrauterino, está en relación con la posibilidad de metástasis en ganglios retroperitoneales y sobrevida subsecuente.
ESTADIO DE LA FIGO
La utilidad pronóstica de los estadios de la FIGO, se ha confirmado en múltiples estudios tanto uni como multi-variados. Este es el factor pronóstico más importante que predice la evolución en mujeres con CE.
TIPO HISTOLÓGICO
El adenocarcinoma endometrioide tiene relativamente buen pronóstico. Por otro lado, el carcinoma seroso es una neoplasia agresiva, con una sobrevida global que varía de 40% a 60% a cinco años. El carcinoma de células claras es también muy agresivo con una sobrevida a cinco años del 30% al 75%.
GRADO HIOSTOLÓGICO
El grado de diferenciación es considerado como uno de los indicadores de diseminación tumoral más importantes. Cuando las neoplasias endometriales tienen un alto grado, tienen más posibilidad de invadir el miometrio y por tanto mayor posibilidad de metástasis en ganglios linfáticos pélvicos y paraaórticos. El 50% de las neoplasias grado 3, invaden más de la mitad de espesor del miometrio con metástasis en los ganglios linfáticos pélvicos y paraaórticos en una proporción del 30% y 20%, respectivamente.
En un estudio se correlacionó la sobrevida con el GH. En los adenocarcinomas endometrioides estadio I o II, la sobrevida a cinco años fue de: grado 1, 94%; grado 2, 84% y grado 3, 72%.
INVASIÓN MIOMETRIAL
La profundidad de invasión al miometrio debe de ser incluida en el reporte histopatológico, de preferencia expresado en milímetros, el involucro de focos de adenomiosis no se considera como invasión.
La invasión miometrial profunda es uno de los factores más importantes que se correlacionan con sobrevidas más cortas y con mayor posibilidad de diseminación extrauterina, falla al tratamiento y recurrencia.
INVASIÓN VASCULAR (IV)
La invasión de vasos linfáticos predice en forma importante, la recurrencia tumoral y la muerte por tumor. Zacho y colaboradores encontraron que la IV, fue un factor importante de muerte secundaria a adenocarcinoma en estudios clínicos iniciales. Las metástasis ganglionares son frecuentes cuando se presenta IV.
INVOLUCRO DE LOS ANEXOS
El 6% de las pacientes con estadio I y II oculto tienen diseminación hacia los anexos. De éstos, 32% tienen metástasis en ganglios pélvicos, comparado con 8% de metástasis en ganglios pélvicos, cuando no hay involucro de anexos. El 20% de las pacientes con involucro de los anexos tienen metástasis en ganglios paraaórticos, lo cual es cuatro veces más común que cuando eso está ausente.
La diseminación intraperitoneal sin afección de anexos, se correlaciona con aumento en la frecuencia de metástasis en ganglios pélvicos y paraaórticos.
CITOLOGÍA PERITONEAL
Del 12% a 15% de pacientes que son etapificados tienen citología peritoneal positiva. De estos, 25% tienen metástasis en ganglios pélvicos y 19% en ganglios paraaórticos.
GANGLIOS PÉLVICOS Y PARAAÓRTICOS
En 1987, en un estudio de 621 pacientes en estadio I y II oculto, 70 (11%) tenían metástasis tanto en ganglios pélvicos como paraaórticos.
SÍNDROMES HEREDITARIOS
El adenocarcinoma de endometrio no es típicamente una enfermedad hereditaria. La predisposición genética se observa en 10% de las pacientes, el 5% de estos se asocian con el síndrome de Lynch, identificar a estos pacientes es de gran utilidad ya que se les puede proponer un tamizaje adecuado, cirugía profiláctica, entre otros.
El síndrome de Lynch o cáncer de colon hereditario no polipoide es un síndrome autosómico dominante, que se asocia con inicio temprano de la enfermedad y el desarrollo de múltiples tipos de cáncer, en particular cáncer de colon y cáncer de endometrio.
Las pacientes con síndrome de Lynch tienen un riesgo del 40% al 60% para desarrollar cáncer de endometrio, lo cual es similar o excede su riesgo de desarrollar cáncer de colon.
La media de edad del diagnóstico de cáncer de endometrio en pacientes con síndrome de Lynch es de 46 a 54 años, y el 18% se diagnostican antes de los 40 años.
Correspondencia:
Dra Isabel Alvarado-Cabrero.
Departamento de Patología, Hospital de Oncología, Centro Médico Nacional Siglo XXI, IMSS.
Av. Cuauhtémoc 330, Colonia Doctores.
C.P. 06700. México D.F., México.
Teléfono: 5627 6900, extensión 22733. Fax: (55) 5513 5395.
Correo electrónico: keme2.tijax12@gmail.com.