Estudio retrospectivo diseñado para evaluar la efectividad y tolerabilidad de docetaxel secuencial a epirrubicina como tratamiento sistémico neoadyuvante (TSN) en mujeres con cáncer de mama localmente avanzado.
Pacientes y métodosParticipó un total de 126 pacientes diagnosticadas con CMLA (70 etapa IIIA; 53 etapa IIIB; 3 etapa IIIC). Las pacientes recibieron FEC (500mg/m2, 75mg/m2, 500mg/m2, respectivamente) cada 3 semanas por 4 ciclos, seguido por docetaxel 75mg/m2 cada 3 semanas por 4 ciclos. La cirugía se realizó al término de la quimioterapia.
ResultadosEl análisis del esquema 4FECr4D por grupos mostró un significativo incremento de respuestas clínicas completas (RCc) al agregar docetaxel a FEC preoperatorio (Wilcoxon: z=±2.35; p=0.019). Se obtuvo una tasa de respuesta objetiva (RO) del 78.5% (intervalo de confianza del 95% [IC 95%], 71.4-85.7) y de respuesta patológica completa (RPc) del 30.2% (IC 95%, 22.2-38.2). En el grupo con RPc, los tumores con etapa IIIA, menor grado nuclear y RE-positivos exhibieron mayores respuestas al TSN (71.1, 84.2 y 61.7%, respectivamente). La proporción de pacientes con ganglios negativos fue del 51.6% (IC del 95%: 42.9 -60.3).
El régimen con FEC produjo mayores efectos emetizantes severos como náusea (3.3%) y emesis (2.1%). El régimen con docetaxel reportó toxicidades severas como mialgia (2.0%), fatiga (1.4%) y neuropatía sensorial periférica (0.4%).
ConclusiónEste estudio mostró que la adición de docetaxel secuencial en dosis estándares a FEC es un régimen sumamente activo, factible y bien tolerado en pacientes con CMLA.
Retrospective study, designed to assess the effectiveness and tolerability of doceta-xel sequential to epirubicin as neoadjuvant systemic therapy (NST) in women with locally advanced breast cancer (LABC).
Patients and MethodsA total of 126 LABC-diagnosed patients were included (70 stage IIIA; 53 stage IIIB; 3 stage IIIC). The patients received FEC (500mg/m2, 75mg/m2, 500mg/m2, res- pectively) every 3 weeks for 4 cycles, followed by docetaxel 75mg/m2 every 3 weeks for 4 cycles. Surgery was performed at the end of the chemotherapy.
ResultsIn the analysis of the 4FEC-4D scheme by groups, a significant increase in clinical complete response (cCR) was observed when docetaxel was added to preoperative FEC (Wilcoxon test, z=-2.35; P=.019). An objective response rate (ORR) of 78.5% (95% confidence interval [95% CI], 71.4 - 85.7) and pathological complete response (pCR) of 30.2% (95% CI, 22.2 - 38.2) were obtained. In the pCR group, tumors with stage IIIA lower nuclear grade and ER-positiveness showed higher response to NST (71.1%, 84.2% and 61.7%, respectively). The proportion of patients with negative lymph nodes was 51.6%. (95% CI: 42.9 - 60.3). The FEC regimen had more severe emetic effects, such as nausea (3.3%) and vomiting (2.1%). The docetaxel regimen produced severe toxicities, including myalgia (2.0%), fatigue (1.4%), and peripheral sensory neuropathy (0.4%).
ConclusionThis study showed that the sequential addition of standard-dose docetaxel to FEC is highly active, feasible and well tolerated in patients with LABC.
El tratamiento sistémico neoadyuvante (TSN) se ha establecido actualmente como la estrategia clínica de referencia más importante para tratar el cáncer de mama localmente avanzado (CMLA), el cáncer de mama inflamatorio y el cáncer de mama operable1–3.
Sin embargo, las respuestas clínicas y patológicas no son lo suficientemente óptimas y tienen repercusiones limitadas en la supervivencia de las pacientes. Por tal motivo, se han emprendido ensayos clínicos con combinaciones de antraciclinas y taxanos4,5.
En la década de los noventa, surgen fármacos como los taxanos (docetaxel y paclitaxel), cuya actividad antitumoral es significativa. Por tal motivo, se realizaron estudios fase II4–8 y fase III9–11 en el entorno de cáncer de mama metastásico, los cuales mostraron tasas de respuesta significativas. Asimismo, los taxanos también han demostrado altos niveles de actividad en las pacientes con enfermedad refractaria a las antraciclinas12–14.
En virtud de los prometedores resultados de dichos ensayos, se desarrollaron con gran interés estudios clínicos aleatorizados en los que se demostró la utilidad de adicionar un taxano secuencial o concomitante (simultáneo) a esquemas que contienen antraciclinas antes de la cirugía, con mejoras de los resultados en las tasas de respuestas clínicas y patológicas, así como en la cirugía conservadora de mama15–21.
Docetaxel es uno de los agentes más activos en el tratamiento del cáncer de mama9,10. La combinación de docetaxel con doxorrubicina es una de las opciones más efectivas que pueden probarse como TSN en el CMLA. En Europa y en muchos otros países constituye la primera línea de tratamiento, con la ventaja de que puede combinarse con otros fármacos citostáticos sin que se presente un incremento en la incidencia de toxicidad se-vera15–21.
La actividad antitumoral significativa y la fácil administración de docetaxel en forma ambulatoria, aunadas a los bajos índices de toxicidad cardíaca de epirrubicina, en combinación con los bajos niveles de toxicidad hematológica acumulativa de ambos fármacos en el tratamiento de pacientes con cáncer de mama, y la relativa ausencia de resistencia cruzada debido a las diferencias en los mecanismos de acción de estos agentes permiten evaluar de manera segura la combinación de antraciclina con docetaxel9,22–26.
Con base en lo anterior, se llevó a cabo este estudio, el cual consistió en agregar docetaxel secuencial a 5-fluorouracilo, epirrubicina y ciclofosfamida (FEC) preoperatorio con el objeto de evaluar la actividad y la tolerabilidad de ambos agentes citostáticos. El esquema 4FECr4D se aplicó a mujeres con CMLA, y se evaluó principalmente la tasa de respuesta patológica.
2Pacientes y métodos2.1Selección de pacientesEste fue un ensayo retrospectivo que se realizó en los Servicios de Oncología Ginecológica y Oncología Médica de la Unidad Médica de Alta Especialidad del Hospital de Gineco-obstetricia N.° 3, Centro Médico Nacional La Raza del Instituto Mexicano del Seguro Social. Las pacientes, tratadas con TSN seguido por cirugía, fueron incorporadas en el período comprendido entre enero de 2009 y diciembre de 2012.
Los criterios de inclusión en este estudio fueron: mujeres menores de 75 años con diagnóstico clínico de CMLA (IIIA, IIIB, IIIC) sin metástasis a distancia, de acuerdo con las normas del American Joint Committee on Cancer (2003)27. El tumor primario se midió bidimensionalmente mediante palpación con calibrador, mamografía o ultrasonido mamario; el diagnóstico histológico de carcinoma invasor se obtuvo por biopsia con aguja trucut o biopsia incisional. Las pacientes debieron presentar un estado funcional de la Organización Mundial de la Salud de 0 o 1, con funciones biológicas adecuadas y sin antecedentes de función cardíaca anormal.
Las pacientes fueron excluidas en caso de presentar antecedentes de cáncer de mama o de otra patología maligna con tratamientos oncológicos previos, infección activa, neurotoxicidad preexistente (grado ≥ 2) y otras enfermedades que pudieran influir en el tratamiento oncológico.
A cada paciente se le realizó una historia clínica completa, una exploración física y análisis celular sanguíneo (pruebas funcionales hematológicas, renales y hepáticas). Los estudios de gabinete realizados fueron: radiografía de tórax, mastografía, gammagrafía ósea y ultrasonido hepático. También se efectuaron estudios de IHQ para determinar el estado de los receptores de estrógeno (RE) y de progesterona (RPg), así como del receptor 2 del factor de crecimiento epidérmico humano (HER2). Todas las pacientes elegibles otorgaron su consentimiento informado por escrito antes de iniciar el tratamiento.
2.2Quimioterapia neoadyuvanteLas pacientes recibieron quimioterapia neoadyuvante intravenosa consistente en 5-fluorouracilo 500mg/m2, epirrubicina 75mg/m2 y ciclofosfamida 500mg/m2 el día 1 de cada 3 semanas por 4 ciclos, seguida por docetaxel 75mg/m2, en una infusión IV de 1h el día, el día 1 de cada 3 semanas por 4 ciclos. Las pacientes no recibieron ciclos adicionales de quimioterapia tras la cirugía.
La premedicación IV indicada en cada ciclo de quimioterapia fue, para FEC: ondansetrón 8mg, dexametasona 8mg y 50mg de ranitidina; previamente a la infusión IV de docetaxel, cada paciente recibió el mismo esquema de premedicación con un aumento de la dosis de dexametasona a 16 mg, y se agregó difenhidramina 50mg. Como tratamiento antiemético posquimioterapia se indicó granisetrón 1mg por vía oral (1 a 5 días, a criterio del médico).
2.3ToxicidadLos eventos adversos provocados por los antineoplásicos se evaluaron de conformidad con los Criterios Comunes de Toxicidad del Instituto Nacional de Cáncer. La toxicidad se clasificó como leve (grado 1), moderada (grado 2) y severa (grado 3-4). La neutropenia febril se definió como una elevación de la temperatura oral > 38.5°C y un recuento de neutrófilos < 0.5×109/l o ausencia de recuperación del recuento de neutrófilos el día del siguiente ciclo sin infección simultánea.
Se indicó tratamiento de rescate en caso de toxicidad no hematológica grado 3-4 (con la exclusión de alopecia y náusea grado 3-4), ante la presencia de leucocitopenia o trombocitopenia grado 3-4 y anemia grado 2. Las pacientes solo recibieron factor estimulante de colonias de granulocitos si experimentaron neutropenia grado ≥ 2 o neutropenia febril. Se indicó transfusión sanguínea con niveles de hemoglobina ≤ 9.0g/l. Una vez superada la toxicidad, se administró el siguiente ciclo de quimioterapia.
La función cardiovascular se evaluó clínicamente ante la sospecha de cardiotoxicidad y, en aquellas pacientes que presentaron un electrocardiograma anormal, se solicitó un estudio de fracción de eyección ventricular izquierda y valoración cardiológica. La reducción de la dosis se evaluó en función de la mielosupresión.
2.4Evaluación de la respuesta clínicaLa respuesta tumoral clínica se clasificó conforme a los criterios de la Unión Internacional Contra el Cáncer28. La respuesta clínica completa (RCc) se definió como la ausencia de actividad tumoral en la mama y en ganglios axilares, evaluados por medio de palpación. La respuesta clínica parcial (RCp) se definió como una reducción del 50% o más en el producto de los 2 diámetros perpendiculares más grandes del tumor primario. La enfermedad progresiva (EP) se definió como un incremento superior al 25% en el tamaño del tumor de la mama o presencia de nuevas lesiones detectadas después de 2 ciclos de tratamiento, y la definición de enfermedad estable (EE) se determinó cuando los resultados de las pacientes no pudieron ser clasificados como RC, RP o EP. La respuesta clínica objetiva (RO) se definió como la suma de la respuesta clínica completa (RCc) y la respuesta clínica parcial (RCp). La respuesta tumoral de las pacientes se consideró valorable si se administraron al menos 2 ciclos de tratamiento.
2.5Evaluación de la respuesta patológicaLa mama y los ganglios axilares fueron examinados por los patólogos del hospital. Cada tumor se preparó con el método de tinción con hematoxilina y eosina. La respuesta tumoral patológica se clasificó conforme a los criterios de Chevallier29: clase 1, ninguna evidencia de tumor residual en la mama ni en los ganglios axilares observados (respuesta patológica completa, RPc); clase 2, el hallazgo histológico de solo carcinoma in situ se incluyó en la categoría de RPc.
2.6Tratamiento locorregionalLa cirugía convencional realizada a cada paciente consistió en una mastectomía radical modificada tipo Madden que incluyó la disección de ganglios axilares (nivel II o III, a criterio del cirujano). La cirugía fue programada en un intervalo no mayor a 6 semanas. Tras la cirugía se indicó radioterapia con dosis de 50Gy en 25 fracciones, administrada en la pared torácica y en las regiones ganglionares.
2.7Estudio de marcadores tumoralesAntes del tratamiento, se determinó el estado de RE y RPg por medio de inmunohistoquímica (IHQ). En general, los tumores teñidos con más del 10% se clasificaron como positivos a RE y RPg. El estado de HER2 del tumor se determinó por IHQ o por análisis de hibridación cromogénica in situ. Los tumores HER2 positivos se definieron con puntuación 3+ con la tinción IHQ. Los tumores HER2 negativos se definieron con puntuación 0 y 1+ con IHQo puntuación 2+ con IHQ y resultado negativo en la hibridación cromogénica in situ.
2.8Métodos estadísticosEl criterio principal de valoración del estudio fue la tasa de pacientes con RPc posquimioterapia. Los criterios de valoración secundarios fueron la tasa de pacientes que presentaron una mejor respuesta tumoral clínica (RO: RCc + RCp) y la incidencia de eventos adversos relacionados con la quimioterapia.
Las estimaciones de mejor respuesta tumoral patológica y clínica estuvieron acompañadas de intervalos de confianza del 95%. Con una potencia estadística del 80% y un nivel de significancia del 5% fueron consideradas estadísticamente significativas con una prueba de hipótesis bilateral.
Se utilizó la prueba de Pearson de chi cuadrado y la prueba exacta de Fisher de acuerdo con la tendencia para detectar cualquier diferencia entre las proporciones de respuestas clínicas y patológicas, así como para determinar las diferencias en las proporciones de los diferentes grados de toxicidad por grupo de tratamiento. La respuesta patológica se evaluó por estado de receptores hormonales y de HER2.
Las tasas de respuesta tumoral clínicas y patológicas se evaluaron para detectar una mejora en la tasa de RO en el intervalo del 70 al 90%, con tasas de RCc del 20 al 40% y de RPc del 20 al 34%, previstas con base en estudios similares reportados en la literatura. Los datos se registraron en Excel y se utilizaron para el análisis estadístico. El proyecto se realizó con recursos propios de la institución.
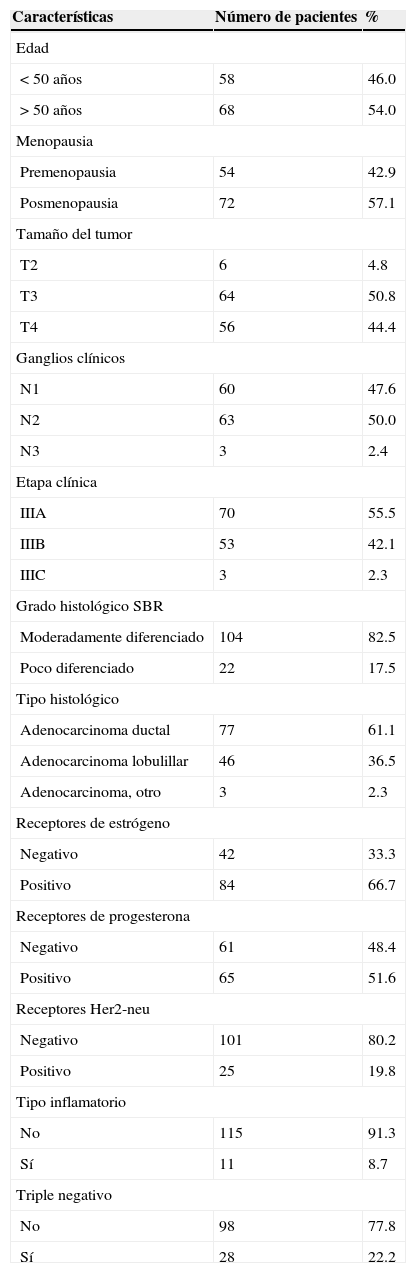
3ResultadosTodas las pacientes con CMLA (n=126) fueron evaluables en cuanto a respuesta clínica, respuesta patológica y efectos adversos relacionados con el TSN. En la tabla 1 se muestran las características clínicas y patológicas de la población de estudio.
Características clínicas y tumorales de 126 pacientes
| Características | Número de pacientes | % |
|---|---|---|
| Edad | ||
| < 50 años | 58 | 46.0 |
| > 50 años | 68 | 54.0 |
| Menopausia | ||
| Premenopausia | 54 | 42.9 |
| Posmenopausia | 72 | 57.1 |
| Tamaño del tumor | ||
| T2 | 6 | 4.8 |
| T3 | 64 | 50.8 |
| T4 | 56 | 44.4 |
| Ganglios clínicos | ||
| N1 | 60 | 47.6 |
| N2 | 63 | 50.0 |
| N3 | 3 | 2.4 |
| Etapa clínica | ||
| IIIA | 70 | 55.5 |
| IIIB | 53 | 42.1 |
| IIIC | 3 | 2.3 |
| Grado histológico SBR | ||
| Moderadamente diferenciado | 104 | 82.5 |
| Poco diferenciado | 22 | 17.5 |
| Tipo histológico | ||
| Adenocarcinoma ductal | 77 | 61.1 |
| Adenocarcinoma lobulillar | 46 | 36.5 |
| Adenocarcinoma, otro | 3 | 2.3 |
| Receptores de estrógeno | ||
| Negativo | 42 | 33.3 |
| Positivo | 84 | 66.7 |
| Receptores de progesterona | ||
| Negativo | 61 | 48.4 |
| Positivo | 65 | 51.6 |
| Receptores Her2-neu | ||
| Negativo | 101 | 80.2 |
| Positivo | 25 | 19.8 |
| Tipo inflamatorio | ||
| No | 115 | 91.3 |
| Sí | 11 | 8.7 |
| Triple negativo | ||
| No | 98 | 77.8 |
| Sí | 28 | 22.2 |
La mediana de edad fue de 50 años (intervalo: 27-75). El tumor se localizó en el CSE en el 60.2%, con ligero predominio de la mama izquierda en el 54.8% de los casos. El promedio de las dimensiones tumorales fue de 7.8±2.4cm (intervalo: 4-17), un tamaño relativamente grande en el momento del diagnóstico tardío para la mujer mexicana. El diagnóstico histológico se realizó con biopsia de aguja de corte grueso en el 50.5% de los casos.
3.1Cirugía y radioterapiaEn el 86.5% de los casos se empleó la modalidad de tratamiento local combinado (cirugía y radioterapia). La cirugía con márgenes libres de lesión en cáncer primario inoperable (etapa IIIB y IIIC) fue posible en 54 de 56 pacientes. Dos pacientes presentaron enfermedad progresiva durante el tratamiento con docetaxel, motivo por el cual no se les sometió a cirugía. La radioterapia se administró tras la cirugía.
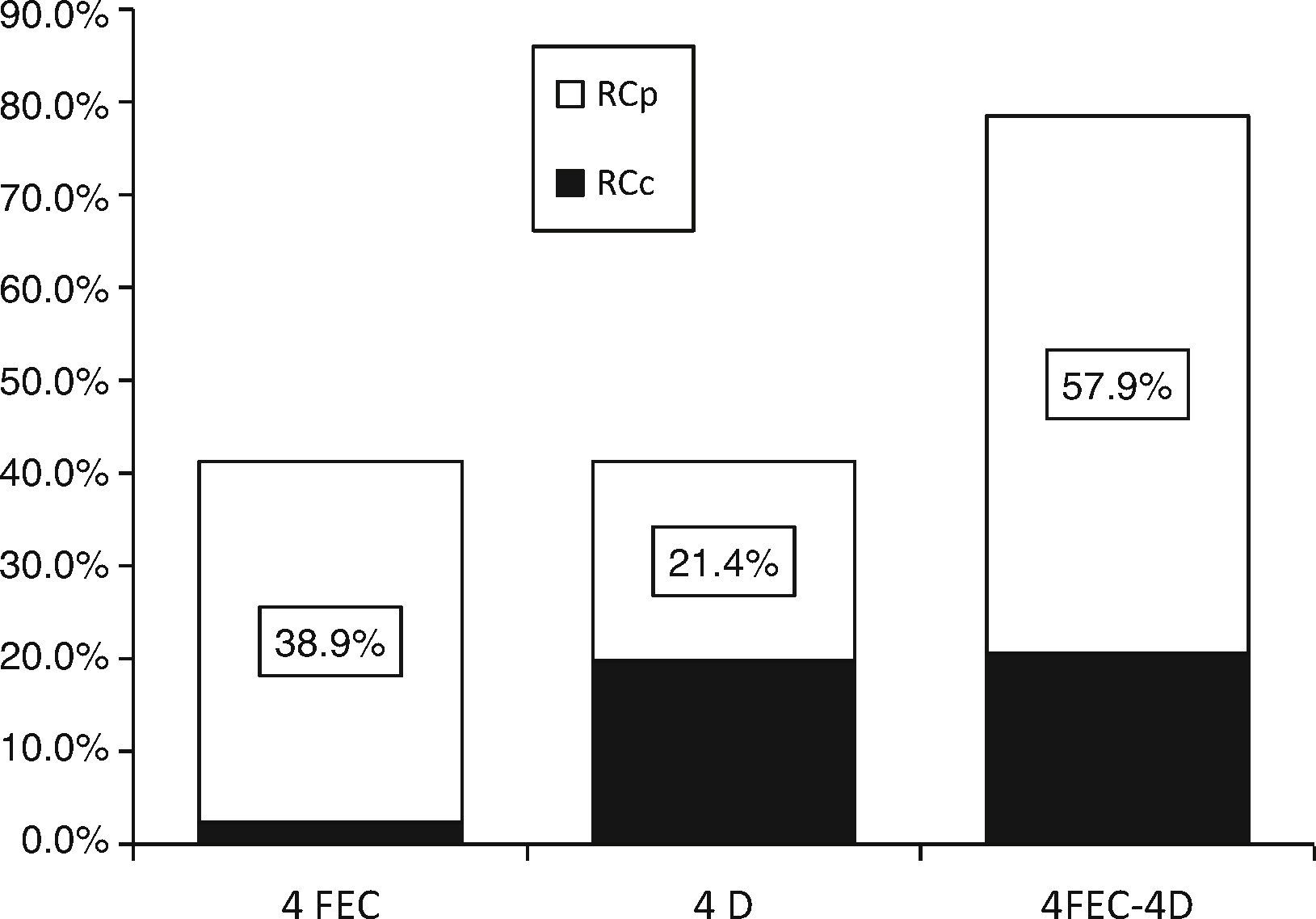
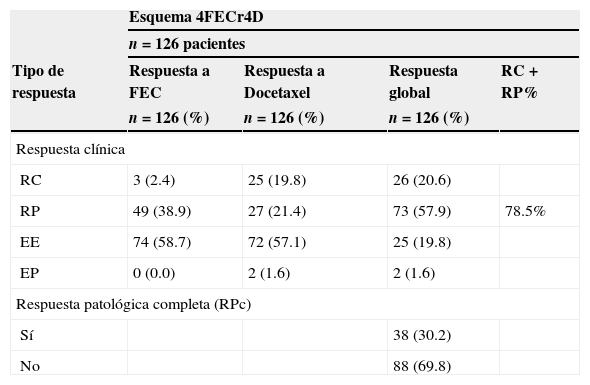
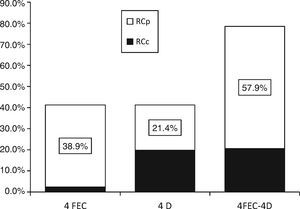
3.2Respuestas clínicasEl análisis por grupos de la respuesta clínica de las lesiones mostró que, al agregar docetaxel a epirrubicina preoperatoria, la tasa de RCc se incrementó significativamente (2.4 vs. 19.8%; prueba de Wilcoxon: z=-2.35; p=0.019) con 4FEC y 4D, respectivamente. Sin embargo, se debe tomar en cuenta el resultado final del efecto sinérgico de ambos fármacos sobre los tumores (fig. 1 y tabla 2).
Respuesta tumoral clínica, análisis por grupos con 4FEC y 4D: La adición dedocetaxel a epirrubicina preoperatoria incrementó la tasa de RCc (2.4% vs. 19.8%; prueba de Wilcoxon: z=−2.35; p=0.019). Con el efecto sinérgico del esquema 4FECr4D, se obtuvo una tasa de respuesta clínica objetiva (RO) del 78.5% con 4FECr4D, ajustada a la respuesta clínica completa (RCc) y a la respuesta clínica parcial (RCp).
Análisis de la respuesta clínica y respuesta patológica posquimioterapia de pacientes con CMLA
| Esquema 4FECr4D | ||||
|---|---|---|---|---|
| n=126 pacientes | ||||
| Tipo de respuesta | Respuesta a FEC | Respuesta a Docetaxel | Respuesta global | RC+RP% |
| n=126 (%) | n=126 (%) | n=126 (%) | ||
| Respuesta clínica | ||||
| RC | 3 (2.4) | 25 (19.8) | 26 (20.6) | |
| RP | 49 (38.9) | 27 (21.4) | 73 (57.9) | 78.5% |
| EE | 74 (58.7) | 72 (57.1) | 25 (19.8) | |
| EP | 0 (0.0) | 2 (1.6) | 2 (1.6) | |
| Respuesta patológica completa (RPc) | ||||
| Sí | 38 (30.2) | |||
| No | 88 (69.8) | |||
FEC: 5-fluorouracilo, epirrubicina, ciclofosfamida; D: docetaxel; RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable, EP: enfermedad progresiva.
La tasa de respuesta clínica objetiva (RO: RCc+RCp) fue del 78.5% (intervalo de confianza del 95% [IC del 95%], 71.3 a 85.7), lo cual incluyó una tasa de RCc del 20.6% (IC del 95%, 13.6 a 27.7) y de RCp del 57.9% (IC del 95%, 49.3 a 66.5) (fig. 1 y tabla 2). También se analizaron los factores predictivos tradicionales (edad, estadio, grado nuclear, grado histológico, RE, RPg, HER2). El análisis de los factores predictivos en relación con la respuesta clínica mostró que la mayoría de las RCc ocurrió en tumores en etapa IIIA, lo cual permitió un mejor control local con cirugía. No se registraron casos de enfermedad progresiva en pacientes con RCc.
3.3Respuestas patológicasAl término del TSN, en el estudio de las piezas quirúrgicas no se encontraron células tumorales residuales invasoras en la mama en el 35.7% (n=45). La tasa de RPc (ausencia de actividad tumoral en la mama y ausencia de metástasis en ganglios axilares) fue del 30.2% (IC del 95%, 22.2 a 38.2) (tabla 2). Después de administrar como máximo 8 ciclos en 101 casos, se obtuvo una RPc en 33 casos, y solo en 5 casos se logró con un esquema incompleto.
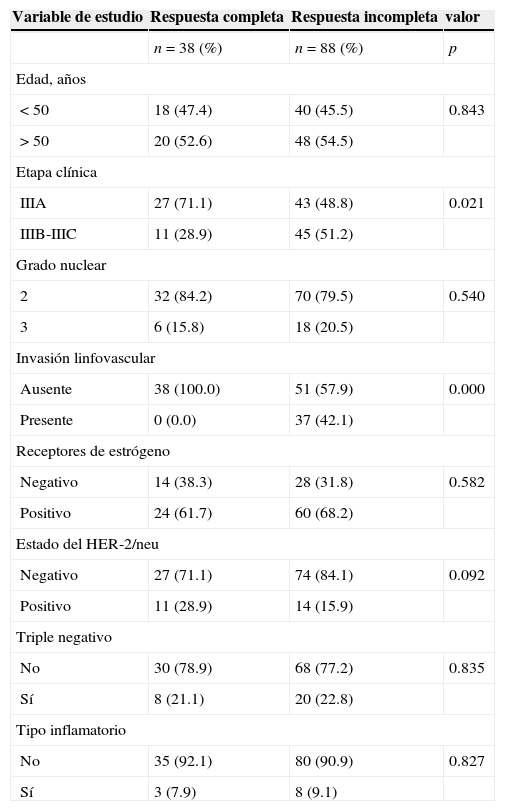
Se realizó un análisis de la respuesta patológica con relación a los factores predictivos tradicionales y solo fue estadísticamente significativo en los tumores en etapa IIIA (p=0.021) y en los tumores con ausencia de invasión linfovascular (p=0.000). La incidencia de RPc también fue directamente proporcional en los tumores con menor grado nuclear y en las pacientes de mayor edad (tabla 3).
Análisis de las características clínico-patológicas asociadas a la respuesta patológica del tumor primario y los ganglios linfáticos axilares a la quimioterapia neoadyuvante
| Variable de estudio | Respuesta completa | Respuesta incompleta | valor |
|---|---|---|---|
| n=38 (%) | n=88 (%) | p | |
| Edad, años | |||
| < 50 | 18 (47.4) | 40 (45.5) | 0.843 |
| > 50 | 20 (52.6) | 48 (54.5) | |
| Etapa clínica | |||
| IIIA | 27 (71.1) | 43 (48.8) | 0.021 |
| IIIB-IIIC | 11 (28.9) | 45 (51.2) | |
| Grado nuclear | |||
| 2 | 32 (84.2) | 70 (79.5) | 0.540 |
| 3 | 6 (15.8) | 18 (20.5) | |
| Invasión linfovascular | |||
| Ausente | 38 (100.0) | 51 (57.9) | 0.000 |
| Presente | 0 (0.0) | 37 (42.1) | |
| Receptores de estrógeno | |||
| Negativo | 14 (38.3) | 28 (31.8) | 0.582 |
| Positivo | 24 (61.7) | 60 (68.2) | |
| Estado del HER-2/neu | |||
| Negativo | 27 (71.1) | 74 (84.1) | 0.092 |
| Positivo | 11 (28.9) | 14 (15.9) | |
| Triple negativo | |||
| No | 30 (78.9) | 68 (77.2) | 0.835 |
| Sí | 8 (21.1) | 20 (22.8) | |
| Tipo inflamatorio | |||
| No | 35 (92.1) | 80 (90.9) | 0.827 |
| Sí | 3 (7.9) | 8 (9.1) | |
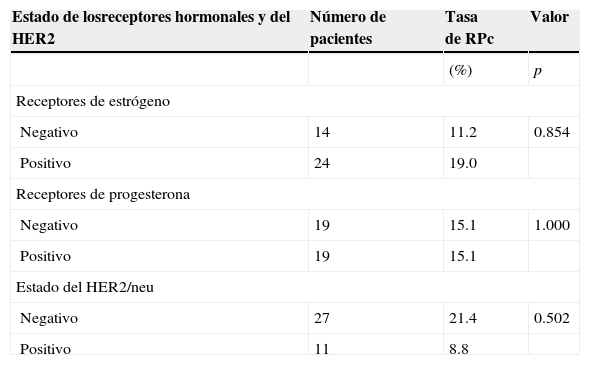
La respuesta patológica puede ser dependiente del estado hormonal del tumor, como lo sugieren otros ensayos acerca del beneficio de agregar un taxano a las antracilinas. Como se observa en la tabla 4, las pacientes con tumores RE-positivos (19%) exhibieron mejores tasas de RPc en comparación con los tumores RE-negativos (11.2%). Con respecto al estado de los RE y el HER2, los datos indicaron que ejercieron pocos efectos favorables a la RPc conforme a la capacidad de docetaxel secuencial preoperatorio.
Respuesta completa patológica conforme al -estado de RE, RPg y HER2
| Estado de losreceptores hormonales y del HER2 | Número de pacientes | Tasa de RPc | Valor |
|---|---|---|---|
| (%) | p | ||
| Receptores de estrógeno | |||
| Negativo | 14 | 11.2 | 0.854 |
| Positivo | 24 | 19.0 | |
| Receptores de progesterona | |||
| Negativo | 19 | 15.1 | 1.000 |
| Positivo | 19 | 15.1 | |
| Estado del HER2/neu | |||
| Negativo | 27 | 21.4 | 0.502 |
| Positivo | 11 | 8.8 | |
RE: receptores de estrógeno; RPg: receptores de progesterona.
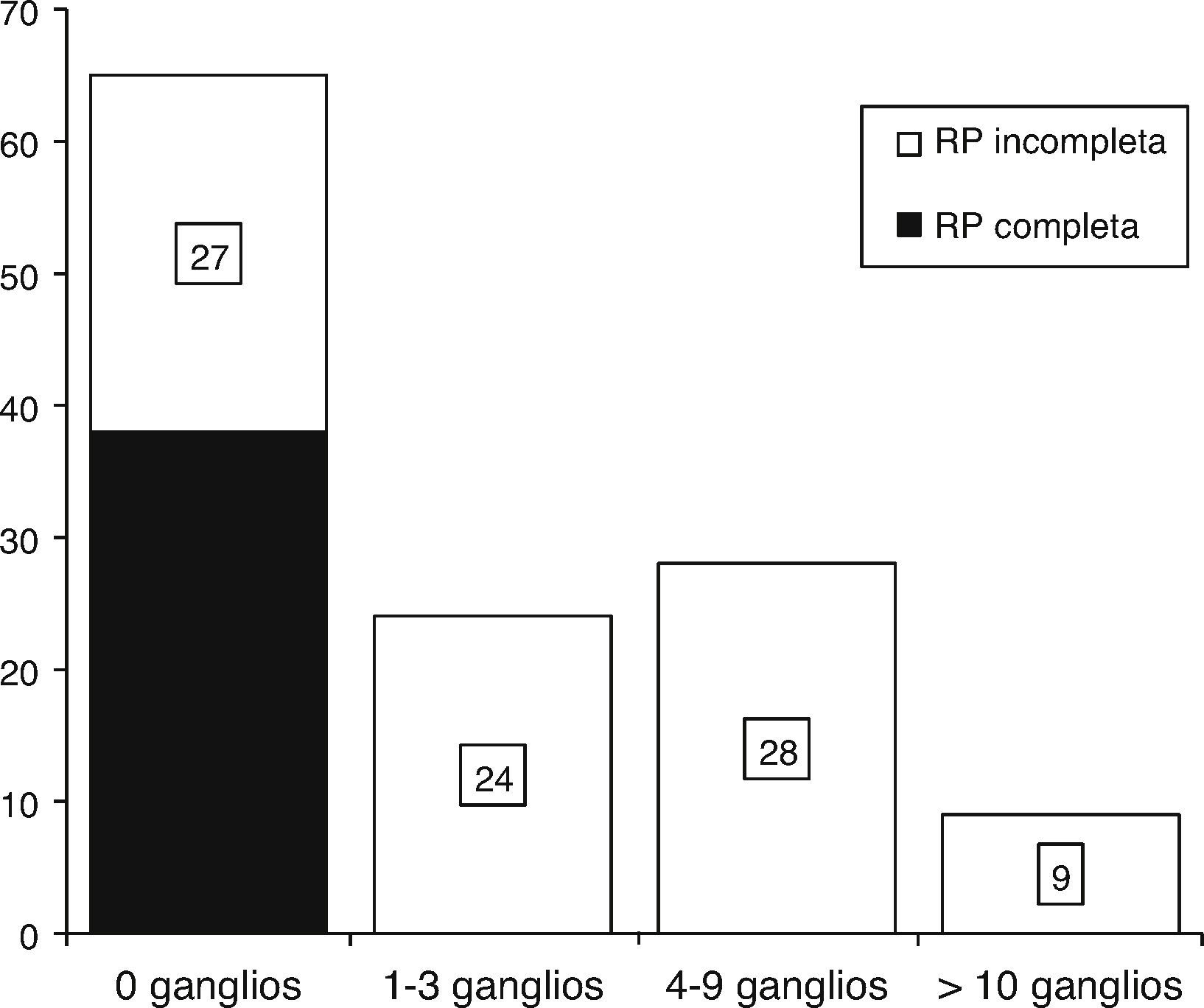
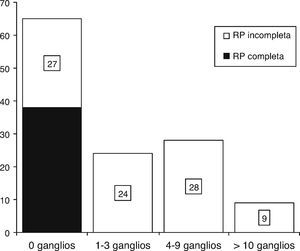
Se evaluó el estado ganglionar axilar patológico posquimioterapia y se encontró presencia de ganglios negativos axilares en el 51.6% de los casos; no se observó ninguna diferencia significativa entre subgrupos (fig. 2).
Análisis histopatológico del estado ganglionar axilar posquimioterapia: se obtuvo una tasa de ganglios negativos del 51.6% (n=65) y una tasa de ganglios positivos del 48.3% (n=61) ajustadas a la respuesta patológica de los ganglios afectados posquimioterapia con 4FECr4D.
RP: respuesta patológica.
Se administraron un total de 975 ciclos en 126 pacientes: 484 ciclos con epirrubicina y 491 ciclos con docetaxel; 101 (80%) pacientes recibieron el esquema completo de 8 ciclos. Veinticinco pacientes recibieron al menos 6 o 7 ciclos de la combinación 4FECr4D, en contra de la recomendación del protocolo.
La mediana del número de ciclos de epirrubicina fue de 4 (de 2 a 4), en tanto que la de docetaxel secuencial como monoterapia fue de 4 (2 a 4). Las medianas de la dosis total real de epirrubicina y docetaxel fueron de 440mg/m2 (límites: 210-640) y de 464mg/m2 (límites: 280-605), respectivamente. La mayoría de los ciclos se administraron cada 3 semanas, como se especificó en el protocolo.
En 18 ciclos se aplicaron reducciones de la dosis de epirrubicina debido a la aparición de toxicidades grado 3, lo cual motivó que en 17 casos no se complementaran los 4 ciclos de FEC. La dosis de docetaxel se redujo en 12 casos por toxicidad grado 3. Solo 12 casos de las 126 pacientes no recibieron el tratamiento con docetaxel como estaba pre-visto.
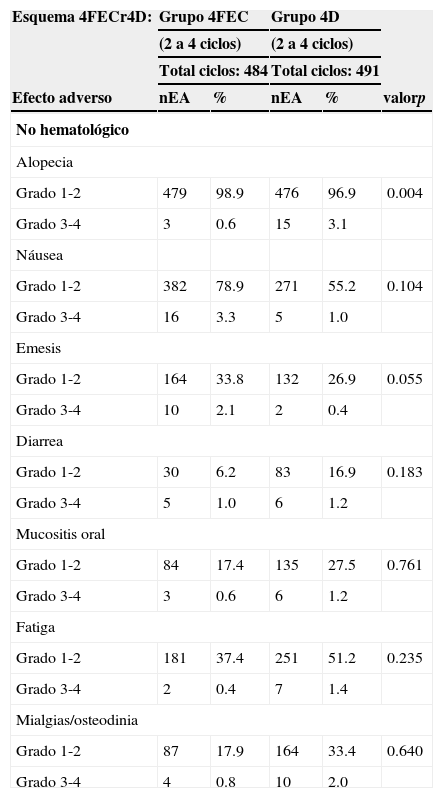
4Toxicidad4.1Toxicidad no hematológicaLa incidencia de eventos adversos grado 1-2 relacionados con el tratamiento (por grupos: 4FEC y 4D) fue variable. Después de la administración de epirrubicina (4FEC), la toxicidad grado 3-4 fue baja y no significativa. La náusea grado 3-4 estuvo presente en el 3.3% con 4FEC y 1% con 4D. Se registraron episodios de emesis grado 3-4 que hicieron necesaria la hospitalización en el 2.1% de las pacientes con 4FEC y en el 0.4% con 4D (tabla 5).
Toxicidad no hematológica por grupos con 4FECr4D
| Esquema 4FECr4D: | Grupo 4FEC | Grupo 4D | |||
|---|---|---|---|---|---|
| (2 a 4 ciclos) | (2 a 4 ciclos) | ||||
| Total ciclos: 484 | Total ciclos: 491 | ||||
| Efecto adverso | nEA | % | nEA | % | valorp |
| No hematológico | |||||
| Alopecia | |||||
| Grado 1-2 | 479 | 98.9 | 476 | 96.9 | 0.004 |
| Grado 3-4 | 3 | 0.6 | 15 | 3.1 | |
| Náusea | |||||
| Grado 1-2 | 382 | 78.9 | 271 | 55.2 | 0.104 |
| Grado 3-4 | 16 | 3.3 | 5 | 1.0 | |
| Emesis | |||||
| Grado 1-2 | 164 | 33.8 | 132 | 26.9 | 0.055 |
| Grado 3-4 | 10 | 2.1 | 2 | 0.4 | |
| Diarrea | |||||
| Grado 1-2 | 30 | 6.2 | 83 | 16.9 | 0.183 |
| Grado 3-4 | 5 | 1.0 | 6 | 1.2 | |
| Mucositis oral | |||||
| Grado 1-2 | 84 | 17.4 | 135 | 27.5 | 0.761 |
| Grado 3-4 | 3 | 0.6 | 6 | 1.2 | |
| Fatiga | |||||
| Grado 1-2 | 181 | 37.4 | 251 | 51.2 | 0.235 |
| Grado 3-4 | 2 | 0.4 | 7 | 1.4 | |
| Mialgias/osteodinia | |||||
| Grado 1-2 | 87 | 17.9 | 164 | 33.4 | 0.640 |
| Grado 3-4 | 4 | 0.8 | 10 | 2.0 | |
nEA: número de efectos adversos.
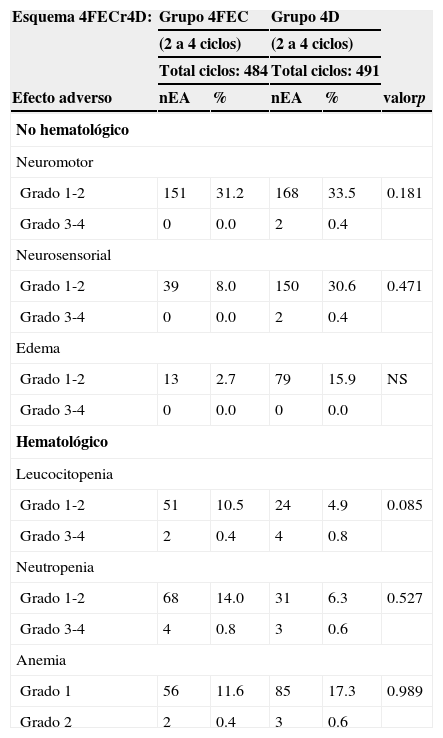
Tras la administración de docetaxel (4D) secuencial, la toxicidad grado 1-2 fue la más común. Las pacientes se vieron afectadas por náusea, emesis, fatiga, mialgias, neuropatías y diarrea, como se muestra en las tablas 5 y 6. El esquema 4FECr4D fue en términos generales bien tole-rado.
Toxicidad no hematológica y hematológica por grupos de 4FECr4D
| Esquema 4FECr4D: | Grupo 4FEC | Grupo 4D | |||
|---|---|---|---|---|---|
| (2 a 4 ciclos) | (2 a 4 ciclos) | ||||
| Total ciclos: 484 | Total ciclos: 491 | ||||
| Efecto adverso | nEA | % | nEA | % | valorp |
| No hematológico | |||||
| Neuromotor | |||||
| Grado 1-2 | 151 | 31.2 | 168 | 33.5 | 0.181 |
| Grado 3-4 | 0 | 0.0 | 2 | 0.4 | |
| Neurosensorial | |||||
| Grado 1-2 | 39 | 8.0 | 150 | 30.6 | 0.471 |
| Grado 3-4 | 0 | 0.0 | 2 | 0.4 | |
| Edema | |||||
| Grado 1-2 | 13 | 2.7 | 79 | 15.9 | NS |
| Grado 3-4 | 0 | 0.0 | 0 | 0.0 | |
| Hematológico | |||||
| Leucocitopenia | |||||
| Grado 1-2 | 51 | 10.5 | 24 | 4.9 | 0.085 |
| Grado 3-4 | 2 | 0.4 | 4 | 0.8 | |
| Neutropenia | |||||
| Grado 1-2 | 68 | 14.0 | 31 | 6.3 | 0.527 |
| Grado 3-4 | 4 | 0.8 | 3 | 0.6 | |
| Anemia | |||||
| Grado 1 | 56 | 11.6 | 85 | 17.3 | 0.989 |
| Grado 2 | 2 | 0.4 | 3 | 0.6 | |
nEA: número de efectos adversos.
El número de pacientes con eventos adversos grado 3-4 fue bajo. Tras la administración de epirrubicina sin factor estimulante de colonias de granulocitos, se registró anemia grado 1 en el 11.6% y anemia moderada en el 0.4% de las mujeres. Epirrubicina ejerció un efecto supresor más profundo sobre los leucocitos en comparación con docetaxel, con un predominio no significativo de toxicidad grado 1-2 (leucopenia en el 10.5% y neutropenia en el 14%). En contraste, la administración de docetaxel derivó en un ligero predominio de anemia grado 1 en el 17.3% (p=0.989), el cual no llegó a ser significativo (tabla 6).
Se requirió un tratamiento de 5 días con factor estimulante de colonias de granulocitos (días 3-5) en 20 de 484 ciclos (4.1%) de epirrubicina y en 13 de 491 ciclos (2.6%) con docetaxel. Solo en un caso se requirió transfusión sanguínea (ciclo 3 con epirrubicina).
En términos generales, los síntomas severos fueron manejables y reversibles. No se registraron eventos tromboembólicos, insuficiencia cardíaca congestiva clínica ni otro evento adverso grave. La fracción de eyección ventricular izquierda se midió antes de la cirugía en 5 pacientes con 4FECr4D; ninguna paciente presentó un valor por debajo del 50%.
5DiscusiónEl cáncer de mama es un problema de salud en nuestro país30,31. En la primera década de este siglo, la combinación primaria de taxanos con otros fármacos como TSN ha producido tasas elevadas de respuesta en el tratamiento del CMLA1–3,16–21.
Los estudios en cáncer de mama han hecho posible establecer la dosis de docetaxel. Normalmentese se recomienda una dosis de 60-100mg/m2 en una infusión IV de 1h cada 3 semanas. Cuando se administra en combinación con una antraciclina, la dosis recomendada de docetaxel es de 75 mg/m2. En cambio, la posología recomendada de paclitaxel es de 175mg/m2 en una infusión IV de 3h cada 3 semanas32–34. Los taxanos también difieren con respecto a la magnitud de la eficacia y la toxicidad en relación con la dosis y el esquema1–3.
Tres importantes estudios aleatorizados han logrado obtener un beneficio importante en las tasas de respuesta clínica y patológica al adicionar docetaxel en forma secuencial a doxorrubicina-ciclofosfamida preoperatorias como tratamiento neoadyuvante, como a continuación se describe.
El ensayo aleatorizado fase III de Aberdeen incluyó a 162 pacientes con cáncer de mama en etapas II-III. Las pacientes fueron tratadas con ciclofosfamida 1,000mg/m2, vincristina 1.5mg/m2, doxorrubicina 50mg/m2 y prednisolona 40mg por 5 días (CVAP), cada 3 semanas por 4 ciclos. Las pacientes que respondieron fueron asignadas aleatoriamente a 4 ciclos adicionales de CVAP (n=52) o a otro grupo (n=52) con 4 ciclos de docetaxel (D). El grupo con 4CVAPr4D, en comparación con el grupo con 8CVAP, demostró tasas significativamente superiores de RO (94 vs. 64%; p=0.002), de RCc (62 vs. 34%; p=0.001) y de RPc (34 vs. 16%; p=0.04) y, en el análisis por intención de tratar, demostró tasas superiores de RO (85 vs. 64%; p=0.03) y RPc (31 vs. 15%; p=0.06), respectivamente. Este estudio demostró que las pacientes que no respondieron a un régimen neoadyuvante con antraciclinas pueden lograr mejores respuestas cuando se cambian a docetaxel19.
El ensayo fase III NSABP B-27 distribuyó aleatoriamente en 3 grupos a 2,411 pacientes con cáncer de mama etapas I-III y evaluó la utilidad de 4 ciclos de docetaxel administrados antes o después de la cirugía tras 4 ciclos de quimioterapia preoperatoria con AC (doxorrubicina 60mg/m2 más ciclofosfamida 600mg/m2) administrados cada 3 semanas. El brazo II con AC seguido por docetaxel (D) por 4 ciclos (ACrDrcirugía) resultó superior al demostrar una tasa más elevada de respuestas frente a los brazos I (ACrcirugía) y III (ACrcirugíarD). La adición de docetaxel preoperatorio a AC se asoció a tasas significativamente superiores de RO (90.7 vs. 85.7%; p=0.001), de RCc (63.6 vs. 40.2%; p=0.001) y de RPc (26.1 vs. 12.9%; p=0.001) e incrementó la proproción de ganglios negativos (58.2 vs. 50.8%; p=0.001) en comparacióncon AC solo. En el subgrupo de pacientes con RPc, la adición de docetaxel preoperatorio mostró una tasa más elevada de supervivencia libre de enfermedad en comparación con el esquema AC solo20.
El estudio fase III GEPARDUO asignó al azar a 913 mujeres con cáncer de mama operable sin tratamiento previo (T2-3, N0-2, M0) a doxorrubicina 50mg/m2 más docetaxel 75mg/m2 cada 14 días por 4 ciclos con apoyo de filgrastim (ADOC) o a doxorrubicina 60mg/m2 más ciclofosfamida 600mg/m2 cada 21 días, seguidas por docetaxel 100mg/m2 cada 21 días por 4 ciclos (ACrDOC). El grupo con ACrDOC, en comparación con ADOC, demostró tasas significativamente superiores de RO por palpación (85 vs. 75.2%; p=0.001) y por imagen (78.6 vs. 68.6%; p=0.001), así como de RPc (15.9 vs. 7.4%; p=0.001). Los resultados a favor de docetaxel secuencial obligaron a concluir el estudio, dado que el esquema ACrDOC (secuencial) fue más eficaz en la inducción de RPc en comparación con ADOC (simultáneo) con dosis densa como quimioterapia preoperatoria21.
En el presente estudio, la suma de los 8 ciclos mostró más efectos adversos grado 1-2, de modo que los 8 ciclos no pueden ser recomendados a todo el grupo de pacientes que responden inicialmente a los 2 primeros ciclos con FEC preoperatorio, como lo señalan otras investigaciones35,36. Los resultados obtenidos por diversos estudios son comparables mediante un régimen compuesto por fluorouracilo, epirrubicina y ciclofosfamida (FEC) o EC seguido por docetaxel para tratar a pacientes con cáncer de mama avanzado no metastásico37–39.
El beneficio de agregar taxanos puede ser limitado en los tumores RE-negativos1,20,21,40. A diferencia de otros ensayos, en el presente estudio los tumores RE-positivos fueron más propensos a exhibir RPc que los tumores RE-negativos con la adición de docetaxel a epirrubicina preoperatoria.
Los datos de este trabajo y de varios estudios aleatorizados han mostrado tasas elevadas de respuesta clínica tras el TSN. Además, han demostrado que existe un ligero incremento en las tasas de RPc19–21, de modo que, actualmente, los estudios sugieren que la práctica en general debe ser continuar con la administración de docetaxel secuencial a las pacientes que exhiben una respuesta inicial a las antraciclinas en el tratamiento primario del cáncer de mama avanzado no metastásico, si bien este enunciado puede modificarse con observaciones a largo plazo1,35.
6ConclusiónEn resumen, el alto índice de respuestas y los bajos niveles de toxicidad severa observados en este estudio indicaron que las dosis convencionales de epirrubicina y de docetaxel secuencial son una opción adecuada en el tratamiento del CMLA.
La adición de docetaxel al esquema FEC preoperatorio es el factor controlable más importante para mejorar la efectividad sin incrementar la toxicidad severa en el tratamiento de pacientes con CMLA debido a que proporciona un beneficio terapéutico importante.
Este trabajo obtuvo el Premio Nacional de Investigación en Oncología en el área de Cirugía Oncológica otorgado por la Sociedad Mexicana de Oncología, A.C., dentro del marco del XXXII Congreso Nacional de Oncología llevado a cabo del 22 al 25 de octubre del 2014 en Ixtapa Zihuatanejo, Guerrero, México.