Medir y comparar el índice neutrófilo-linfocito (INL) con la etapa clínica de melanoma en el momento del diagnóstico. Evaluar la asociación entre el INL en el momento del diagnóstico inicial de melanoma y el estadio clínico en distintas etapas en pacientes de un centro oncológico privado de la ciudad de México.
MétodosEstudio observacional, analítico, retrospectivo; se incluyeron 63 expedientes de pacientes con diagnóstico de melanoma mediante la revisión del expediente clínico, todos ellos con diagnóstico de melanoma reportado por biopsia en un periodo comprendido entre 2002-2015.
ResultadosDe los 63 pacientes estudiados se obtuvo una media del INL de 4.1 (DE 6.44) y una mediana de 2.7, se encontró una correlación de 58% entre el INL (>2.7) y el desenlace de muerte en el subgrupo de pacientes en etapa clínica fue>IIA.
ConclusionesEl presente estudio muestra una tendencia a la asociación entre el INL (>2.7) y la etapa clínica; sin embargo, no fue estadísticamente significativo por la limitante del tamaño de la muestra. Se encontró una correlación única con el subgrupo de pacientes con enfermedad avanzada y un INL>2.7 y el desenlace de muerte, no así en las demás variables (progresión y recurrencia). El presente trabajo es una muestra objetiva de que esta herramienta bioquímica es accesible, de bajo costo, y que podría aportar información pronóstica para el melanoma en etapa avanzada.
Measure and compare the neutrophil-lymphocyte ratio (NLR) with clinical stage of melanoma at diagnosis. To assess the association between NLR at initial diagnosis of melanoma and clinical stage at different stages of patients from a private cancer centre of Mexico City.
MethodsAn observational, analytical, retrospective study was conducted on 63 patients with a melanoma diagnosis by reviewing medical records. The study included all patients diagnosed with melanoma biopsy reported in the period from 2002 to 2015.
ResultsOf the 63 patients studied, a mean LNR of 4.1 (SD 6.44) was obtained. The median was 2.7, and a correlation of 58% was found between LNR (>2.7) and the outcome of death in the subgroup of patients in clinical stage>IIA.
ConclusionsThis study shows a trend association between LNR (>2.7) and clinical stage, which was not statistically significant due to the limited sample size. A single correlation was found with the subgroup of patients with advanced disease and an LNR>2.7 and outcome of death, but not in the other variables (progression and recurrence). This work is objective biochemical proof that this accessible and inexpensive tool could provide prognostic information for advanced-stage melanoma.
El melanoma es un tumor derivado de la proliferación de melanocitos atípicos, con o sin la capacidad de producir pigmento, caracterizado por su gran capacidad de metástasis; produce una neoformación cutánea pigmentada, plana o exofítica, curable durante la etapa inicial pero que sin tratamiento es de rápido avance, pudiendo provocar metástasis linfáticas y hematógenas que provocan una alta mortalidad1.
La mayoría de los melanomas se localizan en la piel (95%) y, menos frecuentemente (5%), en mucosas: oral o genital, retina y meninges. Un 3% de los pacientes desarrollan melanomas ocultos (enfermedad metastásica sin evidencia de tumor primario)2.
El melanoma puede presentarse también como un tumor primario en otros órganos, como: tracto digestivo, sistema respiratorio, sistema nervioso central, coroides, mucosas bucal o vaginal, independientemente de la localización de las metástasis; además, puede desencadenar metástasis en la mayoría de los órganos, con una especial predilección por ganglios, pulmón, hígado y cerebro3.
Representa el 4% de todos los tumores malignos de la piel, aunque es el responsable del 80% de las muertes4.
Las tasas de melanoma han estado aumentando en los últimos 30 años; la frecuencia del melanoma es 20 veces mayor en los blancos que en los estadounidenses de raza negra5.
En general, el riesgo de padecer melanoma en el transcurso de la vida es de aproximadamente un 2% (uno en 50) para los blancos, un 0.1% (uno en 1,000) para los negros y un 0.5% (uno en 200) para los hispanos6.
El riesgo también aumenta con la edad (la edad promedio en el momento del diagnóstico es de 61 años). Pero el melanoma no es poco común incluso entre las personas menores de 30 años. De hecho, es uno de los cánceres más comunes en los adultos jóvenes (especialmente en mujeres jóvenes)7.
En México ocupa el tercer lugar entre los cánceres de la piel, con un 14.1%. Según las estadísticas del Instituto Nacional de Cancerología, ha aumentado hasta un 500% en los últimos años8.
Factores de riesgoEdadPuede aparecer a cualquier edad, aunque cada vez se diagnostican en gente más joven; la mayor frecuencia se concentra en la edad media de la vida. El 41% de los melanomas se diagnostican antes de los 55 años; en pacientes de más de 70 años son más frecuentes los melanomas variedad nodular y lentiginoso acral (58%), mientras que en jóvenes, son los de extensión superficial (74%).
También parece existir una correlación entre la edad y el grosor; los pacientes ancianos tienen un grosor Breslow mayor que los jóvenes9.
SexoSon más comunes en las mujeres, se encuentran con más frecuencia en las extremidades inferiores y en las zonas de mayor exposición al sol y, en general, tienen mejor pronóstico que en los varones, quienes presentan mayor mortalidad en comparación con las mujeres debido a que desarrollan melanomas en localizaciones de peor pronóstico y en etapas más avanzadas10.
Factor racialExiste una mayor incidencia en personas rubias, pelirrojas y de ojos claros. Los pacientes de raza negra tienen una incidencia 10 veces menor que los de raza blanca11.
Presencia de nevusLa existencia de un número elevado de nevus se correlaciona con una mayor probabilidad de padecer melanoma, sobre todo si existen nevus atípicos12.
La existencia previa de un melanoma es otro factor de riesgo importante; el riesgo relativo de desarrollar un segundo melanoma es 70 veces superior al de desarrollar un primer melanoma13.
Factores genéticosAnte la historia familiar de melanoma, existe un riesgo hasta 12 veces superior. En la actualidad se conocen 2 genes de susceptibilidad para el melanoma: el gen CDKN2A (p16), localizado en el cromosoma 9, y el CDK4, localizado en el cromosoma 14.
Luz solar y situación demográficaEs más frecuente en zonas cercanas al ecuador. La exposición a la radiación ultravioleta aumenta de manera importante el riesgo de presentar melanoma; además, todas las longitudes de onda tienen peligro, siendo mayor en las que están entre 290-320nm14.
InmunodepresiónTienen mayor riesgo de tener melanoma pacientes con leucemias, linfomas, trasplantes de órganos, infección por VIH o cualquier otra situación de inmunosupresión patológica o medicamentosa15.
Historia natural e histogénesisInicialmente tienen un crecimiento radial (lentigo maligno, melanoma de extensión superficial y acral lentiginoso) y después un crecimiento vertical, que implica un peor pronóstico por la posibilidad de invasión linfática y hematógena. En la fase de crecimiento radial, el comportamiento es indolente y con escasas posibilidades de diseminación, por lo que es curable desde el punto de vista quirúrgico16.
El crecimiento vertical suele seguir al radial, aunque a veces ocurre desde el inicio, como en el caso del melanoma nodular, donde casi no existe crecimiento radial, por lo que entraña un peor pronóstico17.
Con base en el crecimiento vertical se definen los niveles de invasión de Clark y las medidas de grosor tumoral de Breslow, siendo estos 2 parámetros los principales valores histológicos con valor pronóstico.
Tipos histopatológicosExtensión superficial: más común a nivel mundial en el 80% de casos de raza blanca.
Lentigo maligno: más común en población mexicana y en edades avanzadas.
Acral lentiginoso: más común en personas de raza negra.
Nodular.
Hay otras formas menos frecuentes de melanoma: el melanoma de mucosas y el melanoma desmoplásico18.
El diagnóstico clínico de melanoma se basa en el reconocimiento y la identificación de la transformación de un nevus preexistente, por el crecimiento asimétrico, de bordes imprecisos y coloración abigarrada con áreas negras y áreas menos pigmentadas y azuladas que representan áreas de regresión.
Además de la sospecha clínica, el diagnóstico se realiza también con el apoyo de la dermatoscopia y otros métodos no invasivos, pero se confirma con la histopatología.
Al examinar una lesión pigmentada hay 5 características (ABCDE) que deben evaluarse: asimetría, borde irregular, coloración, diámetro (mayor de 6mm) y elevación19.
Siempre, ante cualquier lesión sospechosa, se deberá realizar una biopsia, preferiblemente mediante una escisión localizada, y ser examinada por un patólogo experimentado para determinar la etapa clínica (EC). Una vez confirmado el diagnóstico, se realizará un estudio de extensión para descartar metástasis a distancia, el cual tiene que ser exhaustivo en las áreas ganglionares de drenaje y, en general, en toda la piel.
Entre los factores que afectan el pronóstico clínico se encuentran: el espesor o grado de infiltración del melanoma, el índice mitótico, la presencia de infiltración tumoral de linfocitos, el número de nódulos linfáticos regionales implicados y la ulceración o hemorragia en el sitio primario20.
La clasificación clínica se fundamenta en si el tumor se ha diseminado a los ganglios linfáticos regionales o a sitios distantes. En el caso de la enfermedad confinada al sitio primario, cuanto mayor sea el espesor y la profundidad de la infiltración local del melanoma, mayor será la probabilidad de metástasis en los ganglios linfáticos o metástasis sistémica y el pronóstico será más precario. El melanoma se puede diseminar mediante extensión local a sitios distantes a través de los ganglios linfáticos o rutas hematógenas. Cualquier órgano puede verse comprometido por metástasis, pero los pulmones y el hígado son sitios comunes.
La EC se determina mediante el examen histológico, el grosor vertical de la lesión en milímetros (clasificación de Breslow; tabla 1), o por el grado anatómico de la infiltración local (clasificación de Clark; tabla 2).
Clasificación de Clark (grado de invasión)
| Grado I | Lesiones que solo implican a la epidermis (melanoma in situ; no es una lesión invasiva) |
| Grado II | Infiltración de la dermis papilar, pero no alcanza la interfase papilar reticular de la dermis |
| Grado III | Infiltración que ocupa y se expande a la dermis papilar, pero no penetra la dermis reticular |
| Grado IV | Infiltración de la dermis reticular, pero no en el tejido subcutáneo |
En cuanto al tratamiento del melanoma, la biopsia de ganglio centinela no es recomendable en estadios IA o IB por el tamaño de sus lesiones. Si el ganglio centinela es negativo, la disección ganglionar linfática no está indicada; los pacientes en estadio iii basado en un ganglio centinela deben someterse a una disección linfática completa de la cadena ganglionar.
Los pacientes con ganglios clínicamente positivos sin evidencia radiográfica de metástasis a distancia deben ser tratados con escisión amplia de sitio primario y una disección linfática completa de la cadena ganglionar involucrada.
La mayoría de los pacientes con enfermedad in situ o en etapas tempranas del melanoma alcanzará la curación por la escisión primaria; sin embargo, los pacientes con lesiones desmoplásicas se encuentran en gran riesgo de recurrencia local. La radiación adyuvante seguida de cirugía puede considerarse para mejorar el control local; si los márgenes se mantienen positivos luego de una cirugía bien realizada, el uso de radioterapia debe ser considerado en pacientes seleccionados (IIB).
En pacientes con melanoma en etapas iniciales, con ganglios negativos, que se encuentran en alto riesgo (estadios IB o ii, grosor de 1.0mm o menos con ulceración negativa), las opciones de tratamiento son evaluación clínica u observación.
En pacientes con ganglios negativos en estadio IIB o IIC, las opciones son evaluación clínica, observación o altas dosis de interferón alfa.
Para pacientes en estadio iii las opciones recomendadas son observación e interferón; el interferón alfa pegilado es una alternativa a la dosis alta de interferón en estadio iii con resección completa con ganglios centinelas positivos y/o clínicamente positivos.
En la enfermedad metastásica a distancia (estadio iv) el tratamiento depende de si la enfermedad es limitada (resecable) o diseminada (irresecable). En el caso de enfermedad limitada se hará la resección, en pacientes con un sitio único de metástasis visceral, un periodo breve de observación o tratamiento sistémico seguido por chequeos repetidos es apropiado para poder seleccionar adecuadamente a los pacientes. Se puede ofrecer tratamiento adyuvante a la resección; para la enfermedad diseminada la terapia sistémica, la incorporación a un ensayo clínico o el tratamiento de soporte serán los tratamientos utilizados. Se encuentran disponibles varias opciones: ipilimumab, nivolumab, pembrolizumab, vemurafenib, dabrafenib (en casos de mutación BRAF600), inhibidores de MEK, quimioterapia como dacarbazina, temozolomida, cisplatino, paclitaxel y carboplatino21.
La recomendación del tratamiento de primera línea se basa en diversos factores, incluyendo mutaciones en BRAF, tiempo de evolución de la enfermedad y presencia o ausencia de sintomatología asociada a la enfermedad, es decir, el estado funcional medido por escalas como Karnofsky o ECOG; en el caso de metástasis cerebrales, el tratamiento es prioritario para evitar hemorragia intratumoral, convulsiones o disfunción neurológica.
Inflamación y cáncerPeter Rous fue el primero en reconocer que el desarrollo del cáncer involucra alteraciones en el ADN («iniciación»), un daño irreversible y que puede persistir en el tejido normal de manera indefinida hasta que ocurra una segunda estimulación («promoción»), que resulta de la exposición de las células «iniciadas a químicos irritantes, factores liberados en el sitio de heridas, resección parcial de un órgano, hormonas, irritación crónica e inflamación22.
Funcionalmente muchos promotores inducen la proliferación celular, reclutan células inflamatorias, incrementan la producción de radicales libres, por el daño oxidativo del ADN, y reducen la reparación de este ADN dañado.
La alteración de los programas de reparación y muerte celular ocurre en tejidos expuestos a inflamación crónica, dando lugar a la replicación del ADN y a la proliferación de células que han perdido su capacidad de controlar su crecimiento normal.
Sin embargo, la inflamación crónica parece deberse a la persistencia de factores iniciadores que causan daño al ADN o a la falla en los mecanismos requeridos para resolver la respuesta inmune.
Para entender la conexión entre la inflamación y el cáncer se pueden distinguir 2 procesos:
- -
Una vía extrínseca: dirigida por las condiciones inflamatorias o infecciosas que aumentan el riesgo de desarrollar cáncer.
- -
Una vía intrínseca: dirigida por alteraciones genéticas que son capaces de desarrollar inflamación y cáncer (activación de oncogenes por mutación, rearreglos cromosómicos y la inactivación de genes supresores del tumor).
Estas 2 vías convergen, lo que resulta en la activación de factores de transcripción, principalmente factor nuclear-kappa B, transductor de señal y activador de la transcripción 3 y el factor 1α inducido por hipoxia. En células tumorales, estos factores de transcripción coordinan la producción de mediadores inflamatorios, incluyendo citosinas y quimiocinas, así como la producción de la ciclooxigenasa 2 (que, a su vez, resulta en la producción de prostaglandinas).
Estos factores reclutan y activan diversos leucocitos, más notablemente las células del linaje mielomonocítico; las citosinas activan los mismos factores clave de transcripción en las células inflamatorias, las células del estroma y las células tumorales, lo que resulta en más producción de mediadores inflamatorios, generando así un microambiente inflamatorio óptimo para el desarrollo del cáncer23.
Existe una fuerte evidencia en estudios genéticos realizados en ratones de que las células del sistema inmune adaptativo llevan a cabo la vigilancia y pueden eliminar tumores incipientes; este proceso es llamado «inmuno-edición»; la respuesta inmune innata, manifestada como inflamación, es crucial para la iniciación de la respuesta inmune adaptativa.
En neoplasias clínicamente evidentes, las respuestas inmunitarias adaptativas eficaces se suprimen a través de la activación de varias vías; un ejemplo de esto es la diferenciación y la activación de células dendríticas, que son iniciadoras clave de la respuesta inmune adaptativa, son inhibidas por señales (tales como la IL-10), presentes en el microambiente tumoral, además los tumores son frecuentemente infiltrados por células T reguladoras, que suprimen las respuestas inmunitarias adaptativas e innatas24.
Índice neutrófilo-linfocitoLa inflamación es un componente crítico en la progresión del tumor. Se sabe ahora que el microambiente tumoral, orquestado por células inflamatorias, es un participante esencial en el proceso neoplásico, promoviendo la proliferación, la supervivencia y la migración de las células neoplásicas25.
Las células tumorales producen varias citosinas y quimiocinas, como la interleucina 6, la interleucina 8, el factor estimulante de colonias de granulocitos y el factor inhibitorio de la migración de los macrófagos, que activan y reclutan neutrófilos de la sangre periférica hacia el estroma del tumor, estimulando la progresión tumoral.
Los neutrófilos promueven el crecimiento tumoral y la angiogénesis al liberar distintos mediadores de la inflamación, como el factor de crecimiento endotelial vascular y la metaloproteinasa 926.
Los neutrófilos generan especies de radicales libres, óxido nítrico y arginasa, los cuales interfieren en la función de los linfocitos T. Además, estas células promueven que el tumor tenga un comportamiento más agresivo, facilitando la inestabilidad genómica y favoreciendo el crecimiento tumoral27.
Por otra parte, un aumento en el número de linfocitos dentro del estroma tumoral se asocia a una mejor supervivencia en varios procesos malignos, lo cual indica que inicialmente el sistema inmune induce una respuesta en relación con el tumor, controlando su crecimiento.
Existen marcadores bioquímicos de respuesta inflamatoria, incluyendo citosinas, proteína C reactiva, el índice neutrófilo-linfocito (INL) y el índice plaquetas-linfocitos, los cuales han sido incorporados en el score pronóstico en distintos tipos de cáncer, tales como el cáncer gástrico, el cáncer pulmonar de células no pequeñas, el cáncer de ovario, el colangiocarcinoma, el carcinoma hepatocelular, el cáncer pancreático y el cáncer nasofaríngeo28.
El INL se propone como un balance entre el estado inflamatorio protumor y el estado inmunológico antitumoral, cuya elevación ha sido reconocida como indicador de peor pronóstico y metástasis en cáncer29.
El INL se define como el recuento absoluto de neutrófilos dividido por el recuento de linfocitos, obtenido a través de un equipo automatizado. Estudios anteriores han demostrado que un INL elevado está asociado a un aumento en la concentración de varias citosinas proinflamatorias, que consecuentemente provocan un daño al ADN celular30.
Aunque ya se ha corroborado el impacto negativo de un INL elevado, estos estudios difieren en los puntos de corte para establecer un INL normal. Mientras algunos estudios categorizan a los pacientes de acuerdo con intervalos de INL (tertiles, cuartiles, quintiles), otros utilizan puntos de corte definitivos de este (INL>2.5, INL>2.7, INL>3, INL>4).
Además, estudios de países occidentales a menudo utilizan un punto de corte elevado de INL comparado con países orientales, lo que refleja la variación de un rango normal en el conteo de neutrófilos y leucocitos dependiendo de la raza31.
En un estudio realizado en el 2014 por The National Health and Nutrition Examination Survey, el INL se estudió en relación con variables personales y demográficas: raza (hispana, blancos no hispanos, negros no hispanos, otros no hispanos), sexo, nivel educativo, comorbilidades, índice de masa corporal, seguridad social, alcoholismo y tabaquismo. Se incluyeron 9,427 muestras de sujetos y se obtuvieron los resultados que exponemos a continuación.
La media del valor absoluto de neutrófilos fue de 4.27×103cél/μL, y el de linfocitos fue de 2.14×103cél/μL. En cuanto al INL, la media fue de 2.15.
El INL en sujetos negros no hispanos e hispanos tuvo una media de 1.76 (IC 95% 1.71-1.81) y 2.08 (IC 95% 2.04-2.12), respectivamente, comparado con los sujetos blancos no hispanos, en los que la media del INL fue de 2.24 (IC 95% 2.19-2.28; p<0.0001). Se demostró que no hubo diferencia significativa del INL en cuanto a sexo, educación, seguridad social y hábito de ingerir bebidas alcohólicas. En cuanto al índice de masa corporal, sí hubo una correlación positiva: a mayor índice de masa corporal, mayor será el INL. Asimismo, el INL se vio afectado en personas que padecían diabetes mellitus y enfermedades cardiovasculares32.
MetodologíaJustificación del estudioActualmente se ha trabajado incansablemente para identificar biomarcadores que puedan predecir manifestaciones clínicas, pronóstico o factor predictivo en los pacientes con cáncer.
Dentro de estos marcadores bioquímicos se encuentra el INL, que representa un índice de fácil determinación, de bajo costo y un marcador altamente reproducible, cuyos componentes (conteo de neutrófilos y linfocitos absolutos) son medidos frecuentemente en la biometría hemática.
Sin embargo, no existen estudios suficientes que evalúen la asociación entre el INL y el melanoma, teniendo como consideración especial el estadio clínico.
Dado que se ha encontrado asociación del INL y otros modelos de neoplasias, se consideró necesario explorar si existía una asociación entre el INL y el estadio clínico en pacientes con melanoma.
Planteamiento del problemaEn una muestra de expedientes de pacientes de un centro oncológico privado de la ciudad de México con diagnóstico de melanoma maligno (2002-2015) se buscará si existe una asociación entre el INL y la EC en el momento de su diagnóstico.
Pregunta de investigación¿Existe una asociación entre el INL y la EC en pacientes con melanoma?
Hipótesis principalEl aumento del INL se asocia con estadios clínicos avanzados de melanoma en el momento del diagnóstico.
Objetivos principales del estudio- -
Medir y comparar el INL con la EC de melanoma en el momento del diagnóstico.
- -
Evaluar la asociación entre el INL en el momento del diagnóstico y el estadio clínico en distintas etapas del diagnóstico inicial de melanoma.
- -
Comparar el INL encontrado en este estudio con otros índices pronósticos, como la clasificación de Breslow y Clark.
- -
Evaluar si existe correlación entre el INL y los diferentes desenlaces clínicos de la enfermedad (muerte, recurrencia, progresión).
- -
Evaluar si existe correlación entre el INL y los diferentes subtipos histológicos del melanoma en el momento del diagnóstico.
Se realizó una búsqueda intencionada de expedientes en el sistema electrónico de pacientes con diagnóstico de melanoma reportado por biopsia.
Y para la valoración de la biometría hemática se obtuvieron resultados del sistema electrónico.
Universo y unidad del estudioUniverso: todos los pacientes con diagnóstico de melanoma reportado por biopsia en un periodo comprendido entre 2002-2015.
Unidad: expedientes revisados de pacientes con diagnóstico de melanoma reportado por biopsia.
Diseño del estudioObservacional, analítico, retrospectivo.
Criterios de inclusión del estudio- -
Expedientes de pacientes con diagnóstico de melanoma por biopsia mayores de 18 años.
- -
Expedientes de pacientes con diagnóstico de melanoma en cualquiera de sus estadios clínicos, reportado por biopsia.
- -
Expedientes de pacientes que cuenten con estudios de laboratorio de no más de una semana de diferencia con respecto a la fecha de la biopsia del diagnóstico.
- -
Expedientes de pacientes con diagnóstico de melanoma que cuenten con resultados de una biometría hemática completa.
- -
Reportes de pacientes que en el momento del diagnóstico inicial de melanoma inicien como melanoma metastásico y que no contaron con los índices de Breslow y Clark.
- -
Expedientes de pacientes con diagnóstico de melanoma que no se encuentren en el sistema electrónico en el momento de la recolección de los datos del estudio.
- -
Expedientes de pacientes con reporte de melanoma in situ reportado por biopsia.
- -
Expedientes de pacientes con diagnóstico de melanoma en los que no se reporte la clasificación de Breslow y Clark (excepto melanoma metastásico).
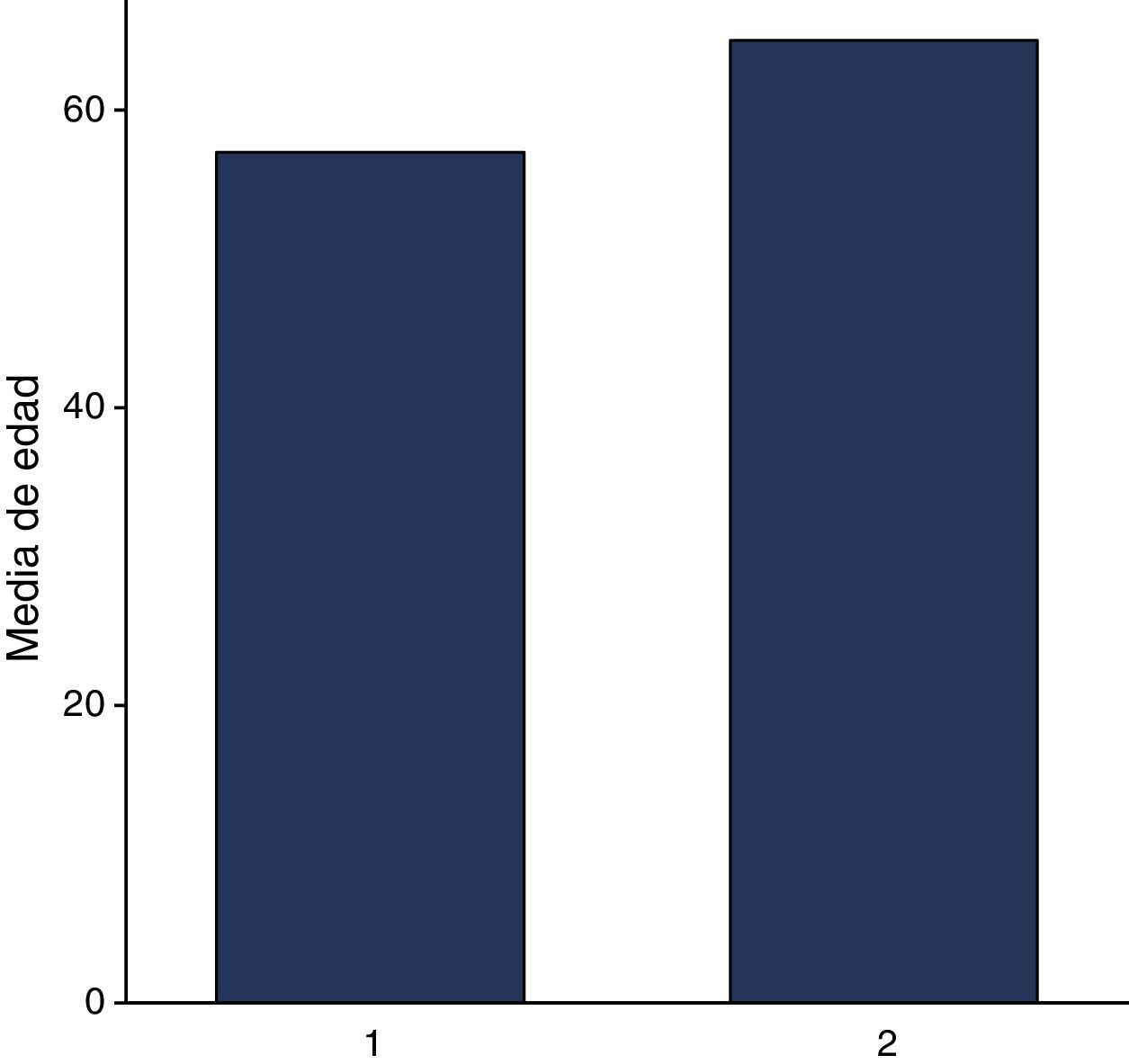
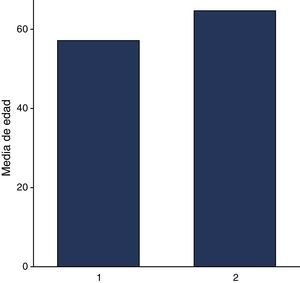
Se incluyeron 63 expedientes de pacientes con diagnóstico de melanoma. El 47.6% (30/63) representó a mujeres y el 52.3% (33/63) a hombres, con una edad promedio general de 61.07 años (DE 14.42). En cuanto a la edad, en mujeres el promedio fue de 57.13 años (DE 15.41 años), y para los hombres, la edad promedio fue de 64.67 años (DE 14.7 años). Respecto a su etnicidad, el 44.4% (28/63) correspondían a raza blanca y el 54% (35/63) a raza hispana (fig. 1).
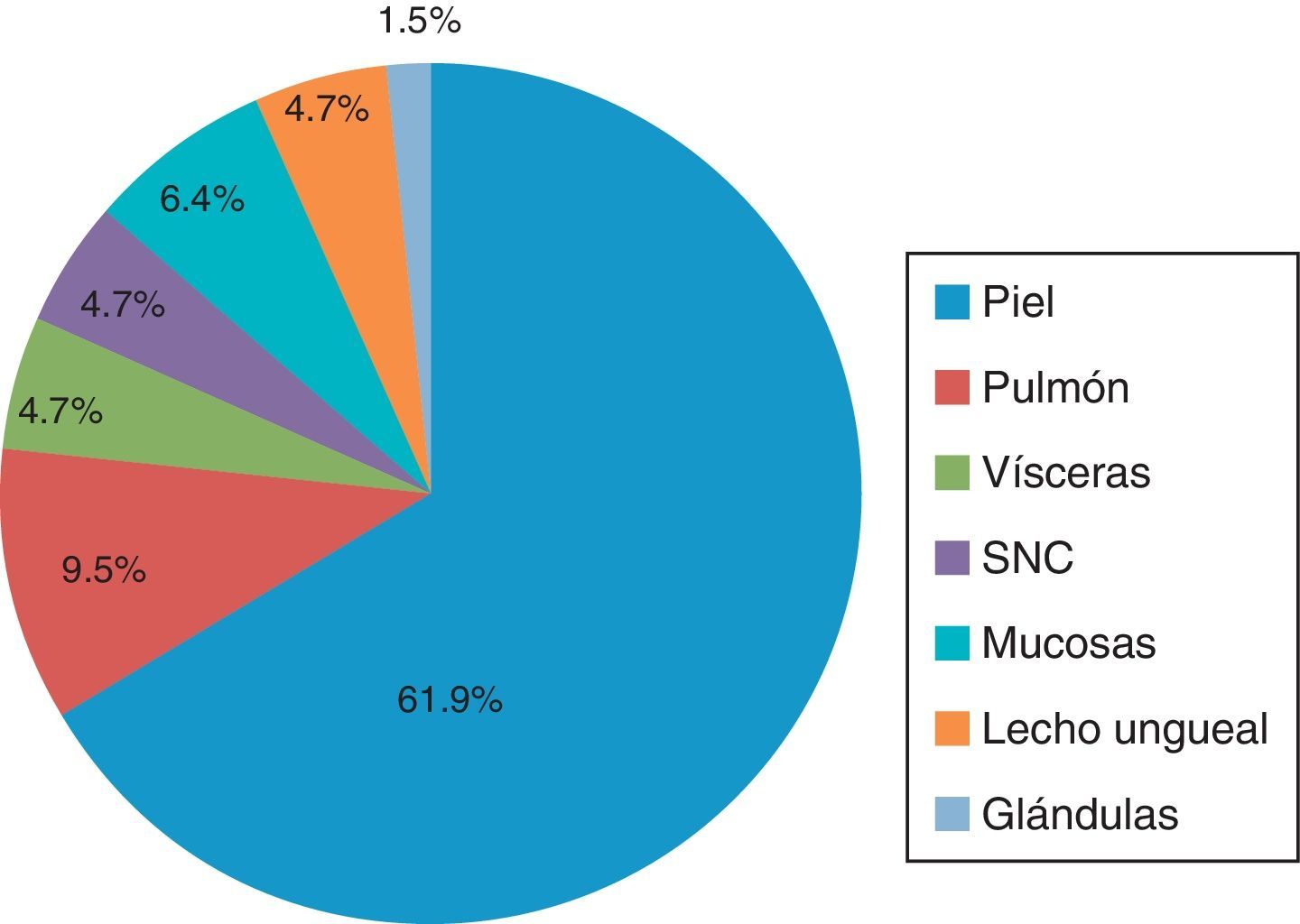
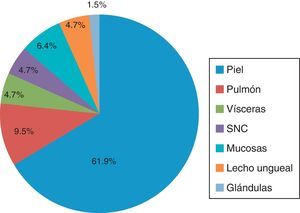
Por localización del tumor primarioLa localización del tumor primario se observó con más frecuencia en piel, con un 61.9%, de los cuales el 15.8% (10/63) se presentaron en piel de extremidad superior, junto con la región de la cabeza y el cuello, con un 14.3% (9/63). El resto correspondió a sitios como piel de la extremidad inferior y región torácica, con 6.3% (4/63) y 11.1% (7/63), respectivamente. Solo en un 6.3% (4/63) no se pudo especificar la región en la piel.
En cuanto a los sitios diferentes a piel, se encontró que el pulmón ocupó el lugar más frecuente de localización, con un 9.5% (6/63), seguido de la localización visceral y el sistema nervioso central, con un 4.7% (para cada uno).
El 6.35% (4/63) se localizó en mucosas y el 4.7% (3/63) en el lecho ungueal. Y con una menor frecuencia en general, solo el 1.5% (1/63) se localizó en glándulas (fig. 2).
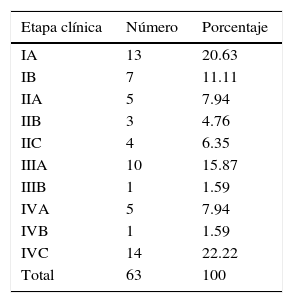
Etapa clínicaSe obtuvo un 31.7% (20/63) en EC I, un 18.9% (12/63) en EC II, un 17.3% (11/63) se clasificaron como EC III y un 31.6% (20/63) como EC IV. En la tabla 3 se observa de manera desglosada cada EC.
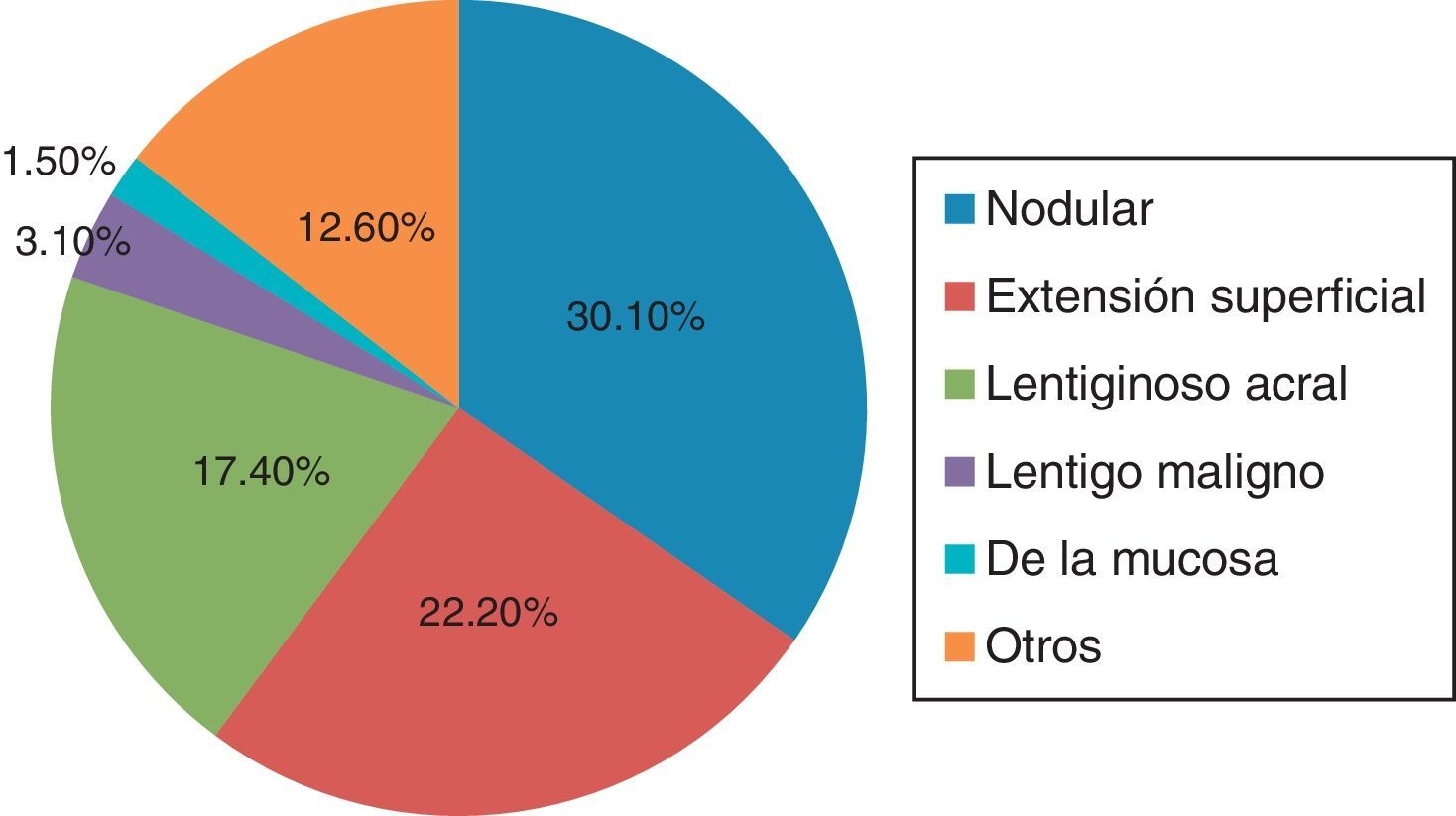
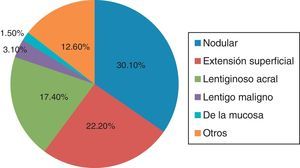
Características anatomopatológicasTipo histológico del melanomaDe las 63 biopsias estudiadas, el 30.1% (19/63) se reportó como tipo nodular, el 22.2% (14/63) como extensión superficial, el 17.4% (11/63) como lentiginoso acral y el 12.6% (8/63) se clasificó en la categoría de otros (como epiteloide, fusocelular).
Con menor frecuencia se reportaron lentigo maligno y de la mucosa (en un 3.1% [2/63] y un 1.5% [1/63], respectivamente). Cabe señalar que un 12.6% (8/63) de las biopsias no reportó tipo histológico (fig. 3).
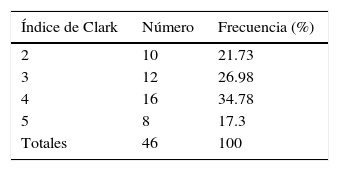
Breslow y ClarkDe los 63 reportes de anatomía patológica estudiados, el índice de Breslow se documentó en el 73% de los pacientes (46/63) en el momento del diagnóstico, obteniéndose un promedio de 1.9mm (±1.58). El mayor índice en un paciente fue de 6.5mm, y el menor, de 0.11mm. Solo el 73% (46/63) de los pacientes contaba con un índice de Clark reportado por biopsia. La frecuencia de pacientes de acuerdo con el índice de Clark se muestra en la tabla 4.
Ganglio centinelaEl procedimiento del ganglio centinela de la muestra de pacientes del estudio fue realizado en 52 (82.5%) de ellos; las frecuencias reportadas pueden observarse en la tabla 5.
Características de laboratorioConteo de células blancas e INL, incluyendo todas las EC.
De los 63 pacientes estudiados y que contaron con biometría hemática completa se obtuvo una media de 7.3×103/μL (DE 2.7×103/μL) en la cuenta de células blancas.
Leucocitos totalesHablando específicamente de neutrófilos absolutos y su porcentaje, se obtuvo una media de 5.0×103/μL (DE 2.7×103/μL) y una media de 65.16% (DE11.76%), respectivamente (tabla 6).
Neutrófilos absolutosLa información sobre los neutrófilos absolutos puede consultarse en la tabla 7.
Linfocitos absolutosEn cuanto al INL, de los 63 pacientes se obtuvo una media de 4.1 (DE 6.44) y una mediana de 2.7 (tabla 8).
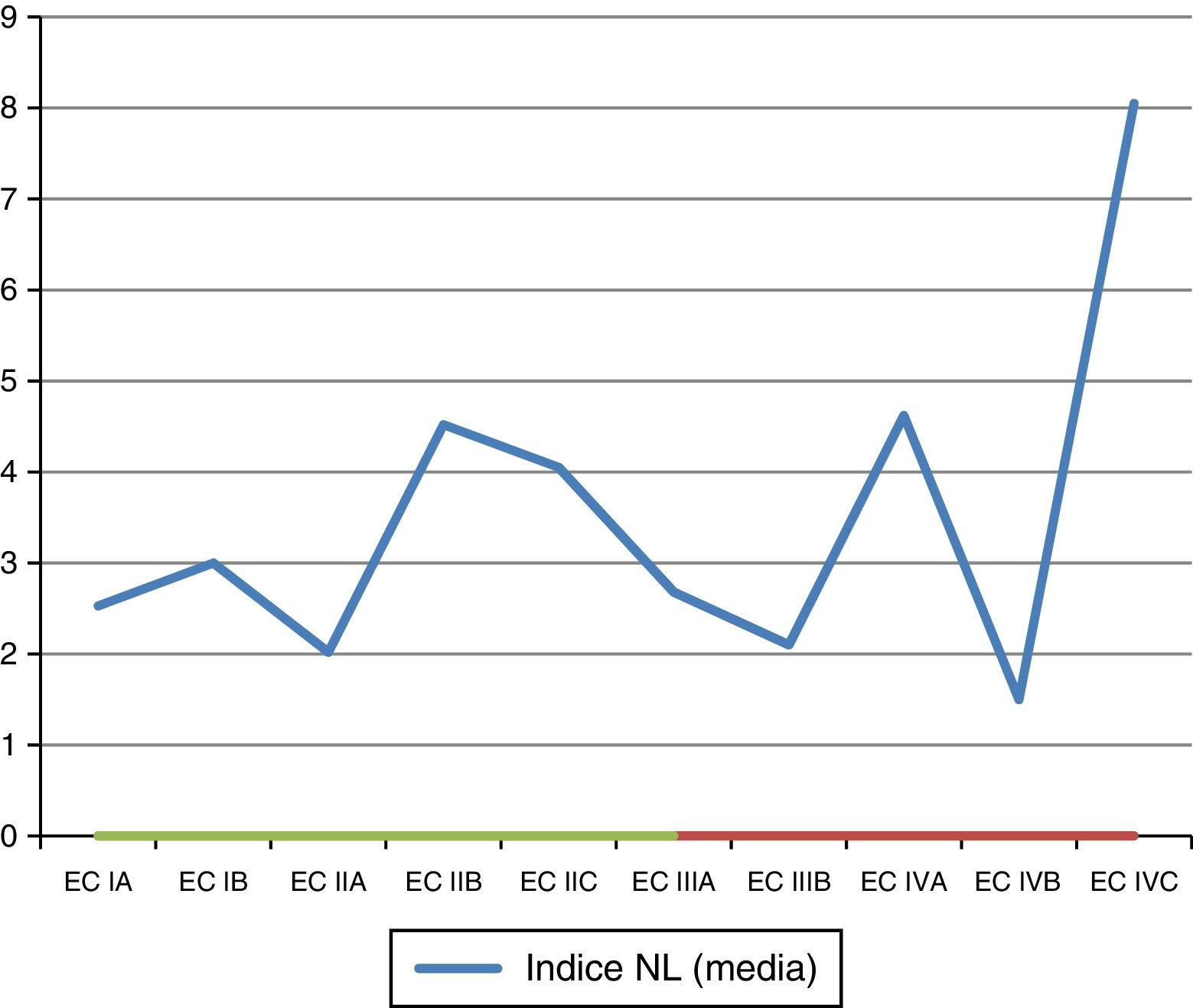
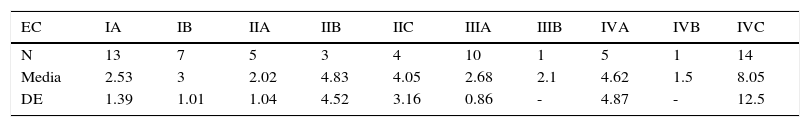
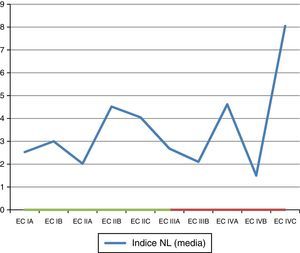
Índice neutrófilo-linfocitoSe analizaron las medias de INL de acuerdo con la EC reportada en el estudio (tabla 9; fig. 4).
Se generó una variable tomando en cuenta a pacientes en EC avanzada (>IIA) y el INL con los valores>2.0 y>2.7, encontrándose una tendencia de asociación con el punto de corte del INL>2.7 (tabla 10).
Al buscar una asociación con el INL existe una tendencia a presentar una asociación entre el INL (>2.7) y estar en una EC avanzada (>IIa) (OR de 2.72; IC 95% 0.85-8.88); sin embargo, no fue estadísticamente significativa (p=0.057).
Pruebas de correlaciónSe evaluó la correlación entre el INL y el desenlace clínico: muerte, recurrencia, progresión.
En este estudio se encontró una correlación del 58% (una magnitud alta de acuerdo con los criterios Gillrod) entre el INL (>2.7) y el desenlace de muerte en el subgrupo de pacientes en EC>IIA. Se encontró correlación entre el INL de 2.7 y el desenlace de muerte en el subgrupo de pacientes con enfermedad avanzada (EC>IIA) con una correlación alta (58%) (p=0.0005).
Al realizar la búsqueda de asociación entre el INL>2.7 (establecido como mediana en este estudio) y una EC avanzada (>IIa) se encontró que existe una tendencia (OR de 2.72; IC 95% 0.85-8.88); sin embargo, esta no es estadísticamente significativa (p=0.057).
Al realizar pruebas de correlación entre el INL (>2.0) y los diversos desenlaces clínicos, no se encontró correlación estadísticamente significativa.
Se decide realizar un análisis de correlación entre el INL (>2.7) y los índices de Clark y Breslow, no encontrando correlación estadísticamente significativa.
A su vez, realizamos un análisis de correlación entre el INL (>2.0) y los índices de Clark y Breslow, no encontrando correlación estadísticamente significativa.
Por último, se buscó correlación entre el INL>2.7 y la presencia de los patrones de presentación del melanoma en el momento del diagnóstico (extensión superficial, ulcerado, nodular, lentiginoso, acral), no encontrando correlación estadísticamente significativa entre estos subtipos y el INL.
Se analizó también la correlación entre el INL>2.0 y la presencia de los patrones de presentación del melanoma en el momento del diagnóstico (extensión superficial, ulcerado, nodular, lentiginoso, acral), no encontrando correlación estadísticamente significativa entre estos subtipos y el INL.
No se obtuvieron correlaciones por no contar con el tamaño suficiente de muestras.
DiscusiónAl elaborar el siguiente trabajo se realizó una búsqueda sistematizada de manera electrónica en la base de datos PubMed, donde se encontraron 730 artículos desde el año 1976 hasta julio del 2015, en donde se incluían las siguientes palabras: neutrophil, lymphocyte, ratio y cancer.
Para este protocolo se establecieron 2 puntos de corte; el primero, de acuerdo con la raza, obtenido en el estudio ya mencionado, por lo que se optó por recomendar un INL de 2.0, ya que la mayoría (54%) de los pacientes incluidos son hispanos.
El segundo, al realizar el análisis estadístico, en el que se tomó como punto de referencia un INL de 2.7 (según la mediana), ya que no se logró obtener una media (promedio) por la gran dispersión de datos debido a que la mayoría de los pacientes analizados se encontraba en EC con indicación quirúrgica como método definitivo curativo, es decir, no existía evidencia de enfermedad al realizarse la medición del INL.
Se realizó un subanálisis de acuerdo con los distintos escenarios clínicos, iniciando con las etapas tempranas en las que, de acuerdo con la literatura, la supervivencia estimada a los 10 años de los pacientes con melanomas t1 es de aproximadamente un 92%, en comparación con solo el 50% de los pacientes con melanomas t4. Del mismo modo, la ulceración es un fuerte predictor en pacientes con melanoma, con tasas de supervivencia a 5 años del 71% para t4a, en comparación con el 53% de los melanomas T4b.
Las debilidades del estudio son que es un análisis retrospectivo y que existieron sesgos de selección, por lo que no se pudieron demostrar los objetivos de este estudio, aunque sí se pudo obtener una correlación del INL y el desenlace de muerte, lo cual pudiera evidenciar un factor pronóstico independiente, siempre y cuando pueda reproducirse esta asociación en estudios prospectivos e incluso con intervención terapéutica.
Actualmente se ha descrito y estudiado el INL en otras neoplasias: cáncer gástrico, tumores sólidos, cáncer colorrectal, cáncer de próstata, linfomas, cáncer cervicouterino, cáncer hepático y sarcomas de tejidos blandos, entre otras.
Existe evidencia en otras neoplasias, como en el caso del sarcoma de tejidos blandos, donde se evaluó el papel del INL en escenario preoperatorio y se correlacionó el índice elevado>2.3 con una disminución en la supervivencia libre de recurrencia (p=0.031), y en la estimación de supervivencia global (p=0.007), como factor pronóstico independiente, sustentando el aumento con la enfermedad activa.
ConclusionesEl presente estudio evidencia una tendencia a la asociación entre el INL>2.7 y la EC (sin embargo, no fue estadísticamente significativo por la limitante del tamaño de la muestra).
Se encontró una correlación única con el subgrupo de pacientes con enfermedad avanzada y un INL>2.7 y el desenlace de muerte, no así en las demás variables (progresión y recurrencia).
Es necesario realizar estudios prospectivos para determinar el papel del ILN en el melanoma, tomando en cuenta los resultados de este estudio, y finalmente poder incluir o descartar este parámetro bioquímico como un marcador pronóstico o probablemente predictivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.