El trasplante alogénico de células progenitoras hematopoyéticas (TACPH) es el tratamiento de elección para diversas hemopatías malignas. Sin embargo, la morbimortalidad asociada al procedimiento limita su uso.
ObjetivosDescribir la supervivencia de pacientes adultos mexicanos sometidos a un TACPH utilizando BUCY 2 reducido.
MétodosEstudio de cohorte retrospectivo de octubre de 1999 a diciembre del 2014. Se evaluaron las características clínicas, la mortalidad asociada a trasplante, la supervivencia libre de enfermedad y la supervivencia global (SG) de 35 pacientes sometidos a TACPH con este nuevo método de acondicionamiento.
ResultadosSe incluyó a 35 pacientes sometidos a TACPH, de donador relacionado HLA idéntico, acondicionados con BUCY 2 reducido, con una mediana de edad de 33 años (rango 16-49). El 60% de los pacientes fueron hombres. El diagnóstico más frecuente fue: síndrome mielodisplásico 14 pacientes (40%), leucemia mieloide crónica 9 pacientes (25.7%), leucemias agudas 10 pacientes (23.5%) y hemoglobinuria paroxística 2 pacientes (5.7%). La mediana de células CD34+transfundidas fue de 2.04×106/kg. La mediana de recuperación de neutrófilos y plaquetas fue de 21 y 18 días, respectivamente. La toxicidad más frecuente fue mucositis (91.4%). La mortalidad relacionada al trasplante fue del 5.7% y la SG a 5 años fue del 72.5%.
ConclusionesEl método de acondicionamiento BUCY2 reducido conserva un efecto citotóxico que permite erradicar la clona maligna y lograr el injerto con mínima morbimortalidad, representando una mejor alternativa para el TACPH.
Allogeneic stem cell transplantation (ASCT) is the ideal treatment for haematological malignancies. However, the morbidity and mortality associated with the procedure limit its use.
ObjectivesTo describe clinical characteristics, toxicity, and survival of adult Mexican patients undergoing ASCT using busulfan with a reduced dose of cyclophosphamide (BUCY 2) as a conditioning method.
MethodsA prospective cohort study was conducted from October 1999 to December 2014, by performing an analysis of clinical characteristics, complications, and survival of 35 patients using this conditioning regimen.
ResultsThe study included 35 patients undergoing ASCT with reduced BUCY 2. All of them had an HLA-matched related donor, with a median age of 33 years (range 16-49), and 60% were male. The patients had the following underlying diseases: myelodysplastic syndrome in 14 patients (40%), chronic myeloid leukaemia in 9 (25.7%), acute leukaemia in 10 (23.5%), and paroxysmal nocturnal haemoglobinuria in 2 (5.7%). The median of transfused CD34+cells was 2.04×106/kg. The median time to neutrophil and platelet recovery was 21 and 18 days, respectively. The most common toxicity was mucositis (91.4%). Transplant related mortality was 5.7%, and 5-year overall survival was 72.5%.
ConclusionsThe conditioning method described earlier preserves a cytotoxic effect allowing eradication of the malignant clone, and achieving a graft with acceptable toxicity, and low transplant related mortality, representing a good alternative for ASCT.
El trasplante alogénico de células progenitoras hematopoyéticas (TACPH) es actualmente el tratamiento de elección para diversas enfermedades hematológicas malignas y no malignas. Desafortunadamente, este procedimiento, además de ser costoso, se asocia a una elevada mortalidad (del 25 al 35%)1,2 y a complicaciones tardías causadas directa o indirectamente por el acondicionamiento3.
Dado que durante las primeras 2 décadas del programa de trasplante de CPH en nuestro centro se observó una elevada morbimortalidad (50%), en los últimos 12 años decidimos implementar un nuevo método de TACPH en hemopatías malignas, diferente del método estándar que se había utilizado hasta entonces. Este consistió en reducir las dosis del esquema de acondicionamiento estándar BUCY 2, que denominamos BUCY 2 reducido. En este estudio se presentan los resultados obtenidos utilizando este acondicionamiento para TACPH en pacientes adultos tratados en nuestra institución.
Material y métodosSe incluyó de manera prospectiva a 35 pacientes que contaban con donador familiar HLA idéntico, tratados de octubre de 1999 a diciembre del 2014.
Obtención de células progenitoras hematopoyéticas y régimen de acondicionamientoLa obtención de CPH se realizó mediante aspiración múltiple de crestas ilíacas, en quirófano y bajo bloqueo espinal. El donador recibió factor estimulador de colonias de granulocitos (10μg/kg/día), 3 a 5 días previos a la aspiración.
Las dosis del esquema de BUCY reducido fueron: busulfán 12mg/kg, dividido en 4 días (3mg/kg/día, en –7, –6, –5, –4), ciclofosfamida 80mg/kg dividido en 2 días (40mg/kg/día, en –3 y –2). La profilaxis para enfermedad injerto contra huésped (EICH) fue a base de ciclosporina A (CyA) y metotrexato (MTX). El MTX se administró por vía IV a dosis de 15mg/m2 el día+3, y 10mg/m2 los días+6 y+11. La CyA se administró por vía IV a dosis de 1.5mg/kg cada 12h, iniciando desde el día –1 y ajustándose de acuerdo con los niveles séricos (200-300 ng/μl) hasta 2005; posteriormente la CyA se administró por vía oral (VO) a dosis de 10mg/kg el día –1 y 5mg/kg a partir del día 0, ajustándose la dosis de acuerdo con los niveles séricos. La CyA se mantuvo hasta los 4 meses postrasplante y después se redujo semanalmente (10%) hasta su suspensión, a menos que hubiera desarrollo de EICH. Se utilizaron los criterios de los institutos nacionales de salud (NIH) de Estados Unidos de Norteamérica (EE. UU.) para evaluar la gravedad de la EICH aguda y crónica4-6.
Profilaxis infecciosaLa profilaxis para infecciones consistió en: ciprofloxacina (500mg c/12h, VO) y aciclovir (250mg c/8h, IV), que se administraron desde el inicio del acondicionamiento. Se administró anfotericina B a dosis de 0.2mg/kg cada 24h a partir del día en que la cuenta de neutrófilos totales fue de<500/μL. Posterior al injerto de la médula ósea (MO) trasplantada, se realizó la determinación semanal de antigenemia para citomegalovirus, mediante cultivos rápidos para detectar leucocitos con la proteína pp65(+), suspendiéndose esta determinación al cuarto mes postrasplante si no había desarrollo de infección. En caso de positivización, se inició tratamiento con ganciclovir a dosis de 5mg/kg IV cada 12h por 14 días. Una vez resuelto el episodio de infección, se continuaba con la determinación de antigenemia (cada 15 días) hasta el primer año postrasplante.
Definiciones operacionalesSe determinó prospectivamente la morbilidad del trasplante mediante la evaluación de la toxicidad de acuerdo con los criterios de los NIH (CTCAE v4.0)7. La mortalidad asociada al trasplante se definió como muerte relacionada al acondicionamiento, a la aplasia postrasplante y/o a las infecciones que se presentaron hasta la recuperación de la inmunidad.
Se consideró injerto de neutrófilos al primero de 3 días consecutivos con una cuenta de granulocitos mayor de 0.5×109/L. El injerto de plaquetas se definió como una cuenta plaquetaria mayor de 20×109/L, por 3 días consecutivos, sin apoyo transfusional. Se definió falla del injerto a la incapacidad para lograr injerto de neutrófilos y plaquetas en los primeros 45 días postrasplante. De 1999 a 2002, se estableció el quimerismo sobre la base del grupo sanguíneo o cromosomas sexuales cuando había diferencia de género. Del 2002 al 2009, el quimerismo se determinó mediante microsatélites con 4 equipos de secuenciación, y a partir del 2010, y hasta la actualidad, el quimerismo se determina mediante polimorfismos de nucleótidos o single nucleotide polimorphism en tiempo real.
En pacientes con LGC, se realizó el seguimiento mediante citogenética y FISH para t9;22, y en algunos pacientes, además con reacción en cadena de la polimerasa para BCR/ABL.
Se obtuvo consentimiento por escrito de todos los pacientes previo a la realización del trasplante.
Análisis estadísticoLas variables continuas se describieron mediante medianas e intervalos y las categóricas en frecuencias y proporciones. Se emplearon curvas de Kaplan-Meier para el cálculo de la supervivencia global, así como medidas de tendencia central para analizar las características de la población, la recuperación postrasplante (días de recuperación de neutrófilos, plaquetas) y días de hospitalización, utilizando el paquete estadístico SPSSv21.0.
ResultadosEn el período de octubre de 1999 a diciembre del 2014 se realizaron 35 trasplantes alogénicos con MO estimulada con factor estimulante de colonias de granulocitos con esquema de acondicionamiento BUCY2 reducido.
La mediana de edad en el momento del TCPH fue de 33 años (intervalo 16-49); 21 hombres (60%) y 14 mujeres (40%). Los diagnósticos, en orden de frecuencia, fueron: síndrome mielodisplásico (SMD) 14 pacientes (40%), leucemia mieloide crónica (LMC) 9 pacientes (25.7%), leucemia linfoide aguda (LAL) 8 pacientes (22.8%), leucemia mieloide aguda (LAM) 2 pacientes (5.7%) y hemoglobinuria paroxística 2 pacientes (5.7%).
La mediana de células CD34+transfundidas fue de 2.04×106/kg (rango 0.99-4.5×106/kg). Todos los pacientes injertaron. La mediana de recuperación de neutrófilos y plaquetas fue de 21 (rango de 14-31) y de 18 días (rango de 7-45), respectivamente. La mediana de hospitalización fue de 37 días (rango de 20-61).
El 94.2% ameritó transfusión de paquetes globulares (33 pacientes). La mediana de paquetes globulares transfundidos fue 4 (rango de 0-16). La mediana de aféresis plaquetarias transfundidas fue 7 (rango de 0-22).
En relación con la toxicidad asociada al esquema de acondicionamiento, todos los pacientes presentaron algún grado de toxicidad, en 17 pacientes (48.5%) se catalogó como grado iii-iv. Un paciente (3.1%) presentó náusea grado iii; un paciente (3.1%) presentó diarrea grado iii; 32 pacientes (91.4%) presentaron mucositis, siendo de grado iii-iv en 18 de ellos (51.4%); 5 pacientes (14.2%) presentaron toxicidad hepática grado iii; ningún paciente presentó vómito o toxicidad renal grado iii-iv; 2 pacientes (6.3%) desarrollaron enfermedad venooclusiva, que revirtió con manejo de soporte.
Con el tratamiento inmunosupresor, 8 pacientes (80%) presentaron respuesta completa y actualmente se encuentran sin tratamiento. De los 4 pacientes restantes, 2 continúan bajo tratamiento inmunosupresor, uno falleció por complicaciones y otro se perdió del seguimiento.
En 8 pacientes (25%) se documentó recaída de la enfermedad: 6 pacientes con diagnóstico de LGC, uno con diagnóstico de LAL y uno con diagnóstico de LAM. El manejo en 5 pacientes con LGC fue con infusión de linfocitos del donador, en 2 con un segundo TCPH alogénico y en uno con TCPH autólogo. En 5 pacientes (15.6%) se documentó rechazo del TCPH; todos recibieron tratamiento con bolos de metilprednisolona. En 4 pacientes (80%) se observó recuperación del injerto al 100% y un paciente (20%) presentó rechazo definitivo, por lo que fue sometido a un segundo TCPH alogénico.
Con una mediana de seguimiento de 53 meses (rango 5-149), 27 pacientes (77.1%) se encuentran vivos, 7 pacientes (20%) han fallecido y uno se perdió. La mortalidad asociada al trasplante fue del 5.7% (2 pacientes). La mortalidad a 30 días es del 0% y a 100 días es del 5.7%. De los 7 pacientes fallecidos, en 3 (8.5%) la causa fue recaída de la enfermedad, un paciente (2.8%) por infección en aplasia y 2 pacientes por complicaciones de quimioterapia de salvamento y otro por otras causas. En el último seguimiento, los 27 pacientes vivos se encuentran sin enfermedad clínica o citogenética.
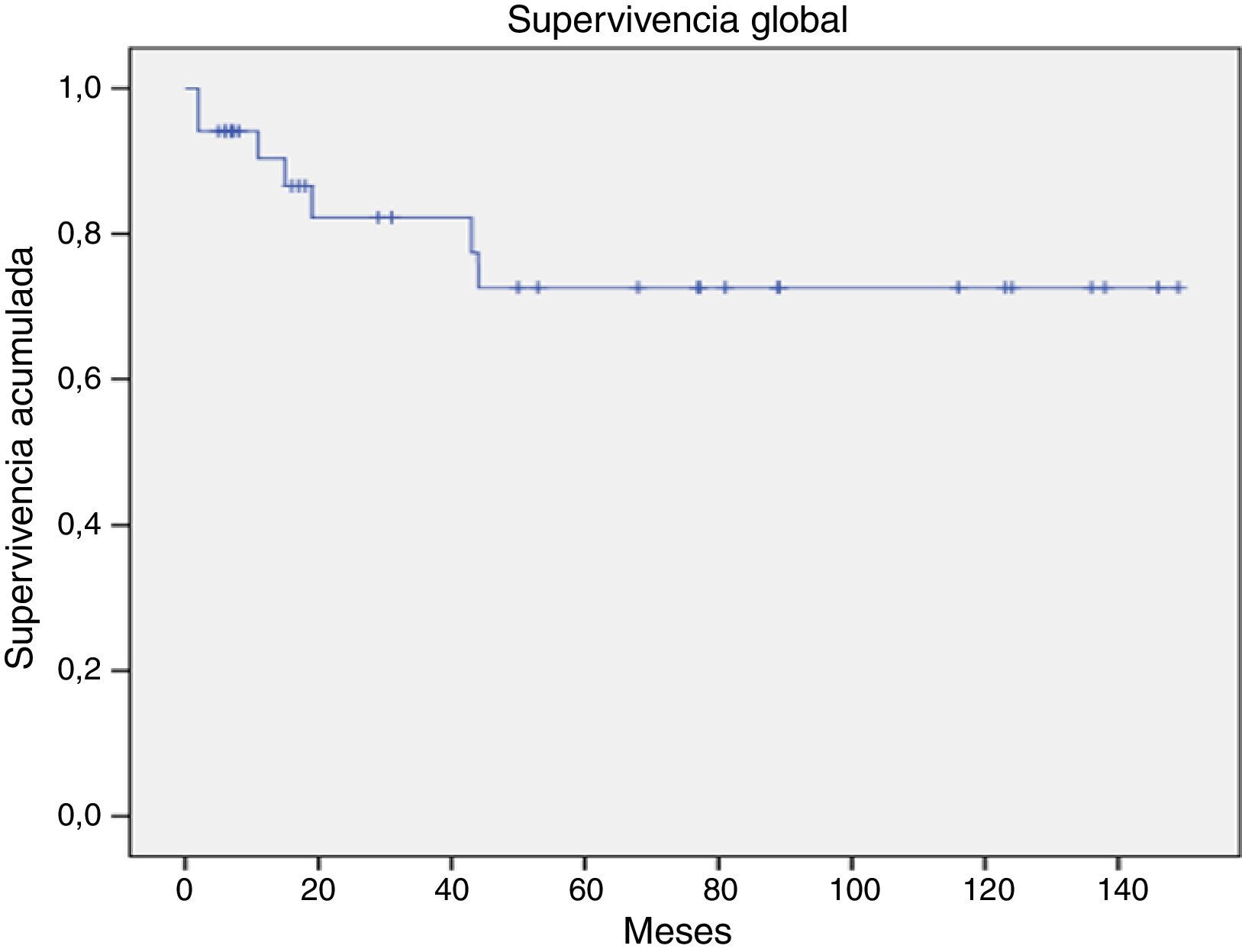
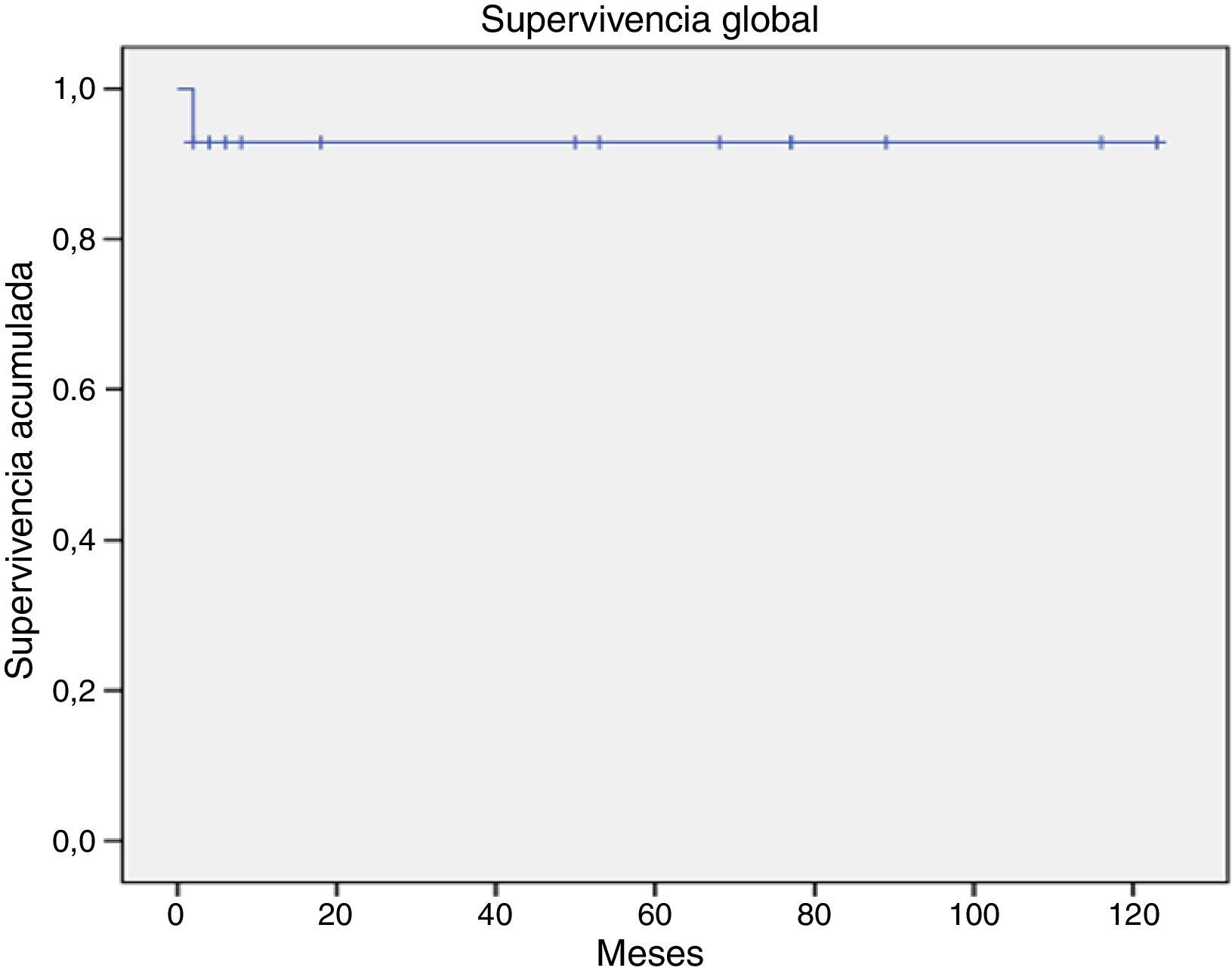
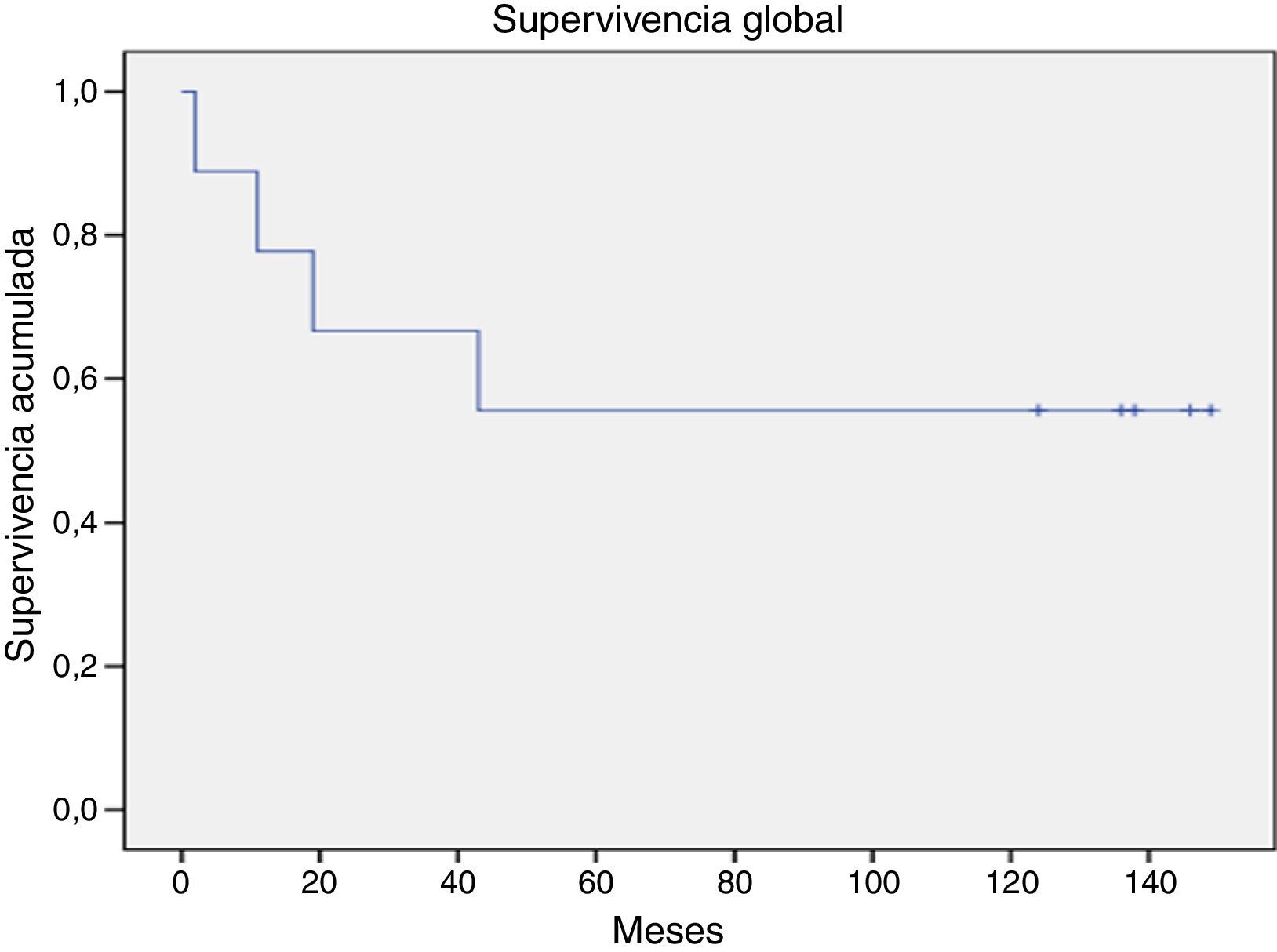
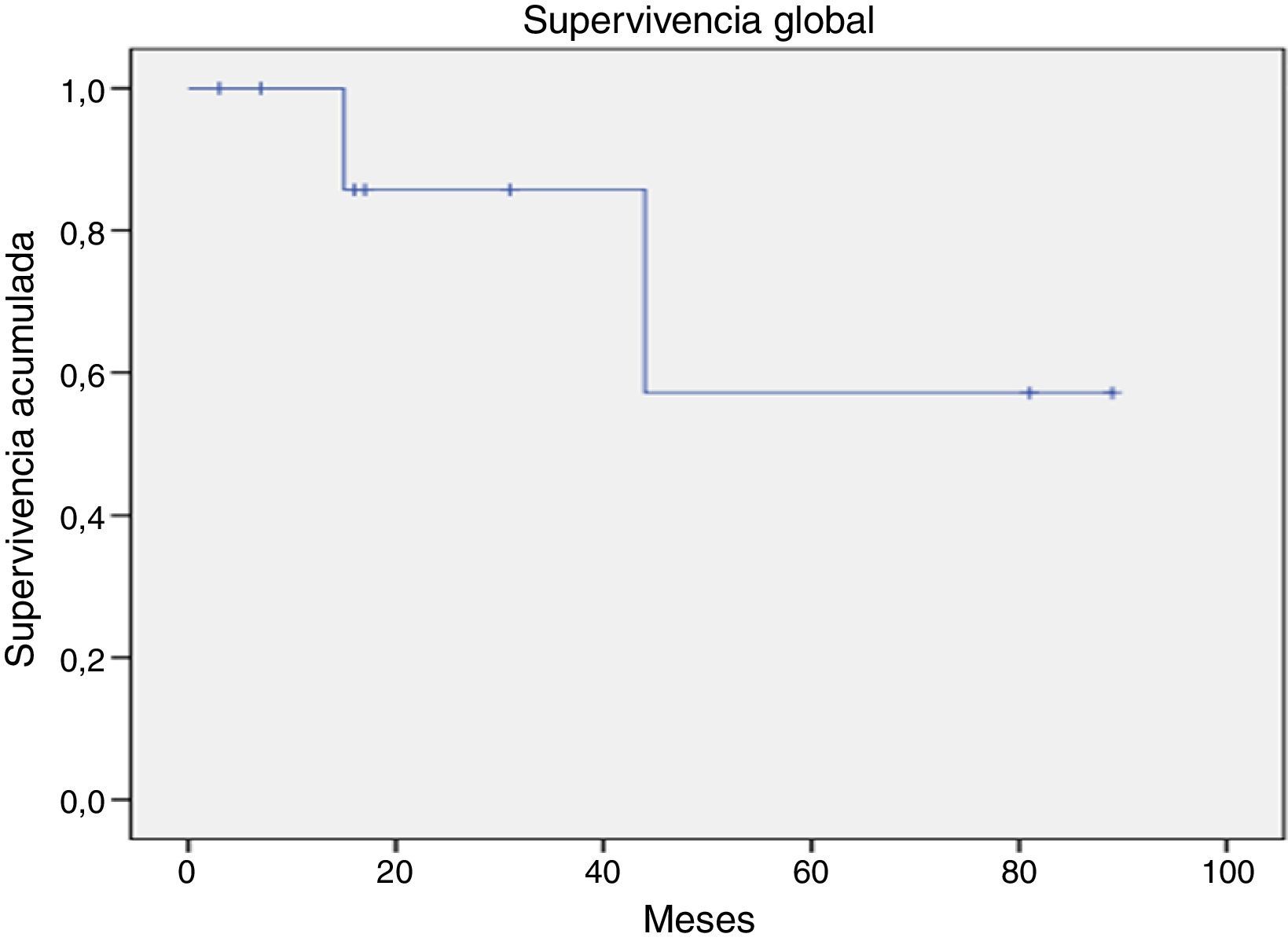
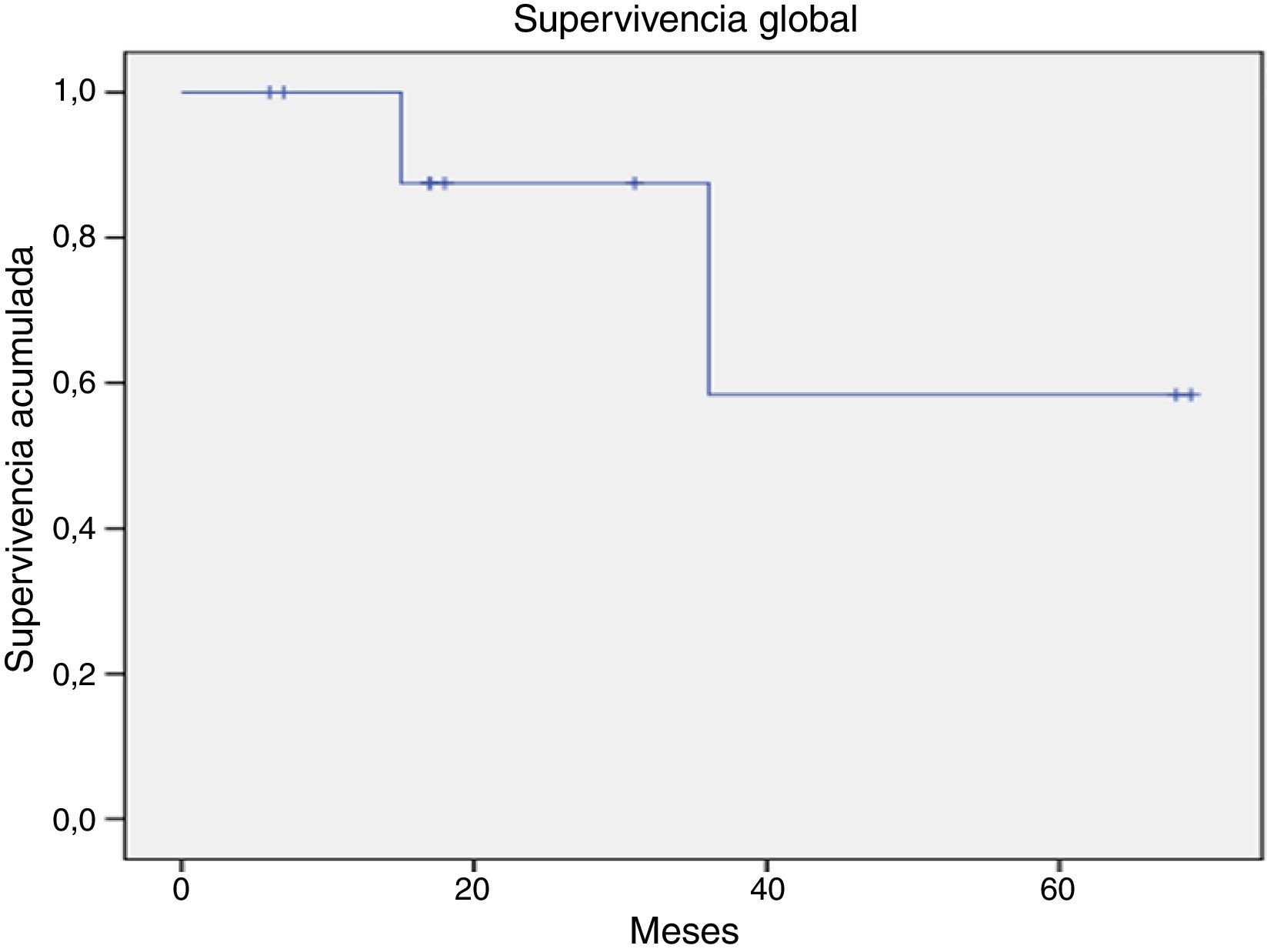
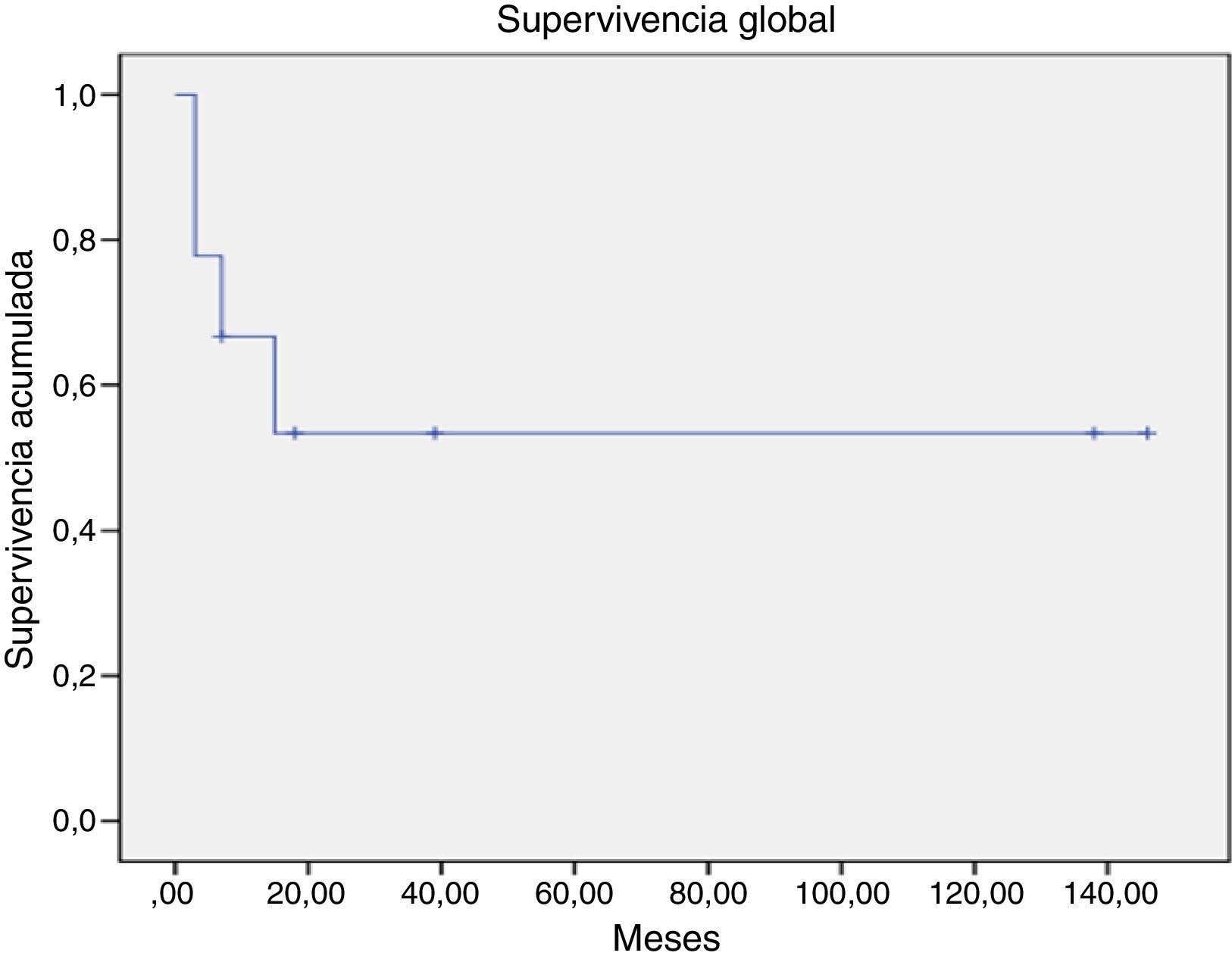
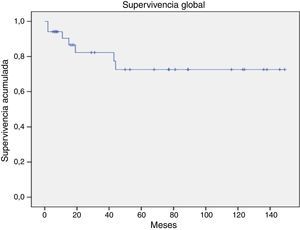
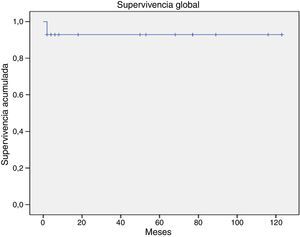
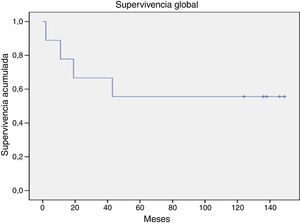
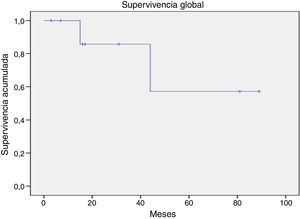
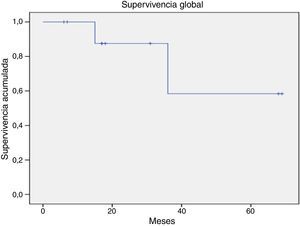
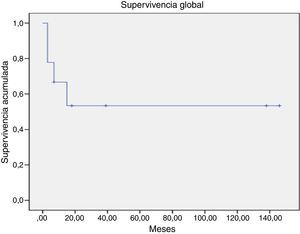
La supervivencia global para todo el grupo a 5 años es del 72.5% (fig. 1). De acuerdo con el diagnóstico, la SG a 5 años fue del 92.8% en SMD, el 55.5% en LGC y el 57.1% en leucemia aguda. La supervivencia libre de enfermedad a 5 años para los SMD fue del 100%, para las leucemias agudas del 58.3% y del 53.3% para las LGC (figs. 2-6).
Una de las limitantes principales para el uso generalizado de los TACPH es su elevada mortalidad (30-40%) y las complicaciones que potencialmente pueden condicionar complicaciones letales y deterioro de la calidad de vida.
Históricamente, se sabe que los pacientes que reciben progenitores hematopoyéticos de sangre periférica presentan complicaciones agudas que varían (dependiendo de la serie consultada) del 14 al 70%, probablemente asociada a la cantidad de linfocitos T alorreactivos contenidos en el inóculo8. Asimismo, la incidencia de complicaciones crónicas con el uso de sangre periférica ha sido mayor que en pacientes que reciben MO sin estimular9.
Por estas razones, en años recientes han emergido nuevas estrategias terapéuticas que intentan reducir su morbimortalidad10. Desde el uso de progenitores obtenidos de MO, estimulación con factor estimulante de colonias, manipulación del injerto con depleción de linfocitos T y uso de potentes inmunosupresores como globulina antitimocito, alemtuzumab como parte del acondicionamiento pretrasplante, entre otras.
La utilización de regímenes pretrasplante menos intensivos, conocidos como acondicionamientos no mieloablativos o de intensidad reducida, tiene como objetivo primordial lograr el injerto de las CPH y la inducción de un efecto de injerto (médula trasplantada) contra malignidad (leucemia aguda, linfoma, mieloma múltiple, etc.) (ICM). Estos acondicionamientos están encaminados a proporcionar la inmunosupresión suficiente para permitir el injerto de las CPH del donador y el consecuente efecto de ICM. Este tipo de trasplantes ha mostrado una reducción de la mortalidad (10-20%), con supervivencias libres de enfermedad en leucemias agudas o crónicas de 52 a 5611-13.
Dada la alta toxicidad y mortalidad asociada con el BUCY 2 estándar durante las primeras 2 décadas del programa de TACPH en nuestra institución, se decidió, a fines de 1999, intentar un nuevo método para reducir la mortalidad asociada al trasplante e incrementar la tasa de curación, con una estrategia diferente de la de los trasplantes no mieloablativos. Este método consiste, en la reducción de la dosis del esquema de acondicionamiento estándar del esquema BUCY 2 (25% de busulfán y 20% de ciclofosfamida), considerando que con esta reducción se conserva su capacidad mieloablativa, con reducción del daño tisular y, por consecuencia, de su toxicidad a diferentes niveles. Esto se traduciría en una reducción en la mortalidad, conservando su capacidad inmunosupresora para permitir el injerto de la médula trasplantada y el subsecuente efecto de ICM.
Por otro lado, en cuanto a la fuente de células progenitoras hematopoyéticas, se decidió utilizar MO estimulada con FEC (obtenida a través de punciones múltiples de ambas crestas ilíacas) en lugar de sangre periférica de donadores previamente estimulados con este factor, que es el método actualmente utilizado por la mayoría de los centros. A este respecto, estudios como el del grupo cooperativo americano14 han mostrado que cuando se usa MO en comparación con sangre periférica, existe una ventaja de esta última en cuanto a velocidad de recuperación hematológica, Sin embargo, el estudio del grupo cooperativo francés15, así como el metaanálisis publicado en 200116, muestran claramente que utilizar CPH de sangre periférica se asocia a un incremento en la frecuencia de EICH, tanto agudo como crónico, existiendo ventaja de la sangre periférica, en cuanto a supervivencia, únicamente en los pacientes con hemopatías en etapa avanzada (LGC en segunda fase crónica, fase acelerada o fase blástica, LAM o LAL refractarias o ≥ 2.a remisión completa, mielofibrosis primaria). La decisión de utilizar MO estimulada con FEC se basó en diversos reportes que muestran que con esta medida se elimina la ventaja que tienen las CPH de sangre periférica en cuanto a la velocidad de recuperación hematológica, tanto en trasplantes autólogos17 como alogénicos18-20. En el estudio de Li et al.10, en el que se comparan diferentes fuentes de progenitores hematopoyéticos, incluida la MO estimulada, se demostró que con el uso de esta fuente hubo una disminución significativa de la incidencia de complicaciones como EICH, comparado con progenitores obtenidos de sangre periférica, sin incrementar la incidencia de recaída y favoreciendo también la supervivencia global comparada con MO sin estimular21.
Nuestros resultados con la utilización de este régimen de acondicionamiento muestran una supervivencia a 5 años del 72.5%, una velocidad de injerto (21 días para los neutrófilos y 18 días para las plaquetas) similar a la publicada con el uso de CPH de sangre periférica, requerimientos transfusionales bajos tanto para paquete globular como para plaquetas, y una hospitalización corta. Lo más importante fue la reducción dramática en la mortalidad asociada al trasplante, que fue del 5.7%, lo que contrasta con los resultados que se obtienen con el esquema estándar (20-40% de mortalidad) y que son inferiores aun a lo obtenido con esquemas de intensidad reducida.
En cuanto a la morbilidad del esquema de acondicionamiento, en nuestra serie la principal toxicidad fue mucositis (grado ii-iii) en la mayoría de los casos, que resolvió con tratamiento de soporte, seguida de náuseas y vómito, que se controlaron con el uso de antieméticos durante el procedimiento del trasplante. La hepatotoxicidad se presentó en el 41.4% de los pacientes; sin embargo, esta fue transitoria, y es importante señalar que ninguna de las toxicidades mencionadas tuvo repercusión en la supervivencia global.
Otro hallazgo relevante fue la baja incidencia de EICH, tanto aguda como crónica (resultados no reportados), lo cual contrasta con lo reportado en los trasplantes convencionales22. La explicación de este hallazgo puede estar relacionada con la reducción de la dosis del esquema de acondicionamiento, que disminuiría el grado de daño tisular, uno de los mecanismos propuestos que inicia la cascada de eventos que culminan con el desarrollo de EICH, así como el uso de MO estimulada como fuente de CPH, tal como se ha reportado en diversos estudios que también han encontrado una baja frecuencia de EICH aguda con el uso de esta fuente de CPH16,17.
En cuanto a la frecuencia de EICH crónica en nuestra serie, fue similar a la reportada en la literatura internacional e inclusive inferior, dependiendo del tipo de patología y de la serie consultada18-21. Una posible explicación para esta reducción de la EICH podría ser que la estimulación de la MO con FEC ocasione una disminución tanto en el número como en la reactividad de la subpoblación de linfocitos que median la EICH. A este respecto, se ha demostrado que el número de células CD34+infundidas utilizando MO estimulada es 9 veces menor que cuando se utilizan CPH de sangre periférica22.
La alta tasa de recaída observada en los pacientes trasplantados por LGC se explicaría por una reducción tanto en el efecto de injerto contra huésped como el de injerto contra leucemia, por lo que esta fuente de CPH probablemente tenga su mayor aplicación en patologías en las que este efecto no sea de utilidad o de eficacia marginal (anemia aplásica, inmunodeficiencias, hemoglobinuria paroxística nocturna, LAL).
ConclusionesNuestros resultados muestran que el método de acondicionamiento BUCY 2 reducido desarrollado en nuestra institución tiene un efecto citotóxico e inmunosupresor que permite erradicar la clona maligna y, a la vez, lograr un adecuado injerto de la médula trasplantada con mínima morbimortalidad. Esto representa una nueva alternativa en el campo del trasplante alogénico de células progenitoras hematopoyéticas, que a largo plazo pudiera reducir los costos del trasplante, al disminuir las complicaciones potenciales asociadas e incrementar la supervivencia de los pacientes, lo cual beneficiaría a las instituciones gubernamentales que llevan a cabo este procedimiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.