Introducción: El cáncer de mama es la neoplasia más frecuente en mujeres y la segunda causa de muerte por cáncer, a pesar de los avances diagnósticos y terapéuticos. Hasta la fecha sólo algunos marcadores moleculares están validados como factores pronósticos y predictivos. PTP1B es una fosfatasa, la cual ha sido implicada en la regulación positiva de algunas vías de señalización en cáncer, entre ellas la vía de HER2. Estudios previos han demostrado una regulación positiva de PTP1B sobre la expresión de HER2. A pesar de esto, el mecanismo que ejerce PTP1B sobre HER2 aún no está bien establecido, asimismo se desconocen los efectos biológicos que esta modulación positiva conlleva.
Objetivo: Evaluar el papel del silenciamiento de PTP1B en la proliferación celular en cultivos primarios de cáncer de mama.
Materiales y método: Se realizaron ensayos de proliferación celular en cultivos primarios de cáncer de mama, en los cuales se silenció PTP1B mediante la transfección de plásmidos pGFPV-RS, que contienen shRNAs para PTP1B.
Resultados: El silenciamiento de PTP1B confiere una menor capacidad de proliferación celular, esto sugiere una menor capacidad de desarrollo de metástasis, en cultivos primarios de cáncer de mama.
Conclusión: El silenciamiento de PTP1B se asocia a una menor capacidad de proliferación celular, lo cual puede deberse a la regulación negativa de HER2. Estos resultados sugieren que PTP1B puede ser un marcador pronóstico y predictivo en cáncer de mama, lo cual justificaría la realización de estudios basados en la inhibición de esta fosfatasa, para desarrollar blancos moleculares específicos.
Introduction: Breast cancer is the most common neoplasm in women and the second leading cause of cancer-related death in spite of diagnostic and therapeutic advances. To date, only a few molecular markers have been validated as prognostic and predictive factors. PTP1B is a phosphatase that has been implicated in some cancer signaling pathways upregulation, including the HER2 pathway. Previous studies have demonstrated positive PTP1B regulation on the expression of HER2. However, the mechanism excerpted by PTP1B on HER2 is not yet well established, and the biological effects that this positive modulation entails are not known as well.
Objective: To assess the role PTP1B silencing on cell proliferation in primary cultures of breast cancer.
Materials and method: Cell proliferation assays were performed in primary cultures of breast cancer, where PTP1B was silenced by transfecting pGFP-V-RS plasmids containing shRNAs for PTP1B.
Results: PTP1B silencing confers a reduction in cell proliferation capacity, which suggests a decrease in the ability to develop metastasis in primary cultures of breast cancer.
Conclusion: PTP1B silencing is associated with a decrease in cell proliferation capacity, which may be due to HER2 negative regulation. These results suggest that PTP1B may be a prognostic and predictive marker in breast cancer, which would warrant the conduction of studies based on the inhibition of this phosphatase in order to develop specific molecular targets.
Introducción
El cáncer de mama es la neoplasia más frecuente en mujeres tanto en países desarrollados como en vías de desarrollo. A nivel mundial, se presentaron para el año 2008, 1.38 millones de casos nuevos (22.9% del total de neoplasias reportadas) y 458,000 muertes (10.9% del total de neoplasias reportadas) debidas a cáncer de mama, lo cual la ubica como la segunda causa de muerte por cáncer en el género femenino, después del cáncer de pulmón1. Las tasas de incidencia a nivel mundial, varían desde 19.3 casos por 100,000 mujeres en el este de África a 89.7 casos por 100,000 mujeres en el oeste de Europa. Los datos publicados por la Sociedad Americana de Cáncer en el 2013 ubican al cáncer de mama como la neoplasia más común en mujeres, lo cual representa el 29% del total de neoplasias reportadas. En Estados Unidos de América (EUA), el cáncer de mama es la segunda causa de muerte por cáncer en la población femenina, lo cual representa el 14% del total de muertes por cáncer, con 39,620 muertes por cáncer en un año2.
En México, los registros epidemiológicos muestran, que el número de nuevos casos reportados de cáncer de mama van en aumento, así como la tasa de mortalidad por esta causa.
Actualmente ocupa el primer lugar como causa de muerte por neoplasia maligna en las mujeres mayores de 25 años. En el año 2008 se reportaron 14,000 casos, lo cual representó el 21% del total de neoplasias reportadas en este género. También se presentaron para esa fecha un total de 5,000 muertes (13% del total de neoplasias reportadas) por cáncer de mama al año1. A pesar de los datos mencionados anteriormente, la tasa de mortalidad ha cambiado en los últimos años gracias al avance en el tamizaje, diagnóstico temprano y tratamiento del cáncer de mama, lo cual ha permitido una mayor supervivencia para estas pacientes.
Los factores pronósticos de mayor relevancia para el cáncer de mama son: el tamaño tumoral y el estado de los ganglios linfáticos axilares3. La supervivencia a 5 años para las pacientes con tumores pequeños y sin metástasis ganglionares varía entre un 85%-92%, mientras que para las pacientes con metástasis ganglionares, esta supervivencia puede disminuir hasta un 40%-80%4-6. El estudio morfológico de dicha neoplasia también aporta parámetros pronósticos de relevancia como lo son el grado de diferenciación y su clasificación histológica5.
En la última década se han investigado más de 100 marcadores pronósticos para cáncer de mama; a pesar de esto, son pocos los marcadores caracterizados y validados5. Entre los distintos marcadores pronósticos se encuentran onco-genes como HER2/neu, ciclina D1, cuya amplificación o sobreexpresión se relaciona con mayor agresividad tumoral y genes supresores como el gen p53, con funciones indispensables en el control del ciclo celular y cuya alteración se asocia a neoplasias más agresivas7,8. Los marcadores pronósticos y predictivos para el cáncer de mama son: los receptores de estrógenos (ER), los receptores de progesterona (PR) y el receptor HER2. Los estudios publicados sobre los genes HER2/neu y p53 les confieren valor pronóstico para el intervalo libre de enfermedad y supervivencia global, asimismo, les otorga valor predictivo indispensable en la terapia neo y adyuvante. Ambos marcadores se han relacionado con mala respuesta al tratamiento con tamoxifeno, inhibidores de aromatasa y regímenes específicos de quimioterapia7,8.
El estudio de las bases moleculares del cáncer ha conducido a la identificación de distintos oncogenes relacionados con los procesos biológicos como la proliferación y diferenciación celular. Las alteraciones descubiertas en estos onco-genes influyen en el comportamiento de algunas neoplasias, uno de los oncogenes más estudiados es HER2/neu/ERBB2. Este oncogén pertenece a la familia de receptores Her/ ERBB, que también incluye al receptor del factor de crecimiento epidérmico (EGFR/Her1/ERBB1), ERBB-3 (Her3) y ERBB-4 (Her4), los cuales pueden formar homo o heterodímeros9. Esta familia la constituye receptores de factores de crecimiento transmembranales tipo I, que funcionan activando cascadas de señalización intracelular en respuesta a señales extracelulares. Estas proteínas están estructuralmente conformadas por un dominio extracelular, uno transmembranal y otro intracelular. El dominio intracelular posee actividad de cinasa de tirosina. Después de la unión del ligando a su dominio extracelular, los receptores de la familia Her sufren dimerización y posteriormente autofosforilación de varios residuos de tirosina, de su dominio intracelular, que sirven de anclaje para varias moléculas de señalización intracelular, que conducen a diversos procesos biológicos10.
Los estudios publicados indican que la sobreexpresión del gen HER2/neu/ERBB2 se detecta en un 20%-30% de los casos de cáncer de mama9,11-13. Slamon et al. describió por primera vez, que la amplificación del gen HER2/neu/ERBB2 en cáncer de mama se asocia con un menor intervalo libre de enfermedad y menor supervivencia, esto le confiere a dicho gen un papel pronóstico en esta enfermedad14. Posteriormente, se publicaron varios estudios en los que se ha confirmado la relación entre la amplificación o la sobreexpresión del gen HER2/neu/ERBB2 y un mal pronóstico en cáncer de mama15. Se encuentra bien establecida la relación entre la sobreexpresión de HER2/neu/ERBB2 y otros factores pronósticos como: tamaño tumoral, alto grado tumoral, receptores hormonales negativos, estadio de la enfermedad, alto índice de proliferación celular16 y DNA aneuploide o tetraploide11,17-19. Sin embargo, la importancia de este oncogén no se limita a la estratificación de las pacientes en distintas categorías de riesgo, sino también es de vital importancia en la toma de decisiones terapéuticas20. Algunos trabajos experimentales revelaron la capacidad de inducir cáncer de mama en ratas, mediante la activación específica y selectiva de HER2; así como la posibilidad de inhibir el crecimiento tumoral mediante el tratamiento con anticuerpos específicos anti-HER221,22. En base a estos estudios, HER2 se convirtió en un blanco terapéutico prometedor para el cáncer de mama23,24. Estudios posteriores comprobaron que, con la utilización de un anticuerpo diseñado en contra del dominio extracelular del receptor HER2, trastuzumab, se producía la inhibición de dicho receptor, lo cual permitió que este medicamento fuera el primer agente biológico aprobado para el tratamiento de cáncer de mama con expresión de HER210,20. Existen estudios que han comprobado la eficacia y la seguridad del trastuzumab en el tratamiento neoadyuvante, adyuvante y en la enfermedad metastásica de cáncer de mama con expresión de HER211,20,23,25-27.
La fosforilación de proteínas en residuos de tirosina es una de las modificaciones postraduccionales más importantes que las células utilizan para regular las respuestas celulares. La regulación del estado de fosforilación en las proteínas es importante para procesos biológicos como la proliferación, diferenciación, migración y muerte celular. Dicho proceso también representa un punto de control para la integración de señales extracelulares y su posterior conversión en respuestas celulares28,29.
Los niveles de fosforilación de proteínas en residuos de tirosina se encuentran controlados por la acción coordinada de 2 tipos de enzimas llamadas: proteínas cinasas de tirosina (PTK, por sus siglas en inglés protein tyrosine kinase) y las proteínas fosfatasas de tirosina (PTP, por sus siglas en inglés protein tyrosine phosphatase)29. Las PTK's son las encargadas de añadir un grupo fosfato sobre residuos de tirosina de proteínas, dicho proceso produce un cambio estructural y promueve la interacción entre proteínas de las diferentes cascadas de señalización celular. A su vez, la acción de las PTK´s es regulada por la acción de las PTP's, dichas proteínas se encargan de quitar un grupo fosfato de un residuo de tirosina de una proteína. Cuando se produce una alteración entre el balance normal de la actividad de las PTK's y PTP's, se provoca una fosforilación aberrante de residuos de tirosina, lo cual ha sido relacionado con la etiología de varias enfermedades entre las cuales se encuentra el cáncer28,30-33.
El genoma humano codifica 107 PTP's, las cuales pertenecen a la superfamilia de las fosfatasas, siendo estructuralmente diversa, con efectos tanto estimulatorios como inhibitorios31,34-37. Las PTP's se dividen en 2 tipos: receptores y no receptores. Las PTP's contienen un dominio catalítico con una secuencia consenso conservada en todas las PTP (VHCSAGxGR[T/S]G), esta secuencia está flanqueada por diferentes dominios que regulan tanto la actividad como la localización de la enzima. El dominio catalítico contiene aproximadamente 280 aminoácidos y presenta un residuo de cisteína conservado que es necesario para la actividad catalítica. La defosforilación de los sustratos ocurre con alto grado de especificidad, a través de un mecanismo de 2 pasos que consiste en la formación de un intermediario que se forma a través de un enlace covalente de fosfato-PTP que subsecuentemente se hidroliza34,38. La función principal de las PTP's es revertir la acción de fosforilación de las PTK's. Sin embargo, las PTP's también pueden potenciar acciones de las PTK's; de este modo se aumentan las señales mitogénicas conduciendo a transformación y proliferación celular39.
Las primeras fosfatasas del tipo no receptor identificadas fueron PTP1B (PTPN1) y TC-PTP (PTPN2)40. PTP1B es una proteína que fue purificada de la placenta humana, se encuentra localizada en el cromosoma 20 específicamente en la región q13.1-q13.235,37,41,42. Esta enzima está formada por 435 aminoácidos con un peso de 50 kDa, contiene un dominio catalítico de 37 kDa hacia su extremo N-terminal, que está flanqueado por 2 dominios ricos en prolina y un dominio en el C-terminal que le permite el anclaje de la enzima a la cara citoplasmática del retículo endoplásmico41,43. La actividad catalítica de esta enzima está controlada por su localización en la superficie del retículo endoplásmico, ya que esto restringe su acceso a ciertos sustratos44-46. También existen otros mecanismos que regulan la actividad de PTP1B, como son: oxidación, fosforilación, sumoilación y proteólisis47-49.
Varios estudios han demostrado que PTP1B juega un papel importante en la señalización de las vías metabólicas y que puede ser un posible blanco terapéutico para la diabetes mellitus, la obesidad y otros desórdenes metabólicos asociados, ya que esta proteína participa en la regulación negativa de la señalización de los receptores de la insulina y la leptina40,50,51. Elchebly et al. demostró que la deleción del gen ptpn1 en ratones causa hipersensibilidad a la insulina y que además, esto está asociado con un incremento de la fosforilación de tirosina del receptor de insulina y sus sustratos primarios50. PTP1B puede inhibir la señalización de otras PTK's como los receptores de PDGF y HGF, mientras que la sobreexpresión de PTP1B en fibroblastos inhibe la transformación por oncogenes que incrementan la fosforilación de tirosinas incluyendo HER2, Src, Bcr-Acl, Crk y Ras47,52.
Esta enzima también es importante para la activación de las GTPasas de Rac y Ras, enzimas que están asociadas con incremento de la proliferación y motilidad celular. Además PTP1B puede activar a Src mediante defosforilación de la tirosina 527 (Y527)36,46,49,53,54. También se ha demostrado que la ganancia o amplificación de la región del cromosoma 20q13, sitio en el cual está localizada PTP1B, está asociada con pobre pronóstico en cáncer de mama. La sobreexpresión de algunas fosfatasas como la PRL-3, se han asociado con una menor supervivencia libre de progresión en cáncer de mama ganglios positivos, lo cual juega un papel pronóstico en este tipo de pacientes55,56. Sin embargo, estos datos contradicen lo que inicialmente se propuso con respecto a las propiedades antioncogénicas de estas fosfatasas, a través de la regulación negativa de la actividad de las PTK´s.
Datos recientemente reportados han demostrado que estas fosfatasas se encuentran involucradas en la regulación positiva de algunas vías de señalización en cáncer. PTP1B es un regulador positivo de la señalización de Ras, lo cual se demostró en fibroblastos deficientes de PTP1B57,58. Estudios recientes han demostrado que PTP1B participa en la vía de HER2 en la iniciación de la tumorigénesis en cáncer de mama. La inhibición de la expresión de PTP1B se asoció con la disminución de la fosforilación de Erk, sugiriendo de esta forma su participación en la génesis de tumores mamarios57,59,60. Julien et al. en el año 2007, demostró en modelos murinos que sobreexpresan HER2, que la deleción del gen ptpn1 producía un retraso en el desarrollo de tumores mamarios y resistencia para el desarrollo de metástasis pulmonares59. Estos resultados también fueron observados por Bentires-Alj y Neel, quienes demostraron que la deficiencia homocigota de PTP1B en modelos murinos, retrasa o impide el desarrollo de tumores mamarios, principalmente aquellos asociados a HER260. Por otro lado, Soysal et al. evaluó recientemente la expresión de PTP1B en tejido de pacientes con cáncer de mama, analizaron un total de 1,402 muestras y demostraron que el 49% de las pacientes presentaban expresión positiva de PTP1B. Asimismo, correlacionaron esta expresión de PTP1B con algunos factores de mal pronóstico ya establecidos, encontraron que existe una tendencia a tener mayor expresión de PTP1B en pacientes HER2 positivo (53% de expresión de PTP1B en pacientes HER2 positivo); sin embargo, esta tendencia no fue estadísticamente significativa. La expresión de PTP1B está asociada de manera significativa con la expresión de receptores de estrógenos (50.7% de expresión de PTP1B en pacientes con receptores de estrógenos positivos), esta expresión positiva de PTP1B también está asociada con los subtipos moleculares luminal B HER2 positivo y basaloide (53.9% expresión de PTP1B en luminal B HER2 positivo y 37.9% expresión de PTP1B en el subtipo basaloide). Asimismo, demostraron que la expresión de PTP1B es un factor pronóstico independiente de supervivencia en las pacientes con cáncer de mama61.
Estudios recientes en nuestro laboratorio demostraron que la sobreexpresión de PTP1B en cantidades crecientes se correlaciona con un aumento progresivo de la expresión de HER2 y que dicho proceso es independiente de la transcripción y amplificación del gen HER2/neu/ERBB2. Se demostró que PTP1B regula positivamente la expresión de HER2 en cultivos primarios de cáncer de mama. El posible mecanismo propuesto para explicar el incremento de HER2 es la disminución de los niveles de la ligasa de ubiquitina Cblb, mediada por la sobreexpresión de PTP1B. Sugiriendo un menor recambio del receptor HER2 con su consecuente acumulación. Por otra parte, se demostró que la sobreexpresión de PTP1B contribuye a una mayor agresividad tumoral, en términos de mayor proliferación y migración celular. A pesar de esto, el mecanismo que ejerce PTP1B sobre HER2 aún no está bien establecido62. Tomando en cuenta los datos antes mencionados, buscamos demostrar que el silenciamiento de PTP1B produce el efecto contrario a su sobreexpresión en cuanto a la regulación de HER2, de comprobar dicho efecto, PTP1B tendría una utilidad importante como factor pronóstico y predictivo en pacientes con cáncer de mama. Razón por la cual el objetivo principal de este estudio es evaluar el papel del silenciamiento de PTP1B sobre la expresión de HER2 y las implicaciones que este mecanismo tiene sobre procesos biológicos, como la proliferación celular en cultivos primarios de cáncer de mama.
Materiales y método
Cultivo de células de cáncer de mama
Los cultivos celulares MBCD3 y MBCD23 fueron generados en el laboratorio a partir de biopsias derivada de una mastectomía radical (protocolo aprobado por el Comité de Ética del Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", referencia 159). Las células fueron sembradas en RPMI (Gibco, Invitrogen, Life Technologies, Carlsbad, California, USA) suplementado con 10% de suero fetal bovino (SFB) más antibióticos y antimicóticos a 37oC, en una atmósfera de 5% de CO2.
Purificación de plásmidos
Los plásmidos utilizados fueron pGFP-V-RS control (sh scramble) y 4 diferentes pGFP-V-RS shRNA para PTP1B con las siguientes secuencias:
• 5'ACGAGGACCATGCACTGAGTTACTGGAAG3'
• 5'TTACCTCTGCTACAGGTTCCTGTTCAA3'
• 5'CCTTCTGTCTGGCTGATACCTGCCTCTTG3'
• 5'GCGCTTCTCCTACCTGGCTGTGATCGAA3'
Se purificaron por Maxiprep con el kit QIAGEN de acuerdo al protocolo del fabricante. Brevemente, 500 mL de cultivo de bacterias se centrifugó a 6,000 RPM por 15 minutos, se retiró el sobrenadante y se resuspendieron las bacterias en 10 mL de buffer P1. Se adicionó 10 mL de buffer P2, se agitó por inversión y se dejó incubar por 5 minutos a temperatura ambiente. Posteriormente, se adicionó 10 mL de buffer P3 y se incubó por 20 minutos a 4°C. Se centrifugó a 10,000 RPM por 30 minutos a 4oC. Se removió el sobrenadante y posteriormente la columna Qiagentip se equilibró con buffer QBT. El sobrenadante se colocó en la columna QIAGEN para permitir la entrada de la resina por flujo de gravedad. Se lavó con buffer QC. Posteriormente se eluyó el DNA con buffer QF. Se precipitó el DNA con isopropanol, se mezcló y se centrifugó inmediatamente a 10,000 RPM durante 30 minutos a 4oC. Se decantó el sobrenadante. Seguidamente se lavó el pellet de DNA con 5 mL de etanol al 70% y se centrifugó a 10,000 RPM por 10 minutos. Se decantó nuevamente el sobrenadante y se secó al aire libre por 5-10 minutos, se redisolvió el DNA en un volumen de agua libre de RNAsas y finalmente, se cuantificó el DNA por medio de espectrofotometría (DU-65, Beckman Coulter, Pasadena, California, USA).
Transfección de Sh-RNAs
Las células MBCD3 y MBCD23 positivas para PTP1B, se transfectaron mediante el protocolo de LipofectAMINE Plus Reagent. Las células se sembraron en placas de 6 pozos a una densidad de 10,000 cél/cm2. Una hora antes de la transfección se cambió el medio a las células, utilizando medio libre de antibiótico y SFB. Se colocó 1 o 2 μg totales de DNA de los plásmidos pGFP-V-RS sh control o los 4 pGFP-V-RS shRNAs para PTP1B con el Plus Reagent en un tubo Eppendorf®, se diluyó en medio libre de suero y antibióticos. Se dejó dicha mezcla durante 15 minutos incubando a temperatura ambiente. Después, se realizó una mezcla de 4 μl de lipofectamina y 96 μl de medio libre de antibiótico y se colocó en un tubo Eppendorf®. Posteriormente, se mezcló el contenido de ambos tubos y se incubó por 15 minutos a temperatura ambiente. Al finalizar dicho procedimiento se colocó en cada plato de cultivo y se incubó por 48 horas. Para expresión estable de los shRNAs se seleccionó con 5 μg/mL de puromicina.
Proliferación celular
Se realizaron ensayos de proliferación celular, para lo cual se sembraron 3,000 cél/cm2 en placas de 48 pozos (Corning, NY, USA) en medio RPMI suplementado con 10% de SFB. Después de la siembra celular, éstas se cultivaron durante 6 días a 37°C con una atmósfera de CO2 al 5%. Las células se fijaron con glutaraldehído al 1.1% durante 20 minutos, después se dejaron en PBS durante 20 minutos los días 0, 2, 4 y 6. Al completarse los 6 días se procedió a teñir las placas con cristal violeta durante 20 minutos. Seguidamente se lavaron con agua las placas para retirar el exceso del colorante. Una vez completado dicho proceso, se solubilizó el colorante en 400 μl de ácido acético al 10% durante 20 minutos. Por último, la absorbancia se midió a 595 nm en un lector de microplaca (Opsys MR, Dynex Technologies, Chantilly, VA, USA). Los resultados se expresaron como el incremento de la densidad óptica con respecto al día cero.
Resultados
Efecto del silenciamiento de ptp1b sobre la proliferación celular
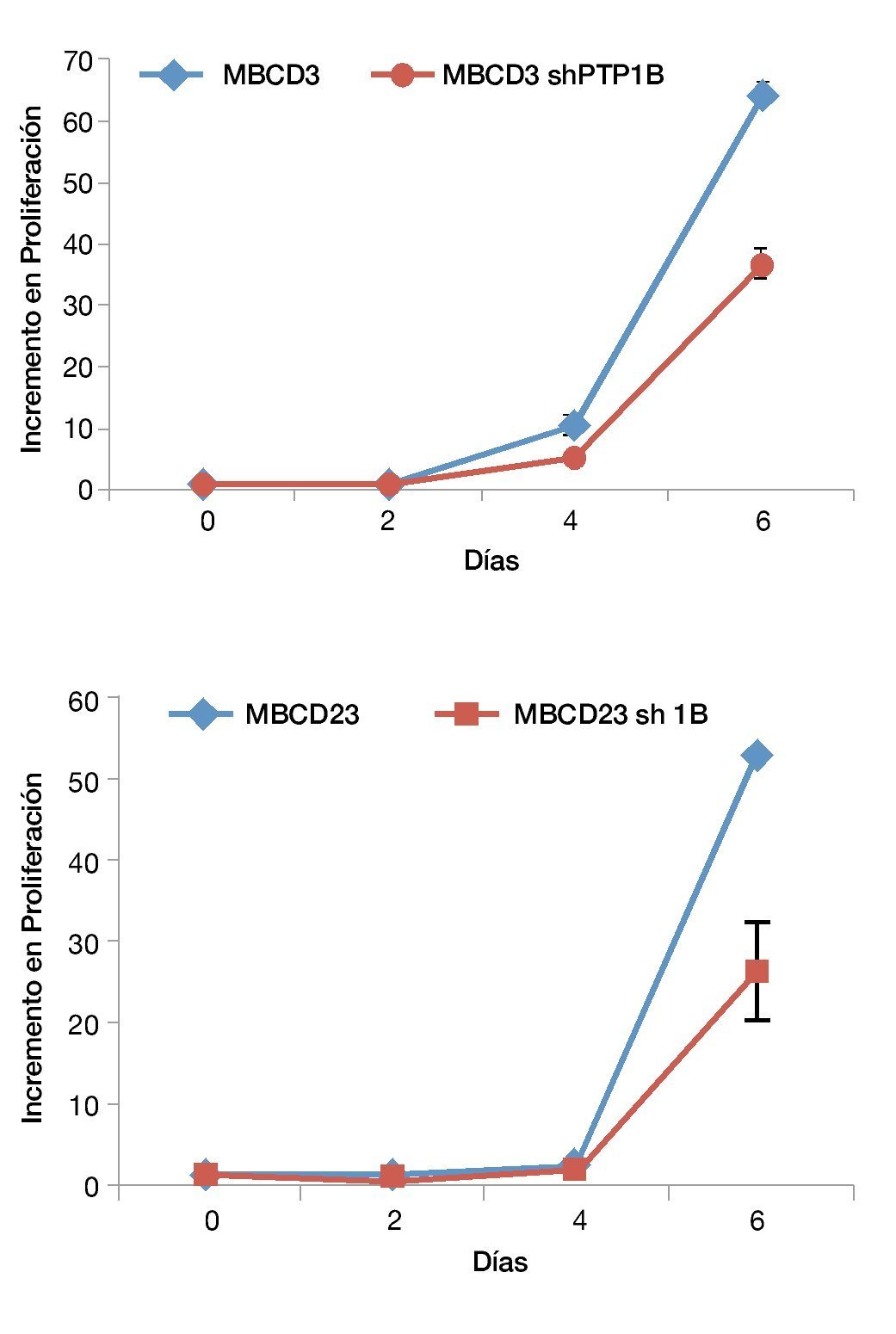
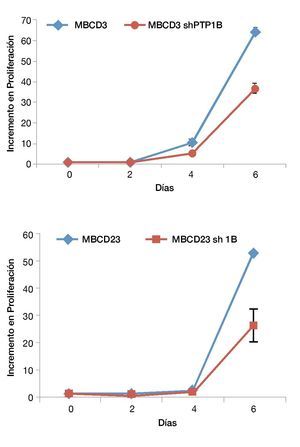
Previamente se había demostrado que PTP1B modula los niveles de expresión de HER2 (López-Zelada, K, datos no publicados)62. Para evaluar el efecto de PTP1B sobre procesos biológicos como la proliferación celular, silenciamos la expresión de esta fosfatasa utilizando shRNAs validados. Se realizaron ensayos de proliferación celular con el fin de evaluar si esta regulación de PTP1B sobre HER2 tiene algún impacto sobre la proliferación celular. Observamos que existe una disminución de la proliferación celular en las células donde se silenció PTP1B mediante shRNAs, esta disminución de la proliferación celular fue evidente a partir del día 2 para las células MBCD3 sh1B y a partir del día 4 para las células MBCD23 sh1B. Es importante mencionar que los efectos proliferativos más sobresalientes se observaron al día 6, cuando la diferencia en la tasa de proliferación es 4 veces menos en las células MBCD3 sh1B comparada con la línea MBCD3 sh control (fig. 1). Estos resultados indican que el silenciamiento de PTP1B induce una menor capacidad de proliferación en las células tumorales de cáncer de mama, lo cual demuestra que esta fosfatasa ejerce una regulación negativa de la expresión de HER2.
Figura 1 Curvas de proliferación celular. Se observa disminución de la proliferación celular en las células MBCD3 y MBCD23 transfectadas con el plásmido pGFP-V-RS PTP1B shRNA, en comparación con las células transfectadas con el plásmido pGFP-VRS sh control.
Discusión
En los últimos años PTP1B ha sido asociada en la oncogénesis de varias neoplasias, entre ellas cáncer de ovario, colon, esófago y mama, entre otras57,63-66. En modelos murinos que sobreexpresan HER2 se demostró que la deleción del gen ptpn1 produce un retraso en el desarrollo de tumores mamarios y resistencia para el desarrollo de metástasis pulmonares59,60. En humanos, se ha demostrado que la ganancia o amplificación de la región del cromosoma 20q13, sitio en el cual está localizada PTP1B, está asociada con pobre pronóstico en cáncer de mama59,60. Recientemente, se reportó en una cohorte de 1,402 muestras de tejido de cáncer de mama, que PTP1B se expresó en el 49% de las muestras, se correlacionó esta expresión de PTP1B con algunos factores de mal pronóstico ya establecidos mostrando una tendencia a tener mayor expresión de PTP1B en pacientes HER2 positivo; asimismo, se demostró que la expresión de PTP1B es un predictor independiente de supervivencia en las pacientes con cáncer de mama61. En nuestro laboratorio, estudios previos han demostrado que PTP1B regula de forma positiva la expresión de HER2 con un efecto dosis-respuesta. Se encontró que la sobreexpresión de PTP1B provoca incremento en los niveles de expresión de HER2 y que esto se asocia a mayor capacidad de proliferación y migración celular en cultivos primarios de cáncer de mama62. En las últimas décadas se han descrito varios mecanismos por los cuales los receptores de factores de crecimiento participan en la oncogénesis, estos incluyen, la amplificación del receptor, la translocación cromosómica y mutaciones puntuales. Estos cambios dan lugar a una mayor actividad catalítica de estos receptores33,67.
Además, existe evidencia creciente que el escape a los mecanismos de regulación negativa del receptor, es un evento importante en la desregulación de los receptores de factores de crecimiento. Hasta el momento se desconoce el mecanismo exacto por el cual la sobreexpresión de PTP1B favorece una mayor expresión de HER2. El posible mecanismo propuesto para explicar el incremento de HER2 es la disminución de los niveles de la ligasa de ubiquitina Cblb, mediada por la sobreexpresión de PTP1B. Sugiriendo un menor recambio del receptor HER2 con su consecuente acumulación. De esta forma se explicaría como la sobreexpresión de PTP1B aumenta los niveles de HER2.
Como anteriormente se mencionó, la sobreexpresión de PTP1B induce una mayor capacidad de proliferación y migración celular en cultivos primarios de cáncer de mama62. Nuestros resultados concuerdan con lo anterior ya que el silenciamiento de PTP1B disminuye la capacidad proliferativa, lo que muy probablemente está asociado con la disminución de HER2 mediado por la ausencia de PTP1B68,69. Algunos estudios sugieren que existen diferentes mecanismos a través de los cuales la activación de HER2 confiere a las células de cáncer de mama una mayor capacidad de proliferación y migración celular, entre estos mecanismos se encuentra la activación de c-Jun o la ruptura de la adhesión celular mediado por STAT370,71, o a través de la activación de otras proteínas intermediarias como metaloproteinasas o integrinas. Se sabe que la simple expresión de HER2 no explica por completo la capacidad invasiva de las células tumorales de mama, pero se cree que este fenotipo invasivo puede estar mediado por la activación y regulación de otras vías de señalización, entre las que se encuentran: PI3K, c-Src, PKCα, FAK, integrina α4 y el factor de crecimiento transformante β, entre otras69,72-77.
Conclusiones
Nuestros resultados coinciden con los datos reportados en modelos murinos, en los cuales se demuestra que la ausencia de PTP1B se asocia con retraso en el desarrollo de tumores mamarios y menor capacidad de desarrollar metástasis pulmonares. Nuestros resultados muestran que el silenciamiento de PTP1B disminuye la capacidad de proliferación celular y por ende, puede conferir una menor capacidad en el desarrollo de metástasis. En su conjunto, estos datos sugieren fuertemente que PTP1B puede ser un marcador pronóstico y predictivo en cáncer de mama y todo esto justificaría realizar estudios basados en la inhibición de esta fosfatasa, para desarrollar blancos moleculares como terapia específica dirigida a disminuir el potencial metastásico de esta enfermedad.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
El presente trabajo se realizó con apoyo del CONACyT 102825.
* Autor para correspondencia:
Vasco de Quiroga N° 15, Colonia Sección XVI,
Delegación Tlalpan, C.P. 14000, México D.F., México.
Teléfono: 5487 0900, ext. 2255, 4481. Fax: 5485 3741. Celular: 555412 6850.
Correo electrónico: l.karlita@hotmail.es (Karla Alejandra López-Zelada).