¿ INTRODUCCIÓN
El cáncer de células renales (CCR) es la forma más común de cáncer renal. 1 En el año 2002, se estimó una detección de 210 000 nuevos casos a nivel mundial.2 Dada la baja manifestación de síntomas, y a pesar del incremento en el número de diagnósticos incidentales, una proporción significativa de pacientes es diagnosticada en estadios avanzados, cuando la sobrevida es menor: los pacientes con CCR metastásico (CCRm) tienen una sobrevivencia mediana < 13 meses y una tasa de sobrevivencia a cinco años inferior a 10%.3-7
El CCR se conoce como el prototipo de los tumores sólidos que no responden favorablemente al tratamiento con quimioterapia o radioterapia. En algunos casos, presenta respuesta favorable a inmunoterapia con interferón-alfa (IFN-a) o interleucina-2 (IL-2), lo cual ha significado un beneficio modesto en términos de sobrevida, pero inducido a la presentación de efectos indeseables.8,9
En respuesta al reto que representa el manejo del CCR para los oncólogos, y con base en la mejor comprensión de la biología molecular del mismo, en años recientes se han desarrollado diversos agentes terapéuticos enfocados a retrasar la progresión de la enfermedad. Entre estos, están: bevacizumab, sorafenib y sunitinib.
Bevacizumab (Avastin®, F. Hoffmann La Roche Inc., Basilea, Suiza) es una molécula que bloquea la formación de vasos sanguíneos en el tumor. Se ha estudiado el uso de bevacizumab como monoterapia y en combinación con IFN-a en el manejo de CCRm, siendo este último esquema el que presenta resultados más favorables.10-12 Sorafenib (Nexavar®, Bayer AG, Leverkusen, Alemania), es un inhibidor de crecimiento y vascularización del tumor,
mecanismos que determinan la progresión de la enfermedad. Se ha estudiado el uso de sorafenib para manejo de CCRm, como agente de primera y segunda línea.13,14 Sunitinib (Sutent®; Pfizer Inc., Nueva York, Estados Unidos de América), es un inhibidor de la proliferación celular y de la angiogénesis tumoral, el cual ha sido estudiado extensivamente para el manejo de CCRm.15-19
Sorafenib y sunitinib están incluidos en el formulario interinstitucional de medicamentos de México para el manejo de CCRm (país en el que se detectaron 1 289 nuevos casos de cáncer renal en el año 200120), bevacizumab aún no cuenta con esta indicación, a pesar de los diversos estudios que sugieren su uso en la bibliografía. A pesar de esta situación, no existe evidencia sobre el impacto -económico y en salud- que tendría la implementación de cualquiera de estas terapias en México. Surge entonces la necesidad de identificar la terapia que provea del mayor beneficio clínico a un costo aceptable para el sistema de salud mexicano.
El objetivo de este estudio fue estimar el costo-efectividad y costo-utilidad de sorafenib y bevacizumab+IFN-a, respecto al de sunitinib, como tratamientos innovadores, de primera línea, para manejo de CCRm, en horizontes temporales de dos y cinco años, desde la perspectiva del Instituto Mexicano del Seguro Social (IMSS).
¿ MATERIAL Y MÉTODOS
DESCRIPCIÓN DEL MODELO
Se desarrolló un modelo de Markov en Microsoft Excel® (Microsoft Corp. Redmon, WA, Estados Unidos de América), el cual refleja la historia natural de la evolución del CCRm en una cohorte hipotética de pacientes basada en información real extraída retrospectivamente de expedientes clínicos en México. Todos los pacientes del modelo fueron sometidos a diferentes esquemas terapéuticos de primera línea para el manejo de CCRm. En el modelo se ingresaron pacientes adultos con CCRm confirmado histológicamente y con el componente histológico (convencional) de células claras, lesiones medibles radiográficamente, función adecuada de órganos vitales y un estado funcional ECOG de 0 a 1. Se asume que estos pacientes son representativos de la población del estudio A6181034 de sunitinib vs. IFN-a como agente de primera línea para el tratamiento de CCRm, en la que 36.6% de pacientes presentaron pronóstico favorable, 56.9% pronóstico intermedio y 6.5% pronóstico pobre, de acuerdo con los criterios de riesgo del Memorial Sloan-Kettering Cancer Center (MSKCC).19
El modelo estima los costos, la sobrevivencia libre de progresión y los años de vida ganados, ajustados por calidad de vida asociados a cada uno de los tratamientos de primera línea para CCRm a lo largo de horizontes de análisis de dos y cinco años. Los costos y los resultados de efectividad se descontaron a valor de una tasa de 5% anual, de acuerdo con lo estipulado en la Guía para la conducción de estudios de evaluación económica para la actualización del Cuadro Básico de Insumos del Sector Salud en México.21 Se definió la duración del ciclo de Markov a seis semanas.
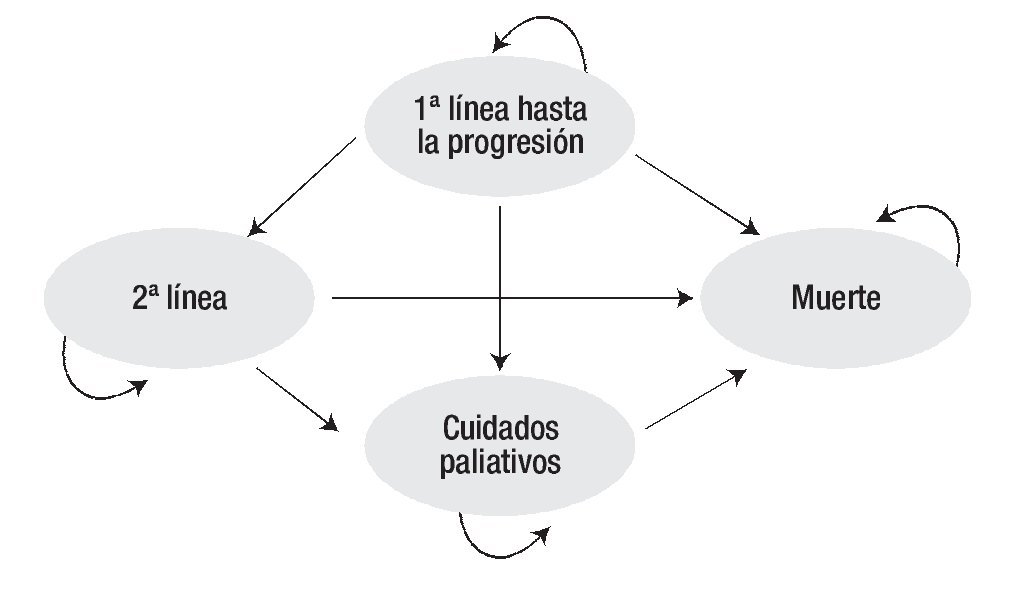
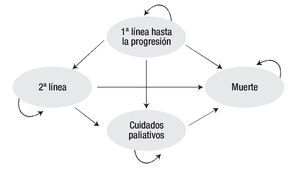
Los pacientes reciben tratamiento de primera línea hasta la progresión de la enfermedad (de acuerdo con la evaluación del investigador). Una vez que la enfermedad progresa, el paciente puede ser sometido a tratamiento de segunda línea o a cuidados paliativos hasta su fallecimiento, como consecuencia de la enfermedad (Figura 1). Las unidades de efectividad clínica fueron los meses libres de progresión (MLP) y los años de vida ganados ajustados por calidad (AVAC). Los resultados del análisis sobre costo-efectividad y costo-utilidad, se expresan en términos de la razón de costo-efectividad incremental (RCEI) y la razón de costo-utilidad incremental (RCUI) respectivamente, empleando a sunitinib como referencia, ya que constituye la única terapia recomendada por el National Institute for Health and Clinical Excellence del Reino Unido (NICE por sus siglas en inglés), como tratamiento de primera línea para CCRm 22,23.
Figura 1. Modelo de Markov de tratamiento de primera línea y progresión del CCRm.
Dada la falta de evidencia clínica que permita modelar adecuadamente las terapias de segunda línea, se asumió que 80% de los pacientes recibe terapia de segunda línea y la composición de la misma varía de acuerdo al tratamiento utilizado en la primera línea; por último, se asumió una duración fija de seis meses para el tratamiento de segunda línea. Se consideró la presentación de efectos secundarios (fatiga, náuseas, neutropenia, síndrome de mano-pie, hipertensión, diarrea, entre otros) relacionados con los tratamientos, de acuerdo a las incidencias reportadas en estudios clínicos.12,14,19
TRATAMIENTOS
Los pacientes que ingresaron al modelo, fueron sometidos a terapia con sorafenib (400 mg dos veces al día), bevacizumab+IFN-a (10 mg/kg cada dos semanas + 9 MUI tres veces a la semana, peso promedio por paciente: 70 kg) o sunitinib (50 mg/día durante cuatro semanas, seguidas por dos semanas sin tratamiento), como agentes de primera línea para el manejo del CCRm.
FUENTES DE EFECTIVIDAD
Ante la ausencia de estudios clínicos que comparen head to head la eficacia de las terapias consideradas en este análisis, fue necesario realizar una comparación indirecta, usando la terapia basada en IFN-a como referencia, la cual es la alternativa común en los estudios a partir de los cuales se extrajeron los datos para modelar la eficacia clínica de cada una de las terapias consideradas en el análisis. Se consideró este abordaje como válido, dado que el grupo de pacientes tratado con IFN-a en los estudios clínicos con los que se estimó la eficacia clínica, presentaron características basales similares.12,14,19
La eficacia de la terapia basada en IFN-a, se estimó a partir de los resultados finales de sobrevida global del estudio A6181034.24 Para modelar la eficacia de la terapia de IFN-a en horizontes temporales mayores a la duración del periodo de seguimiento del estudio clínico A6181034, fue necesario estimar las curvas de sobrevivencia de Kaplan-Meier y posteriormente ajustarlas a una distribución de probabilidad de tipo Weibull. Se seleccionó a la distribución Weibull en función de su capacidad para reproducir adecuadamente la eficacia clínica observada.
Después de haber modelado el proceso de sobrevivencia para los pacientes bajo tratamiento con IFN-a, se estimó la eficacia a largo plazo asociada a los otros tratamientos sobre la base de sus razones de riesgo respecto de IFN-a publicadas en la bibliografía.12,14,24-26 Las probabilidades acumuladas de sobrevida fueron convertidas en probabilidades de transición.
FUENTES DE CALIDAD DE VIDA
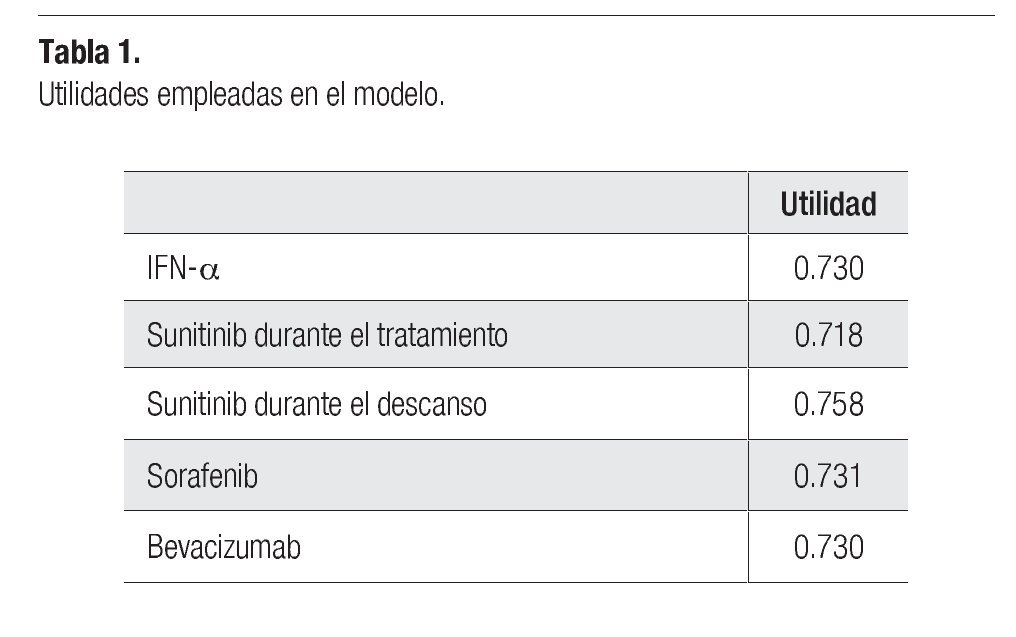
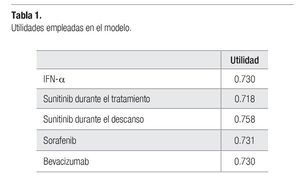
Los datos referentes a la calidad de vida, corresponden a cada estado de salud incluido dentro del modelo y se obtuvieron mediante el instrumento EuroQol (EQ-5D) en el estudio de sunitinib (Pfizer. Protocol 1034: A6181034-A3 - A Phase 3, randomized study of SU011248 vs. interferon-a as first-line systemic therapy for patients with metastatic renal cell carcinoma. October 27, 2005). Los datos fueron obtenidos al inicio del ciclo de administración, al final del mismo, al final del periodo de descanso, a la suspensión del tratamiento y en el retiro del estudio. Los valores de utilidad (calidad de vida), a lo largo de la evolución del CCR, se expresaron al inicio del tratamiento con sunitinib (Tabla 1).
No se encontró evidencia acerca de la utilidad percibida por los pacientes tratados con sorafenib y bevacizumab+IFN-a, por lo que se asumió que los pacientes tratados con sorafenib tienen la misma utilidad que los pacientes tratados con sunitinib (ponderada por los periodos de administración y descanso del tratamiento con sunitinib). En el caso de la terapia con bevacizumab+IFN-a, se asumió que tiene los mismos niveles de utilidad que los observados en el brazo de IFN-a.
COSTOS
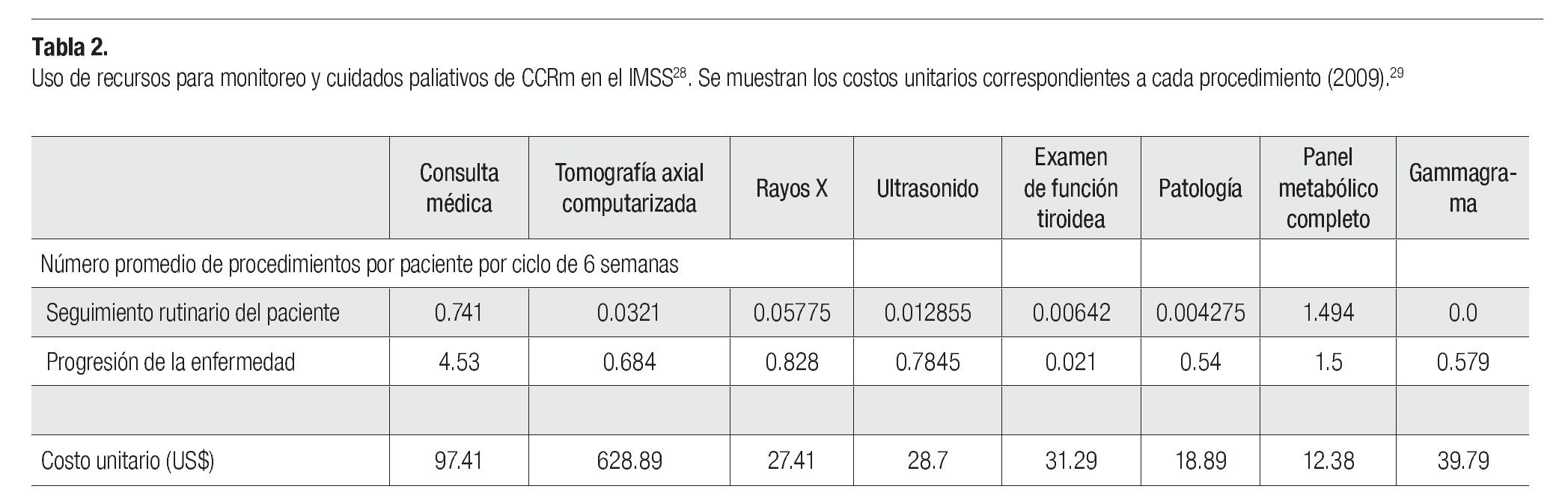
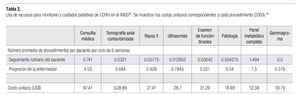
El modelo considera los costos médicos directos en los que incurre una institución representativa del sistema de salud mexicano (IMSS), como consecuencia de la atención a pacientes con CCRm. Específicamente se consideraron: el costo de medicamentos para el manejo de CCRm; el costo de seguimiento de los pacientes que presentan beneficio clínico debido a las terapias de primera y segunda línea; el costo relacionado con el manejo de eventos adversos severos y el costo asociado a cuidados paliativos de los pacientes en fase terminal. Los costos están expresados en dólares de los Estados Unidos de América de 2009 (US$), considerando un tipo de cambio de MX$13.5/US$, promedio en el primer semestre de 2009.27 Se utilizó el perfil sobre el uso de recursos estimado a partir de la revisión de expedientes (n = 80) de pacientes atendidos en el servicio de Urología del Hospital de Oncología del Centro Médico Nacional Siglo XXI del IMSS (Tabla 2).28
El costo de los recursos médicos, corresponde a los costos unitarios por nivel de atención médica en el tercer nivel de atención del IMSS, aprobados para 2009 (Tabla 2).29 El costo de los medicamentos para el manejo de CCRm, fue extraído de dictámenes a licitaciones de adquisición de bienes a nivel federal, publicadas en el portal de compras gubernamentales de México (www. compranet.gob.mx, consultado en Mayo 12, 2009).30
ANÁLISIS DE SENSIBILIDAD UNIVARIADO: BENEFICIOS NETOS INCREMENTALES
Para identificar a los parámetros cuya variación (hasta ± 40%) genera un mayor impacto en el beneficio neto incremental (BNI, Eq. 1) de las terapias, se llevó a cabo un análisis de sensibilidad univariado, empleando un umbral de costo-utilidad (l) de US$ 30,000/QALY, monto equivalente a tres veces el producto interno bruto per cápita de México en 2008 (aproximadamente US$ 10,00031) y un límite sugerido por la Organización Mundial de la Salud (OMS), para determinar el costo-efectividad de las intervenciones en salud en los países en vía de desarrollo.32 Un BNI > 0 indica que, a una l (disponibilidad a pagar, DAP) dada, la intervención de referencia representa un ahorro para el pagador, respecto de la intervención evaluada.
BNI= lLE - ΔC Eq.1
Donde:
BNI = Beneficio Neto Incremental (US$)
L = Umbral de costo-efectividad, costo-utilidad (US$/unidades de efectividad ganadas).
ΔE = Efectividad incremental de la intervención evaluada respecto de la efectividad de la intervención de referencia (AVAC).
ΔC = Costo incremental de la intervención evaluada respecto del costo de la intervención de referencia (US$).
ANÁLISIS DE SENSIBILIDAD PROBABILÍSTICO
Para confirmar la consistencia de los resultados estimados por el modelo ante variaciones en los parámetros de entrada, se realizó un análisis de sensibilidad probabilístico por medio de una simulación Monte Carlo de segundo orden (5 000 iteraciones), cuyos resultados se emplearon para calcular las curvas de aceptabilidad. Para llevar a cabo el análisis de incertidumbre, las distribuciones de probabilidad imputadas a los parámetros de acuerdo a su naturaleza fueron: b para las proporciones de pacientes y utilidades; logonormal para las razones de riesgo y gamma para los costos. Para los costos totales por fase de tratamiento, los costos promedio ponderados por manejo de eventos adversos y la probabilidad de reducción/interrupción de dosis debida a eventos adversos (parámetros en los que no fue posible obtener datos acerca de su variabilidad), se asumió una desviación estándar equivalente a 10% del valor promedio del parámetro para imputar las distribuciones de probabilidad. No se consideró una variación en el costo de los medicamentos para el manejo de CCRm debido a que éstos se encuentran fijos dentro de las instituciones públicas de salud en México.30
¿ RESULTADOS
EFECTIVIDAD
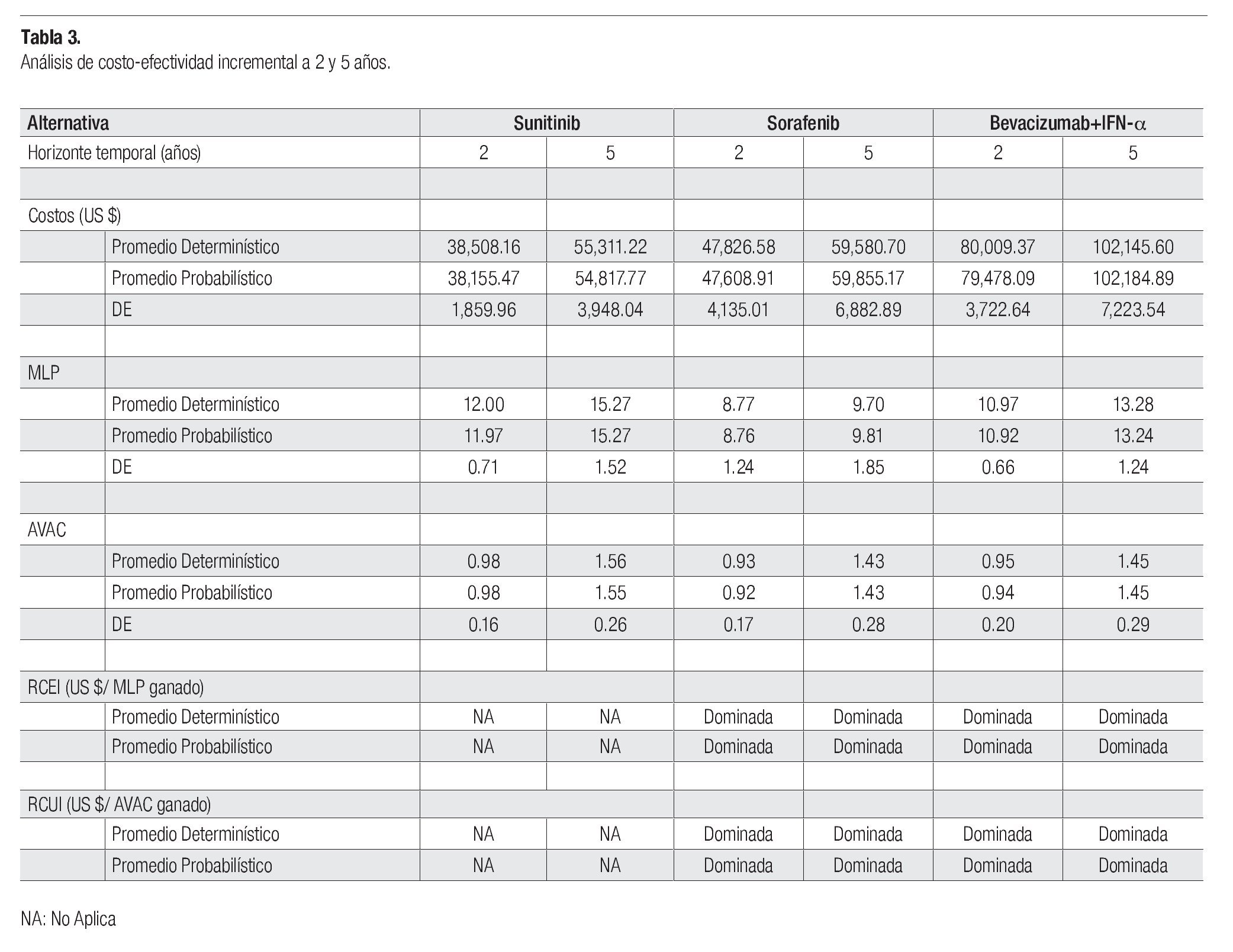
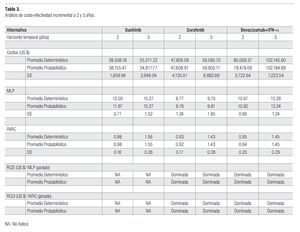
Los pacientes sometidos a la terapia basada con sunitinib, permanecieron un promedio de 12.0 y 15.3 meses libres de progresión de la enfermedad a los dos y cinco, respectivamente. Los pacientes tratados con sorafenib y bevacizumab+IFN-a, permanecieron en este estado de salud 3.2 y 1.0 meses menos que los pacientes tratados con sunitinib (horizonte de análisis de dos años), mientras que en el horizonte a cinco años, se estimaron 5.6 y 2.0 meses menos para estas alternativas, que en los pacientes tratados con sunitinib (Tabla 3).
A los dos años de haber iniciado el tratamiento de primera línea, los pacientes tratados con sunitinib alcanzaron 0.98 AVAC´s, mientras que aquellos que usaron sorafenib y bevacizumab+IFN-a alcanzaron, respectivamente 0.05 y 0.03 AVAC´s menos que los AVAC´s estimados para los pacientes del grupo de sunitinib. A los cinco años, los pacientes tratados con sunitinib alcanzaron 1.55 AVAC´s, mientras que para los pacientes tratados con sorafenib y bevacizumab+IFN-a se estimaron 1.43 y 1.45 AVAC´s, respectivamente.
¿ COSTOS
El costo del tratamiento farmacológico por un ciclo de seis semanas, resultó en US$ 3,211, US$ 5,699 y US$ 8,661 para sunitinib, sorafenib y bevacizumab+IFN- a, respectivamente. Al cabo de dos años, el costo por paciente de la terapia basada en sunitinib, resultó en US$ 38,508, cantidad que relacionada al costo farmacológico de sunitinib, representa 64.6%; el costo de la terapia farmacológica de segunda línea, 25.1%; el seguimiento y los cuidados médicos durante la primera y segunda línea, 5.8% y, 5.4% corresponde a los cuidados paliativos. El costo por paciente de la terapia con sorafenib resultó en US$ 47,827, de los cuales, el costo del agente de primera línea representó 74.6%; el costo de la terapia farmacológica de segunda línea, 15.8%; el seguimiento y los cuidados médicos durante la primera y segunda línea, 2.7% y, 6.9% de los cuidados paliativos. Por último, la terapia con bevacizumab+IFN- a, requeriría de una inversión de US$ 80,009 que se distribuyen en: 87.2% por el costo de los agentes de primera línea, 7.8% de los agentes de segunda línea, 2.1% correspondiente a cuidados y seguimiento médico durante la primera y segunda línea y, 2.9% para cuidados paliativos.
A los cinco años, el costo promedio por paciente tratado con sunitinib ascendió a US$ 55,311, cantidad que se integra por 56.9% del costo de sunitinib, 25.8% por el tratamiento de segunda línea, 4.4% por los cuidados médicos y seguimiento durante el tratamiento farmacológico, y 12.9% por los cuidados paliativos. El tratamiento con sorafenib requiere US$ 59,581 integrados por: 65.3% del costo de sorafenib, 16% por el de agentes de segunda línea, 2.5% por los cuidados médicos durante el tratamiento farmacológico y 16.2% derivado de los cuidados paliativos. Finalmente, el tratamiento con bevacizumab+IFN-a, tuvo un costo de US$ 102,145, constituidos por 82.1% del agente de primera línea, 8.5% por los agentes de segunda línea, 2% de cuidados médicos y 7.3% por cuidados paliativos.
ANÁLISIS INCREMENTAL
Dado que la efectividad y la utilidad estimadas por el modelo son mayores en la población sometida a tratamiento con sunitinib que a las estimaciones respectivas para las poblaciones sometidas a tratamiento con sorafenib o bevacizumab+IFN-a, y a que la terapia con menores costos es la basada en sunitinib, esta intervención sería costo-ahorradora en el IMSS.
ANÁLISIS DE SENSIBILIDAD UNIVARIADO
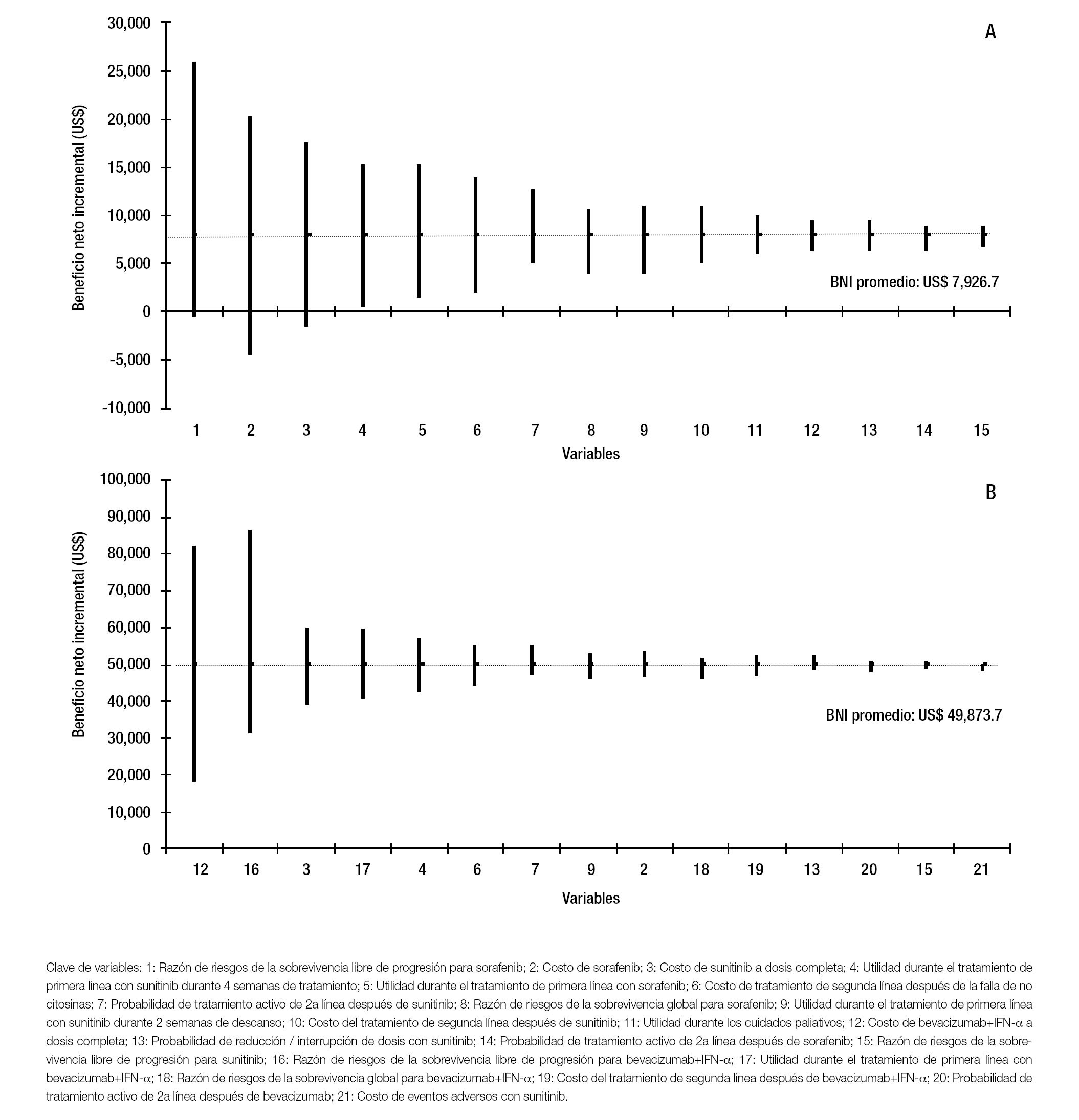
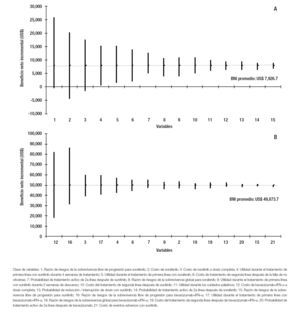
De acuerdo con el diagrama de tornado, las tres variables que presentan un mayor impacto en el BNI cuando se compara a sunitinib con sorafenib son: la razón de riesgos de sobrevivencia libre de progresión para sorafenib y el costo de sorafenib y sunitinib. Una reducción de 40% en el costo de sorafenib o un aumento de 40% en la razón de riesgos de sobrevivencia libre de progresión para sorafenib o en el costo de sunitinib llevarían a que el IMSS obtuviera ahorros derivados del uso de sorafenib. El BNI promedio para la institución, es de US$ 7,927, que implica el ahorro promedio por paciente, por el uso de sunitinib respecto de sorafenib (Figura 2,panel A).
Figura 2. Análisis de sensibilidad univariado. Panel A: Sunitinib vs. sorafenib. Panel B: Sunitinib vs. bevacizumab+IFN-a.
En el caso de bevacizumab+IFN-a, las tres variables con mayor impacto en el BNI son: el costo de bevacizumab, la razón de riesgos de sobrevida libre de progresión para bevacizumab y el costo de sunitinib. A pesar de las variaciones de ± 40% en el valor de referencia de todas las variables involucradas en el análisis de sensibilidad univariado, no se proyectaría que la institución obtenga ahorros derivados del uso de bevacizumab+IFN-a. El BNI promedio para la institución es de US$ 49,874, lo que se traduce en un ahorro promedio por paciente, por el uso de sunitinib respecto de bevacizumab+IFN-a (Figura 2, panel B).
ANÁLISIS DE SENSIBILIDAD PROBABILÍSTICO
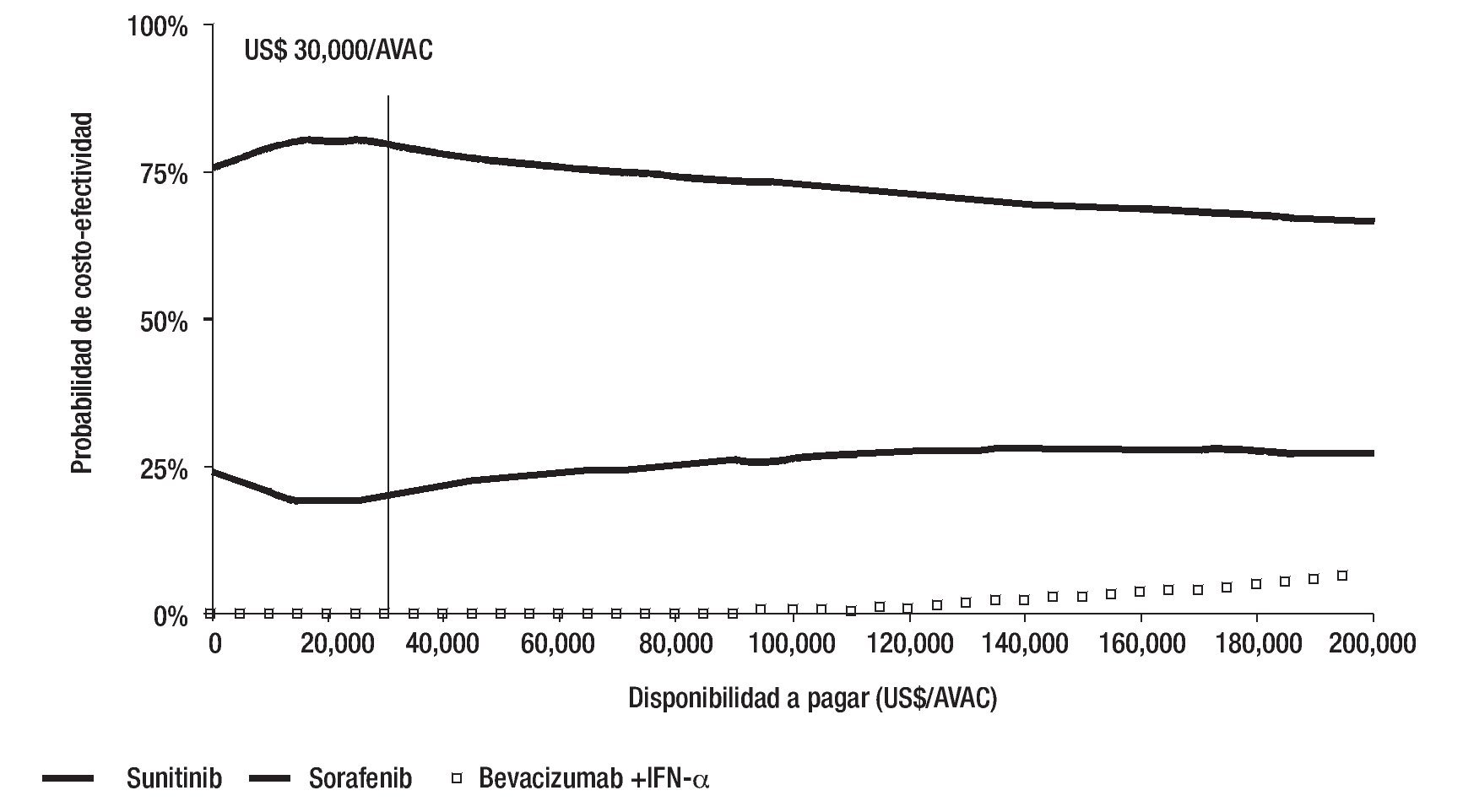
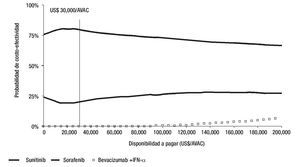
Las estimaciones obtenidas con el análisis de sensibilidad probabilístico, son consistentes con las estimaciones del análisis determinístico (Tabla 3). Dado que la DAP máxima en el contexto mexicano no está especificada explícitamente, se realizó un análisis de sensibilidad a lo largo de un intervalo muy amplio de DAP (US$0 a US$200,000/AVAC ganado). La representación gráfica de este análisis de sensibilidad muestra en el eje y la probabilidad de que la RCUI verdadera de la intervención sea menor o igual a una DAP específica, mostrada en el eje x. La gráfica obtenida se denomina curva de aceptabilidad.
Figura 3. Curvas de aceptabilidad de los tratamientos para CCRm en México.
Estas curvas muestran que, independientemente de la DAP, sunitinib es el agente de primera línea óptimo para el manejo de CCRm, es decir, es el tratamiento con la mayor probabilidad para que su RCUI sea menor o igual a un valor l dado. A una DAP de US$ 30,000/ AVAC, sunitinib tiene una probabilidad de 81% de ser costo-efectivo, sorafenib 19% y bevacizumab+IFN-a 0%. En el máximo umbral de DAP obtenido en este análisis (US$ 200,000/AVAC ganado), el tratamiento con sunitinib es 70.5% costo-efectivo, sorafenib 22.3% y bevacizumab+IFN-a 6.53% (Figura 3).
¿ DISCUSIÓN
En este análisis se determinaron los potenciales beneficios farmacoeconómicos por uso de sunitinib como agente de primera línea para el tratamiento de CCRm en una institución representativa del sistema de salud mexicano, el IMSS. La terapia basada en sunitinib representaría menores costos para el IMSS que los que tendrían las terapias de sorafenib y bevacizumab+IFN-a. Las estimaciones del periodo de sobrevivencia libre de progresión, muestran que sunitinib provee mayor beneficio clínico que las terapias basadas en sorafenib y bevacizumab+ IFN-a, resultado soportado también por la evidencia clínica reciente.33 Con base en lo anterior, sunitinib es una terapia menos costosa y más efectiva (dominante) que sorafenib y bevacizumab+IFN- a, en horizontes de análisis de dos y cinco años.
De acuerdo con los resultados del análisis de sensibilidad univariado, las variables que tienen un mayor impacto sobre el BNI son clínicas: las razones de riesgo de sobrevida libre de progresión para sorafenib y bevacizumab, así como las económicas: el costo de los tres agentes de primera línea. En general, los resultados del análisis de sensibilidad univariado son consistentes a variaciones de ± 40% en el valor promedio de los parámetros del modelo. Sin embargo, cuando se compara sunitinib vs. sorafenib, se observa que sólo un aumento importante en el costo de sunitinib o la razón de riesgos de sobrevivencia libre de progresión de sorafenib o una disminución drástica en el costo de sorafenib, llevarían a que el tratamiento con éste, representa una ventaja económica sobre el tratamiento con sunitinib. En el caso de bevacizumab, a pesar de variaciones de hasta ± 40% en el valor promedio de los parámetros, sunitinib representa una ventaja económica consistente sobre esta alternativa. Estos resultados deben interpretarse con cautela, porque en el análisis de sensibilidad univariado, no se consideran los efectos de la potencial correlación entre las variables.
En el análisis probabilístico de sensibilidad, los costos y efectividades promedio obtenidos son consistentes a los estimados por el análisis determinístico. La probabilidad de que la terapia con sunitinib sea costo-efectiva es, en el peor de los escenarios, de 70.5% con DAP comprendida entre US$ 0 y US$ 200,000.
El beneficio potencial de usar sunitinib como tratamiento de primera línea en pacientes de CCRm, también ha sido estudiado en otros contextos nacionales y con otros comparadores. Aunque los resultados de tales análisis no son directamente comparables con los nuestros, por haberse obtenido bajo diferentes consideraciones, es posible identificar tendencias.
Remák y colaboradores,34 así como Godoy y colaboradores,35 evaluaron el costo-efectividad y el costo-utilidad de sunitinib frente a IFN-a, como tratamiento de primera línea para CCRm en el contexto de los Estados Unidos de América (EUA) y Colombia respectivamente. Sus resultados mostraron que sunitinib es una alternativa costo-efectiva y dominante sobre IFN-a en sus respectivos contextos nacionales.
A través de un modelo independiente, Tenorio y colaboradores,36 estimaron el costo-efectividad de sunitinib, sorafenib y bevacizumab+IFN-a como tratamientos de primera línea para CCRm en el contexto de dos instituciones de salud representativas del sistema de salud mexicano (IMSS y el Instituto Nacional de Cancerología - INCAN), mostrando que sunitinib es una intervención costo-efectiva respecto de IFN-a y dominante sobre sorafenib y bevacizumab+IFN-a.
Benedict y colaboradores,37 estimaron que sunitinib es una alternativa costo-efectiva a sorafenib y dominante sobre bevacizumab+IFN-a y temsirolimus en el contexto de los EUA. En la actualización de sus resultados, sorafenib también fue dominado por sunitinib.38 Asimismo, en una extensión de su análisis previo, Godoy y colaboradores,39 empleando únicamente la sobrevida global como medida de efectividad, corroboraron en el contexto colombiano los resultados de Benedict y colaboradores.37,38
En una revisión sistemática que consideró documentos publicados hasta noviembre de 2008, Norum y colaboradores,40 observaron que a pesar de que la magnitud de la RCEI de sunitinib se encuentra distribuida en un intervalo de valores muy amplio, sunitinib presenta el mejor perfil de costo efectividad entre los documentos analizados.
En este sentido, se puede argumentar que el beneficio económico y en salud de usar sunitinib respecto de las terapias con sorafenib y bevacizumab+IFN-a obtenido en este estudio, es consistente con lo reportado en la bibliografía internacional. Esto constituye un resultado muy importante para los oncólogos y tomadores de decisiones mexicanos ante la carencia de guías clínicas para el tratamiento del CCRm en este país.
Las principales limitaciones de esta investigación, tienen relación con la validez externa de las utilidades obtenidas en el estudio 1034, ya que no existe evidencia del uso del instrumento EQ-5D en cáncer renal en pacientes mexicanos. Por otro lado, también ante la ausencia de evidencia publicada, fue necesario hacer imputaciones sobre la utilidad asociada a los tratamientos con sorafenib y bevacizumab+IFN-a, estableciéndola de acuerdo a los datos derivados del estudio 1034. Sin embargo, se considera que los resultados del análisis son robustos a variaciones importantes en los niveles de utilidad dados los resultados del análisis de sensibilidad univariado.
Una limitación inherente al diseño del estudio es la comparación indirecta de tratamientos contra el CCRm a través de un comparador común, dada la ausencia de este tipo de estudios en la bibliografía internacional. Aunque puede verificarse que las características basales de la población de los estudios clínicos son comparables, es posible que existan otras diferencias en el diseño de los estudios que podrían tener un impacto en los resultados de este análisis. Para superar adecuadamente este tipo de limitaciones en esta evaluación económica, surge la necesidad de llevar a cabo estudios clínicos head to head entre las alternativas consideradas en este análisis. En tanto, dado que los resultados del análisis de sensibilidad probabilístico fueron robustos con las estimaciones del análisis determinístico, se confirma la tendencia observada en los últimos, lo que brinda certidumbre acerca de los resultados de la presente investigación.
En conclusión, el tratamiento con sunitinib de pacientes diagnosticados con CCRm, en comparación con los tratamientos con sorafenib y bevacizumab+IFN-a, es la opción que presenta el menor costo para la institución (IMSS), el mayor periodo libre de progresión de enfermedad y el mayor nivel de calidad de vida para los pacientes, razones por las que se constituye como una opción costoahorradora en el tratamiento de primera línea de pacientes con CCRm en México.
¿ DECLARACIÓN DE CONFLICTO DE INTERÉS
Esta investigación se realizó con el apoyo financiero de Pfizer México. Al momento de la realización del estudio, Joaquín Mould-Quevedo y Emilio Muciño-Ortega, eran empleados de Pfizer S.A de C.V.
Correspondencia: Dr. Joaquín Federico Mould Quevedo. Pfizer S.
A. de C. V. Paseo de los Tamarindos 40, Col. Bosques de las Lomas. Delegación Cuajimalpa. C.P. 05120, México D.F. México.
Correo electrónico:joaquin.mould@pfizer.com