Introducción: Los tumores neuroendocrinos (NET) son neoplasias poco comunes, pero con una tasa de incidencia cada vez más alta en el mundo. El objetivo de este estudio es describir la experiencia del Centro Médico Nacional "20 de noviembre" en el manejo de pacientes con NET.
Material y método: Se realizó un estudio de tipo retrospectivo, transversal, observacional y descriptivo, en pacientes con diagnóstico de NET atendidos en el Servicio de Oncología quirúrgica del Centro Médico Nacional "20 de noviembre", de enero de 1999 a junio de 2010. El análisis se realizó mediante la prueba de ji cuadrada, curvas de Kaplan y Meier y una regresión de Cox.
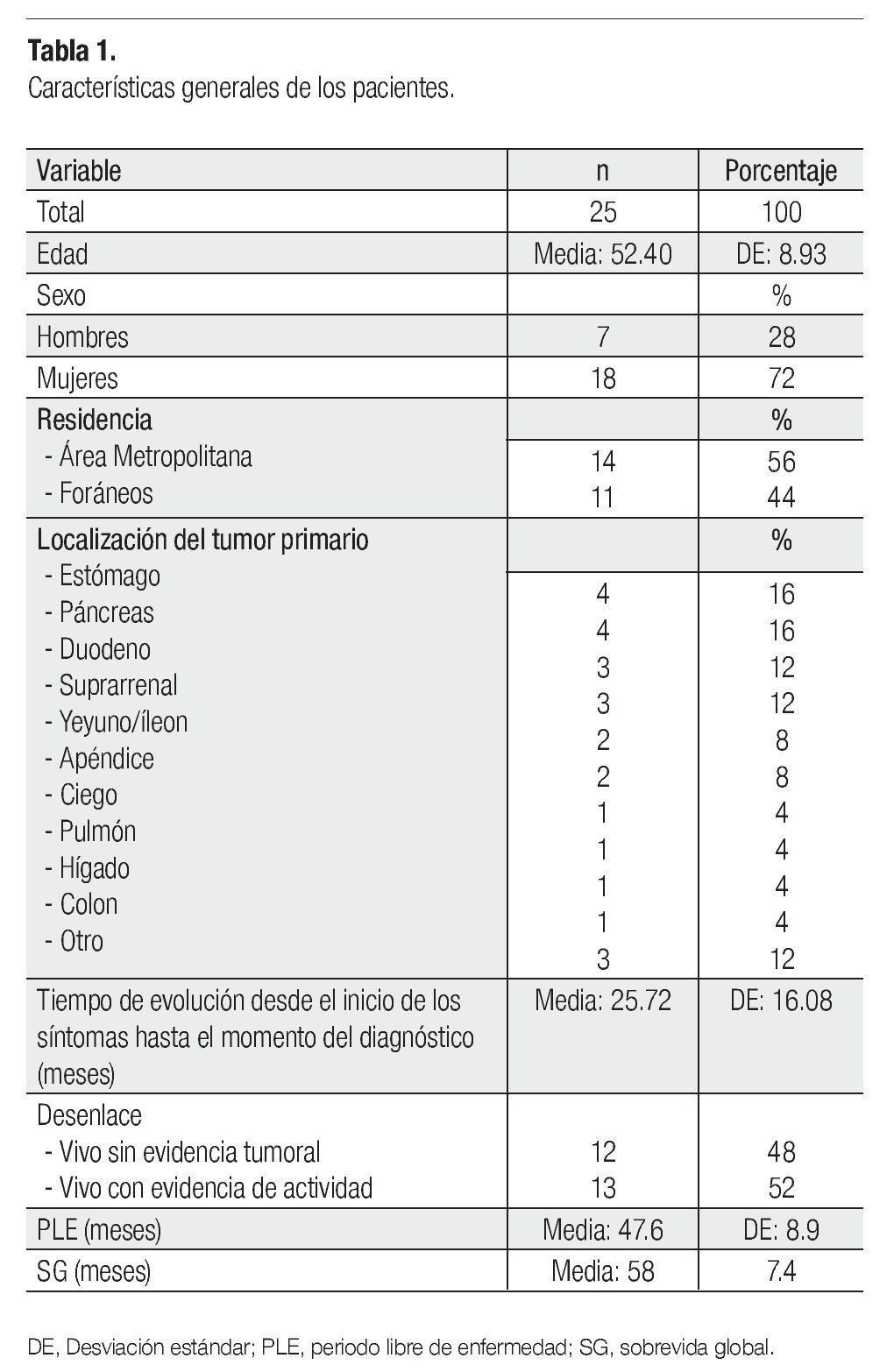
Resultados: Se identificó a 25 pacientes con diagnóstico de NET, la media de edad fue de 52.4 ± 8.93 años y la relación hombre:mujer fue de 1:2.57. La media entre el tiempo de evolución fue de 25.72 ± 16.08 meses. El síntoma más frecuente fue dolor. La mayoría de los tumores era bien diferenciada (17%) y localizada (60%). Los órganos más afectados fueron estómago y páncreas. El tratamiento más utilizado fue la resección quirúrgica. Hubo 32% de recaídas. Las variables que afectaron la supervivencia fueron localización, extensión, grado de diferenciación y tratamiento administrado (p<0.05).
Conclusiones: La cirugía es el tratamiento preferido para este grupo de neoplasias, tanto del tumor primario como de la recaída. Cuando esto no es posible, el uso de los nuevos tratamientos sistémicos resulta una buena opción. Se deben realizar más estudios de tipo prospectivo, con el fin de mejorar el tratamiento para estos tumores.
Introduction: Neuroendocrine tumors (NET) are uncommon neoplasms, but show steady growing incidence rates throughout the world. The aim of this study is to describe the expertise in the management of patients with neuroendocrine tumors.
Material and method: We performed a retrospective, transversal, observational, and descriptive trial, including patients diagnosed with NET and treated by the surgical oncology service, at the National Medical Center "20 de noviembre" from January 1999 through June 2010. The analysis was performed using the Wilcoxon X2 and Kaplan-Meier curves.
Results: There were 25 patients with NET, the mean age was 52.4 years ± 8.93, male : female ratio was 1:2.57. The mean of diagnosis time was 25.72 ± 16.08 months. The most common symptom was pain. Most tumors were well differentiated (17%) and located (60%). The most frequently affected organs were stomach and pancreas. The most used treatment was surgical resection. There were 32 % of relapses. Variants affecting survival were location, extent, differentiation degree, and treatment given (p<0.05)
Conclusions: Surgery is the first choice treatment for these neoplasms, both primary and relapsing. If not feasible, the use of new systemic treatments is a good option. Prospective studies are necessary in order to improve these tumors treatment.
¿ INTRODUCCIÓN
Los tumores neuroendocrinos o NETs (por sus siglas en inglés, NeuroEndocrine Tumors), comprenden un grupo heterogéneo de neoplasias con histología común. Afectan glándulas endocrinas como la hipófisis, las paratiroides y la suprarrenal neuroendocrina, así como los islotes endocrinos dentro de tejidos glandulares, como la tiroides o el páncreas. Igualmente, afecta a las células neuroendocrinas dispersas entre células exocrinas, como las de tracto gastrointestinal (GI) y respiratorio (sistema endocrino difuso). Tradicionalmente, los tumores hipofisarios, tiroideos y paratiroideos se estudian por separado. Los NETs del tracto GI, pulmones y timo se denominaban tumores carcinoides, aunque este término ha caído en desuso. Una pobre diferenciación del tumor indica un alto grado de malignidad, pero la gran mayoría de NETs exhibe buena diferenciación y un crecimiento relativamente lento.1 En 1907, Oberndorfer fue el primero en designar con el vocablo carcinoides a tumores ileales originados en las células enterocromafines (EC), productores de serotonina, que mostraban mejor pronóstico que los adenocarcinomas y de los que actualmente, se sabe poseen mecanismos neuroaminérgicos y/o receptores específicos en membrana celular, como los de somatostatina, lo cual es importante para identificar y tratar estos tumores.2
Aunque los NETs son tumores raros, han incrementado su tasa de incidencia en los últimos 30 años. Esto se debe, probablemente a la disponibilidad de mejores métodos diagnósticos. Los NETs más comunes son del tracto GI. En una serie de 13 715 pacientes con NET, publicada en 2003 y basada en los datos del programa estadounidense Sobrevida, Epidemiologia y Resultados Finales (SEER, por sus siglas en inglés, Surveillance, Epidemiology and End Results), se informó una incidencia ajustada al año para hombres y mujeres blancos de 2.47 y 2.58 de 100 000/año, respectivamente.3 La incidencia fue más alta entre la población negra (hombres 4.48/mujeres 3.98 de 100 000). La serie más grande es la registrada por Yao,4 a partir de datos del SEER con 35 618 casos, durante el periodo de 1973 a 2004. La incidencia ajustada por año fue de 1.09 en 100 000 para 1973, misma que incrementó hasta 5.25 en 100 000 para 2004, con una prevalencia ajustada a este periodo de 103,312 casos, lo que demostró que los NET son más comunes de lo que se pensaba, ya que al comparar esta prevalencia con la de otros tumores gastrointestinales, los NETs fueron más comunes que los tumores de esófago, hepatobiliares, de estómago y de páncreas en EUA.
En el presente artículo se analizan datos de la experiencia obtenida en el manejo de los pacientes con NETs, atendidos en el Centro Médico Nacional "20 de noviembre" del ISSSTE a lo largo de 10 años.
¿ MATERIAL Y MÉDOTOS
Estudio retrospectivo, observacional y analítico, en el que se revisaron los expedientes de pacientes con diagnóstico de NET, de la base de datos de Tumores Neuroendocrinos del Servicio de Tumores Mixtos y del archivo gráfico electrónico del Centro Médico Nacional (SIAH, texto y SIAH, gráfico). Se incluyeron pacientes con reporte de patología que confirmaba el diagnóstico de NET, atendidos por el Servicio de Oncología de ese centro hospitalario durante el periodo comprendido entre enero de 1999 y junio de 2010. Se excluyeron pacientes que no contaban con expediente clínico completo y quienes abandonaron el tratamiento, o se perdieron durante su seguimiento. Se analizaron variables como edad, sexo, lugar de residencia y año de ingreso. Se consideró el tiempo entre el inicio de síntomas y el diagnóstico, el síntoma o signo predominante, el lugar donde se realizó el diagnóstico, los estudios diagnósticos más usados, la localización al diagnóstico, el tipo de inmunohistoquímica usado, la extensión de la lesión, el tipo de tratamiento empleado, si hubo o no recaída y su tratamiento. Todo ello se comparó con el intervalo libre de progresión (ILP) y la supervivencia global (SG). Se clasificó a los tumores por su extensión en localizados, con extensión regional y metastásicos.
Se definió como localizado, al tumor confinado del todo al órgano de origen. Con extensión regional, al que va de los límites del órgano de origen hasta alrededor de los tejidos u órganos adyacentes, o que infiltra ganglios linfáticos regionales. Metastásico, se calificó al tumor que se extiende a sitios remotos del órgano de origen. Para el grado de diferenciación, se usó una clasificación de la OMS de 2004, que define a tumores carcinoides o a tumores de las células de islotes pancreáticos, como tumores bien diferenciados o G1, a los carcinoides atípicos, como moderadamente diferenciados o G2, tumores pobremente diferenciados como G3, y tumores anaplásicos como G4. Los tumores mixtos fueron aquellos con componente de adenocarcinoma y de tumores neuroendocrinos. Los tumores neuroendocrinos pancreáticos (GEP-NET) se clasificaron como insulinomas, gastrinomas, somatostatinomas, vipomas o tumores no funcionales, según se describieron en el Servicio de Patología y de acuerdo, con su comportamiento clínico.
La estadística se valió del programa SPSS versión 16. Las variables nominales se describieron en número y en porcentaje, y las continuas en media y desviación estándar. Se realizó un modelo de regresión de Cox y se recodificaron las variables predictivas para que tuviesen el número de sujetos necesarios para entrar al modelo (variables dummies), y como variables dependientes a ILP y SG.
Se recodificaron algunas variables, para que las categorías tuvieran al menos cinco sujetos. Las variables continuas se expresaron en media y desviación estándar (DE) y las discretas en número y porcentaje. Para comparación de variables discretas se usó la prueba de ji cuadrada.. Las variables con efecto en el intervalo libre de enfermedad y la sobrevida global, fueron analizadas mediante curvas de Kaplan y Meier y una regresión de Cox. Las diferencias se estimaron como significativamente estadísticas cuando la p<0.05.
¿ RESULTADOS
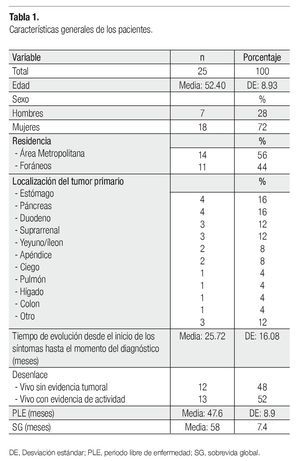
Se identificó un total de 25 pacientes con diagnóstico de NET confirmado por histopatología. En la Tabla 1 presentamos sus características demográficas. La incidencia de NET fue de 0.1% en pacientes atendidos por primera vez, en el Servicio de Oncología del CMN "20 de noviembre" en el periodo de 10 años. La edad promedio fue de 52.4 años, con rango de edad de entre 30 a 73 años. El sexo más afectado fue el femenino. La media en el tiempo de evolución fue 25.72 meses (DE ±16.08), con un rango que fue desde un un día hasta 212 meses (Tabla 1).
El síntoma predominante más frecuente fue dolor (28%), seguido de sangrado de tubo digestivo alto (20%). Veinte por ciento de los pacientes era asintomático. El estudio de laboratorio y gabinete más útil para diagnóstico fue la TC (32%). La endoscopia fue el siguiente en frecuencia (12%). Un paciente (4%) se diagnosticó como NET de apéndice en el estudio histopatológico, después de una apendicectomía de urgencia por apendicitis aguda.
Los sitios primarios más frecuentes fueron estómago y páncreas (16%, cada uno), seguidos del duodeno y de la glándula suprarrenal (12%, cada uno), del intestino delgado y el apéndice (8%, cada uno) y los menos frecuentes fueron ciego, pulmón, hígado y colon (4%, cada uno). La mayoría de NETs fue localizado (60%), y con evidencia de metástasis (32%). La mayor parte de NETs era bien diferenciada (17%), con 8% de tumores moderadamente diferenciados, y 4% de poco diferenciados e indiferenciados. No fue posible determinar el grado de diferenciación, en cuatro pacientes con los datos existentes en el expediente. En el 48% de los tumores, no se utilizó ningún tipo de inmunohistoquímica para integrar diagnóstico histopatológico. Cromogranina A fue el marcador tumoral más frecuente, en combinación con sinaptofisina (20%).
El tratamiento de NETs primarios fue quirúrgico en 60% de los pacientes, por resección completa (48%) o incompleta (12%). En relación con el tratamiento sistémico, 20% de nuestra población lo recibió como única modalidad, de la cual 4% recibió sólo octreotida LAR, 8% recibió quimioterapia citotóxica, y 8% otro tipo de tratamiento sistémico (inhibidores de tirosincinasa y bisfosfonatos, entre otros). Veinte por ciento recibió terapia combinada con cirugía y otra modalidad de tratamiento. De los ocho pacientes con metástasis en el diagnóstico, siete tuvieron metástasis hepáticas y un paciente en hueso. El tratamiento para ellos consistió en quimioterapia citotóxica (n=3), octreotida LAR (n=2), metastasectomía (n=1) y otros (n=2). El estudio de seguimiento más usado fue la TC, en ocasiones combinada con otros estudios, como el de catecolaminas urinarias. Se documentó recaída en ocho pacientes, de los cuales tres tuvieron recaída a hígado, uno recaída loco regional, y uno más en hígado y ovario. Los tres pacientes restantes la tuvieron a otros sitios. El tratamiento para pacientes con recaídas fue octreotida LAR (n=2), quimioterapia (n=1), combinación de octreotida LAR con metastasectomía (n=1), terapia de citorreducción (n=1) y algún otro tratamiento como IFN-alfa (n=1).
Los NETs con diferenciación en páncreas representaron 28% (n=7) del total de la muestra, de los cuales tres fueron gastrinomas, dos insulinomas y dos no funcionales. La localización más frecuente fue el páncreas en cuatro pacientes (57.2%). Un gastrinoma se localizó en el duodeno y dos más en el estómago. El comportamiento de éstos fue benigno en 57% y maligno en 43%. El síntoma predominante fue sangrado de tubo digestivo alto en 43%, de los pacientes con GEP-NETs. El tratamiento para el tumor primario en este subgrupo de pacientes fue diferente con respecto al resto de los NETs. Las modalidades empleadas fueron resección completa con octreotida LAR adyuvante en dos (28.6%), y el tratamiento sistémico en dos más (28.6%). Dos pacientes presentaban metástasis hepáticas al momento del diagnóstico, por lo que fueron tratados con inhibidores de la tirosincinasa. Sólo dos pacientes (28.6%) tuvieron recaída, uno a hígado y otro loco regional, los cuales fueron tratados con citorreducción, IFN-alfa y octreotida LAR.
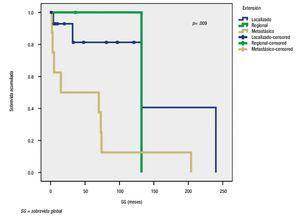
El seguimiento promedio fue de 58.04 ± 7.36 meses, la media en el ILP fue de 47.6 meses y la media de SG, fue de 58.04 meses. Al final del estudio, el 48% de los pacientes estaban vivos y sin evidencia de actividad tumoral, el restante 52%, también vivo, pero con evidencia de actividad tumoral. No se registraron muertes hasta el cierre del estudio. De acuerdo con las curvas de sobrevida de Kaplan-Meier, la localización del NET primario no influenció el ILP, con un valor p=0.076. Sin embargo, entre las variables que sí influyeron, se encontró la extensión del tumor y el grado de diferenciación, con una p<0.05, con lo cual se alcanzó el mayor intervalo en tumores localizados y bien diferenciados. Con respecto a esta última variable, se formó un subgrupo de acuerdo con el grado de diferenciación y extensión. Se observó que, en tumores localizados, el grado de diferenciación influenció en la supervivencia (p<0.05), a diferencia de los tumores metastásicos, donde no se encontró dicha influencia.
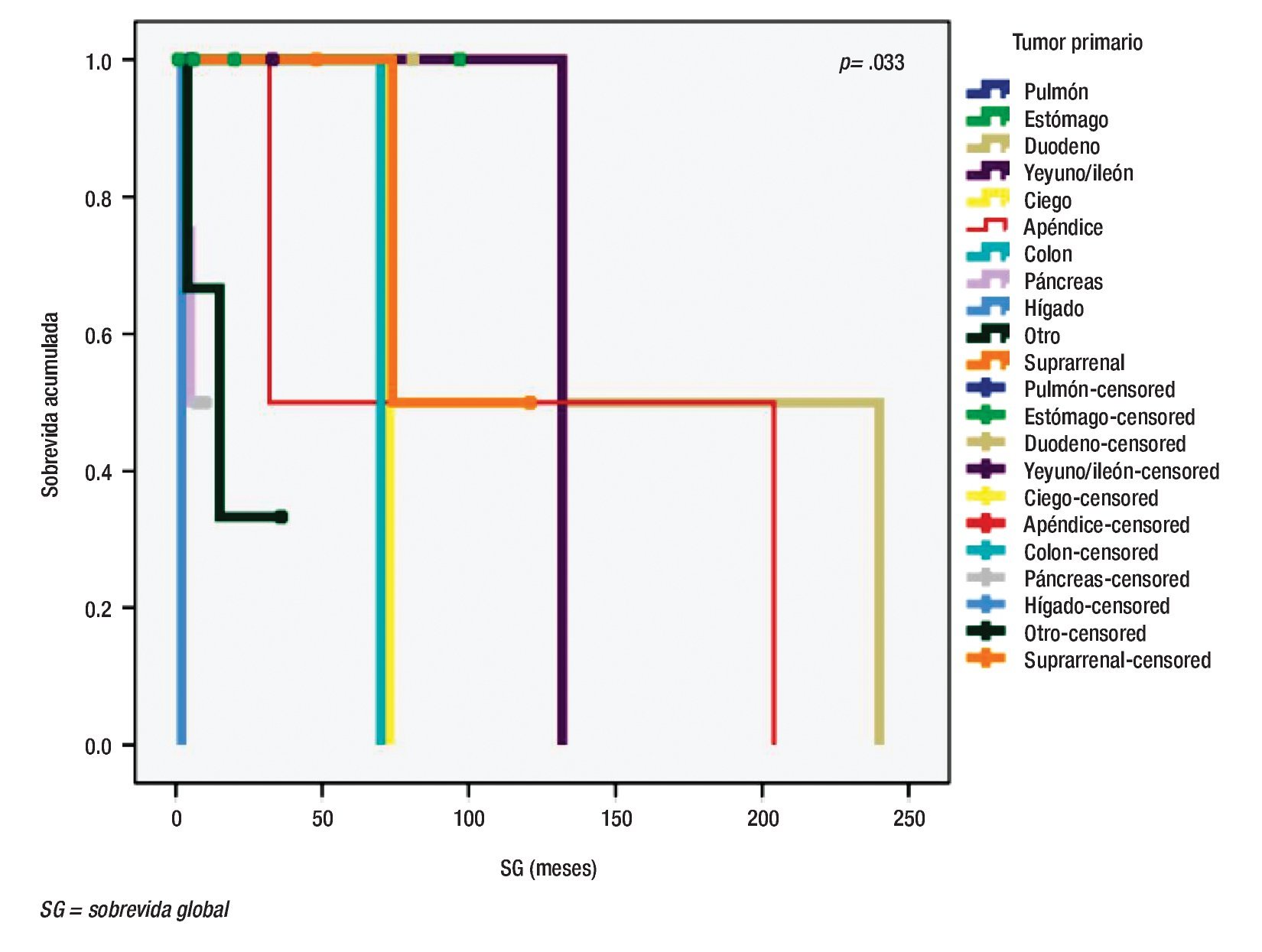
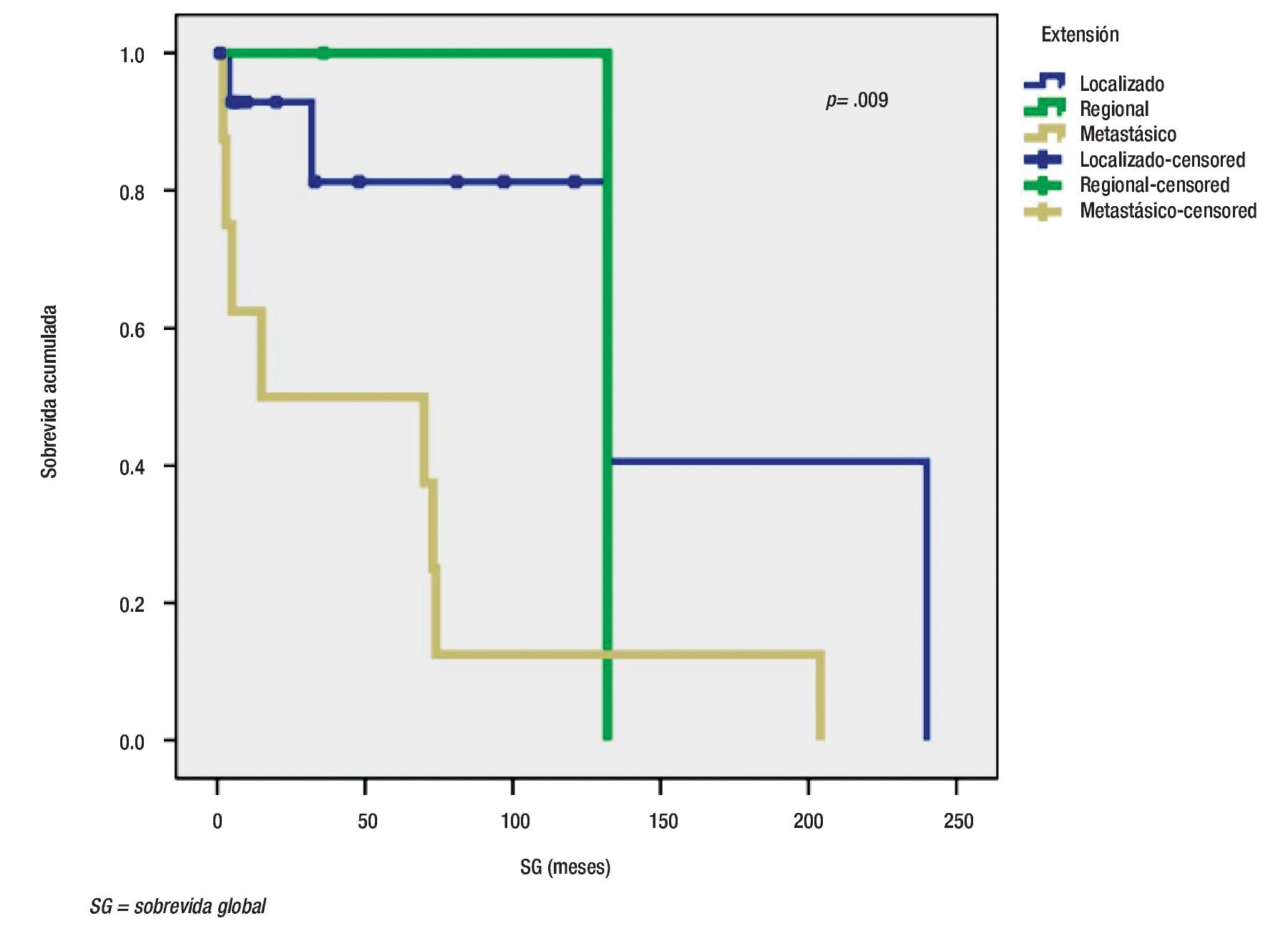
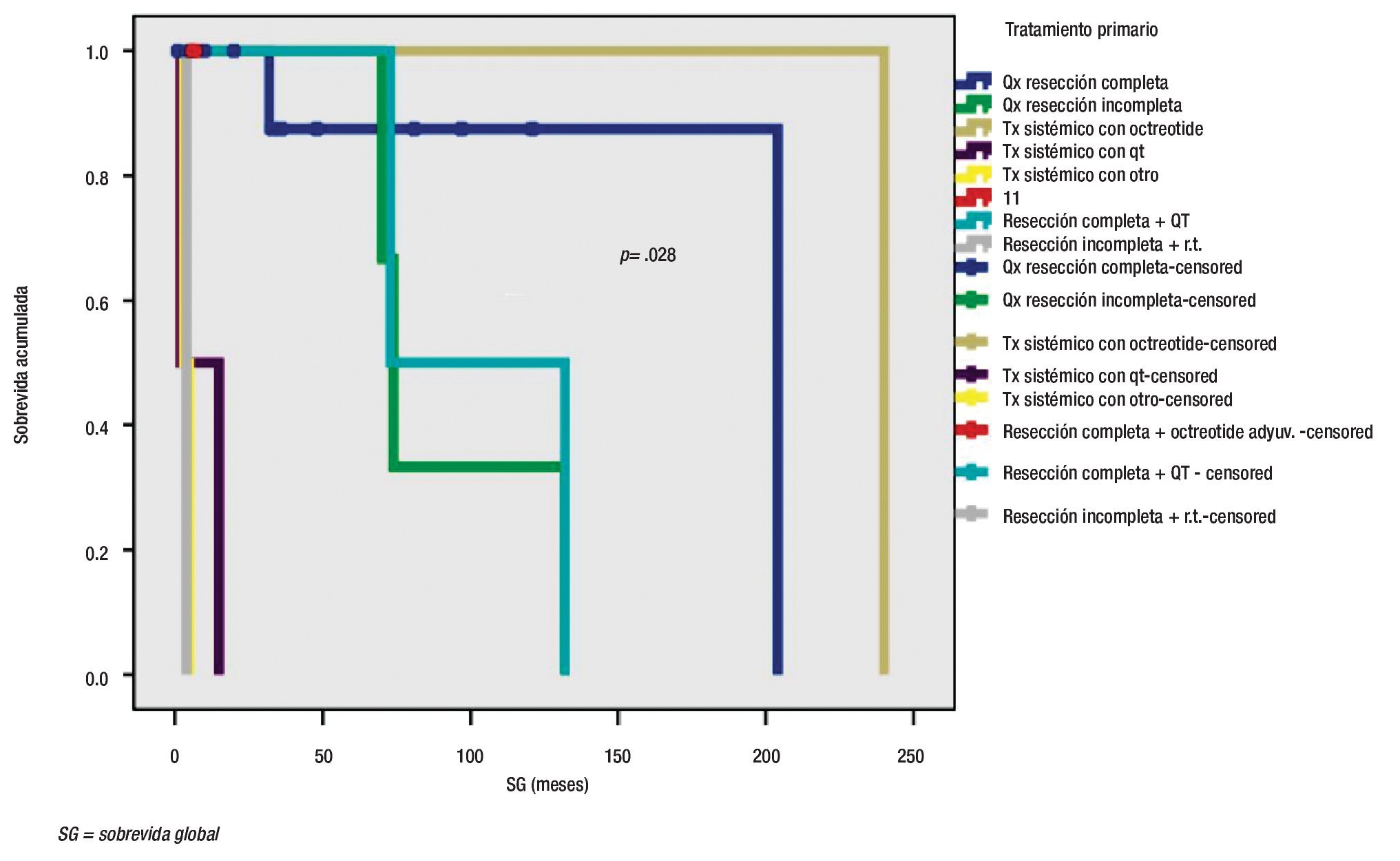
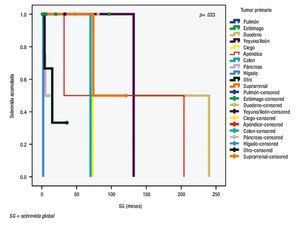
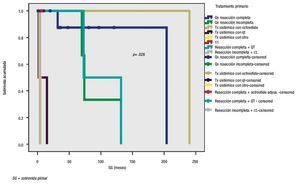
Para la SG, la localización del tumor primario sí mostró diferencia significativa, además de mejores tasas de supervivencia para tumores localizados en el duodeno y el apéndice (Figura 1). La extensión del tumor también influenció a la SG (Figura 2). Al analizar el grado de diferenciación, resultó que éste no afectó la SG significativamente, pero en un subgrupo de extensión del tumor, la diferencia sí fue significativa para tumores localizados, con una p<0.05, mientras que en tumores metastásicos, la supervivencia no fue afectada por el grado de diferenciación. Finalmente, el tratamiento utilizado para el tumor primario también afectó significativamente a la SG (Figura 3).
Figura 1. Sobrevida global de acuerdo con la localización del tumor primario.
Figura 2. Sobrevida global de acuerdo con extensión del tumor primario.
Figura 3. Sobrevida global de acuerdo al tratamiento utilizado.
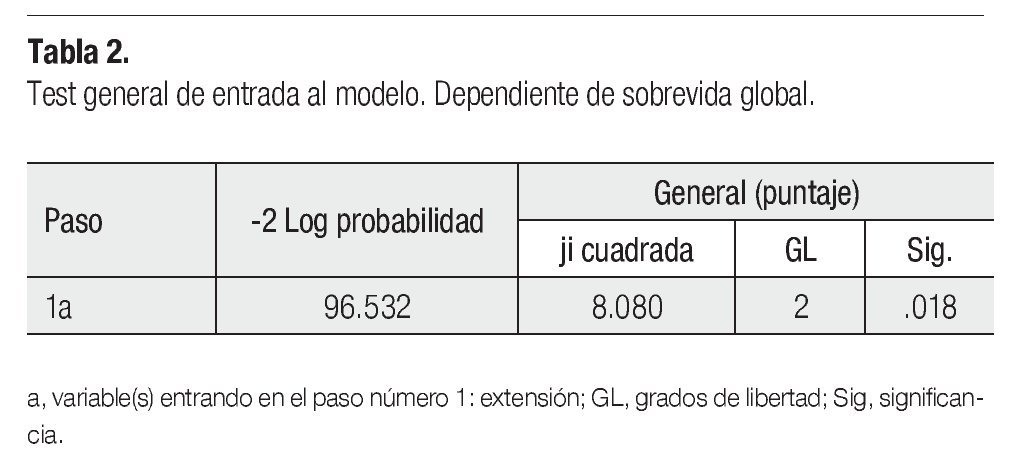
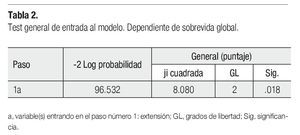
En la regresión de Cox, se incluyeron las siguientes variables predictivas para la SG: sexo, edad, tiempo de evolución, tumor primario, presencia de metástasis y recaída. Tanto para el PLE como la SG, la única variable que entró en el modelo con significancia estadística fue la extensión (localizado o regional vs metastásico). La extensión metastásica fue el único factor predictor, controlado por el resto de variables clínicas (Tabla 2).
¿ DISCUSIÓN
El aumento en la incidencia de NETs está asociado con el incremento de la sospecha clínica de los médicos, combinado con la disponibilidad de mejores recursos diagnósticos. La raza más afectada es la blanca (81%), seguida de la negra (afroamericana, 12%), asiática (5%) e indígena norteamericana (1%). Los NETs fueron tumores poco frecuentes en nuestra población derechohabiente. Sin embargo, como lo indican los resultados, la mayoría se detectó durante 2009. Aunque se han informado NETs en pacientes de todas las edades, la media de edad al diagnóstico en nuestros pacientes es similar a la serie más grande de la que tenemos conocimiento (SEER)4 y de igual forma, el sexo más frecuentemente afectado fue el femenino. Los NETs usualmente son esporádicos, pero también se presentan como NETs múltiples y ocurren en síndromes genéticos como neoplasia endocrina múltiple (NEM) tipo 1, neurofibromatosis tipo 1, síndrome de Hippel-Landau, y esclerosis tuberosa, con una frecuencia muy baja (<1%) en tumores carcinoides, y muy alta (80% a 100%) en tumores endocrinos pancreáticos (insulinomas, de 5% a 20%; gastrinomas, de 25% a 30%; tumores no funcionales de >50%). Los NETs gastroenteropancreáticos o GEP-NETs (Gastroenteropancreatic Neuroendocrine Tumors), son los tumores más frecuentes (67.5%), seguidos de los broncopulmonares (25.3%). Los GEP-NET representan alrededor del 2% de todos los tumores GI, con una incidencia global de 2.5 a cinco casos por 100 000 habitantes al año, y con un ligero predominio entre mujeres. La agresividad, potencial metastásico y pronóstico de NET, varían según la localización del tumor primario.5
El sistema endocrino difuso del tracto GI es el más grande del organismo, con más de 16 tipos de células endocrinas que producen más de 50 péptidos o aminas.
Los GEP-NETs son capaces de preservar y amplificar la actividad de las células que los originan. Se caracterizan por secretar un gran número de péptidos y neurotransmisores, y por desarrollar síndromes clínicos (NETs funcionales). Puede tratarse de tumores no funcionales (biológicamente inactivos). Esto se debe a la síntesis hormonal o a su secreción y rápida degradación, a la síntesis de hormonas precursoras o inactivas, o a la cosecreción de hormonas antagonistas.5,6
En nuestra serie, el tiempo desde el inicio de los síntomas hasta el diagnóstico varió desde 0.03 a 120 meses, debido a que el paciente con menor tiempo de evolución presentó un cuadro de apendicitis aguda, y el que más tardó fue un gastrinoma que recibió manejo como enfermedad úlcero péptica durante 10 años. La media en el tiempo de evolución fue de 25.72 meses, lo que nos habla de la amplia gama de formas de presentación con las que cursan estos tumores.
El síntoma más frecuente fue dolor y sangrado de tubo digestivo, lo que se relaciona con los sitios de localización del tumor. En esta muestra, el estómago y el páncreas fueron los sitios más frecuentes. Los síntomas compatibles con síndrome carcinoide fueron rubicundez, diarrea e hipertensión arterial, presentes en sólo 12% de los casos, lo que corresponde a lo informado en la literatura médica.1,6 Aunque sólo el 48% de los pacientes fue diagnosticado en nuestro centro hospitalario, este porcentaje constituyó la mayoría de los pacientes. Dado que se trata de un hospital de concentración, el resto de los pacientes fueron referidos y con el diagnóstico de NET.
Como se señaló, las localizaciones más frecuentes de NETs en nuestra serie fueron estómago y páncreas, a diferencia de lo informado en otras, donde los sitios más comunes fueron intestino delgado, recto y ciego.5,6 A pesar de que la localización no tuvo una diferencia con respecto al sexo (p>0.05),4 sí tuvo un efecto en la SG y se observó que los NETs en duodeno, apéndice e intestino delgado alcanzan mejores tasas de supervivencia. En relación con la extensión del tumor, la mayoría de los tumores estaba localizada. No obstante, hasta 32% se encontraba con evidencia de metástasis, también por arriba de lo informado previamente,4 sólo unos cuantos pacientes presentaban extensión regional. Por supuesto, el ILP y la SG resultaron afectados por esta variable. El grado de diferenciación más común fue el bien diferenciado, el resto de los grados fueron raros en la serie. En general, el impacto de la diferenciación en la supervivencia fue discreto y mayor en tumores aún localizados (Figura 2).
La tomografía computarizada (TC) es el método preferido para identificar el tumor y sus metástasis, sin embargo, en algunos casos la especificidad de la TC abdominal es pobre. El uso de péptidos radiomarcados y centellografía ofrece datos diagnósticos y recientemente se ha comprobado su valor terapéutico.7,8 La localización del primario con centellografía con octreótide marcado con I111 u OctreoscanTM es superior a TC y MRI, y ayuda en el diagnóstico y localización de carcinoides primarios o recurrentes, en predicción de respuesta a los análogos de somatostatina, en la estadificación y en la definición de enfermedad de apariencia benigna. La sensibilidad diagnóstica de este estudio se ha reportado hasta en 90% de pacientes asintomáticos y en pacientes con síntomas > 90%.9,10
En el tratamiento de NET, la cirugía es aún la piedra angular. Igual que en otras series, la cirugía fue el tratamiento con intento curativo más empleado por nosotros. En este informe, 60% de los pacientes fue sometido a resección completa o incompleta. La mayoría de las veces, la cirugía consistió en resección radical del órgano de origen, siempre que esto fue posible. Se realizaron cinco hemicolectomías (una con resección hepática), tres enucleaciones, tres adrenalectomías, dos resecciones amplias, una lobectomía pulmonar, una pancreatectomía distal, una gastrectomía total, una gastrectomía parcial, una resección intestinal, una ooforectomía y una tumorectomía. En ningún paciente se realizó linfadenectomía electiva, a menos que hubiera evidencia de metástasis ganglionares. Existe controversia en cuanto al beneficio de linfadenectomía. Los argumentos a favor son que mejora la etapificación, asegura resección R0, identifica metástasis ocultas, mejora el control loco regional y aumenta supervivencia sin incrementar morbilidad ni mortalidad. Los argumentos en contra son que no ofrece ventaja alguna en enfermedad avanzada, conlleva un aumento de morbilidad, de costos y no ofrece beneficio en la supervivencia.11-14
En general, los NET pancreáticos fueron llevados a cirugía con resección completa; no obstante, muchos recibieron octreotida para control preoperatorio. A diferencia de lo que informa la literatura,15,16 el tumor funcional más común en nuestra muestra fue el gastrinoma, seguido de insulinoma y de los tumores no funcionales. Sin embargo, el procedimiento realizado, la recaída y la sobrevida global no variaron con respecto a los informes previos. 17,18
El tipo de cirugía realizada afectó notablemente a la SG y al ILP de nuestros pacientes. Los mejores resultados con cirugía se lograron cuando fue posible realizar resección completa; en caso contrario, se alcanzaron con resección incompleta combinada con un tratamiento sistémico, como octreotida LAR.
Las metástasis hepáticas por tumores neuroendocrinos representan 10% de todas las metástasis a hígado, en contraste con el resto, la presencia de éstas se asocian a sobrevida prolongada aún sin tratamiento (30% a cinco años). Sin embargo, el dolor y la debilidad asociada a hepatomegalia y cambios hormonales afectan la calidad de vida del paciente. Noventa por ciento de las metástasis son multifocales y bilaterales al diagnóstico; con frecuencia su resección no es posible. No obstante, los pacientes pueden recibir cirugía citorreductora, si al menos 90% del tumor es resecable. La cirugía de tipo paliativo se indica en tumores funcionales con metástasis no operables con el objetivo de controlar los síntomas, cuando el tumor primario se localiza en intestino delgado y ocasiona obstrucción, o bien, si la cirugía permitirá un tratamiento multimodal.19-21 Nosotros realizamos sólo una cirugía citorreductora en un paciente que presentó recaída loco regional. Las metastasectomías hepáticas reportan una supervivencia a cinco años de 50% a 76%, en pacientes con embolización de la arteria hepática y cirugía, contra una supervivencia de 20% a 30% en pacientes sin tratamiento.22,23 En nuestra experiencia, de los siete pacientes que presentaban metástasis hepática al momento del diagnóstico, sólo en uno fue posible realizar metastasectomía, y de los tres pacientes que presentaron recaída a hígado, sólo en uno fue posible realizar el mismo procedimiento. La embolización portal para conseguir hipertrofias hepáticas compensadoras, la radiofrecuencia y las hepatectomías secuenciales aumentan la resecabilidad y actualmente son de gran utilidad para tumores con metástasis hepáticas no candidatas a cirugía de inicio.24,25 El control de los síntomas para radiofrecuencia y quimioembolización se ha logrado hasta en 70% a 80% y 60% a 95%, respectivamente.26-30
El trasplante hepático se ha considerado una opción, aunque la experiencia es limitada de acuerdo con las series reportadas.31-33 No obstante, se han alcanzado porcentajes de sobrevida global hasta de 69% a cinco años en pacientes con NET gastrointestinales.34 Una revisión sistemática reciente demostró tasas de sobrevida de hasta 44% a cinco años con una sobrevida media de 54.45 +/- 6.31 meses en pacientes con NET pancreáticos avanzados sometidos a trasplante hepático.35 Los factores que se han informado y están asociados con buenos resultados son la edad menor de 55 años y un grado de proliferación tumoral bajo con un Ki67 < 10%.36
La terapia sistémica con el uso de análogos de somatostatina como octreotida y lanreotide es útil para el tratamiento del síndrome carcinoide. Su efectividad para reducir la rubicundez facial y la diarrea es hasta del 70% a 80%. Además se ha demostrado que tienen un efecto citostático especialmente en los NETs bien diferenciados.37,38 El estudio PROMID fue un ensayo clínico doble ciego controlado, que demostró que el uso de octreotida de liberación prolongada (Octreotida LAR) alargó el tiempo de progresión hasta ocho meses en NETs derivados del intestino medio metastásicos funcionales y no funcionales.39 En nuestra serie, la octreotida LAR como modalidad única alcanzó las mejores tasas de supervivencia en pacientes en que no fue posible realizar cirugía. Interferón (IFN) alfa es útil como terapia adicional cuando el síndrome carcinoide no se resuelve con los tratamientos anteriores, además se han informado respuestas parciales de 4% y enfermedad estable en 26% en series prospectivas con el uso de IFN alfa.40,41 La mielosupresión, fatiga y toxicidad son las principales limitantes con este tratamiento. La quimioterapia citotóxica se indica en pacientes como primera línea en NET pobremente diferenciados y en los que presentan NET bien diferenciados con enfermedad rápidamente progresiva o con metástasis extensas que no han respondido o han mostrado progresión después del uso de otros tratamientos. Los esquemas de quimioterapia que mostraron respuestas modestas en estudios prospectivos fueron estreptozocina en combinación con 5-FU o doxorrubicina, empero, la toxicidad renal fue hasta de 35%.42,43 La temozolamida en combinación con talidomida y bevacizumab se evaluó en dos estudios prospectivos, donde la respuestas fueron mejores para los NET pancreáticos (45% de respuestas parciales con temozolamida mas bevacizumab).44,45 Un estudio reciente informó respuesta parcial hasta de 70% con la combinación de temozolamida y capecitabine.46 Los NET pobremente diferenciados de células pequeñas que asemejan al carcinoma pulmonar de células pequeñas son tratados con la combinación de platino con inhibidores de la topoisomerasa. 47
Los tumores neuroendocrinos son tumores altamente vascularizados, y expresan tanto factor de crecimiento del endotelio vascular (VEGF) como receptor del VEGF. La evidencia actual apoya el uso de blancos moleculares en la vía de señalización del VEGF. En un estudio fase III que comparó el uso de sunitinib vs placebo en 171 pacientes con NET pancreáticos avanzados, se encontró una mejoría en la supervivencia libre de progresión (SLP) con una media de 11.4 meses en el grupo de sunitinib, en comparación con 5.5 mes en el grupo control (p<0.001).48 En este estudio, los inhibidores de la vía de mTOR son otros blancos moleculares prometedores para el tratamiento de los NET avanzados, de acuerdo con los resultados de dos estudios fase III que evaluaron la respuesta al tratamiento con everolimus (RADIANT-2 y RADIANT- 3). En el primero se aleatorizaron, 429 pacientes con tumor carcinoide avanzado a recibir everolimus + octreotida LAR o sólo octreotida LAR. Los resultados en la media de la SLP favorecieron al grupo de everolimus (16.4 meses vs 11.3 meses). Sin embargo, en la revisión por un comité central, la p=0.026, no alcanzó significancia estadística (preestablecida como p=0.024).49 En el segundo estudio, se incluyeron 410 pacientes con NET pancreático avanzado, 207 pacientes recibieron everolimus 10 mg/día hasta la progresión y 203 pacientes sólo placebo. La media en la SLP en el grupo experimental fue de 11 meses, en comparación con el grupo placebo que fue de 4.6 meses. El estudio concluyó que everolimus reduce el riesgo de progresión en 65% (RR= 0.35, p=<0.0001), independientemente si el paciente había recibido o no tratamiento previamente con análogos de somatostatina o quimioterapia.50
El pronóstico para los pacientes con NET y GEPNET depende de la localización y la extensión de la enfermedad. En general, tumores de apéndice y recto tienen mejor pronóstico, con supervivencia a cinco años de cerca del 100% en tumores localizados. En contraste, los NETs de intestino delgado (en especial de íleon) son más agresivos y tienen peor pronóstico. Otros factores pronósticos adversos descritos son el grado histológico alto, la presencia de metástasis hepáticas, el índice proliferativo por Ki-67 >25%, los tumores pobremente diferenciados y el número de metástasis hepáticas. El único factor que se ha encontrado que mejora la sobrevida es el tratamiento inicial con cirugía.51
¿ CONCLUSIÓN
Los NETs son neoplasias raras. Su incidencia ha aumentado notablemente, quizá por un incremento en la sospecha clínica y por avances de métodos diagnósticos. Muchos de estos tumores no causan síntomas y el diagnóstico puede llegar a ser muy tardío. El sangrado de tubo digestivo es frecuente en NETs con diferenciación pancreática (GEP-NET). La cirugía con resección completa continúa siendo la piedra angular para tratar la lesión primaria y metástasis susceptibles de resección. El uso de octreotida LAR resulta una buena opción en resección incompleta, en presencia de metástasis o en la recaída. El pronóstico de NET es bueno, ya que la mayoría se clasifica como tumores bien diferenciados, y se registra una buena tasa de SG, a pesar de la presencia de metástasis o recaída. Aunque la localización más frecuente de éstas últimas es el hígado, pueden ser susceptibles a resección quirúrgica. La recaída es frecuente en NET y actualmente se disponen de nuevos tratamientos que han mejorado la SLP; sin embargo, se requiere de mayor investigación con estudios prospectivos que valoren el uso de estas nuevas opciones de tratamiento y que además contemple la posibilidad de adyuvancia, con el objetivo de disminuir el porcentaje de recaída. No obstante, la baja frecuencia de estos tumores es la principal limitante con las que nos enfrentamos.
Correspondencia: Subdirección de enseñanza, 2º piso, Hospital 20 de noviembre, ISSSTE. San Lorenzo # 502, Col del Valle, CP. 03100, Del. Benito Juárez. México, D.F., México.
Teléfono: 5200 5003. Ext.14618. Celular: 04455 2952 2954.
Correo electrónico:drpabelm@hotmail.com