¿ INTRODUCCIÓN
Antecedentes: Los tumores del SNC son los tumores sólidos más frecuentes en la edad pediátrica, en México la incidencia es de 17 por millón cada año y suceden 560 nuevos casos por año.1 El ependimoma es el tercer tumor más frecuente en la infancia.2
En la niñez, los tumores cerebrales son biológica e histológicamente heterogéneos y varían de lesiones localizadas de bajo grado a tumores de alto grado con diseminación en el neuroeje.3 La mortalidad en estos casos ha disminuido 23% desde 1975, debido a los avances en el tratamiento con quimioterapia.4 Con el desarrollo de nuevas técnicas para diagnóstico inmunohistoquimico y de biología molecular, se ha logrado un mayor conocimiento sobre el comportamiento biológico de los tumores, estableciendo subgrupos morfológicamente similares pero con un diferente comportamiento biológico. En los tumores malignos existe una sobre expresión de ciertos antígenos que le confiere mayor agresividad.5
La sobre expresión de Ki67 se relaciona con mal pronóstico en pacientes con tumores de alto grado,6 así como también CD133 implica mayor vascularidad y agresividad. Estas y otras alteraciones encontradas se han asociado con la evolución clínica y el resultado histopatológico, encontrando una fuerte relación, lo que nos obliga a continuar con esta línea de investigación.
Recientemente, algunos grupos han logrado encontrar células madre en tumores cerebrales y se han logrado cultivar tanto de tejido cerebral sano como tumoral, con diferencias en la expresión de antígenos.7 Con el uso de un modelo para generación de astrocitomas de alto grado, fue posible identificar subpoblaciones celulares concretas dentro del tumor, que eran capaces de transmitir este tumor cuando a nivel clonal se trasplantaban en el cerebro de ratones inmunodeficientes. La aportación de los tumores cerebrales ha sido decisiva a la hora de aceptar la existencia de células madres tumorales, porque fueron las primeras que se definieron,8, 9 y porque el avance en la identificación y seguimiento de estos tumores ha permitido su localización en nichos cerca de los tejidos neovasculares formados con el crecimiento del tumor.10 La posibilidad de identificación nace al obtener un anticuerpo monoclonal que reconocía un antígeno de superficie de las células madre neurales denominado CD-133.11 Se localizaron células CD-133+ en el glioblastoma multiforme y se encontró que era la fracción CD-133+ la que mejor inducía nuevos tumores cerebrales, tras su trasplante en nuevos ratones, al compararla con la fracción CD-133-.9 La identificación de células CD-133+/nestina+, permitió descubrir la proximidad de estas células cerca de los capilares nuevos que se forman con el crecimiento del tumor.10
El crecimiento de las células madre tumorales se identifica mediante la formación de neuroesferas y en algunos estudios se ha demostrado que la formación de estas en tumores malignos tiene un gran peso pronóstico, de tal manera que aquellos que tienen mayor formación de neuroesferas indican rápida progresión tumoral y muerte a corto plazo independientemente de la edad, género y de la expresión del antígeno Ki-67,12 p53, BCL-2 y otros marcadores inmunohistoquímicos.
El cultivo de estas células se ha estado empleando de manera reciente con resultados muy alentadores en la identificación de nuevos factores pronósticos y nuevas estrategias terapéuticas.
La finalidad de este trabajo es presentar un caso clínico de un paciente quien desarrolla un tumor cerebral de alto grado cuyas células fueron cultivadas mediante este tipo de crecimiento, presentando formación de neuroesferas renovables, lo cual no se relacionó con el resultado histopatológico, pero sí con la evolución clínica fatal rápidamente progresiva.
¿ PRESENTACIÓN DEL CASO
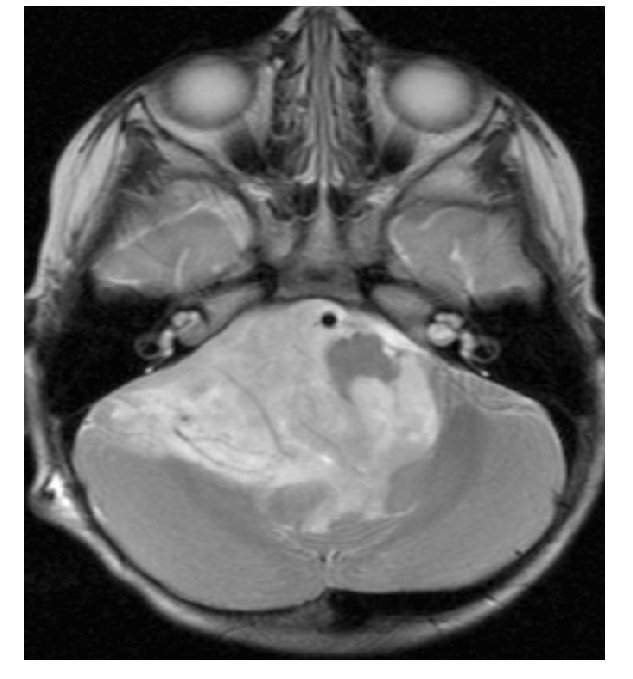
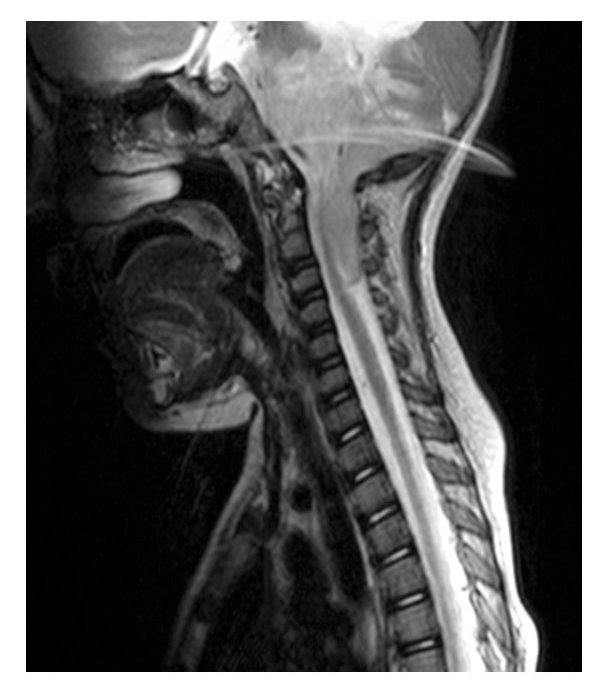
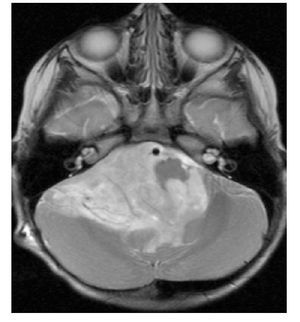
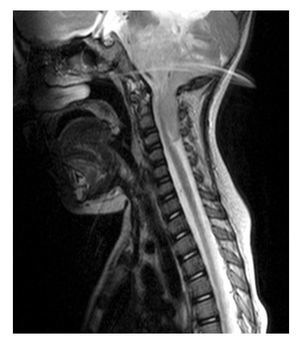
Niña de un año 11 meses de edad, con padecimiento de dos meses de evolución previo a su diagnóstico, con disminución de fuerza muscular de ambas extremidades inferiores, vómito, cefalea y crisis convulsivas, en ese orden de aparición. Se le realizó un estudio tomográfico, con el que se evidenció hidrocefalia secundaria a masa tumoral en fosa posterior. Se colocó válvula de derivación ventriculoperitoneal y posteriormente se realizó resonancia magnética, corroborando masa tumoral en fosa posterior de aproximadamente 10 cm por 10 cm, que infiltraba el tallo y se extendía por debajo de foramen magno hasta la tercera vértebra cervical (Figuras 1 y 2). Los resultados de laboratorio no revelaron alteraciones considerables.
Figura 1. Resonancia magnética, con la que se corroboró la presencia de una masa tumoral en fosa posterior, de aproximadamente 10 cm por 10 cm.
Figura 2. Resonancia magnética con la que se observa la infiltración al tallo y su extensión por debajo de foramen magno hasta la tercera vértebra cervical.
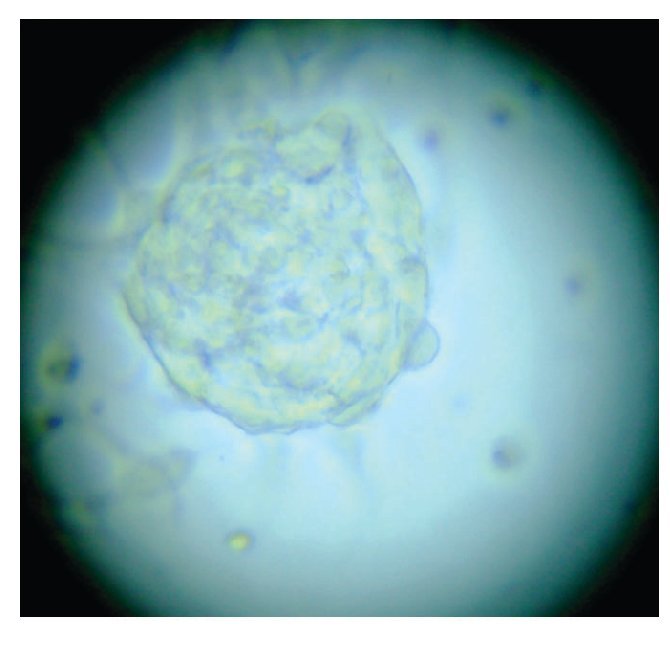
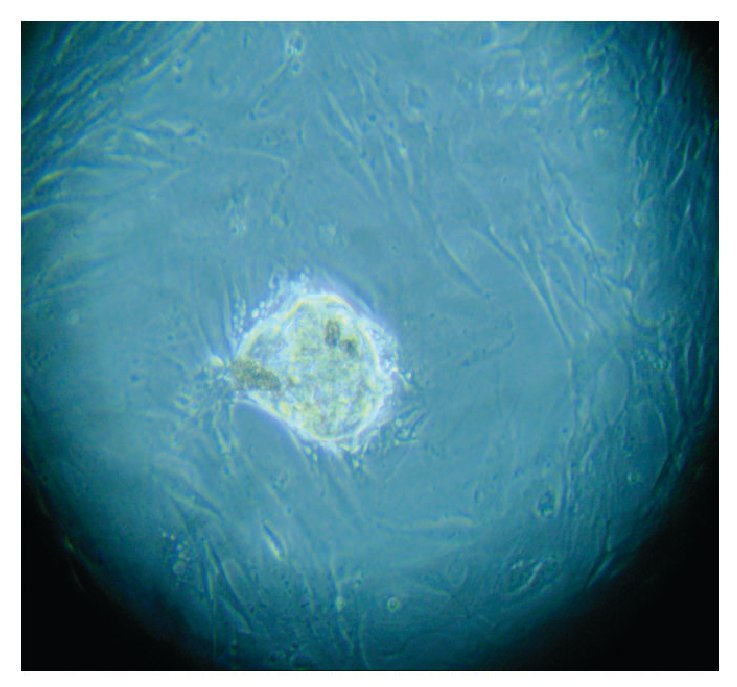
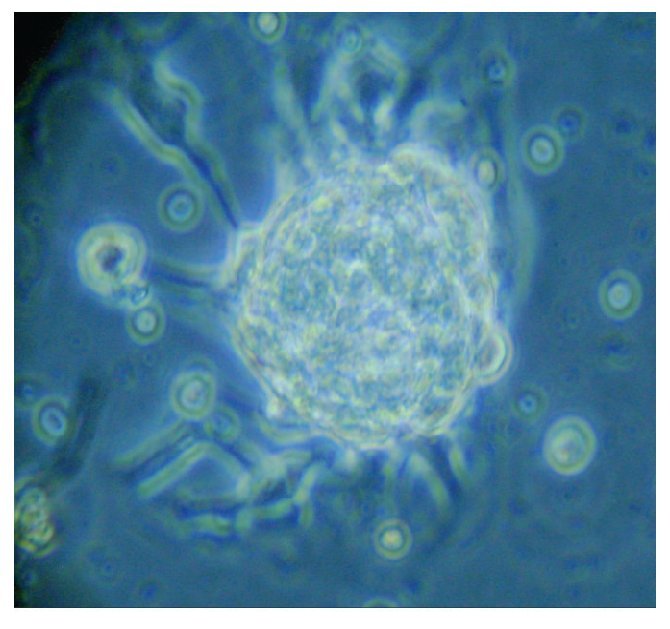
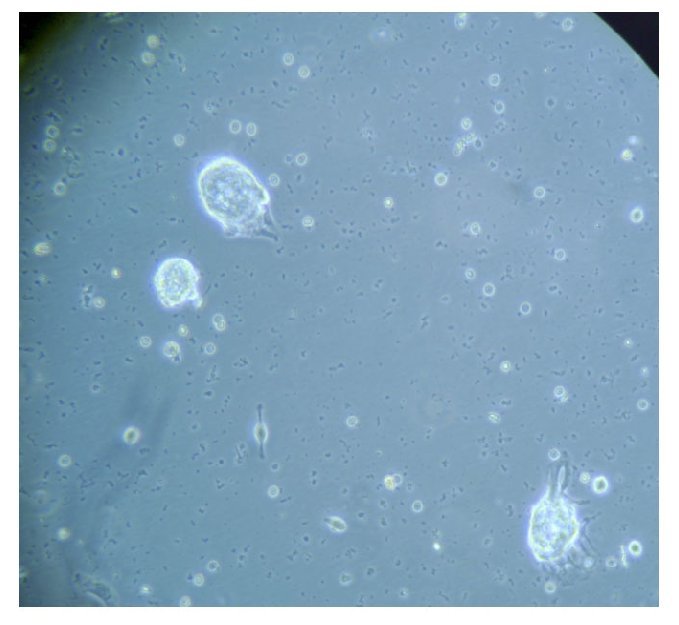
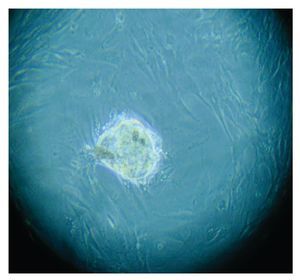
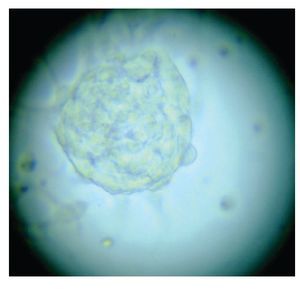
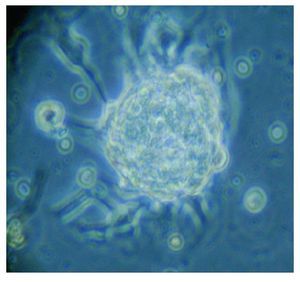
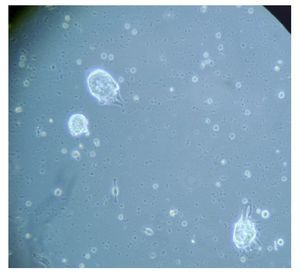
Con base en este diagnóstico, se realizó resección tumoral parcial, con informe de patología de un ependimoma clásico. De la muestra tumoral se realizaron cultivos, encontrando formación de neuroesferas renovables en cuatro cultivos (Figuras 3 a 6). Se inició tratamiento con base de carboplatino, ifosfamida y etoposido el 26 de octubre de 2010, sin complicaciones agudas. Se logró su estabilización y una buena recuperación postquirúrgica, por lo que fue posible egresarla. Después de siete días, se ingresó a urgencias por deterioro neurológico progresivo de 12 horas de evolución. Es valorada por neurocirujano descartando disfunción valvular por lo que es manejada con medidas antiedema, ventilación mecánica y aminas vasoactivas sin presentar respuesta favorable al tratamiento. Presentó paro cardiorespiratorio, sin respuesta a maniobras avanzadas y fallece por progresión tumoral ocho horas posterior a su ingreso.
Figura 3. Imagen de cultivo tumoral, basal.
Figura 4. Imagen cultivo tumoral. Posterior a siete días (Pase 1)
Figura 5. Imagen cultivo tumoral. Posterior a 15 días (Pase 2)
Figura 6. Imagen cultivo tumoral. Posterior a 18 días (Pase 3)
El informe de inmunohistoquímica mostró positividad para CD-133 en 80%; positividad para BCL-2 en 60% así como para Ki-67 en 70% y sobre expresión de p53 en 80% de las células estudiadas.
¿ DISCUSIÓN
El cultivo de neuroesferas en tumores cerebrales ha sido utilizado, encontrando diferentes patrones de crecimiento en relación con el grado de malignidad del tumor. En los primeros estudios realizados, se demostró su capacidad neoplásica al trasplantar estas neuroesferas de células madres tumorales en animales de experimentación, observando crecimiento tumoral de la misma estirpe celular.13 La interpretación de esta formación de neuroesferas implica una mayor agresividad de las células madres tumorales, así como una mayor capacidad de diseminación. Trabajos previos han sugerido que, además del crecimiento, la expresión de algunos genes y proteínas, como nestin y CD-133, asociada a las células madres tumorales se relaciona con un pobre pronóstico clínico.14
Esta correlación entre la formación de neuroesferas y la severidad clínica, empieza a tener un peso en el pronóstico de estos pacientes y pareciera muy consistente; sin embargo, no explica la hipótesis de que el mal pronóstico esté asociado con la actividad de las células madres tumorales cerebrales.12
El crecimiento de neuroesferas se ha estado comparando con algunos antígenos de proliferación celular para determinarlo como factor pronóstico. En este sentido, se ha demostrado que las neuroesferas tiene una mayor asociación con el resultado clínico cuando se asocia con el antígeno Ki-67, demostrando la severidad de las células tumorales independientemente del grado tumoral, edad y proliferación celular.12,15
En nuestro caso, se informa sobre la asociación que existe entre la evolución clínica tórpida y el crecimiento de neuroesferas renovables, pero no así con la histología señalada como tumor de bajo grado. En la bibliografía sí se ha informado sobre la asociación de la mala evolución clínica con el crecimiento de neuroesferasal.15 Estos resultados nos obligan a continuar utilizando estos procedimientos para lograr un mejor conocimiento sobre el comportamiento biológico tumoral. De mayor peso aún es que nuestro paciente haya demostrado positividad para marcadores de mal pronóstico, como el Ki-67, el BCL-2, el CD-133 y la sobre expresión del oncogén p53, lo que nos obliga a realizar un estudio integral del comportamiento biológico del tumor de cada caso en particular de manera individualizada, sin conformarse con el sólo informe histopatológico para plantear una estrategia terapéutica.
En conclusión, consideramos necesario la realización de estudios clínicos siguiendo esta línea de investigación, con la finalidad de establecer nuevos factores pronósticos y dianas para tratamiento dirigido de manera integral para cada niño.
Correspondencia: Dr. Enrique López Aguilar.
Av. Cuauhtémoc 330. Colonia Doctores. 06720, México, D. F.
Teléfono: 5255 5627 6900, extensión: 22528.
Correo electrónico:elopezaguilar@hotmail.com