Introducción: El cáncer germinal de testículo es frecuente de 15 a 35 años de edad. Avances en su diagnóstico y tratamiento permiten una supervivencia superior a 90%. La linfadenectomía retroperitoneal primaria y posquimioterapia tiene un rol establecido de tipo diagnóstico y terapéutico, con una morbilidad considerable. Debido al menor trauma quirúrgico y la mejor apreciación de estructuras anatómicas en el abordaje laparoscópico, se motivó su introducción, como una opción de manejo. Son pocos los estudios con un nivel de evidencia adecuado que den un soporte científico para su práctica, faltan en linfadenectomía retroperitoneal laparoscópica (LRL) ensayos clínicos aleatorizados que la comparen con la cirugía abierta.
Objetivo: Presentar nuestra experiencia en LRL indicada en cáncer germinal de testículo.
Material y métodos: Análisis retrospectivo de características demográficas y resultados tempranos, de la base de datos creada de forma prospectiva con pacientes operados de LRL con diagnóstico de cáncer de testículo no seminoma (CTNS).
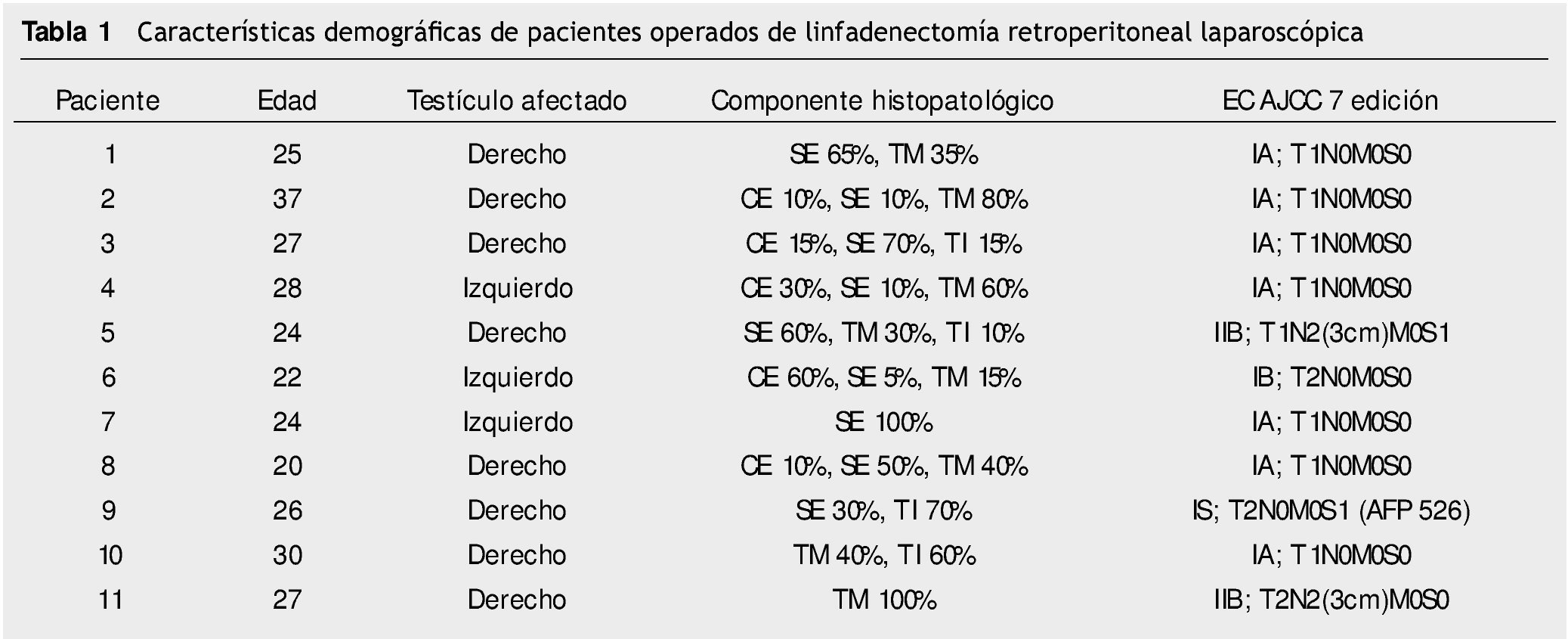
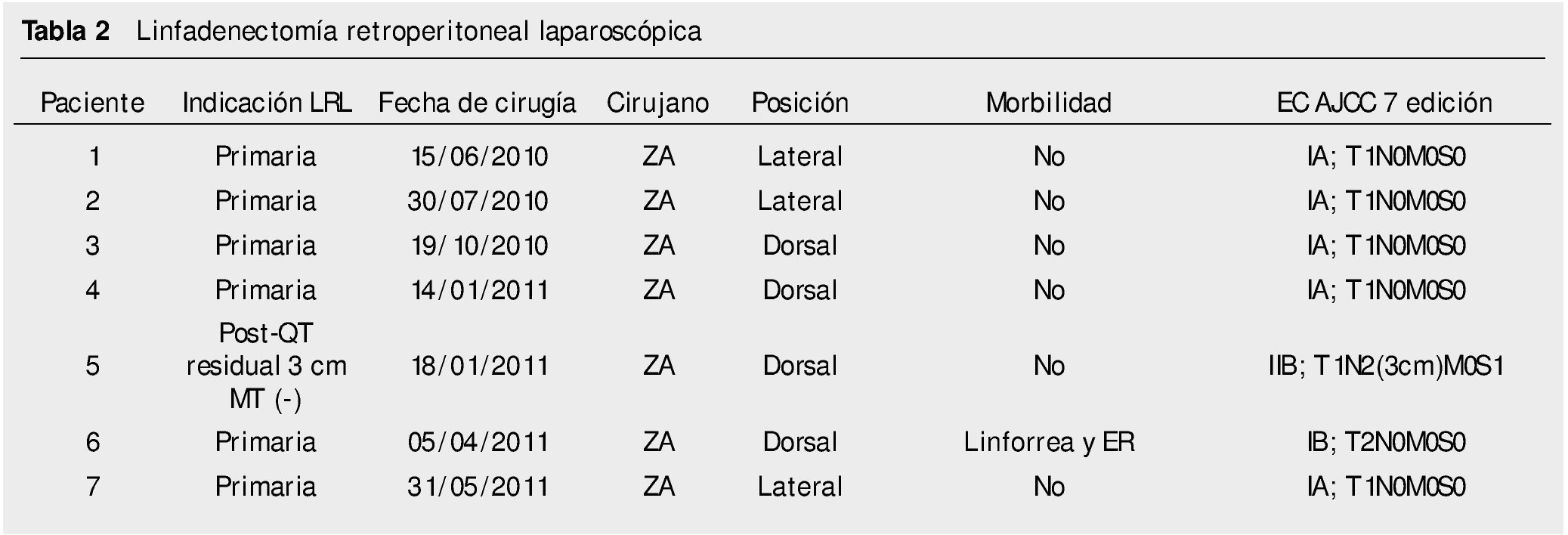
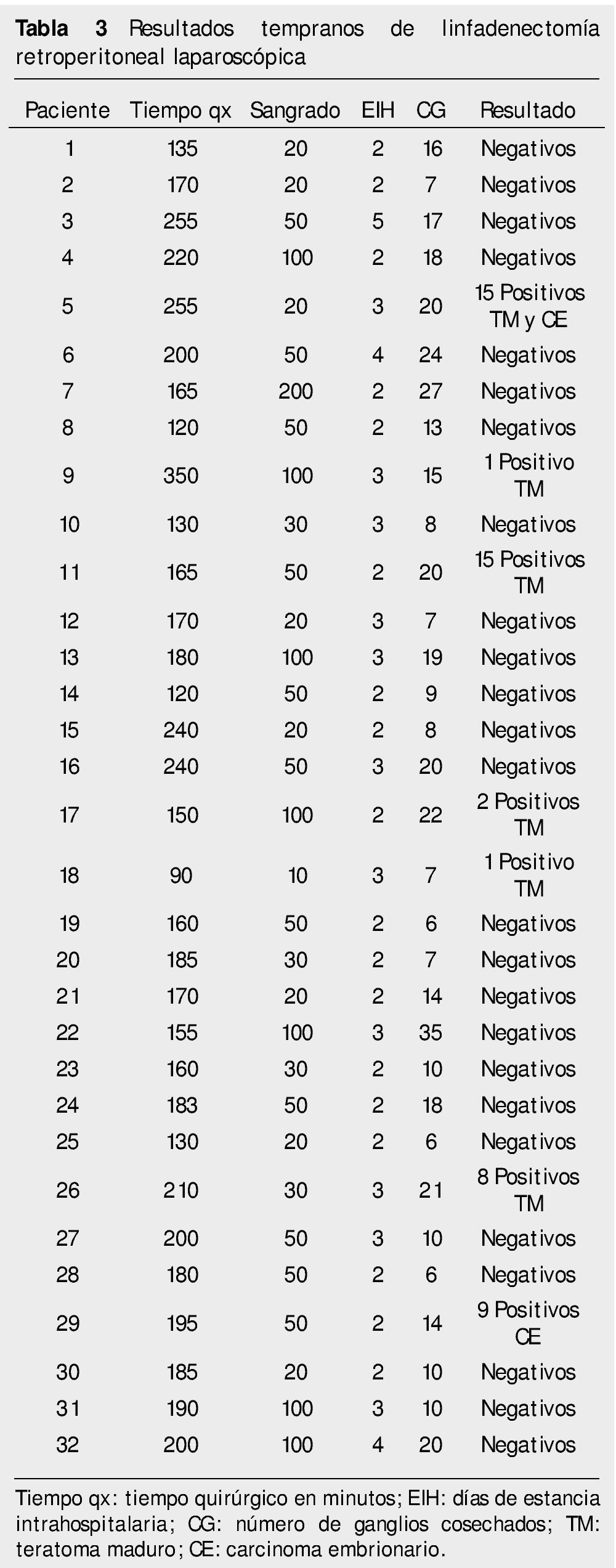
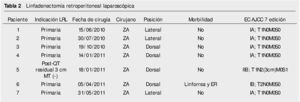
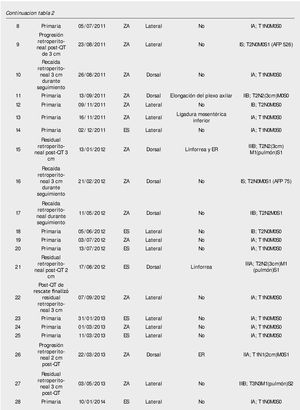
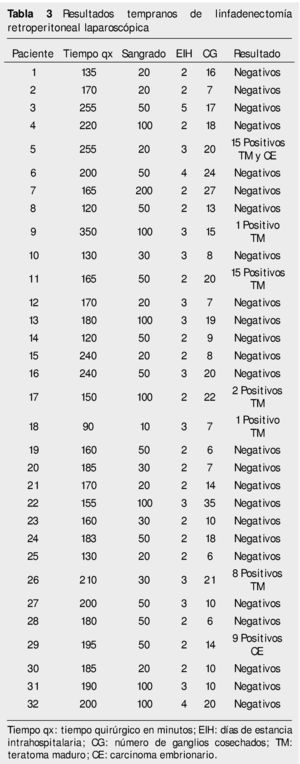
Resultados: Del 15 de junio de 2010 a 25 de abril del 2014, se han operado 32 pacientes de LRL transperitoneal por CTNS, por 2 cirujanos. En veinte pacientes la indicación fue etapificadora, 8 pacientes residual posquimioterapia y 4 pacientes recaída retroperitoneal en seguimiento; tiempo quirúrgico, sangrado y estancia hospitalaria promedio de 183 minutos, 54.3 mL y 2.56 días, respectivamente; 25% de morbilidad del tipo Clavien I-II: 4 quilorreas, 2 eyaculación retrógrada, uno ligadura de mesentérica inferior y uno elongación del plexo braquial; promedio de cosecha ganglionar 14.12 ganglios.
Conclusión: La LRL es una cirugía compleja, que requiere una curva de aprendizaje y conocimientos en cirugía abierta y laparoscópica avanzada de retroperitoneo.
Background: Germinal testicular cancer occurs most often in men 15 to 35 years old. Advances in diagnosis and treatment have led to a greater than 90% survival. Primary and post-chemotherapy retroperitoneal lymph node dissection has an established role in the diagnosing and treatment of this neoplasm but with considerable morbidity. Due to less surgical trauma and better appreciation of anatomical structures in the laparoscopic approach has motivated us to introduce as an option of management. There are few studies with whit sufficient evidence to support its use and there is lack randomized trials that comparing open vs. Laparoscopic approaches.
Objective: Present our experience with laparoscopic retroperitoneal lymphadenectomy (LRL) in germinal testicular cancer
Material and methods: Retrospective analysis of demographic characteristics and early results, of the database created with patients undergoing LRL diagnosed with nonseminoma testicular cancer (NSTC).
Results: June 15th 2010 at April 25th 2014, 32 patients were operated transperitoneal LRL for NSTC by 2 surgeons. Twenty patients the indication was staging LRL, 8 patients post-chemotherapy and 4 by LRL in patients whit retroperitoneal relapse at follow-up. Surgical time, bleeding and hospital stay averaged 183 minutes, 54.3 mL and 2.56 days, respectively, 25% morbidity rate Clavien I-II (8 patients); 4 lymphatic leakage, 2 retrograde ejaculation, a ligature of inferior mesenteric artery and brachial plexus elongation, Showing a nodal count of 14.12 nodes.
Conclusion: The LRL is a complex surgery that requires a learning curve and expertise in advanced laparoscopic and open retroperitoneal surgery.
Introducción
A pesar de que el cáncer germinal de testículo representa el 2% de todos los tumores malignos, es la neoplasia sólida más frecuente en el grupo de edad de 15 a 35 años, representando un problema de Salud Pública1. Los avances en el conocimiento de su biología tumoral, diagnóstico y tratamiento han permitido alcanzar supervivencias mayores a 90%2. Se clasifica en 2 subtipos: seminoma y no seminoma, en este último se incluye el subtipo histológico seminoma con elevación de alfa-fetoproteína (AFP) y los germinales mixtos. Para el tratamiento del subtipo seminoma en etapas clínicas IA y B (séptima edición AJCC3), existen 3 modalidades de manejo4: observación, un ciclo de quimioterapia con carboplatino y radioterapia a retroperitoneo; su elección está dictada por el riesgo de recaída, basada en el tamaño tumoral y presencia o ausencia de infiltración a rete testis; en la etapa IIA5, el tratamiento es radioterapia retroperitoneal. En etapas avanzados la indicación es quimioterapia; el régimen y el número de ciclos están basado en la clasificación del riesgo propuesto por International Germ Cell Cancer Consensus Group (IGCCCG)6,7; riesgo bajo: 4 ciclos de EP (etopósido y platino) o 3 ciclos de BEP (bleomicina, etopósido y platino) y riesgo intermedio: 4 ciclos de BEP, no hay alto riesgo en seminoma. En residual posquimioterapia mayor de 3 cm, por el alto índice de enfermedad viable, deberá someterse a una tomografía por emisión de positrones8, biopsia guiada por tomografía o si es factible linfadenectomía retroperitoneal, con el objetivo de documentar actividad y deberá elegirse segunda línea de quimioterapia si es positivo. En el subtipo no seminoma ya sea con componente histológico puro (coriocarcinoma, senos endodérmicos, carcinoma embrionario o teratoma maduro e inmaduro) o mixto, posterior a la orquiectomía, en el manejo de las etapas clínicas I también hay 3 modalidades de manejo9: observación estrecha, quimioterapia con uno o 2 ciclos de BEP, o linfadenectomía retroperitoneal etapificadora, su elección es controversial10 y deberá elegirse basado en múltiples factores como morbilidad de cada una de las terapias, costo, preferencia informada del paciente y principalmente del conocimiento del riesgo de recaída de cada una de las terapias, que está dictado por la presencia o ausencia de invasión linfovascular en la pieza de la orquiectomía y porcentaje de componente carcinoma embrionario, ya que la presencia de ambos eleva el riesgo de recaída retroperitoneal hasta 50%. En el resto de las etapas clínicas el tratamiento está basado en quimioterapia, el número de ciclos y el régimen también está basado en la clasificación del riesgo de IGCCCG6,7; riesgo bajo (etapas IS, IIA S1, IIB S1, IIC y IIIA) 4 ciclos de EP o 3 ciclos de BEP, y riesgo intermedio (IIIB) o alto (IIIC) 4 ciclos de BEP, casos selectos de etapas clínicas II donde los marcadores son negativos, se debe considerar la linfadenectomía retroperitoneal primaria por el riesgo de teratoma maduro7. En el manejo de residual posquimioterapia mayor de 1 cm con marcadores tumorales negativos está indicada la linfadenectomía retroperitoneal11,12, ya que en 20% hay tumor viable susceptible de segunda línea de quimioterapia, 30% teratoma maduro no sensible a quimioterapia.
El abordaje abierto para resecar los ganglios retroperitoneales conlleva una morbilidad de 25% a 50%13-16, 12% intraoperatorias, 32% postoperatorias, 7% tardías y 8% del tipo de la clasificación Clavien III-IV cuando se realiza en pacientes posquimioterapia17,18. El abordaje laparoscópico está descrito desde 1992 por el Dr. Rukstalis DB et al.19 en etapa clínica I. Los beneficios debidos al menor trauma quirúrgico, la mejor visualización de estructuras anatómicas han permitido su expansión en diferentes centros hospitalarios de excelencia con el objetivo de disminuir la morbilidad del procedimiento abierto, sin embargo son pocos los estudios que dan un sustento científico20.
Material y métodos
La capacitación y adiestramiento en cirugía de mínimo acceso laparoscópico permitió obtener el Consentimiento Institucional y del Comité de Ética del Hospital Juárez de México (N° Registro HJM 233/14-A), para que bajo consentimiento informado del paciente con diagnóstico de cáncer germinal de testículo no seminoma, se someta a linfadenectomía retroperitoneal por vía laparoscópica (LRL) transperitoneal en los siguientes escenarios:
1. LRL primaria o etapificadora, como una modalidad de manejo en etapa clínica I no seminoma (tumor confinado al testículo sin evidencia de enfermedad por estudios de imagen y marcadores tumorales negativos o que se negativizan a las 4 semanas postorquiectomía; AFP, fracción B de la gonadotropina coriónica humana y deshidrogenasa láctica).
2. En actividad retroperitoneal menor a 2 cm con marcadores tumorales negativos.
3. En residual posquimioterapia mayor de 1 cm y menor de 3 cm.
4. Como recaída retroperitoneal aislada con marcadores tumorales negativos durante el seguimiento.
Realizamos un análisis descriptivo de características demográficas y resultados tempranos que fueron captados de forma prospectiva en cada visita del paciente, se registraron diferentes variables en el programa Microsoft Excel®: edad, lado de testículo afectado, marcadores tumorales preoperatorios, etapa clínica, componentes del tipo histológico, fecha de la cirugía, cirujano efector, posición, tiempo quirúrgico, sangrado operatorio, estancia hospitalaria, cosecha ganglionar y resultado histopatológico
Técnica
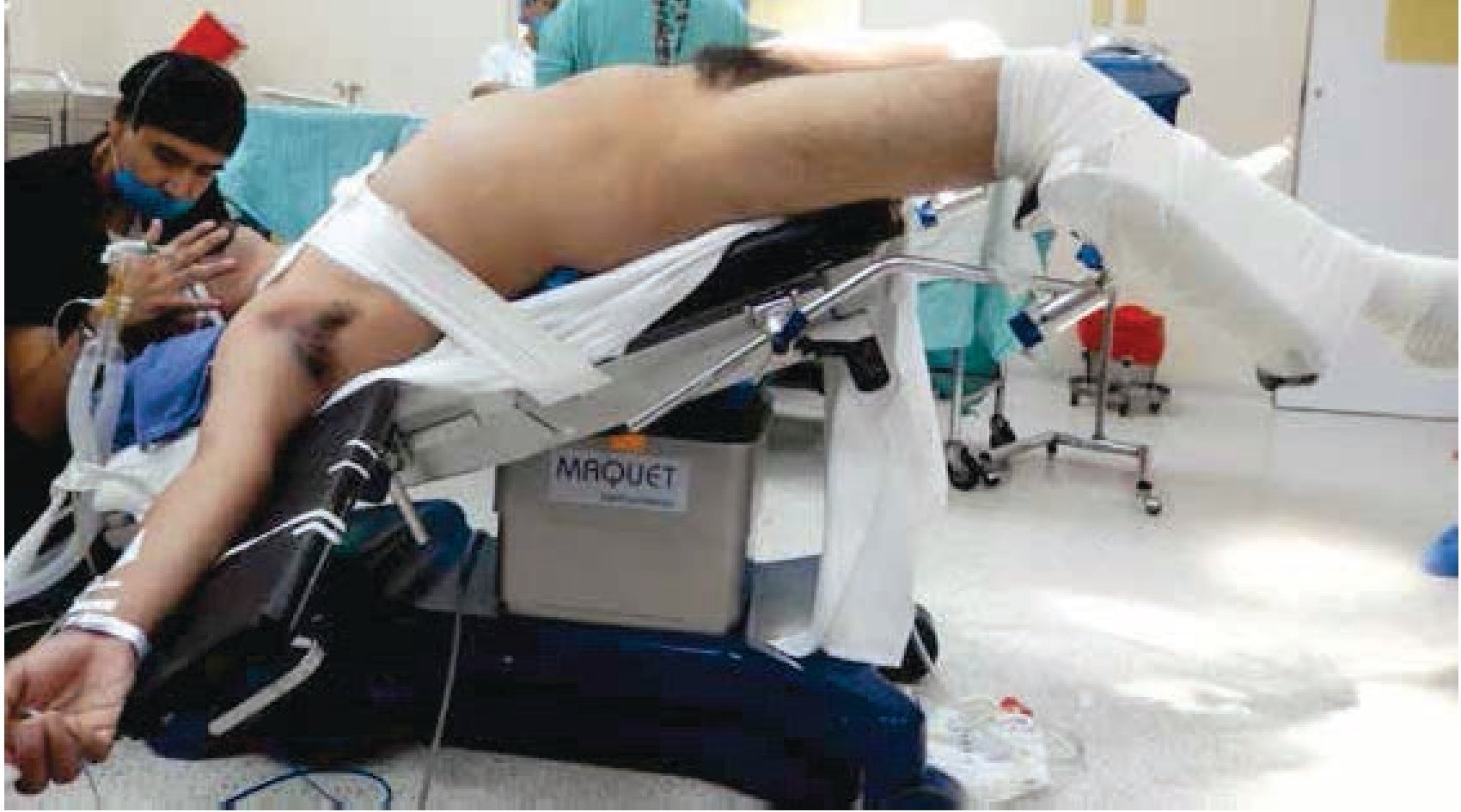
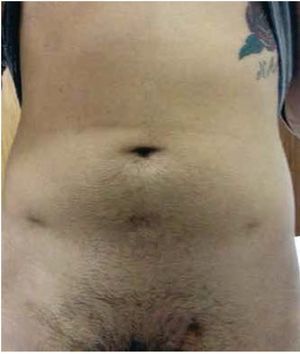
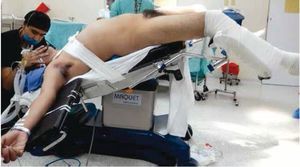
La técnica y preparación preoperatoria para la LRL que usamos en etapa clínica I no seminona (marcador negativo o normalizado a las 4 semanas postorquiectomía) ya está previamente publicada21, en pacientes con CTNS posquimioterapia la técnica es la siguiente: con el paciente en posición decúbito y fijado a la mesa quirúrgica que permita movilizarlo sin riesgo de caída y lesiones nerviosas (fig. 1), se crea neumoperitoneo con técnica cerrada (Veres) en abdomen virgen; el primer puerto se ubica de 10 mm umbilical por donde se realiza la laparoscopía, se coloca el resto de los puertos de trabajo, para la cámara un puerto de 10 mm en la línea media en el punto medio entre la cicatriz umbilical y el pubis, la mano derecha en el puerto inicial donde se creó el neumoperitoneo y la mano izquierda con uno de 10 mm en la unión del tercio interno con los 2 tercios externos de la línea que une la cresta ilíaca antero-superior izquierda con la cicatriz umbilical y la mano del ayudante en el punto que une el tercio interno con los 2 tercios externos de la línea que va del cresta ilíaca antero-superior derecha a la cicatriz umbilical de 5 mm (fig. 1). Se posiciona al paciente 30 grados lateral derecho y Trendelenburg para poder medializar a la derecha las asas intestinales y exponer la raíz del mesenterio, para realizar su apertura y acceder al retroperitoneo (fig. 2). El cirujano entre las piernas y la pantalla frente a él. El ayudante que llevará la cámara se posiciona en el lado derecho del paciente, se procede a iniciar la disección con equipo de energía ultrasónica, se expone el campo quirúrgico de disección bilateral: lateral ambos ureteros, límite superior son ambas venas renales y límite inferior entre el cruzamiento de los ureteros con los vasos ilíacos. En pacientes posquimioterapia se realiza exéresis de linfáticos bilaterales con preservación nerviosa simpática, incluyendo los ganglios paracavos, precavos, intercavo-aórticos, preaórticos y paraaórticos. Para exponer el retroperitoneo se colocan 4 riendas con Prolene® 2.0, agujas rectas en la raíz del mesenterio anudadas y exteriorizadas en la pared abdominal. Se termina procedimiento con un drenaje Penrose dirigido a lecho de disección y cierre de los puertos de trabajo.
Figura 1 Muestra en el posquirúrgico de la ubicación de los puertos de trabajo en linfadenectomía retroperitoneal laparoscópica con el paciente en posición decúbito.
Figura 2 Paciente en posición quirúrgica, 30 grados lateral izquierdo y Trendelenburg.
Resultados
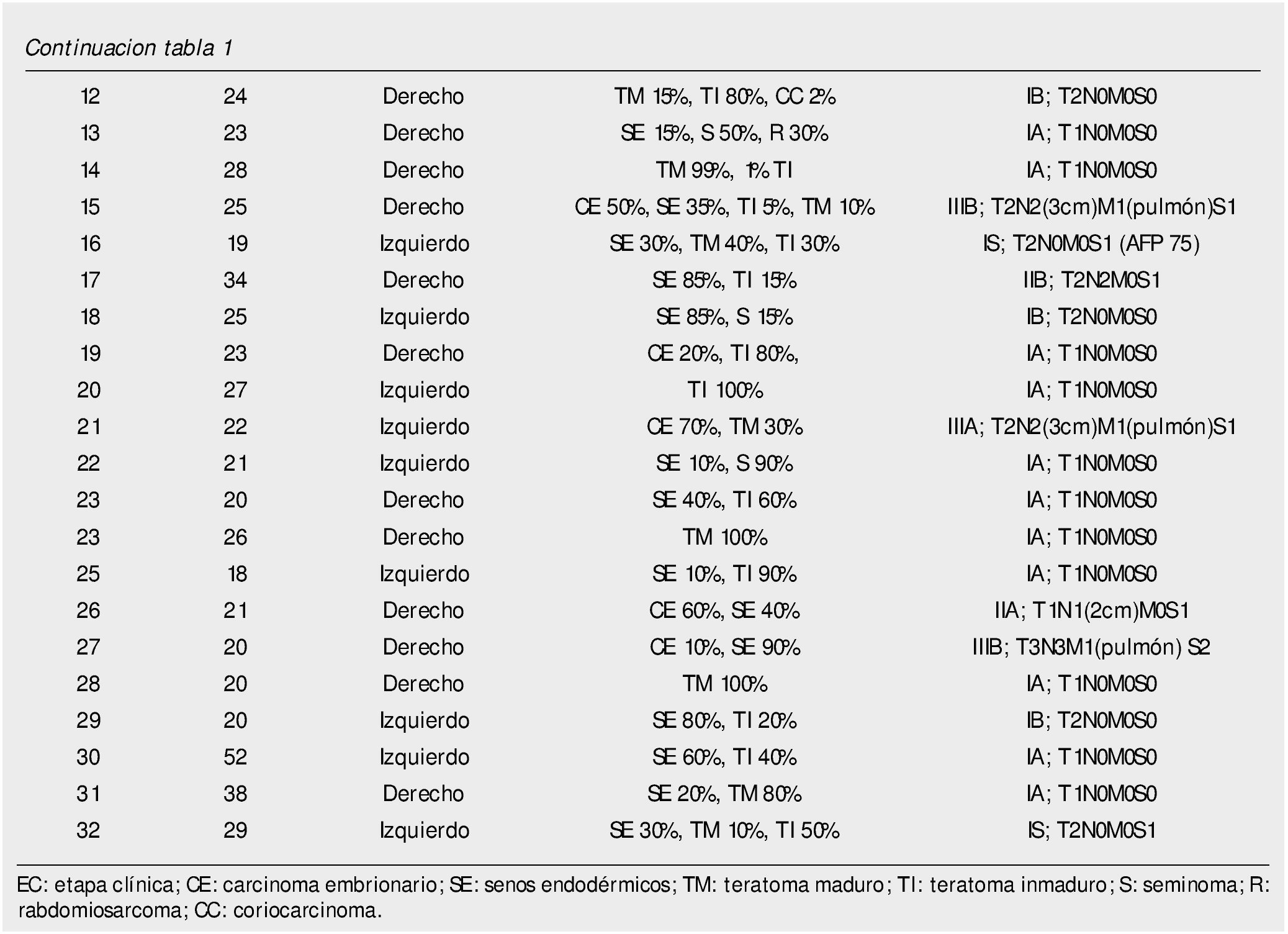
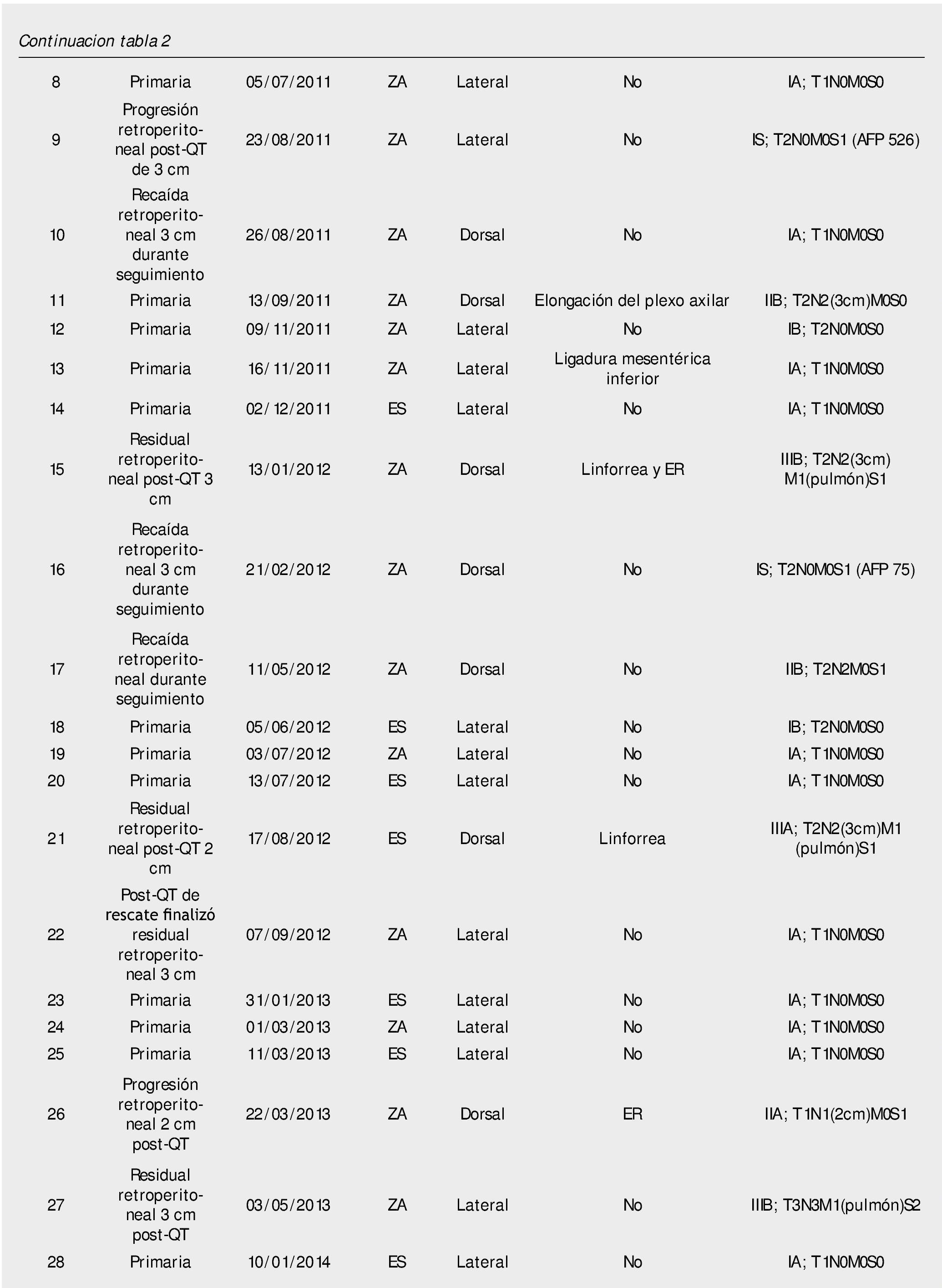
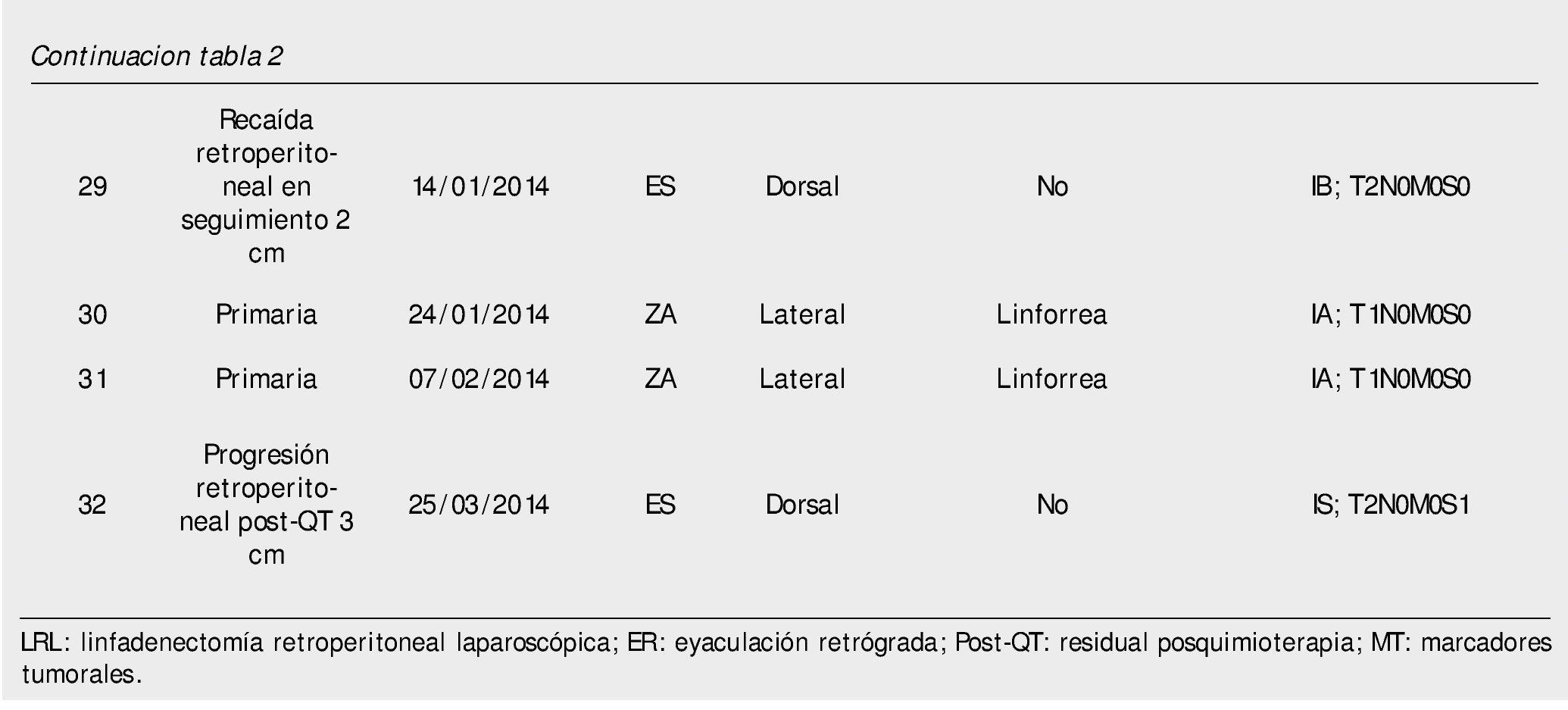
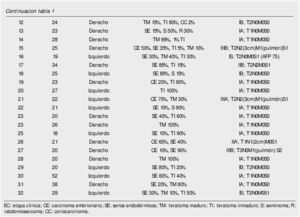
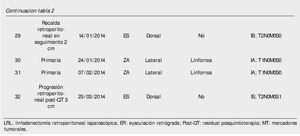
Del 15 de junio de 2010 al 25 de marzo de 2014, se han operado 32 pacientes de LRL por vía transperitoneal (12 pacientes en decúbito supino y 20 en decúbito lateral según el lado afectado), con diagnóstico de CTNS, por 2 cirujanos expertos en Cirugía Laparoscópica Avanzada y abierta de retroperitoneo: 23 ZA y 9 ES, la edad promedio 25.78 años (rango 18 a 52 años), en el 62.5% (20 pacientes) el testículo afectado fue el derecho, el resto de las características demográficas se muestran en la tabla 1. La indicación (tabla 2) de la LRL fue en 20 pacientes (62.5%) de tipo primaria o etapificadora; 19 pacientes etapa clínica I (16 IA, 3 IB y uno IIA), marcadores tumorales negativos; 4 pacientes con progresión retroperitoneal durante la quimioterapia y marcadores tumorales negativos; 4 pacientes residual posquimioterapia y; 4 pacientes con recaída retroperitoneal durante el seguimiento y marcadores tumorales negativos, de estos últimos su tratamiento primario fue: 2 en seguimiento en IA y IB, y 2 posquimioterapia (uno IIIB y otro IS) promedio 5.75 meses. El tiempo quirúrgico, sangrado y estancia hospitalaria promedio fue de 183 minutos, 54.3 mL y 2.56 días, respectivamente (tabla 3); el 25% de morbilidad del tipo Clavien I-II: 4 quilorreas, 2 eyaculación retrógrada, uno ligadura de mesentérica inferior y uno elongación del plexo axilar (tabla 2); promedio de cosecha ganglionar 14.5 ganglios (rango 6-35) (tabla 3). En el 18.75% (6 pacientes), la linfadenectomía fue terapéutica debido a que el resultado de patología evidenció teratoma maduro en un paciente (N° 29) (tabla 3) en etapa clínica IB, que se dejó en seguimiento sin tratamiento adyuvante, este presentó recaída retroperitoneal con marcadores tumorales negativos, la pieza de linfadenectomía documentó enfermedad viable a carcinoma embrionario, que motivó tratamiento quimioterapéutico de segunda línea.
Discusión
El tratamiento actual del cáncer germinal de testículo es multidisciplinario, este ha permitido supervivencias mayores a 90%22. Después de la orquiectomía, la elección del tratamiento es basada en el tipo histológico y la etapa clínica7. En el subtipo no seminoma etapa I, la diseminación es altamente predecible a retroperitoneo (10% fuera o sistémica), por lo que se ha propuesto la linfadenectomía abierta, como parte de su tratamiento23, sin embargo conlleva una morbilidad considerable, que ha motivado el uso de otras opciones como regímenes de quimioterapia basado en BEP24, uno o 2 ciclos, o protocolos de seguimiento25 estrecho por el riesgo de recaída hasta 50% dictado por la presencia de invasión linfovascular y el porcentaje de componente carcinoma embrionario, su elección depende de múltiples factores como el consentimiento informado del paciente y la morbilidad de cada una de ellas. La vigilancia requiere apego, costo y en baja frecuencia segundas neoplasias por la exposición a la radiación y la quimioterapia BEP, ya sea uno o 2 ciclos confiere riesgo en desarrollar fibrosis pulmonar, segundas neoplasias, neurotoxicidad, ototoxicidad y nefrotoxicidad. La morbilidad principal de la linfadenectomía retroperitoneal13,14 es debida al trauma quirúrgico de incisiones xifo-púbicas y a la exposición del retroperitoneo, durante la disección existe el riesgo de lesión vascular, intestinal y nerviosa, la lesión del simpático lumbar trae como consecuencia la eyaculación retrógrada e infertilidad, sin embargo la selección de pacientes, la modificación en los límites de disección, el conocimiento anatómico y el volumen del cirujano y hospitalario, han permitido hasta en 90% conservar la eyaculación anterógrada y resultados oncológicos comparables a la quimioterapia26. La razón de esta opción de manejo es que es terapéutica en teratoma y pT1, y diagnostica en tumor viable que requiera quimioterapia27.
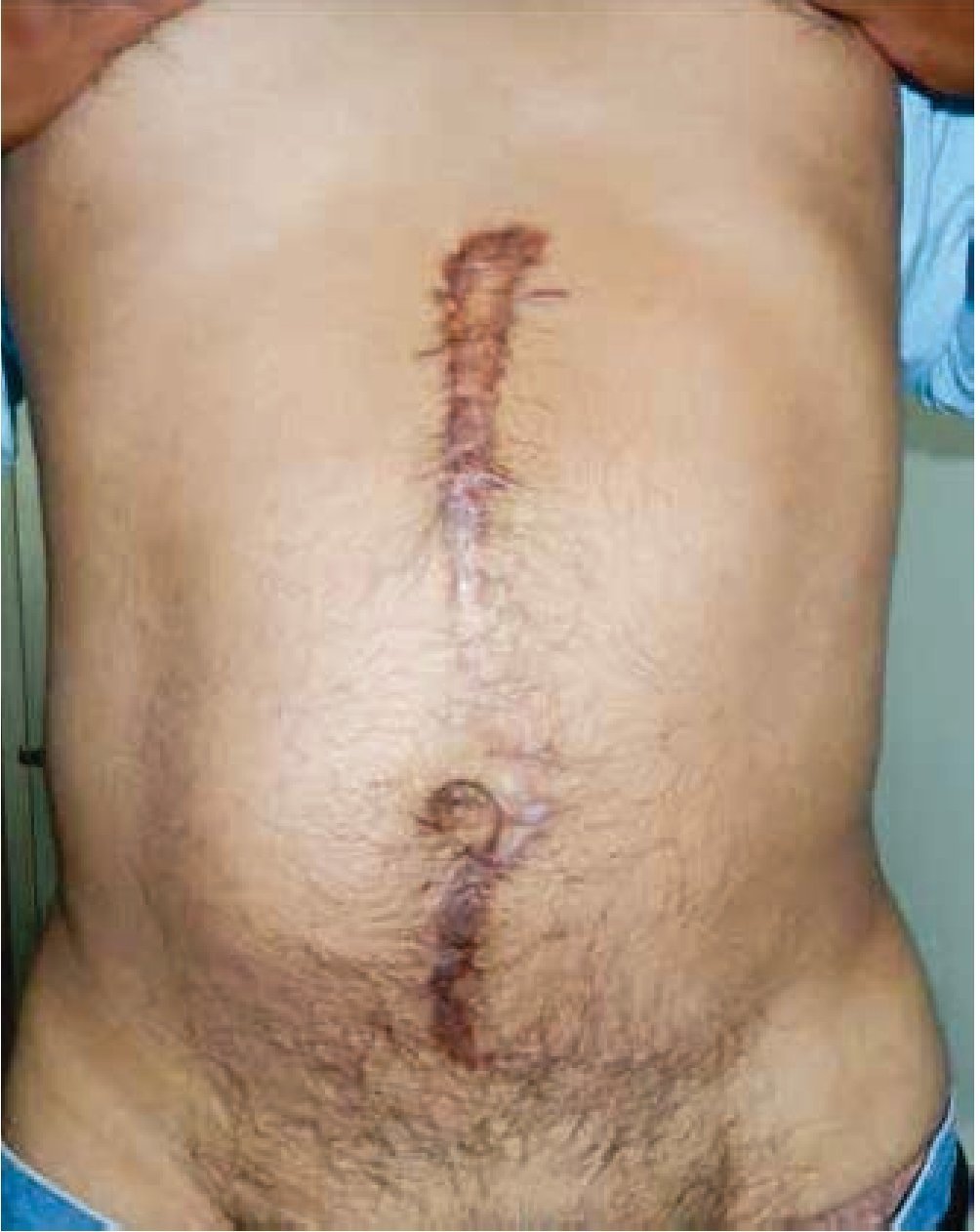
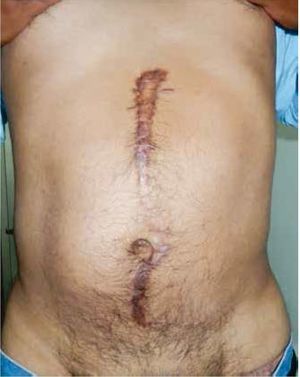
Los pacientes con diagnóstico de no seminoma11, que finalizan con respuesta radiológica y sérica completa en la primera línea de quimioterapia, se decide observación a pesar de que en 30% se ha reportado tumor viable y teratoma retroperitoneal; los que finalizan con marcadores tumorales positivos se envían a segunda línea de quimioterapia y aquellos con marcadores tumorales negativos y residuales mayor de 1 cm retroperitoneal, se llevan a resección del residual; con resultados de 50% fibrosis o necrosis, 40% teratoma y 10% carcinoma viable, estos resultados son dependientes de múltiples variables, como tamaño del residual, marcadores tumorales pretratamiento y su comportamiento durante los ciclos de quimioterapia. La tomografía por emisión de positrones para evaluar el residual posquimioterapia en no seminoma, no tiene ningún papel por la alta tasa de falsos negativos (40%). La resección del residual consiste en una linfadenectomía retroperitoneal abierta, sin embargo conlleva una morbilidad12,16,18 considerable que ha motivado modificar los límites de disección, con el riesgo latente hasta 30% de recaída fuera del campos de disección y comprometer la sobrevida global, actualmente los límites recomendados son bilaterales con preservación de las estructuras nerviosas simpáticas, esta discusión es controversial y sólo casos selectos pueden llevarse a disección modificada11,28,29, tumor retroperitoneal inicial menor a 5 cm, lado izquierdo, cáncer de testículo derecho con ausencia de teratoma maduro y ausencia de cáncer viable en la masa residual. La disección retroperitoneal abierta requiere incisiones en línea media xifo-púbicas (fig. 3) con movilización intestinal para exponer los límites de disección y a veces extenderse hasta la región suprahiliar renal y ambas cruras diafragmáticas, en ocasiones para combinarse con disección mediastinal y cervical cuando se documente actividad por clínica e imagen y magnificar la morbilidad posquirúrgica19-21, esto ha motivado la introducción de resecciones por vía laparoscópica y toracoscopía, con el objetivo de minimizar esta morbilidad por el trauma quirúrgico de las incisiones, de la manipulación y tracción del tejido30-33, sin embargo falta evidencia nivel 1, que apoye el uso cotidiano de esta técnica.
Figura 3 Incisión abdominal en linfadenectomía retroperitoneal abierta.
Conclusión
La LRL en CTNS es un abordaje en expansión, en diferentes centros quirúrgicos de excelencia, debido a que es una cirugía compleja y depurada, requiere una curva de aprendizaje por lo que es necesario que se realice con un equipo experto en cirugía abierta y de mínima invasión retroperitoneal, para obtener resultados óptimos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Hospital Juárez de México, Unidad de Oncología.
Av. Instituto Politécnico Nacional N° 5160,
Colonia Magdalena de la Salinas, Delegación Gustavo A. Madero,
C.P. 07760, México D.F., México. Teléfono: 57477560, ext. 7254.
Correo electrónico: eriksosa2011@hotmail.com (Erik Efraín Sosa-Durán).