En la última década se han introducido nuevas terapéuticas antineoplásicas, muchas de las cuales tienen repercusiones cutáneas secundarias a los diferentes mecanismos de acción. El anticuerpo contra el receptor del factor de crecimiento epidérmico (EGFR) representa uno de los avances en el manejo de cáncer colorrectal y de cabeza y cuello. Los efectos generados por este medicamento a nivel cutáneo representaban una limitante debido a que, al ser su efectividad dependiente de la dosis, era preciso modificar la misma y, por otro lado, la tolerancia física y cosmética de los pacientes era baja. Hoy en día se manejan los efectos de manera adecuada; sin embargo, también es necesario considerar la profilaxis a fin de disminuir el grado de afección.
Over the last decade, new anticancer therapies have been introduced, many of which have skin implications associated with different mechanisms of action. The antibody against the epidermal growth factor receptor (EGFR) represents one of the advances in the management of colorectal and head and neck cancer. The effects caused by this mediciation at the cutaneous level used to limit its use, since as its effectiveness is dose-dependent, doses had to be modified, and there was also poor physical and cosmetic tolerance by the patients. Today, the effects are properly managed; however now we must consider prophylaxis in order to reduce the degree of skin involvement.
El receptor del factor de crecimiento epidérmico (EGFR) es una proteína trasmembranaria que se expresa en muchas células epiteliales y desempeña un papel importante en la supervivencia, el crecimiento, la diferenciación, la proliferación y la movilidad celular1.
El receptor está constituido por la porción extracelular de unión al ligando, la porción trasmembranaria y un dominio intracelular tirosina cinasa2.
Este receptor, perteneciente a la familia ErbB, es mediador de señales por ligandos como EGF, TGFa, anforregulina, epiregulina, betacelulina y HB-EGF3,4.
Muchos tumores sólidos, incluidas algunas neoplasias malignas gastrointestinales, presentan sobreexpresión del EGFR. Esta desregulación resulta en un crecimiento descontrolado, proliferación y angiogénesis asociados a un peor pronóstico, manifestado por un incremento en el potencial metastásico.
Actualmente existen fármacos inhibidores del EGFR, los cuales pueden dividirse en función de su mecanismo de acción en inhibidores de tirosina cinasa (tyrosine kinase inhibitors), siendo estos moléculas pequeñas que inducen selectivamente la activación de esta enzima, y en anticuerpos monoclonales, moléculas que se unen específicamente al EGFR con gran afinidad y que actúan de manera competitiva con las señalizaciones activadoras de esta vía.
Ambos tipos de compuestos pueden producir toxicidad significativa a nivel cutáneo, siendo este efecto tan importante que hasta un 75% de los pacientes tratados con estas terapias las suspendían aunque el grado de toxicidad fuera i-ii5.
Estos medicamentos muestran una eficacia clínica que incrementa la respuesta citotóxica en los tumores dependientes del EGFR, motivo por el cual se han vuelto un reto el conocimiento y el entendimiento de los efectos secundarios cutáneos, así como el tratamiento más adecuado y la prevención de los mismos. Esto nos ha llevado a establecer ciertas directrices, con el empleo de ciertos medicamentos que han ofrecido reducciones significativas de hasta de un 50% en la severidad de los efectos cutáneos, haciendo completamente tolerable la terapéutica antitumoral y permitiendo predecir los efectos para así poder intervenir de manera profiláctica.
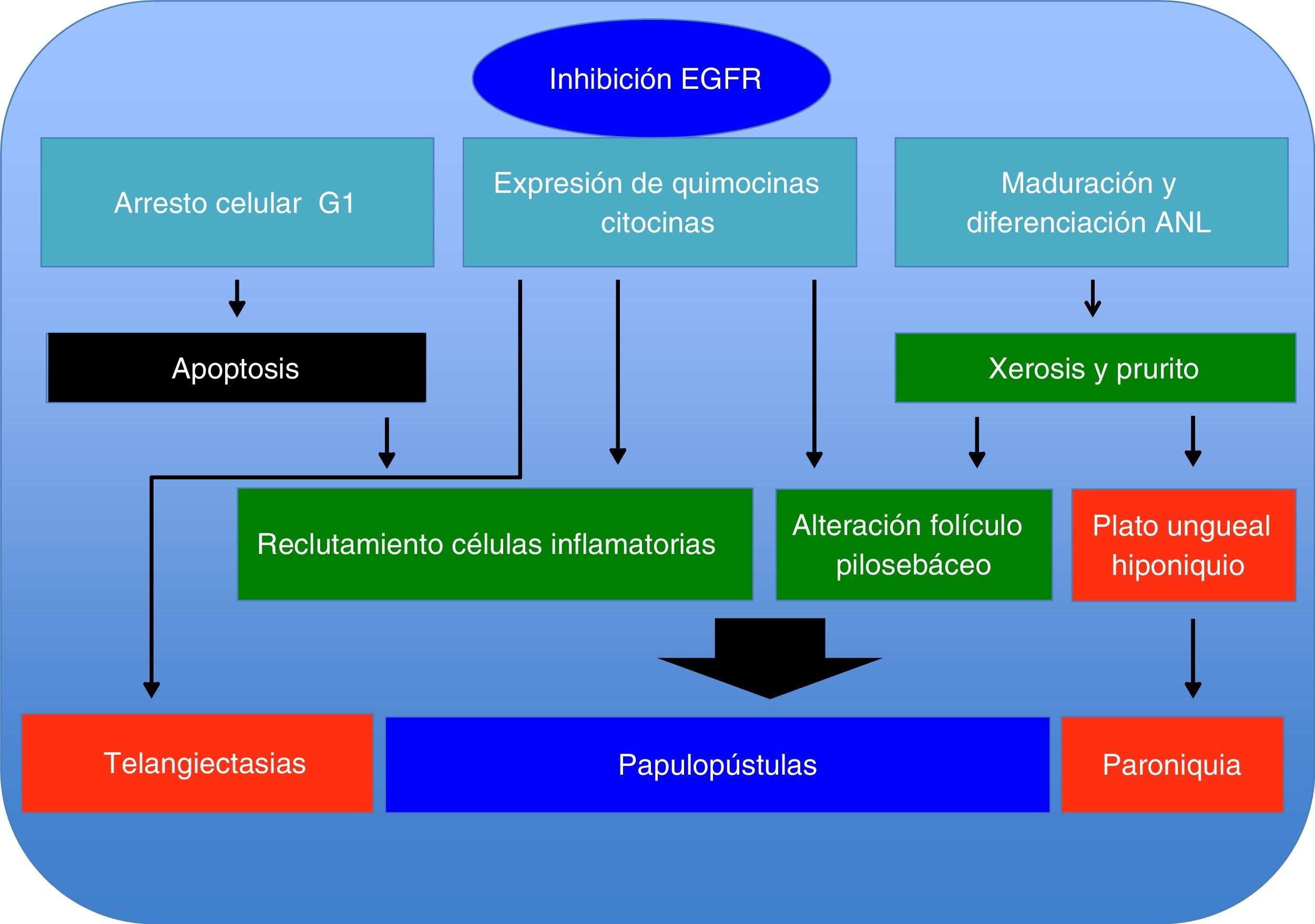
Mecanismo del daño cutáneoEl EGFR desempeña funciones importantes en la piel, al igual que en otros epitelios, las cuales están relacionadas con la supervivencia, la proliferación, los procesos de maduración y la movilidad celular1. Hoy sabemos que, dependiendo del ligando que active al receptor, el buen funcionamiento de dicha unión establece un equilibrio en la reparación tisular y en los procesos de inflamación e inmunidad cutánea. Este receptor se puede activar al ser estimulado por moléculas que presenten ligandos de tipo EGF (EGF, TFGa, HB-EGF, betacelulina, epirregulina), resultando en fosforilación intracelular de la tirosina, la cual inicia un serie procesos a través de diferentes vías: la vía de proteína cinasa activada por mitógenos, involucrada en proliferación celular, la vía de fosfatidilinositol 3-cinasa, la cual se relaciona con la progresión y la supervivencia del ciclo celular, así como otra vía de señalización de división celular, movimiento, invasión y adhesión por medio de proteínas de transducción y activadoras de la transcripción (STAT)6.
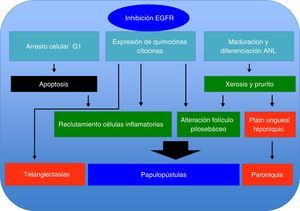
Los inhibidores del EGFR modifican de manera significativa la cinética celular en la piel. Al disminuir la fosforilación del EGFR, existe un incremento en la activación de P27, lo cual genera una detención del ciclo celular en G1, promoviendo fenómenos de apoptosis y generando una desorganización de los queratinocitos infundibulares y basales que se observa entre los días 4 y 12, y coincide con el inicio de lesiones dermatológicas y xerosis7,8.
Estudios de inmunohistoquímica demuestran una disminución importante en los niveles del marcador de proliferación celular Ki67 en el estrato basal de estos pacientes.
Por otro lado, la acción de estos inhibidores del EGFR genera un efecto proinflamatorio, donde al activar las funciones proinflamatorias del queratinocito, este sintetiza diferentes quimiocinas (IL-8, Gro-a, MCP-1, RANTES, MIP3a) con función de quimiotaxis hacia PMN y células dendríticas, citocinas (IL-1, IL-6, IL-18, GM-CSF y TNFa) que conducen a la activación y el reclutamiento de neutrófilos, monocitos y linfocitos a nivel cutáneo, donde la manifestación clínica de estos eventos es el rash pápulo-pustular.
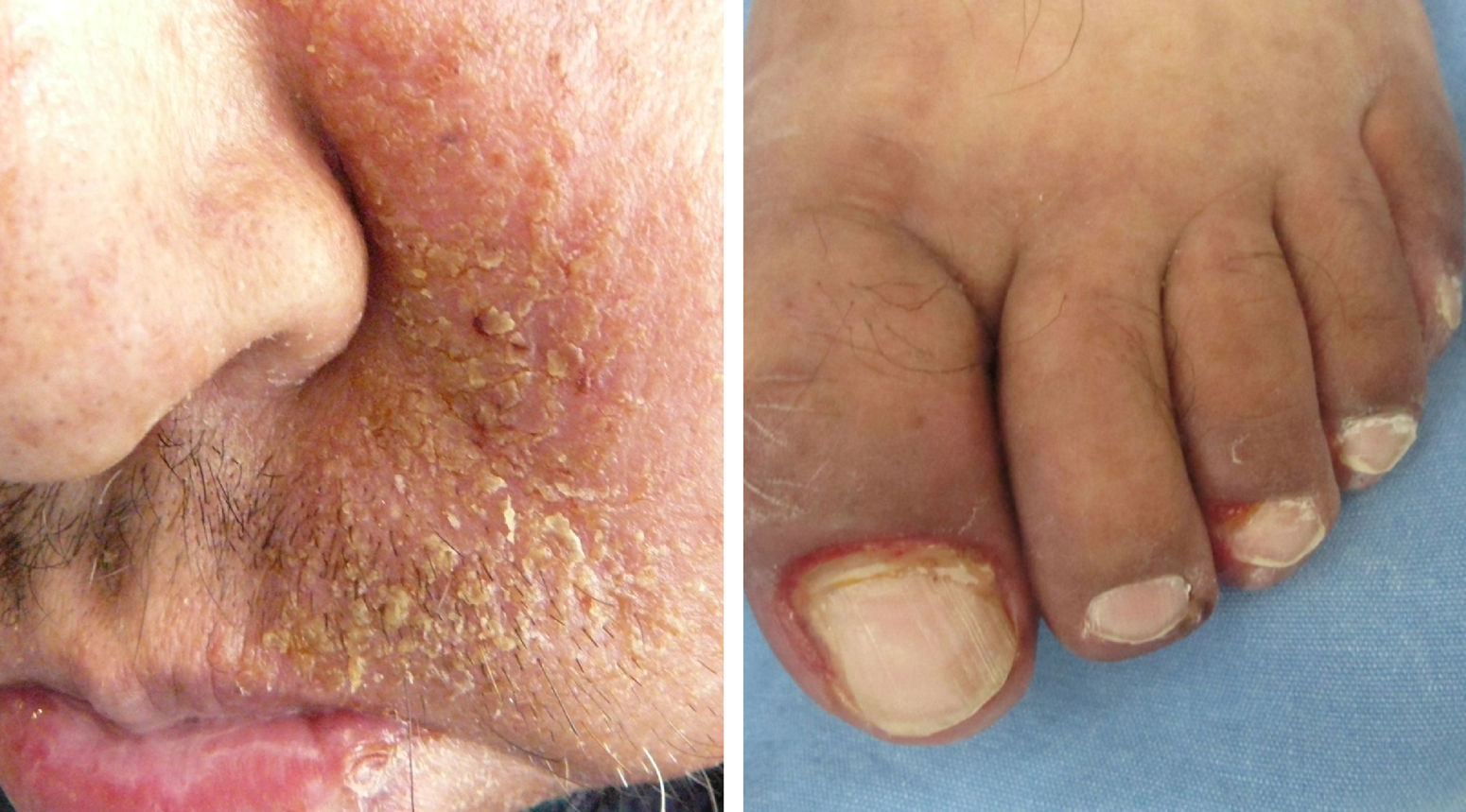
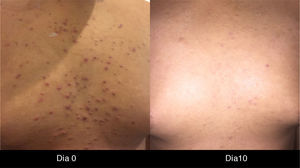
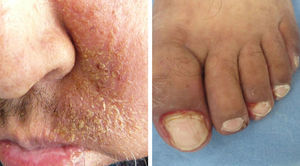
La IL-18 activa un factor mitógeno de proliferación de las células endoteliales9-11, lo cual podría explicar la presencia de telangiectasias, así como de la formación de granulomas piógenos (fig. 1).
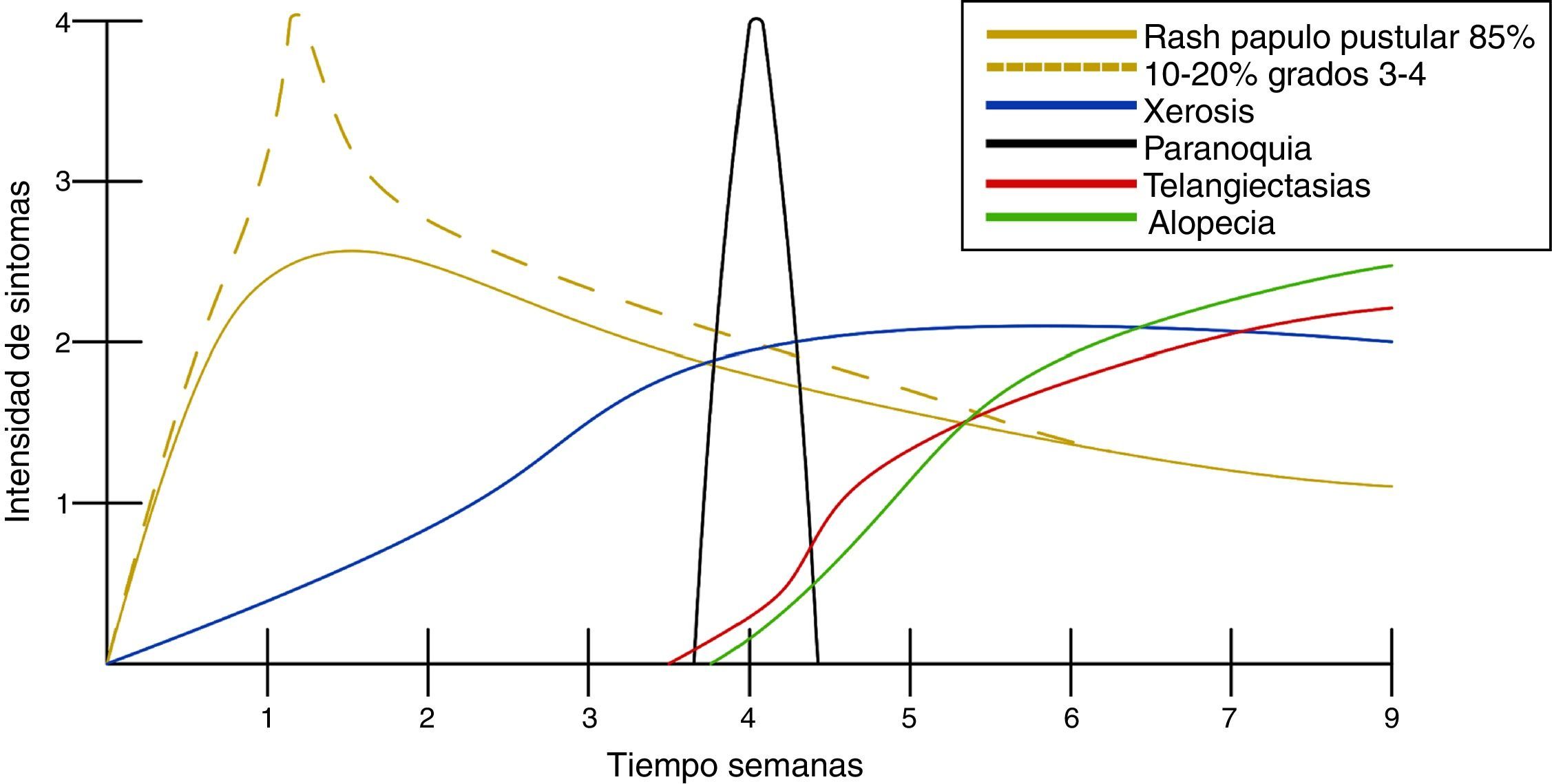
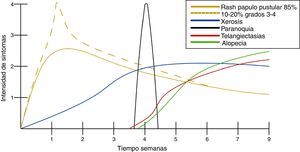
Manifestaciones cutáneasDespués de casi un década de experiencia con medicamentos inhibidores del EGFR, la secuencia del desarrollo de toxicidad cutánea es predecible5,12 (fig. 2).
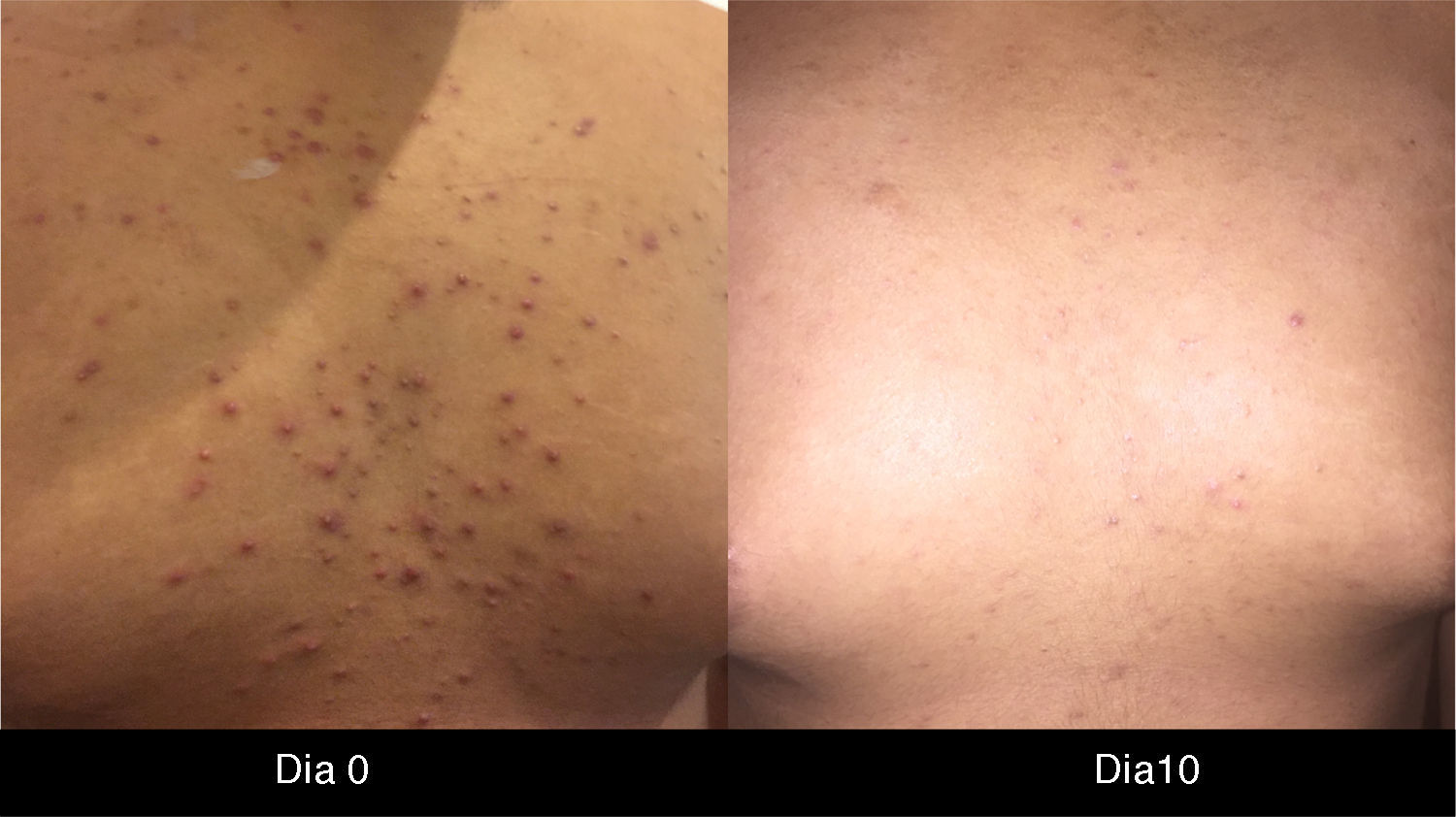
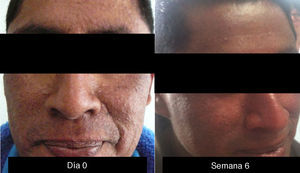
Es la toxicidad cutánea más frecuente, también conocida como reacción acneiforme o pápulas y pústulas foliculares inflamatorias. Esta lesión se presenta principalmente en zonas seborreicas, incluida la cara, donde suele localizarse en el surco nasolabial, la frente, el mentón y la región retroauricular. Otros lugares en que suele presentarse incluyen hombros, cara anterior y posterior del tórax, la piel cabelluda, glúteos y pubis, pero con menor frecuencia. La morfología de estas lesiones asemeja la del acné, donde las pápulas y pústulas aparecen sobre una base eritematosa. Los pacientes pueden referir prurito de intensidad leve a moderada13. Se ha reportado que este tipo de dermatosis se puede presentar desde la primera semana de tratamiento hasta 3 semanas tras el inicio del mismo, y que se resuelve al suspender el medicamento durante las siguientes 4 semanas en promedio14. Este tipo de reacción se presenta en el 85% de los pacientes tratados con el anticuerpo anti-EGFR y solo en un 10-20% de individuos se manifiesta con grados de severidad iii-iv15,16. Este efecto secundario genera un deterioro importante de la calidad de vida de los pacientes. En un estudio donde se evaluó a los pacientes con una herramienta Sindex-16, los resultados revelaron que no solo son el prurito y la irritación la causa, sino que se considera que el efecto más importante es el estético17, siendo esto la causa de la suspensión del tratamiento.
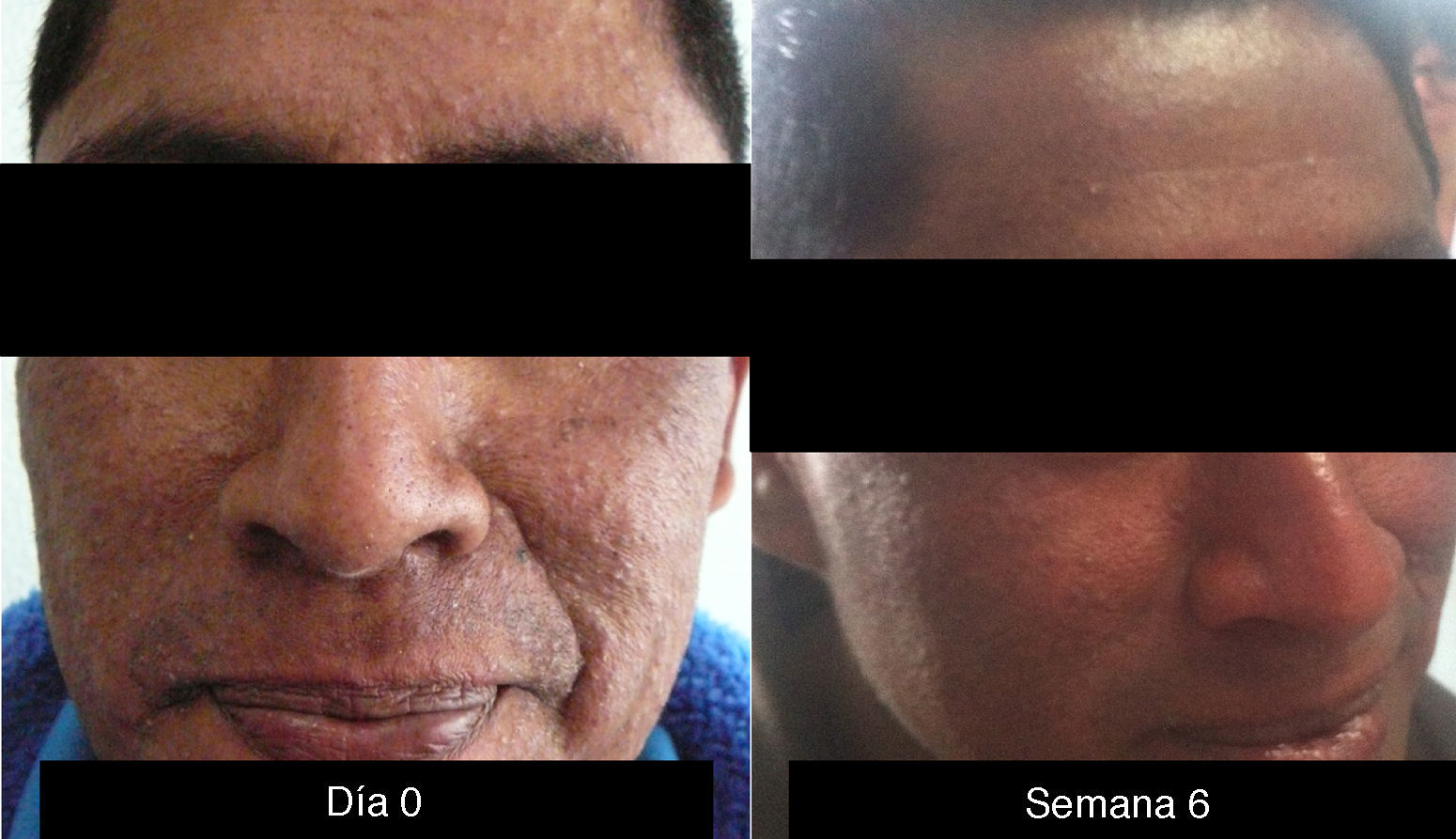
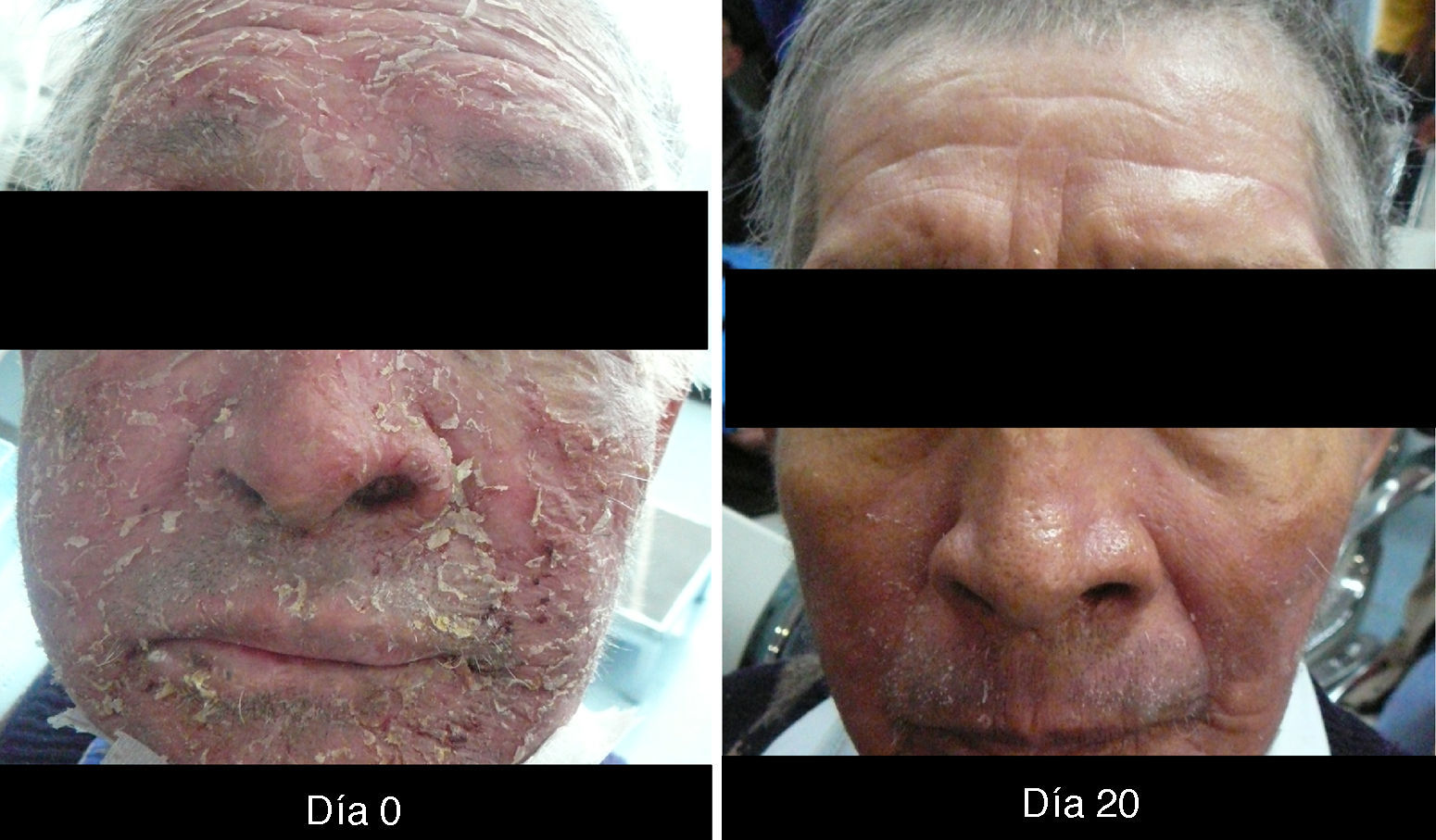
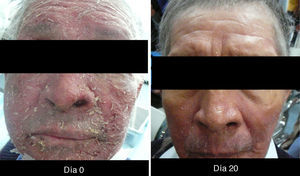
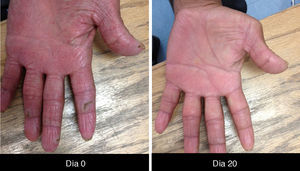
XerosisAl ser tratados con inhibidores del EGFR, los pacientes desarrollan xerosis en el transcurso de 2 a 3 semanas18, afección que involucra resequedad y que puede evolucionar a eccema xerótico, complicándose con fisuras sumamente dolorosas y sobreinfección bacteriana. La superficie corporal afectada es mayor, presentándose descamación con láminas blancuzcas de pequeñas a medianas y en regiones acrales, así como fisuras, acompañadas de prurito y dolor. Se puede presentar sequedad de las mucosas oral, nasal y vaginal15.
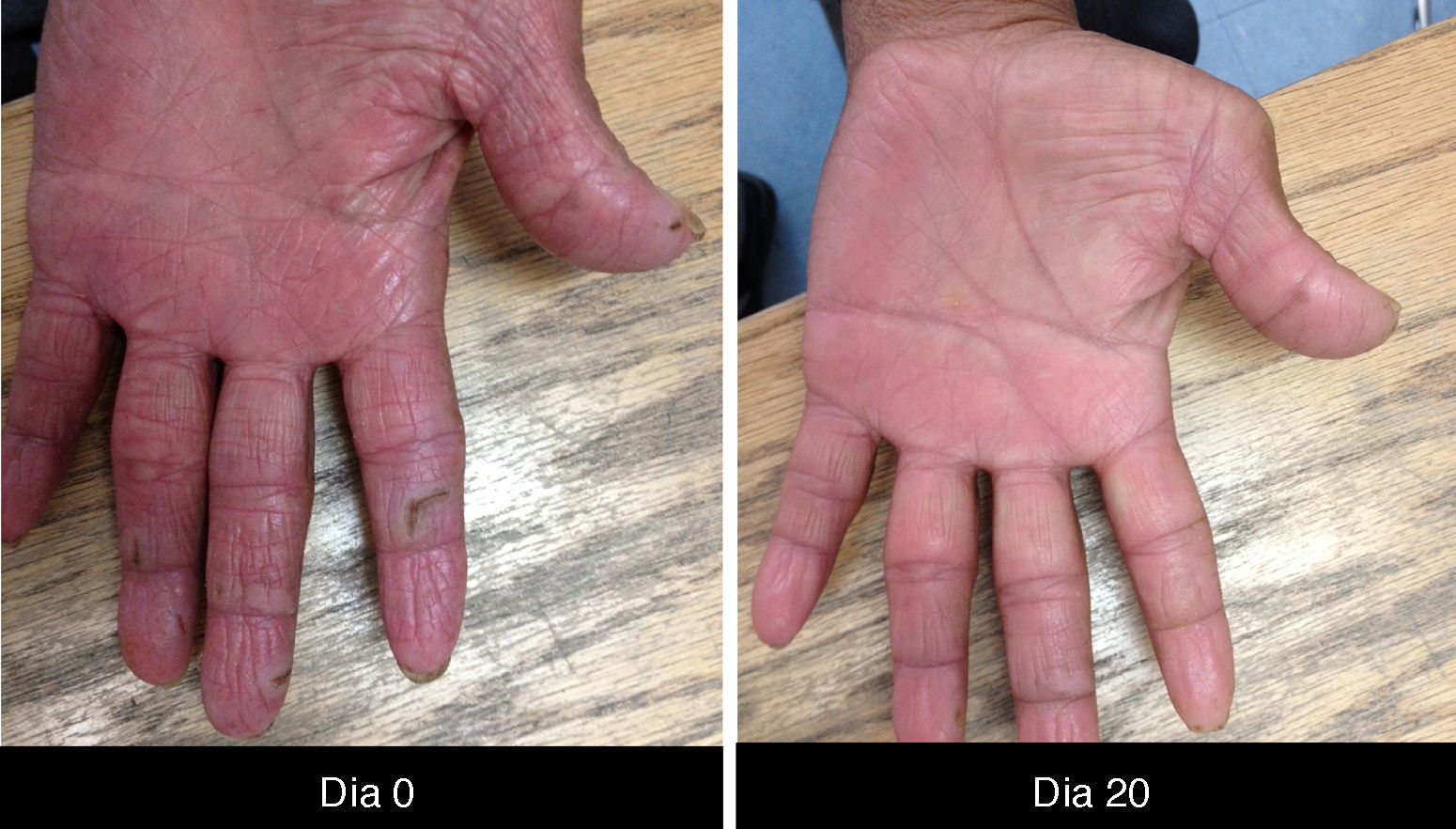
Cambios unguealesEs un complicación tardía del tratamiento en la que el paciente presenta paroniquia que clínicamente se expresa con inflamación periungueal y de la lámina ungueal, siendo el más afectado el primer ortejo. Se trata de una lesión sumamente dolorosa que puede sobreinfectarse con Staphylococcus aureus.
El granuloma telangiectásico se considera una complicación probablemente secundaria a la penetración y retención del fragmento del lecho ungueal o descamación, lo cual deriva en una reacción de cuerpo extraño debido a que esta lesión no es infecciosa.
Trastornos del pelo, hiperpigmentación y telangiectasiasLas alteraciones del pelo regularmente se pueden observar después de varios meses de tratamiento. El vello corporal y el cabello se vuelven más delgados y rizados, y también se puede encontrar tricomegalia de las pestañas en el 20% de los pacientes, así como alopecia de predominio frontal y secundaria al proceso inflamatorio del folículo piloso. La hiperpigmentación es posterior al proceso inflamatorio secundario al rash pápulo-pustular y a la fotosensibilidad; se observan telangiectasias por el adelgazamiento de la epidermis con vasos dilatados por el efecto directo sobre las células endoteliales derivado de la inhibición del EGFR16.
ManejoDurante la última década, desde las primeras publicaciones en 2006, se ha intentado lograr un control de los efectos cutáneos generados por los inhibidores del EGFR. Inicialmente, la observación clínica de estas manifestaciones cutáneas llevó a generar experiencia con diversas moléculas que tendrían efecto, dada la apariencia de la dermatosis. Hoy queda claro que la secuencia del desarrollo de las lesiones cutáneas es predecible y el conocimiento de que estos efectos pueden ser tratados de forma profiláctica, abatiendo de este modo la severidad por debajo del 50%, hace mucho más tolerable el tratamiento de la neoplasia. Es sabido que muchas veces se requieren modificaciones de la dosis del antineoplásico para obtener mejoría de la dermatosis.
Cabe señalar que se considera tratamiento preventivo cuando se instituye el manejo dermatológico antes de los primeros síntomas, y tratamiento reactivo una vez presente la dermatosis y depende del grado de la misma17.
La base de lo anterior radica en el conocimiento involucrado en el desarrollo de este tipo de dermatosis. Actualmente, las guías canadienses, alemanas y americanas12,18-21, así como nuestra propia experiencia, han cambiado desde los primeros reportes, aunque coinciden de manera muy clara en ciertos parámetros de tratamiento. Sabemos que mantener la integridad de la piel es uno de los pilares del tratamiento en cualquier enfermedad cutánea, sobre todo en aquellas de carácter exfoliativo y/o inflamatorio como en este caso.
Los cuidados generales son esenciales, incluida la fotoprotección22. Estas medidas, que en ocasiones pasamos por alto, son uno de los pilares fundamentales para conservar en la medida de lo posible las características cutáneas normales. Se recomienda evitar los baños, solo duchas rápidas con agua templada, evitar los jabones neutros o detergentes que barren la capa lipídica y aplicar emolientes suaves por lo menos 2 veces al día23.
Asimismo, consideramos que la correcta identificación de la manifestación cutánea presente es fundamental para el éxito del tratamiento.
Rash pápulo-pustularEl rash pápulo-pustular es la manifestación cutánea más frecuente y encontramos que, en la literatura mundial, dentro de los medicamentos que mejor respuesta generan figuran la doxiciclina 100mg 2 veces al día y la minociclina 100mg día, incluso a manera de profilaxis12,20,22,24,25.
Scope et al., en 2007, reportaron una disminución superior al 50% del rash pápulo-pustular asociado a cetuximab en las primeras 2-4 semanas de tratamiento26. Las tetraciclinas son antibióticos con una gran capacidad antiinflamatoria. La minociclina es una tetraciclina semisintética que presenta un mayor potencial antiinflamatorio, con actividad sobre el factor mitógeno activador de la proliferación de linfocitos27,28, supresión de la quimiotaxis y migración de neutrófilos29,30, sobrerregulación de citocinas antiinflamatorias como IL-1031 y reducción de los niveles de IL-6. El citado estudio de Scope et al. es el pilar para el manejo y posteriormente para la profilaxis del rash pápulo-pustular con minociclina e hizo que potencialmente estos pacientes pudieran ser tratados con dosis adecuadas este anticuerpo inhibidor del EGFR sin modificación de las mismas, lo cual generó una mayor tolerancia y apego al tratamiento. Esto derivó en que esta terapéutica se clasificara dentro de un nivel de evidencia ii de recomendación como manejo profiláctico5.
Cuando la dermatosis es grado i, e incluso antes de la presencia manifiesta de síntomas, algunos autores recomiendan iniciar el manejo con clindamicina tópica al 2% acompañada por esteroides de baja a mediana potencia (hidrocortisona al 1%). Sin embargo, se debe tener cuidado con el uso prolongado de corticoides en ciertas áreas como la cara. Cuando el paciente presenta dermatosis grado ii, se inicia minociclina 100mg día o doxiciciclina 100mg 2 veces al día. En los casos de dermatosis de grado iii, se recomienda el mismo manejo, pero suspendiendo la administración de cetuximab por una semana.
Existen casos reportados de manejo con vitamina K en crema, apósitos, inhibidores tópicos de calcineurina y diferentes terapéuticas, pero se requiere de un mayor número de pacientes para poder darle sustento al uso de estas modalidades32 (figs. 1 y 2).
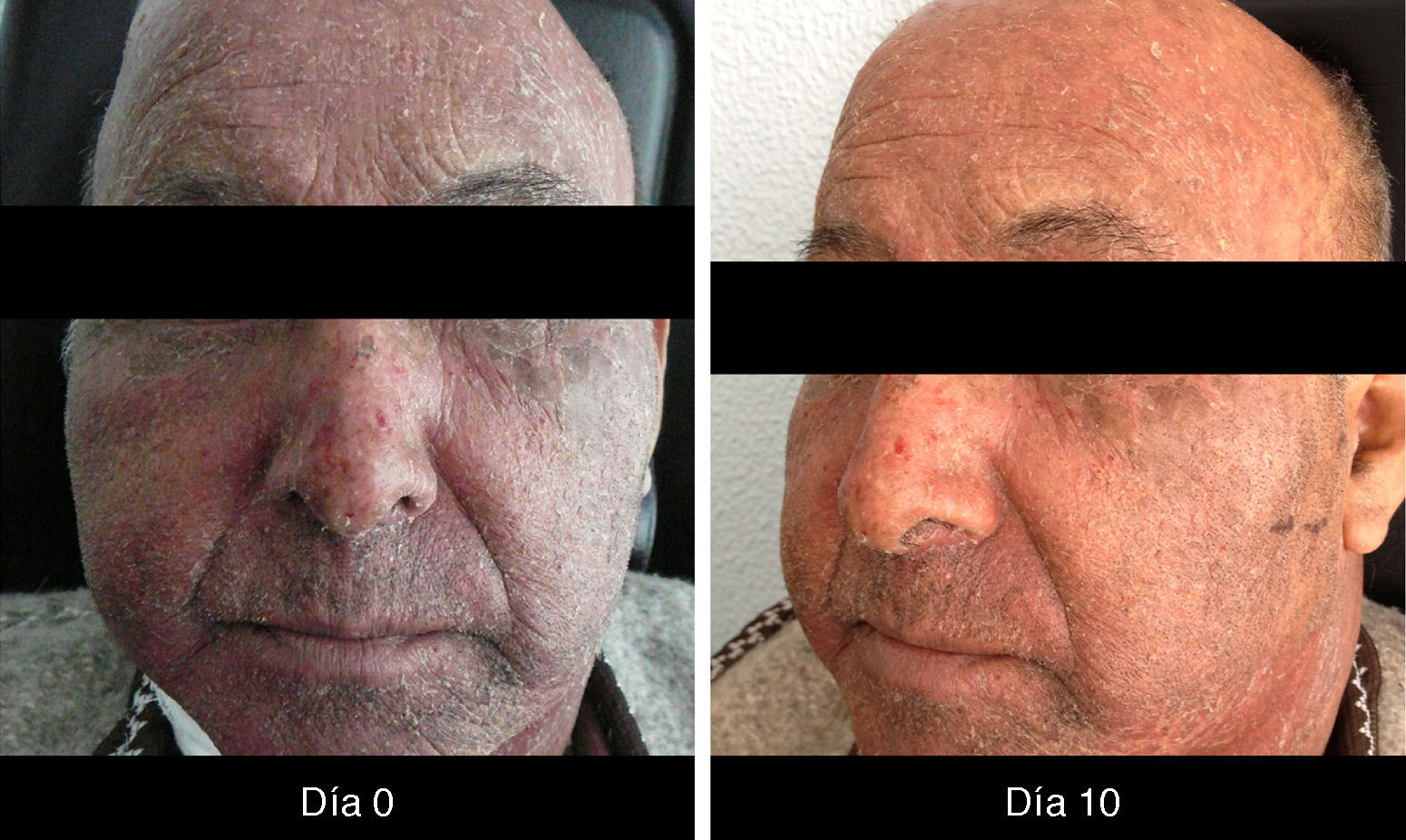
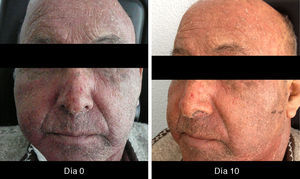
XerosisLa xerosis es relativamente sencilla de manejar con emolientes petrolados (para áreas acrales) y cremas; sin embargo, es importante llevar un seguimiento adecuado, puesto que algunos pacientes evolucionan a una forma exfoliativa que requiere manejo con esteroides de baja potencia por periodos cortos y que, en algunos casos, se complica con fisuras que son sumamente dolorosas y requieren manejo con queratolíticos suaves y reepitelizantes en combinación con esteroides de mayor potencia, como triamcinolona, y en nuestro país, con acetónido de fluocinolona en áreas de eccema33 (figs. 3 y 4).
Algunos pacientes pueden presentar fenómenos de sobreinfección generada por Staphylococcus aureus, lo cual genera un proceso de impetiginización donde se aconseja cultivo de la secreción y manejo con antibióticos tópicos o sistémicos32.
Las paroniquias se deben a este fenómeno descamativo inflamatorio y que es necesario tratar con fomentaciones, en nuestra experiencia con sulfato de cobre que es secante y antiséptico, acetato de aluminio, agua con sal o vinagre y en otros centros de atención, antibióticos tópicos; algunos autores indican tomar cultivo previo34 (fig. 5).
La hiperpigmentación es un fenómeno residual secundario al proceso inflamatorio. Por tal motivo, se recomienda el uso profiláctico de fotoprotección SPF > 30 diariamente35. Los cambios en el pelo, cuando se trata de hirsutismo, pueden ser mejorados con depilación, rasurado, electrólisis, láser o eflornitina36.
Dermatitis por radiación y cetuximabLa radiación es actualmente un pilar dentro del tratamiento de diversas neoplasias35,37. El uso de radioterapia más cetuximab es considerado el tratamiento de referencia para los carcinomas epidermoides de cabeza y cuello localmente avanzados y el carcinoma colorrectal38,39.
Existen algunos reportes de dermatitis por radiación severa al combinar estas 2 terapias40,41, con índices de un 48-50% en grado iii o iv42.
Como se mencionó previamente, los inhibidores del EGFR pueden tener repercusiones a nivel cutáneo asociadas a la respuesta inflamatoria e inmunitaria. A nivel tumoral, cetuximab incrementa la sensibilidad de las células a la radiación43. Al combinar ambas terapéuticas, la interacción induce una respuesta inflamatoria más acusada a nivel dermo-epidérmico, lo cual genera un daño que se manifiesta en forma de eritema, edema, mayores niveles de descamación, ampollas con exudado seroso y en algunas ocasiones necrosis (fig. 6).
Todo lo anterior puede además retrasar el proceso de recuperación cutánea y complicarse con procesos infecciosos secundarios.
Ha sido necesario modificar el cuadro clínico de la evolución debido a las diferencias clínicas (tabla 1).
Tabla modificada de evaluación en pacientes con radiodermitis y uso concomitante de inh EGF
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | |
|---|---|---|---|---|
| Modificación asociada a medicamentos | Eritema, leve descamación seca | Eritema de moderado a severo Descamación severa. Costras no hemorrágicas confinadas mayormente a pliegues | Descamación húmeda o costras hemorrágicas. No respetan pliegues. Sangrado inducido por traumatismo menor o abrasión. Sobreinfecciones que requieren antibióticos sistémicos | Áreas extensas y confluentes de costras hemorrágicas y ulceración (> 50% área afectada) Sangrado espontáneo (> 40% área afectada) Necrosis ulceración con destrucción extensa |
En nuestra experiencia, la radiodermitis se ha presentado en grados ii-iii con edema importante, incremento de la descamación y, en algunos casos, se presentan fisuras y costras hemorrágicas.
Al igual que con el rash, la tendencia del manejo de estos pacientes se inclina hacia la profilaxis y, cuando no se logra, entonces hacia el manejo de la fase aguda, incluso en revisiones sistemáticas. La fase aguda de la dermatosis puede ser desde muy pruriginosa hasta dolorosa, además de que presenta un componente cosmético puesto que tiene el potencial de generar procesos de cicatrización anormal. Existen 39 estudios, de los cuales 36 se enfocan en la profilaxis y 3 en el manejo agudo44.
Nuevamente, se deben indicar medidas generales de cuidado de la piel45, como el uso de emolientes, agua termal, bepantenol y pentoxifilina. Los corticoides tópicos muestran una reducción importante de la severidad de la reacción; sin embargo, son muchos los que han sido evaluados46,47.
En el manejo de la fase aguda, los corticoides también funcionan de forma adecuada, mejorando los síntomas de ardor e inflamación48. Otros remedios, como el ácido hialurónico, sucralfato, caléndula y apósitos de diferentes materiales, también han sido utilizados con el propósito de reparar la piel dañada49.
Es importante considerar que estos pacientes normalmente presentan dolor, de modo que es necesario agregar analgesia en algunos casos.
Finalmente, es preciso considerar que el seguimiento de estos pacientes debe ser semanal dependiendo del grado de radiodermitis, esto en razón de la rápida evolución que pueden tener hacia una fase ampollosa o necrótica. Se considera que, en caso de grado iii, debe valorarse la suspensión de la radioterapia, no de cetuximab; sin embargo, un grado iv requiere de la suspensión de ambas terapéuticas50.
DiscusiónSi bien la evidencia disponible es mucha, poco es el soporte en apoyo del uso de agentes específicos. Es necesario evaluar protocolos que sugieran eficacia.
Los efectos secundarios de los anticuerpos inhibidores del EGFR (figs. 7 y 8) son predecibles y susceptibles de tratamiento, de modo que es claro que el futuro radica en la prevención.
Se requiere de una actitud proactiva y de un abordaje interdisciplinario a fin de establecer un manejo profiláctico y de este modo limitar la incidencia y la severidad de los síntomas asociados al uso de este tipo de medicamentos, ofreciendo a los pacientes mayores niveles de tolerancia, mejorando la calidad de vida y optimizando los beneficios que estos medicamentos ofrecen a los pacientes al disminuir la necesidad de reducción o abandono del tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.