Se presenta una revisión de la literatura sobre el melanoma nasomaxilar acompañada por un caso, inicialmente diagnosticado por clínica como pólipo nasal. Histológicamente, la lesión era poco diferenciada y solo a través del estudio de inmunohistoquímica se determinó su estirpe. Mediante tratamiento quirúrgico radical se eliminó el tumor, sin que se presentara recidiva tumoral. La paciente presentó una buena calidad de vida durante 16 meses y falleció posteriormente tras desarrollar metástasis a cerebelo.
A literature review is presented on nasomaxillary melanoma, together with a case report of a patient initially clinically diagnosed with a nasal polyp. Histologically, the lesion was poorly differentiated, and its origin could only be determined by immunohistochemical study. The tumour was removed by radical surgery. There was no recurrence, with the patient having a good quality of life for 16 months, but died after developing cerebellar metastases.
El melanoma primario de mucosas presenta una incidencia global del 1.3% y de estos casos, menos del 5% se ubican en la región nasomaxilar1-3. En los Estados Unidos (EUA) se diagnostica melanoma nasal a razón de 0.3 por millón de habitantes y en senos paranasales 0.2 por millón4. La frecuencia se incrementa con la edad, dado que más del 65% de estos pacientes son mayores de 60 años. No se han identificado los factores de riesgo asociados al desarrollo de melanomas de las mucosas, aunque la exposición ocupacional al formaldehído se ha sugerido como un factor de riesgo de melanomas mucosos nasosinusales5.
Los melanocitos derivan embriológicamente de la cresta neural y se localizan en la capa basal de las mucosas bucal, nasal, ocular, ótica, gastrointestinal y genital, así como en las leptomeninges6. Sin embargo, la función del melanocito en las mucosas no es plenamente comprendida, aunque se cree que puede formar parte del sistema inmunitario involucrado en la defensa antimicrobiana con funciones fagocíticas, producción de citocinas y presentación de antígenos7.
Por no existir un sistema de estadificación TNM especifico para melanoma mucoso de cabeza y cuello, se emplea el sistema o clasificación de Ballantyne, la cual considera estadio I, enfermedad localizada o in situ; estadio II involucrando nódulos linfáticos regionales, y estadio III metástasis distante8.
En los melanomas nasomaxilares, la masa tumoral, la obstrucción nasal y la epistaxis son los datos clínicos más frecuentes, aunque cabe señalar que estos datos antecedieron hasta con 8 meses el diagnóstico en 115 casos reportados por el Instituto de Patología de las Fuerzas Armadas de los Estados Unidos9. Este tipo de tumor se presenta como una masa friable, carnosa, polipoide y no pigmentada hasta en el 25% de los casos, lo cual frecuentemente ocasiona un diagnóstico inicial erróneo como pólipo nasal ulcerado2,10. En la nariz se presenta en la pared nasal lateral, en los cornetes medio e inferior, el septum nasal y el vestíbulo, y puede extenderse al seno maxilar11.
El melanoma oral es más común en los hombres y puede desarrollarse a partir de un nevo melanocítico preexistente12; su localización más frecuente es en el paladar duro y encía superior13. En 1995, la Western Society of Teachers of Oral Pathology acordó que los melanomas mucosos orales primarios fueran considerados en forma separada de los melanomas cutáneos debido a su comportamiento característico14.
Desde el punto de vista histológico, Prasad clasificó el melanoma nasal con base en el grado de invasión tumoral por niveles: 1 in situ, 2 invasivo superficial y 3 invasivo profundo, este último, obviamente, el de peor pronóstico. También se identificaron 3 fenotipos celulares: plasmocitoide, epitelioide y sarcomatoide o celular fusiforme, aunque en ocasiones se presentan los fenotipos combinados2,15. Los tumores con fenotipos celulares mixtos son los más agresivos, se asocian a una elevada prevalencia de invasión vascular y metástasis16 y el 30% de ellos contiene pigmento citoplásmico17. La proliferación de melanocitos atípicos se ubica inicialmente a lo largo de la unión entre los tejidos epitelial y conectivo18. De un 13 a un 25% de los melanomas pueden ser amelánicos, es decir, no presentan pigmento citoplásmico y en estos casos deben considerarse en el diagnóstico diferencial el linfoma, el carcinoma indiferenciado, el fibrosarcoma y el tumor maligno de la vaina del nervio periférico, todos estos por tratarse de neoplasias poco diferenciadas y pleomórficas19,20, haciéndose necesario recurrir a marcadores de inmunohistoquímica para esclarecer la estirpe celular2,9,20.
El comportamiento clínico del melanoma es impredecible21, a menudo presenta infiltración al tejido óseo en el momento del diagnóstico, así como también existencia de metástasis22.
Las opciones de tratamiento dependerán de varios factores, entre ellos la diferenciación de la lesión y el grado de extensión, considerándose como primera elección el tratamiento quirúrgico, donde los márgenes quirúrgicos deben de ser amplios con 1 a 2 cm de tejido sano20. Cuando el tamaño del tumor es mayor de 4 mm, se recomienda un margen quirúrgico hasta de 3 cm6.
Se ha informado una supervivencia del 15% a 5 años12, con un periodo de supervivencia de 2 a 22 meses, incluso con tratamiento con quimioterapia, radioterapia e inmunoterapia, con un periodo libre de enfermedad de entre 9.3 y 14.4 meses22,23. Los tumores mayores de 3 cm se asocian a un peor pronóstico, altos índices de recurrencia (69%) y hasta un 65% de mortalidad directamente relacionada con la enfermedad9, donde entre el 40 y el 50% de los pacientes presentan metástasis pulmonares, óseas, hepáticas y en el sistema nervioso central3.
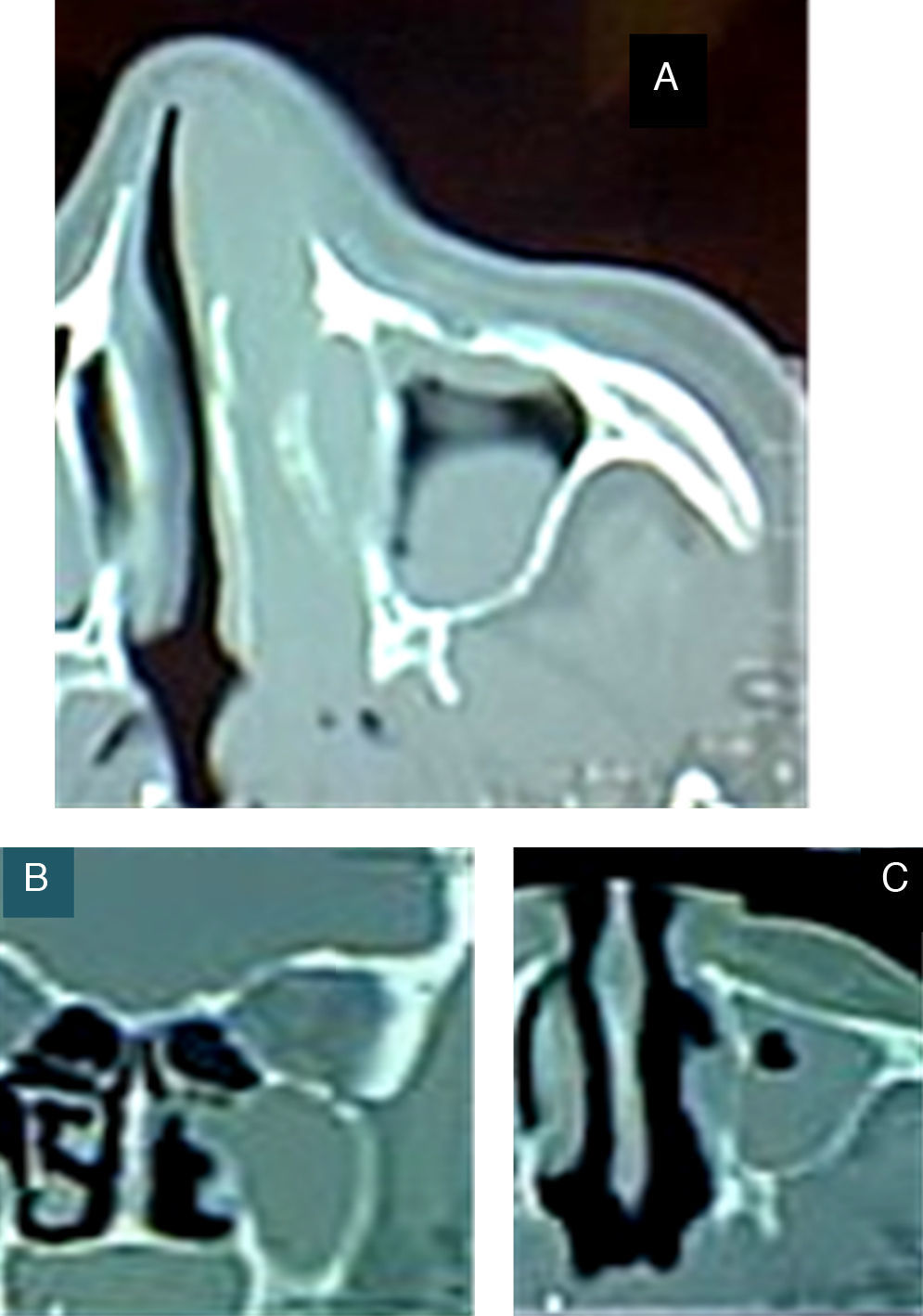
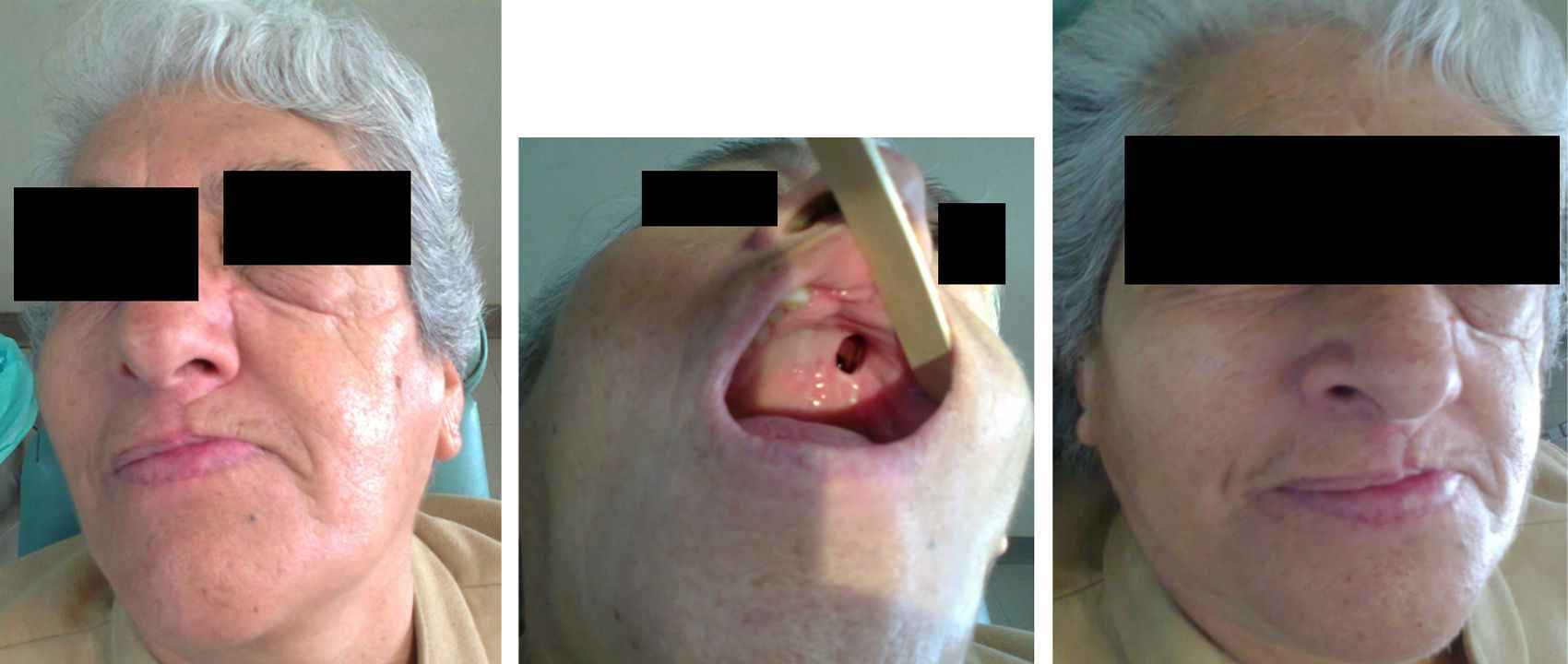
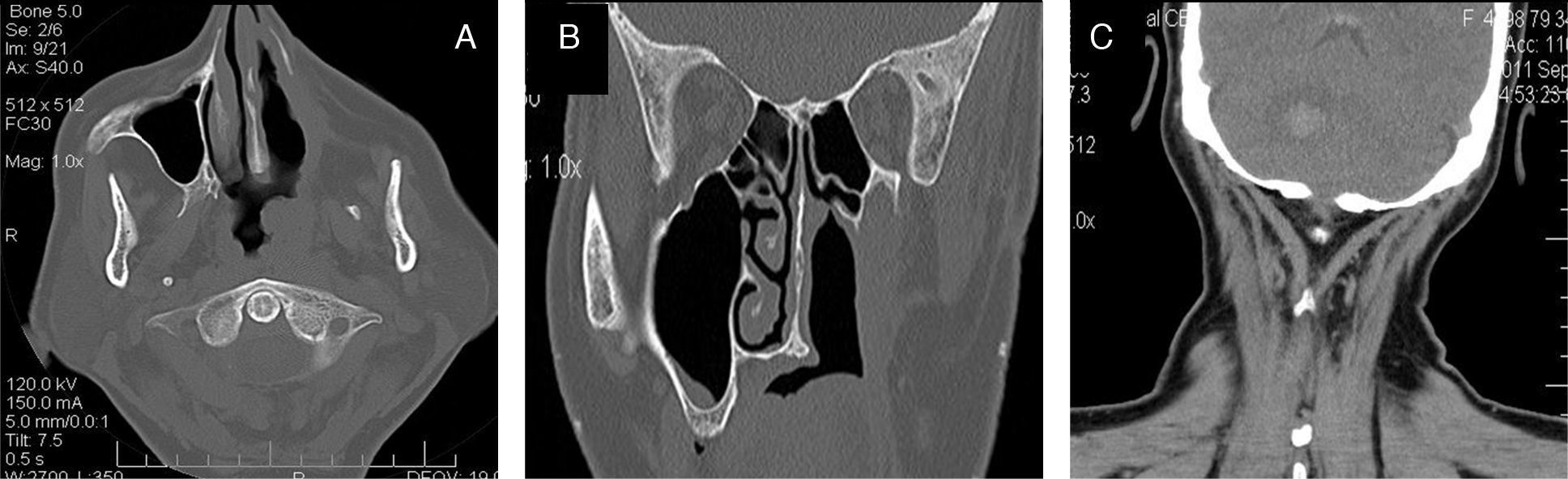
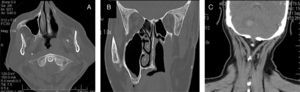
Presentación del casoMujer de 64 años de edad, sin antecedentes neoplásicos familiares, con diabetes tipo ii de un año de evolución y bajo tratamiento con hipoglucemiantes por vía oral; casada, con 7 hijos, peso de 78kg y talla de 1.54 m. Inició su padecimiento con epistaxis súbita e intermitente de la fosa nasal izquierda en octubre del 2009. Su médico familiar diagnosticó un pólipo nasal que abarcaba el 90% de la luz de la fosa nasal (fig. 1 A-C).
A) TAC inicial previa a la biopsia, con masa tumoral que ocupa la fosa nasal izquierda, sin sobrepasar la línea media y con extensión al seno maxilar izquierdo. B) TAC posterior a la biopsia escisional de la fosa nasal con turbinectomía; fosa nasal izquierda libre, cornete izquierdo ausente, tumoración con afectación de la pared nasal externa. C) Tumoración que ocupa el seno maxilar, sin extensión a la órbita (figs. B y C son previas a la maxilectomía).
El servicio de Otorrinolaringología practicó una biopsia, encontrando tumor nasal dependiente del cornete inferior, de aspecto polipoide, tanto nasal como en seno maxilar. Se resecó solo el tumor nasal el 24 de marzo del 2010. La paciente cursó un posoperatorio sin complicaciones.
El estudio histopatológico reportó neoplasia maligna poco diferenciada, pleomórfica y sin evidencia de pigmento melánico, considerándose el diagnóstico diferencial entre carcinoma epidermoide frente a linfoma linfoblástico y se sugirió un estudio de inmunohistoquímica para el diagnóstico categórico. Se practicaron pruebas de anticuerpo HMB-45 (Labvision) (+++) y Melan-A (A 103, DAKO) (++), las cuales ambas resultaron positivas y se estableció el diagnostico de melanoma epitelioide maligno el 12 de mayo del 2010.
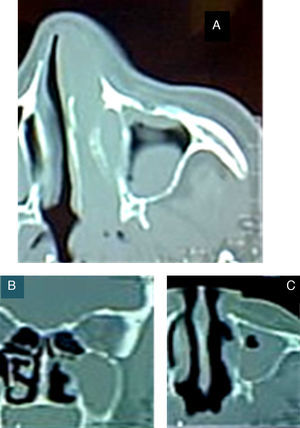
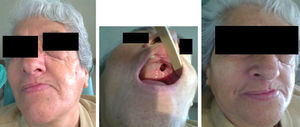
Se programó la cirugía y, previamente a la resección quirúrgica, se confirmó clínicamente que no existían datos de actividad tumoral en la nariz, la cavidad bucal ni la cara, como tampoco existían ganglios cervicales palpables, considerándose sin compromiso ganglionar (fig. 2).
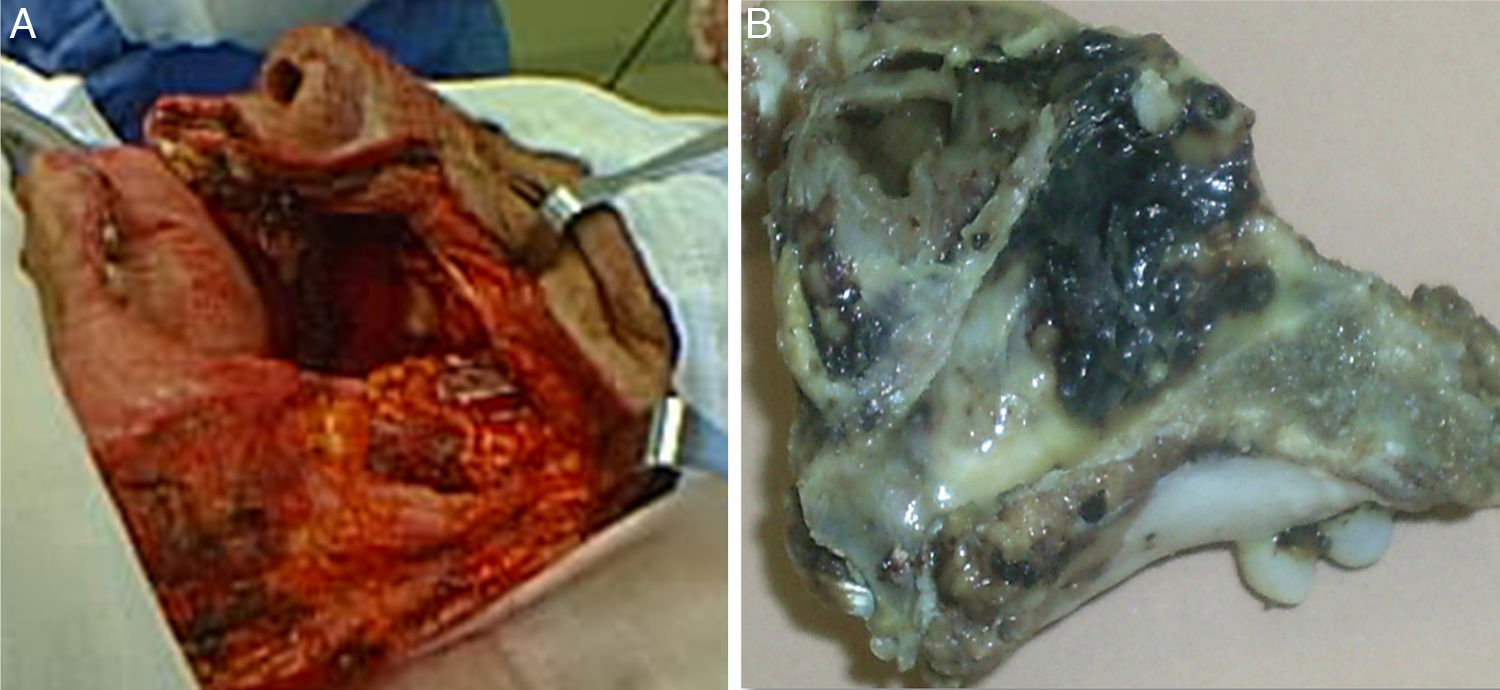
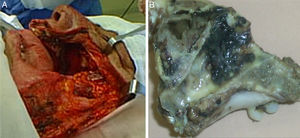
Los servicios de Oncología Quirúrgica y Cirugía Maxilofacial, bajo anestesia general, llevaron a cabo una maxilectomía total izquierda el 25 de mayo del 2010 (fig. 3). En el procedimiento se identificó mucosa del seno maxilar engrosada e irregular; paladar, vómer y nasofaringe sin actividad tumoral. Se conservó el paladar blando y el piso de la órbita por ausencia de tumor.
La paciente presentó sangrado del defecto cavitario 2 h tras la cirugía, el cual fue controlado por compresión directa mediante gasas sin mayores complicaciones. Cursó un posoperatorio regular y fue egresada del hospital el tercer día posquirúrgico, presentando fenómeno de Bell manifiesto por discreta neuropraxia de la rama cigomática del nervio facial y blefaroedema, los cuales se resolvieron en forma espontánea.
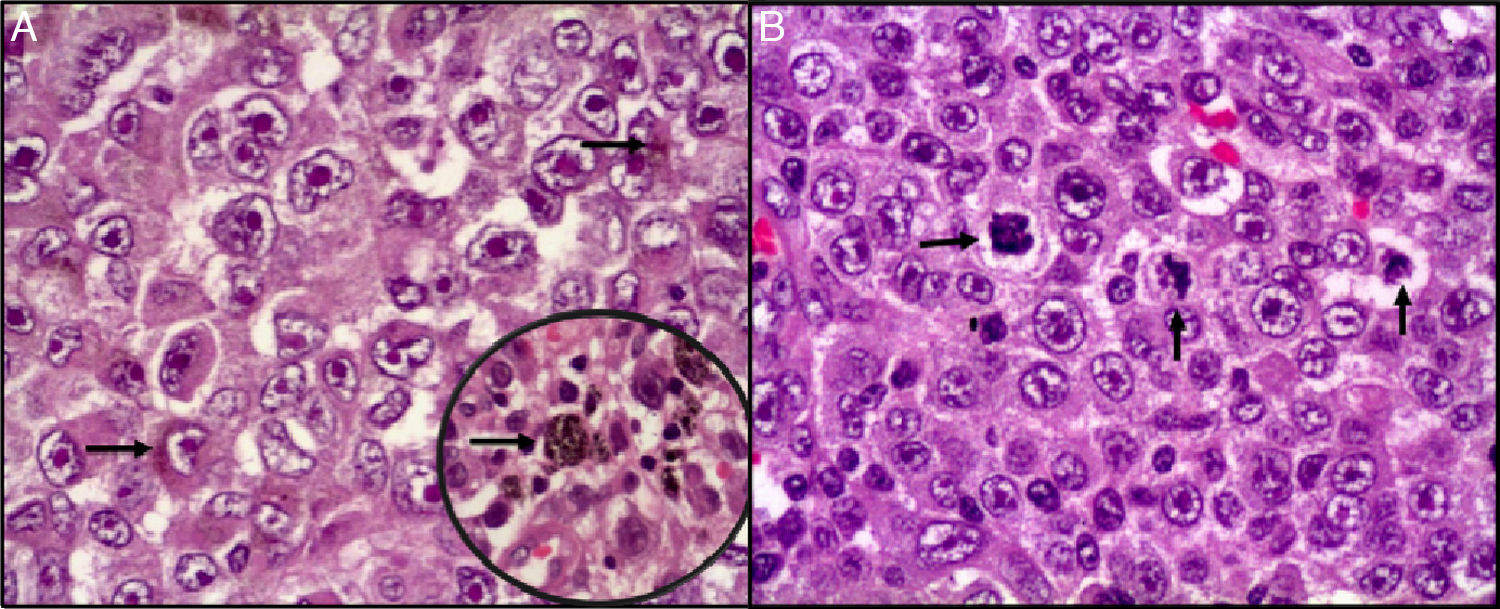
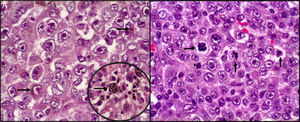
Se realizó estudio histopatológico de la pieza quirúrgica, encontrándose microscópicamente proliferación neoplásica con patrón sólido de infiltración, compuesta por elementos celulares de abundante citoplasma eosinófilo, granular y con presencia de pigmento de aspecto melánico en múltiples focos. Los núcleos presentaron pleomorfismo moderado y nucléolo eosinófilo prominente (fig. 4).
Histopatología. A) Proliferación neoplásica, irregularidad de la membrana nuclear con cromatina desplazada a la periferia, nucléolo eosinófilo prominente. Se observa en el citoplasma pigmento melánico (flechas). B) Mitosis atípicas abundantes entremezcladas con células neoplásicas pleomórficas (flechas).
La paciente evolucionó satisfactoriamente, con cicatrización adecuada y sin datos clínicos de recidiva tumoral (fig. 5).
Se inició quimioterapia con dacarbacina, de la cual solo se administraron 3 de 6 ciclos, suspendiéndose por la aparición de toxicidad gastrointestinal el 18 de noviembre del 2010. No se administró radioterapia complementaria.
La paciente permaneció asintomática por 16 meses tras la maxilectomía, sin que se registraran datos de recidiva o actividad tumoral metastásica.
Sin embargo, el 19 de septiembre del 2011 presentó mareo, náuseas, cefalea confusional, vértigo, disartria, vómito de contenido gástrico e irritabilidad, sin focalización ni datos meníngeos y cuello sin adenopatías. La tomografía craneal mostró una lesión metastásica cerebelosa derecha (fig. 6).
Ante la situación, se estableció un tratamiento con radioterapia paliativa con 30Gy por 6 MV a cráneo con 2 campos laterales. El 21 de octubre se agregaron vómitos, hemoptisis y parestesia de miembros pélvicos inferiores a los síntomas. El 3 de noviembre presentó hemiparesia derecha, sin datos de cráneo hipertensivo ni cefalea. El 18 de noviembre concluyó el curso de radioterapia paliativa y 2 meses después de la aparición de la metástasis en el sistema nervioso central la paciente falleció el 9 de enero del 2012, a 27 meses del inicio de sus síntomas y a 20 meses del diagnóstico definitivo de melanoma.
DiscusiónEl primer reporte de un melanoma primario de mucosas fue publicado en 1859 por Weber24. En 1885, Lincoln reporta el primer melanoma en mucosas de cabeza y cuello25, el cual constituye una neoplasia de baja frecuencia, pocas veces diagnosticado en la mucosa oral o nasal y cuya etiología es incierta.
Clínicamente, los melanomas pueden presentar un aspecto polipoide «benigno» cuando se aparecen en regiones nasales y paranasales, enmascarando la verdadera identidad de la lesión, como en el caso que nos ocupa. Cuando el estudio histopatológico de la biopsia inicial no fue concluyente, hizo necesario el estudio por inmunohistoquímica a fin de establecer un diagnóstico categórico. Entre los diagnósticos diferenciales del melanoma se encuentran el linfoma, el carcinoma indiferenciado, el fibrosarcoma, los tumores malignos de la vaina del nervio periférico pigmentados, el neuroblastoma olfatorio y el carcinoma sinonasal9,23,26. Recientemente, se han desarrollado nuevos anticuerpos con una mayor especificidad para el diagnóstico del melanoma, los cuales pueden incluirse en un panel de inmunohistoquímica que, sobre la base del aspecto histológico de la lesión, pueden facilitar el diagnóstico diferencial.
La concurrencia del melanoma en la fosa nasal y el seno maxilar puede deberse a invasión por contigüidad, la cual, cuando se presenta, hace más difícil el tratamiento quirúrgico debido a que la lesión tumoral llega a tener grandes dimensiones que dificultan la resección total. La ubicación, el volumen del tumor y la extensión condicionan un peor pronóstico27. Los melanomas en los senos paranasales, y específicamente en el seno maxilar, tienen mal pronóstico a corto plazo, reportándose una media de supervivencia del 0% a 5 años25,28; en otros reportes es inferior al 15%12 y en 39 casos de pacientes con tumores nasomaxilares solo el 10% se encontraba libre de enfermedad y el 74% falleció con la enfermedad9.
El lapso trascurrido entre el diagnóstico histopatológico y el tratamiento quirúrgico radical fue de 13 días; sin embargo, la paciente refirió el inicio de sus síntomas en octubre del año 2009, en tanto que su tratamiento quirúrgico radical se efectuó en mayo del 2010: 7 meses vitales, desfavorablemente propiciados primero por el establecimiento inicial del diagnóstico clínico de un pólipo nasal y luego por el retraso en el diagnóstico final, a saber, una lesión que involucraba toda la fosa nasal izquierda y parte del seno maxilar, con afectación de la pared nasal. El retraso en el diagnóstico, las dimensiones del tumor y las dificultades técnicas para la resección completa del tumor primario son aspectos identificados como factores que condicionan un mal pronóstico9. Sin embargo, con el tratamiento quirúrgico radical realizado, la paciente permaneció libre de enfermedad, sin presentar recidiva tumoral local ni metástasis regional por 16 meses, con una buena calidad de vida. Desafortunadamente, desarrolló metástasis cerebelosa, sin evidencia de metástasis pulmonares, hepáticas u óseas, las cuales son las más frecuentes, reportándose en el 54, el 35 y el 25%, respectivamente9,28,29, mientras que la frecuencia reportada de metástasis en el sistema nervioso central oscila entre el 2 y el 20%28. La supervivencia libre de enfermedad reportada va de 9.3 a 14.4 meses22,23, en tanto que en la paciente de nuestro caso fue de 16 meses; en ella, desafortunadamente, no se completó la administración de los ciclos completos de quimioterapia sistémica debido al desarrollo de toxicidad gastrointestinal, la cual obligó la suspensión del tratamiento farmacológico, aunque Albino reporta solo una respuesta parcial del 20% con la quimioterapia30 y también que la radioterapia postoperatoria no ha mostrado mejora en la supervivencia global31.
ConclusiónHemos presentado un caso de melanoma nasomaxilar, tumor poco frecuente que se diagnosticó clínicamente de manera inicial como un pólipo nasal y solo mediante inmunohistoquímica se determinó la estirpe histológica. Al administrar un tratamiento quirúrgico radical se logró la eliminación del tumor, sin que se presentara recidiva local tumoral y otorgando a la paciente una buena calidad de vida por 16 meses. Desafortunadamente, la paciente presentó metástasis a distancia en el sistema nervioso central y falleció 4 meses después.
Conflicto de interesesLos autores declaran que no existen relaciones económicas ni de cualquier otra índole susceptibles de generar conflictos de intereses que pudieran influir o haber influido en la preparación y realización del presente manuscrito para su publicación.