La mayoría de los meningiomas son tumores benignos asociados a buen pronóstico, sin embargo, puede haber variables agresivas y con un comportamiento clínico desfavorable, a pesar de ser tumores histológicamente benignos. Por lo general, tienden a recurrir, metastatizar y diseminarse.
Presentamos el caso de una mujer de 50 años, que presentó un meningioma del ala mayor del esfenoides cuyo principal síntoma fue dolor de ojo y aumento del volumen del mismo, se resecó la lesión periorbitaria y se reportó como meningioma sincitial con intensa permeación o diseminación neural. El tumor fue positivo para vimentina y EMA, y negativo para PGAF, neurofilamentos y citoqueratinas. Los filetes nerviosos fueron positivos para proteína s-100 y factor de crecimiento neuronal (FCN), en los nidos infiltrantes en tejidos blandos sólo se observan en la periferia.
La diseminación neural de los meningiomas es un hallazgo poco común y al igual que los tumores en cabeza y cuellos suele ser de mal pronóstico.
Most meningiomas are benign tumors associated with good prognosis; however, aggressive variants with unfavorable clinical behavior despite of being histologically benign tumors may occur. Generally, these neoplasms tend to recur, metastasize and spread.
We report on the case of a 50 year-old woman who presented with a meningioma of the greater wing of the sphenoid bone, with the main symptoms being eye pain and increased eye volume. The periorbital lesion was resected and reported as syncytial meningioma with intense neural permeation or dissemination. The tumor tested positive for vimentin and epithelial membrane antigen, and negative for glial fibrillary acidic protein, neurofilaments and cytokeratins. The nerve fibers tested positive for s-100 protein and neural growth factor; in nests infiltrating soft tissues, they are only observed at the periphery.
Neural spread of meningiomas is a rare finding and, like head and neck tumors, it is usually associated with poor prognosis.
Introducción
El meningioma es un tumor intracraneal común que representa del 14% a 19% de todas las neoplasias intracraneales primarias1. La mayoría de los meningiomas se encuentran adheridos a la duramadre, la médula espinal y/o la aracnoides, así como a la pared de los ventrículos y meninges. Se originan a partir de las células meningoteliales de la capa aracnoidea, siendo tumores benignos de lento crecimiento, la mayoría corresponde a grado I de acuerdo a la clasificación propuesta por la Organización Mundial de la Salud (OMS)2, sin embargo existen sus contrapartes más agresivas como el meningioma grado II y el anaplásico grado III de acuerdo a la OMS2. Estos tumores tienden a recurrir, crecer y diseminarse, hasta llegan a dar metástasis a distancia; a pesar de ser histológicamente benignos tienden a comportarse agresivamente2. La recurrencia no es infrecuente en particular para las variantes atípicas y anaplásica2. De acuerdo con la OMS, el 94.3% de los meningiomas son benignos, con una tasa de recurrencia a 5 años del 3% en comparación con el 38% y el 78% de los meningiomas atípicos y anaplásicos, respectivamente2. Existen varios parámetros histológicos que se han identificado como indicadores de la conducta agresiva y predictivos de recurrencia de los meningiomas3, que incluye la alta celularidad, alto índice mitótico, pleomorfismo nuclear, presencia de focos de necrosis e invasión de estructuras adyacentes2,5-7. Otros indicadores pronósticos reportados de recurrencia del tumor constituyen el cambio en la morfología histológica, la transformación maligna, la heterogeneidad celular y la multicentricidad, también se ha descrito la diseminación neural como factor de mal pronóstico independientemente del grado histológico8,9.
El objetivo de este trabajo fue presentar un caso de meningioma del ala mayor del esfenoides, que se diseminó por vía neural en forma difusa hasta los tejidos blandos, cursando como masa periorbitaria con pérdida de la agudeza visual en forma progresiva.
Presentación del caso
Mujer de 59 años de edad, con antecedente de histerectomía con ooforectomía derecha hace 19 años por probable miomatosis uterina. Inició padecimiento actual en 2008, con edema periocular en ojo izquierdo, con aumento progresivo de volumen hasta llegar a medir 5 cm de diámetro, además presentaba disminución de agudeza visual desde un año previo en forma progresiva. Acude al Instituto Nacional de Neurología y Neurocirugía (INNN) por dolor ocular intenso y aumento de volumen del mimo. A la exploración física presenta edema periorbitario blando y depresible, sin adenomegalias. La valoración neurológica fue normal y la agudeza visual estaba disminuida, sin percepción de la luz en el ojo izquierdo, los movimientos oculares mostraban limitación a la abducción, además presentaba disminución de la audición izquierda. Se sometió a resección de la lesión periocular.
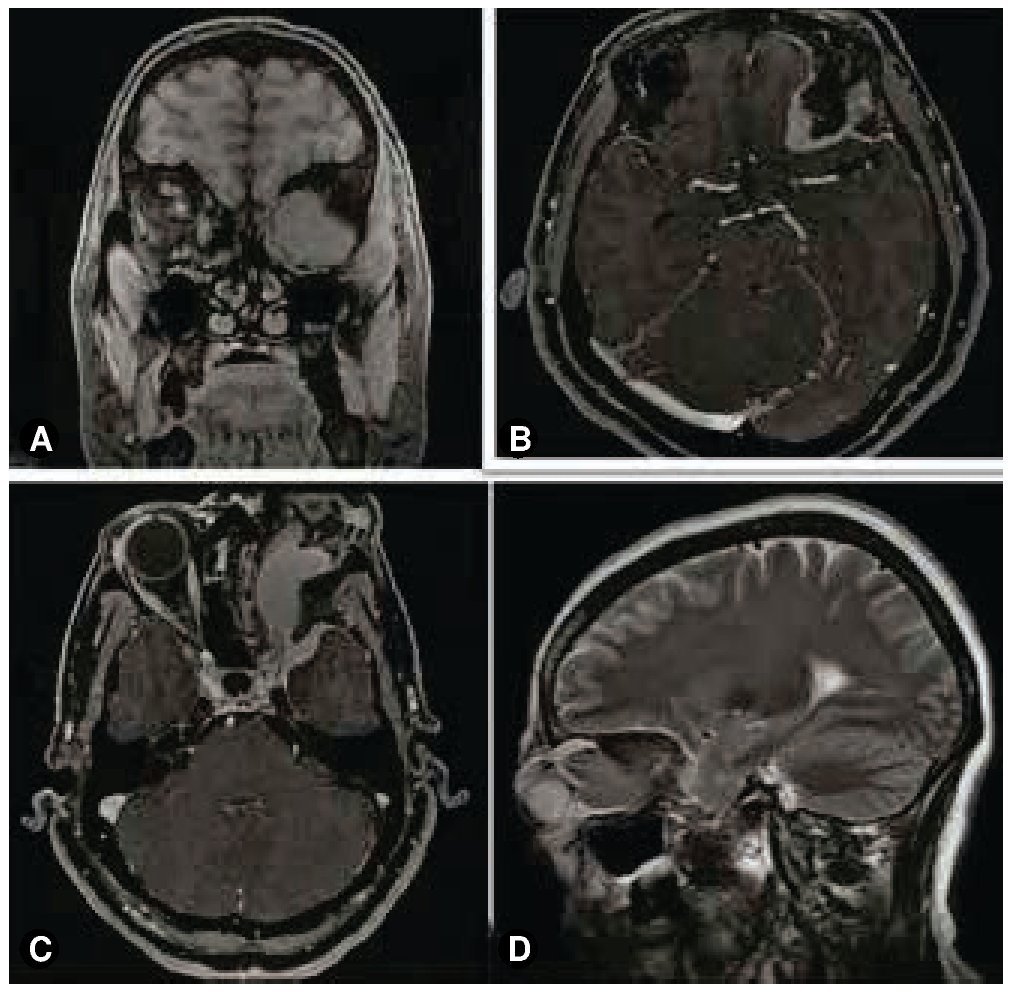
Figura 1 Imágenes radiológicas. A) Resonancia magnética en T1 COR/3D FS, la cual muestra una lesión expansiva de contornos lobulados bien definidos, con base de implantación ancha en relación con el ala mayor del esfenoides ipsilateral. B) Resonancia magnética en T1 con gadolinio, que exhibe una lesión isointensa en la diferente secuencia, tras la administración del contraste tiene un reforzamiento intenso en relación con el seno cavernoso y el polo frontal medial ipsilateral. C) Resonancia magnética en T1 con gadolinio, que muestra como la lesión se extiende en el espacio intra y extraconal izquierdo condicionando proptosis, así como desplazamiento medial del nervio óptico con engrosamiento polipoide de seno maxilar izquierdo. D) T2 lateral, expone como la lesión se extiende difusamente, apreciándose mejor la lesión en seno maxilar izquierdo.
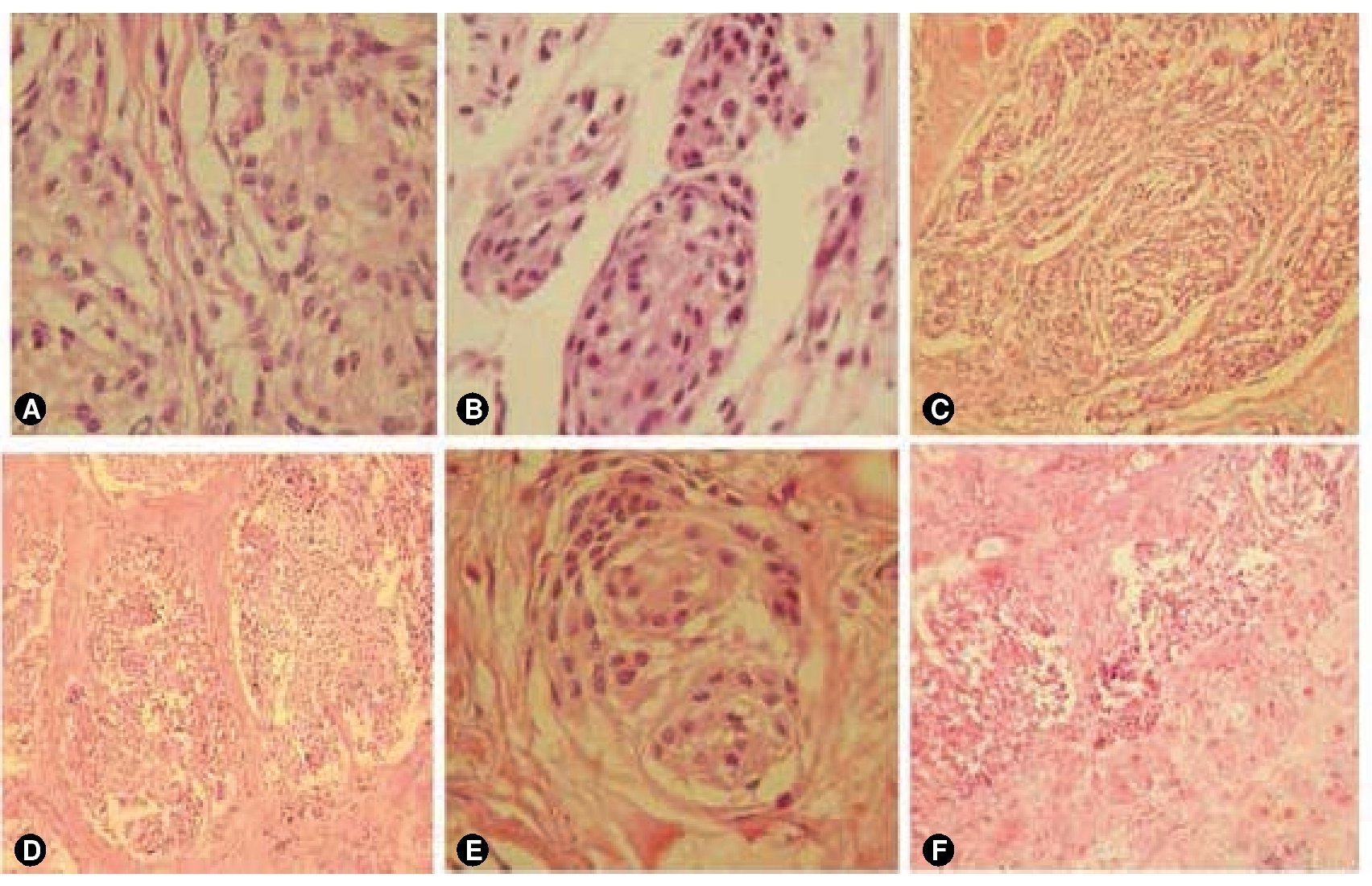
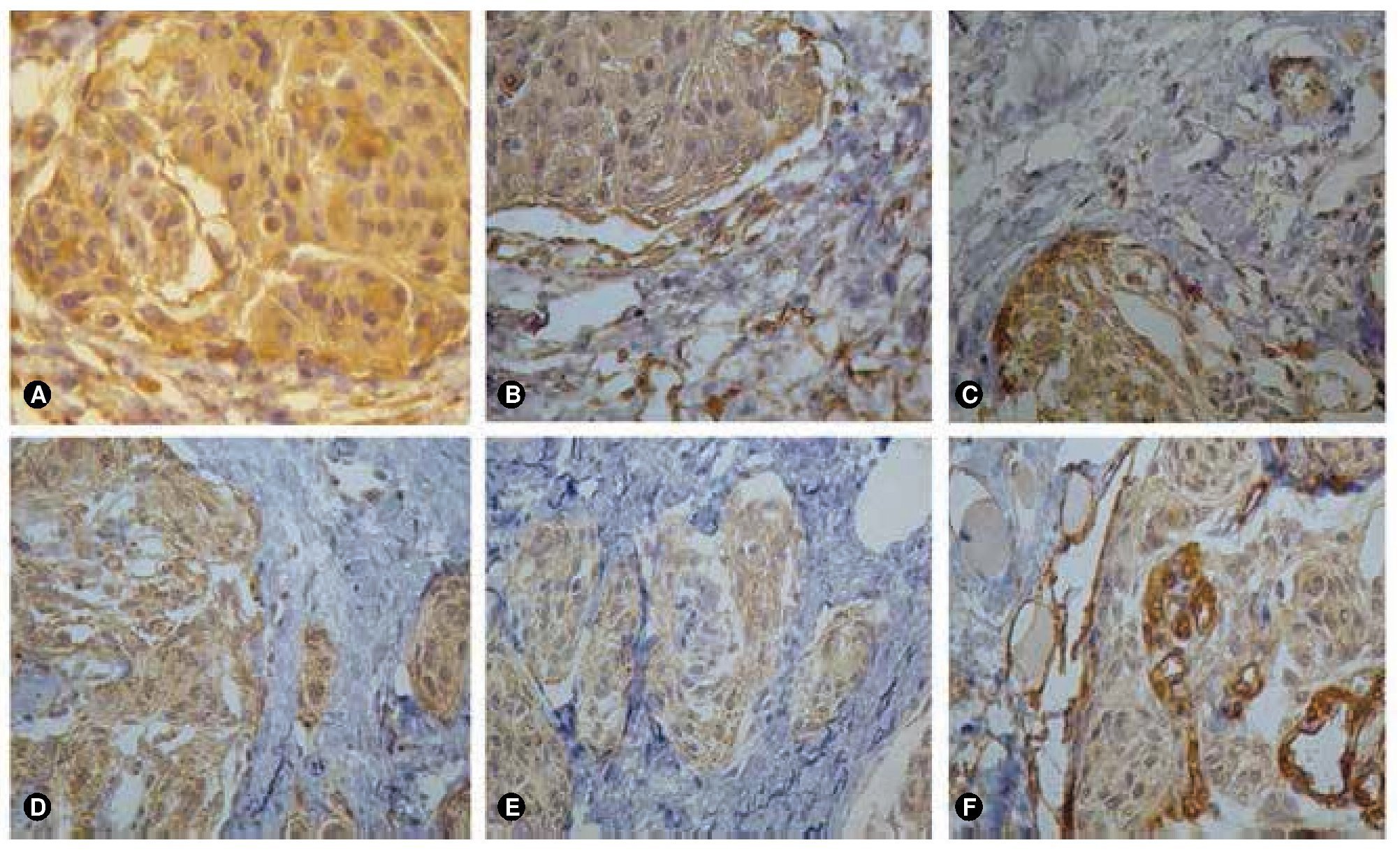
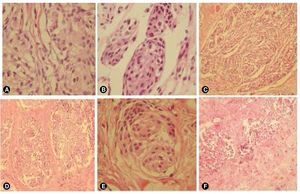
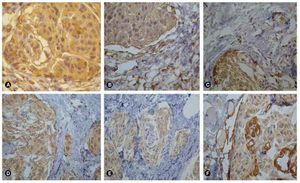
Las imágenes radiológicas muestran una lesión expansiva de contornos lobulados bien definidos, la cual muestra una base de implantación ancha en relación con el ala mayor del esfenoides ipsilateral, se comporta isointensa en la diferente secuencia y tras la administración del gadolinio tiene un reforzamiento intenso en relación con el seno cavernoso y el polo frontal medial ipsilateral (fig. 1). Se asocia a hiperostosis esfenoidal. Dicha lesión se extiende en el espacio intra y extraconal izquierdo, condicionando proptosis así como desplazamiento medial del nervio óptico. Los giros rectos se encuentran lateralizados hacia la derecha, hay incremento de los diámetros de los vientres musculares de los rectos inferior y lateral derechos. El parénquima cerebral, cerebeloso y el tallo cerebral no mostraron alteraciones. Había paso de líquido cefalorraquídeo al interior de la silla turca, lo que condiciona compresión ventral de la hipófisis; con engrosamiento polipoideo de seno maxilar izquierdo. Se diagnosticó como meningioma del ala mayor del esfenoides izquierdo con extensión infraorbitaria e intracraneana. Histológicamente, el tumor estaba formado por células meningoteliales de un meningioma sincitial, que corresponde al grado I de acuerdo a la OMS2 (figs. 2A y 2B), sin embargo llamó la atención que los filetes nerviosos se encontraban con presencia de células meningoteliales, los cuales infiltraban en forma difusa (figs. 2C y 2D). A mayor infiltración de estos se observaron atipias celulares (fig. 2E). El tumor infiltraba también a los tejidos blandos y músculo (fig. 2F). Por inmunohistoquímica el tumor fue positivo para vimentina (fig. 3A). Los filetes nerviosos fueron positivos para proteína s-100 (fig. 3B) y para el factor de crecimiento neural (FCN); se observan también en la periferia de los nidos del meningioma, lo que sugiere invasión y/o diseminación intraneural (fig. 3C), en los vasos también se evidencian células neoplásicas (fig. 3D).
Figura 2 Hallazgos histológicos. A), B) Se observa el tumor formado por células meningoteliales arremolinadas. C) Se exhiben los filetes nerviosos con presencia de células meningoteliales que los infiltraban en forma difusa. D) A mayor infiltración de estos, se observaron atipias celulares. E), F) El tumor infiltraba tejidos blandos y músculo.
Figura 3 Tinciones de inmunohistoquímica (IHQ). A) El tumor fue positivo para vimentina en forma difusa; B) se observa la positividad para proteína s-100, C) se exhiben los filetes nerviosos positivos para proteína s-100, y también D) se muestra la positividad para CD34 en los vasos sanguíneos, que evidencian células meningoteliales (IHQ, 400x).
Discusión
Los meningiomas son, por lo general, tumores recidivantes y/o raramente con tendencia a malignizarse, se ha referido que pueden difundirse a través de la vía hematógena, linfática o rutas del líquido cefalorraquídeo, a través de las meninges3-9.
La diseminación tumoral perineural se refiere a una extensión neoplásica contigua a lo largo de un nervio. Como puede ser clínicamente silente, la imagen radiológica juega un papel fundamental en la evaluación y la delimitación de la infiltración perineural en tumores malignos de cabeza y cuello, que a su vez afecta a la planificación del tratamiento10-13. La diseminación y/o infiltración perineural de los tumores de cabeza y cuello es un fenómeno bien descrito en la literatura médica quirúrgica y de imagen. Implica extensión neoplásica directa de un tumor primario mediante el nervio como un andamio, y es de gran importancia clínica. La diseminación tumoral perineural conlleva un pronóstico grave. Se asocia con un aumento de casi 3 veces en la recidiva local y la disminución de aproximadamente 30% en la tasa de supervivencia a 5 años9-13. La diseminación perineural ahora se considera un indicador pronóstico independiente en la estadificación del tumor, según la última edición de la clasificación TNM de los tumores malignos13.
El mecanismo exacto de la diseminación tumoral perineural es muy controversial. Los linfáticos intraneural se han propuesto como la ruta de difusión. Sin embargo, esta teoría está por ahora firmemente rechazada ya que ninguna célula neoplásica se ha observado en los vasos linfáticos10-12.
No obstante, es importante mencionar que en el sistema nervioso central no hay linfáticos.
La incidencia de diseminación tumoral perineural varía de 2.5% a 5.0%, con una amplia variedad de neoplasias malignas de cabeza y cuello13. El carcinoma adenoideo quístico que surge de la glándula salival es la neoplasia maligna más común asociada con la infiltración perineural, con una tasa de hasta el 60%14. Esto puede estar relacionado con una alta expresión de moléculas de adhesión de células neurales (NCAM), que se detecta en aproximadamente el 93% del carcinoma adenoideo quístico con la infiltración perineural14.
El receptor de neurotrofinas p75 también ha despertado mucho interés en el estudio de la diseminación tumoral perineural15. Durante el desarrollo del sistema nervioso, es la interacción entre el FCN y el receptor p75 -que se encuentra en las células de Schwannlo que estimula la migración de células de Schwann a lo largo del nervio15.
Radiológicamente, la resonancia magnética (RM) en T1 con supresión grasa se utiliza ampliamente para aumentar la visibilidad del tumor del nervio infiltrado, anulando la señal de la grasa circundante16,17. Sin embargo, cuando se utiliza una técnica de supresión grasa selectiva en frecuencia, artefactos de susceptibilidad particularmente alrededor de un prominente seno esfenoidal, pueden oscurecer el foramen de la base del cráneo. No obstante, se usa el contraste isotrópico de alta resolución espacial volumétrica interpolado en la secuencia en apnea con saturación de la grasa, para evaluar plenamente las vías neuronales a través de los agujeros de base de cráneo sin artefactos15,16. En la fase aguda, las imágenes de RM en T2 muestran señales hiperintensas en los músculos que simulan edema. Esto es porque el T2 de agua extracelular es más largo que el T2 de agua intracelular. Además, el aumento de la mejora del contraste también se observa en estos músculos, debido al aumento subyacente en la perfusión y la acumulación de medio de contraste en el espacio extracelular15,16. El diagnóstico diferencial incluye los tumores neuronales primarios como Schwannomas, infecciones fúngicas invasivas, tales como aspergilosis o mucormicosis (en individuos severamente inmunocomprometidos) y trastornos inflamatorios meníngeos, como la sarcoidosis e histiocitosis.
Las metástasis a distancia de los meningiomas benignos son extremadamente raras y casi todos los casos reportados fueron asociados con un tumor intracraneal grande3,18. Por otra parte, la tasa de metástasis a distancia podría llegar al 5% para el tipo atípico (grado II) y del 30% para los meningiomas anaplásicos o malignos, grado II2,4. Según un informe, los tumores que metastatizan generalmente tenían características histológicas compatibles con un fenotipo maligno, como la necrosis focal, invasión cerebral, pleomorfismo celular y mitosis frecuentes5-7,18. La vía más común de metástasis en los meningiomas se considera que es a través del líquido cefalorraquídeo, pero esto no explica metástasis extraneurales12-14,18.
El comportamiento agresivo de los meningiomas pueden estar asociados a síndromes genéticos, tales como la neurofibromatosis tipo 2 (NF2) o ser incididos por radioterapia19. Sin embargo, se han descrito alteraciones y/o mutaciones genéticas asociadas a meningiomas agresivos tales como la pérdida del cromosoma 1p, 6q, 10, 14q, 18q, 22q, o ganancia del 1q, 9q, 12q, 15q, 17q y 20q20. Estas aberraciones genéticas pueden están asociadas a alteraciones que participan en el ciclo celular que afecta los genes CDKN2A (p16INK4A), p14ARF, LEF1, SNAI2, TGFB3, TGFB1, TGFBR2, TWIST20. La presencia de células inmaduras de tipo células madre también se han asociado a mal pronóstico en los meningiomas21,22. Los meningioma por lo general expresan vimentina y EMA, pero la expresión de CD133, CD44 y CD166, así como la pérdida de la expresión de la E-cadherina nos permite identificar meningiomas de células progenitoras, que son marcadores de mal pronóstico2. Así como, la expresión de neurofilamentos y/o de la PGAF y de marcadores de células madre de tipo neural (Nestin, Sox2, y CD133), son marcadores que se expresan tanto en mutaciones genéticas de tipo mesenquimatosos y/o a mutaciones de NF221.
El gen LEF1, que se ha demostrado recientemente ser una molécula crucial en la convergencia de la TGF-β y vías de señalización Wnt/β-catenina, puede desempeñar un papel importante en las vías de señalización que convergen en un fenotipo mesenquimatoso en meningiomas24. La vía de señalización Wnt en meningiomas atípicos y anaplásicos contienen las pérdidas en los cromosomas 10 y 14. La desregulación de los genes implicados en la ruta de Wnt de señalización, tales como CCND1 es una característica de los PRM, y esta vía de señalización en combinación con la adquisición de características mesenquimatosas que puede contribuir a las características de la progresión maligna23,24.
Yan J et al.25 reporta un caso de meningioma extracraneal orbital que se extendía por nasofaringe en una paciente con FN2, y Tabernero M, et al.26 evidencia la asociación entre mutación del gen NF2 en pacientes posmenopáusicas y meningiomas. Consideramos, el tumor nasal también podría corresponder a un meningioma.
Conclusiones
Reportamos el caso de una mujer menopáusica con meningioma, quien cursó con lesión periorbitaria y que radiológicamente correspondía a un meningioma del ala mayor del esfenoides con diseminación perineural, lo que explicaría una probable mutación del gen NF2, que corresponde a un comportamiento poco habitual de este tumor y que probablemente el engrosamiento polipoide de seno maxilar izquierdo se deba a un meningioma.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Departamento de Neuropatología,
Instituto Nacional de Neurología y Neurocirugía "Manuel Velasco Suárez".
Av. Insurgentes Sur N° 3877, Colonia La Joya, Delegación Tlalpan,
C.P. 14269, México D.F., México.
Teléfono: (525) 5606 3822, ext. 1029. Fax: (525) 5424 0808.
Correo electrónico: mltenasuck@gmail.com (Martha Lilia Tena-Suck).