Reunión sobre Tratamiento Médico del Cáncer Mamario
LAS HADAS, MANZANILLO, COLIMA, ENERO DE 2010
Coordinadores
Dr. Jesús Cárdenas Sánchez
Dra. Aura Erazo Valle
Dr. Víctor M. Lira Puerto
(1941-2010)
En recuerdo del maestro, compañero y extraordinario amigo, esta edición está dedicada al Dr. Víctor M. Lira Puerto, uno de los pilares de la oncología médica en México y Latinoamérica.
¿ I. INTRODUCCIÓN
El Consenso Nacional Sobre Diagnóstico y Tratamiento del Cáncer Mamario se realizó por primera ocasión en Colima en septiembre de 1994 y en él participó un grupo representativo de todas las instituciones oncológicas del país. La publicación de sus conclusiones tuvo una amplia difusión y sirvió como guía práctica para el tratamiento de esta enfermedad; más aún, inició con ello también una estandarización relacionada con el diagnóstico y los diferentes tipos de tratamientos.1 Las posteriores revisiones del consenso de 1998-20002, 20053 y 20084 han dado seguimiento y actualización a estas guías y han formado parte en buena medida de los documentos analizados para la integración de la Norma Oficial Mexicana en la materia.5
De todos los temas vinculados con el cáncer mamario, los de la oncología médica son los que mayores cambios e innovaciones han experimentado en los últimos años. Es por ello que en enero de 2007 se celebró la Primera Reunión sobre Tratamiento Médico de Cáncer Mamario, con la participación de un gran número de especialistas en la materia de todo el país. Al igual que en el consenso, la metodología de este foro permitió inferir varias conclusiones que luego se publicaron y difundieron entre la comunidad oncológica nacional.6
Debido a las importantes publicaciones de los últimos años con relación a temas de tratamiento médico del cáncer mamario, particularmente en lo relacionado con subtipos moleculares, terapias blanco, así como a un mayor conocimiento de los factores predictivos de riesgo, se decidió actualizar y ampliar los temas revisados en el 2007. En enero del presente año se reunieron oncólogos médicos representantes de las principales instituciones del país, quienes en diferentes grupos de trabajo revisaron, antes de la celebración de la reunión, los diversos temas de la agenda y presentaron para su discusión las propuestas de cambios o adiciones a la publicación previa. Las conclusiones aprobadas en consenso son el motivo de esta publicación.
Los resultados de la reunión podrán servir a la comunidad oncológica en general, y a los oncólogos clínicos en particular, para llevar a cabo mejores valoraciones de los tratamientos médicos de sus pacientes con cáncer mamario. Asimismo, los directivos de las instituciones de salud podrán tomar en consideración las conclusiones delineadas a continuación con la finalidad de hacer más efectivos los recursos disponibles para tratar esta enfermedad.
¿ II. BASES MOLECULARES DEL CÁNCER MAMARIO
Desde el punto de vista clínico, el cáncer mamario se considera una enfermedad heterogénea. Esta presuposición se revisó de forma general con las observaciones de los patrones clínicos de evolución relacionados con la edad de las pacientes, el estado menopáusico, el tamaño tumoral y la afectación ganglionar, los cuales tienen valor pronóstico pero escaso valor predictivo.1,2
Con posterioridad, el estudio patológico permitió distinguir los diferentes tipos histológicos y el grado de diferenciación celular. La inclusión de nuevas tecnologías, como la inmunohistoquímica, permitió identificar factores pronósticos y predictivos más precisos y bien validados en la actualidad.
En fecha reciente, con el desarrollo de la biología molecular, ha surgido la oncogenómica, una nueva rama de la medicina que estudia la caracterización genómica de las neoplasias. Con esta nueva herramienta de estudio ha sido posible demostrar que el cáncer mamario es en realidad una enfermedad heterogénea.
El informe inicial de Perou del año 2000 hizo posible reconocer cuatro grupos de enfermedad: tipo basal, tipo luminal, HER2/neu positivo y normal. Es importante considerar que este estudio incluyó de manera inicial 40 distintos tipos de cáncer mamario, en los que se analizaron los patrones de expresión génica para configurar un catálogo de 1 753 genes; éstos se expresan con una alta variabilidad, lo que determinó los grupos descritos de forma inicial. Tales agrupaciones de genes identificadas de esta forma se conocen como plataformas o firmas genéticas y su finalidad es caracterizar al cáncer mamario como una enfermedad única en cada sujeto y posibilitar, a manera de analogía, la delineación de un "retrato" de la enfermedad para cada paciente para establecer en consecuencia un tratamiento específico con alto valor pronóstico y predictivo.3
A partir del primer reporte se ha desarrollado una intensa investigación, que ha incrementado el conocimiento e intentado precisar con mayor exactitud los diferentes patrones clínicos de este padecimiento. Se han identificado subgrupos dentro de los grupos notificados de manera inicial, como el caso de los subtipos luminales A y B, y los subgrupos del HER2/neu, común y anormal.1-2
Estos hallazgos han suscitado una gran expectativa, dado que se ha observado que los casos de la forma luminal de la enfermedad, por ejemplo, se relacionan con la expresión de receptores hormonales y que de los subtipos descubiertos, el luminal A es en especial hormonosensible y quimiorresistente.
Se ha reconocido que los grupos del cáncer de tipo basal muestran negatividad a los marcadores conocidos y disponibles con inmunohistoquímica; entre ellos figuran los receptores hormonales y HER2/neu (también conocidos en clínica como "triple negativos"), dentro de los cuales también se han identificado subgrupos. Los más frecuentes se vinculan con la expresión de p53 y BRCA en un 75% y son altamente quimiosensibles, si bien con respuestas de corta duración; asimismo, sus contrapartes son quimiorresistentes y con un curso biológico más agresivo. En términos clínicos, estos tumores son frecuentes en pacientes jóvenes, expresan elevados índices de actividad proliferativa y durante las recurrencias muestran una especial afinidad visceral.4
A partir de los factores pronósticos conocidos se han desarrollado algunas herramientas de uso clínico, como el Adjuvant On line, cuya utilidad se ha validado aunque también se ha observado una falta de precisión considerable: hasta en una proporción de 30% sobreestima la probabilidad de supervivencia o recurrencia en las poblaciones estudiadas. En buena medida, la gran expectativa suscitada por los nuevos métodos se debe a la enorme necesidad de asegurar resultados terapéuticos en las pacientes sometidas a tratamientos adyuvantes.
La importancia adicional radica también en que la mejor comprensión de la biología de esta enfermedad permitirá utilizar de mejor modo los recursos terapéuticos. Por ejemplo, en los casos "triple negativos" no existe un tratamiento específico (llamado también blanco específico), como en los casos de la enfermedad hormonosensible (o de tipo luminal) y de clase HER2.5,6
El desafío es muy grande debido a la falta de estudios prospectivos que validen los resultados y a la enorme infraestructura requerida para la valoración de los subtipos, además de que la tipificación de las diferentes variantes biológicas reconocidas no se ha dilucidado con precisión. En la actualidad, entre las plataformas génicas más estudiadas y con aplicación clínica pueden mencionarse las firmas de 21 y 70 genes, que ya se encuentran en valoración prospectiva para determinar mejor su valor pronóstico y predictivo.6
¿ III.QUIMIOPREVENCIÓN PRIMARIA DEL CÁNCER MAMARIO
Los resultados de un meta-análisis sobre el uso del tamoxifeno como preventivo (incluido el estudio National Surgical Adjuvant Breast and Bowel Proyect P-1 --NSABP P-1-), tamoxifeno versus placebo mostró una reducción de 38% de la aparición del cáncer invasor e in situ en pacientes de alto riesgo, según el modelo de Gail. Resultados similares se publicaron en fecha reciente en una actualización con ocho años de seguimiento del protocolo STAR (tamoxifeno versus raloxifeno) que incluyó a más de 18 000 participantes posmenopáusicas. Los resultados mostraron que ambos fármacos son efectivos en la disminución del cáncer invasor (ligeramente mayor con el tamoxifeno) e in situ, con un perfil de seguridad discretamente en favor del raloxifeno.1
Debido a que el tratamiento quimiopreventivo no está exento de riesgos, sobre todo en mujeres posmenopáusicas, su institución debe basarse en cuidadosas consideraciones.
Está indicado en los siguientes casos:
Mujeres con alto riesgo de desarrollar cáncer mamario valorado con el modelo de Gail u otro similar.
Pacientes con antecedentes de carcinoma ductal in situ, lobulillar in situ o hiperplasia ductal atípica.
Personas con pocas probabilidades de desarrollar complicaciones vasculares o cáncer de endometrio.
Está contraindicado en las situaciones siguientes:
Mujeres con bajo riesgo de desarrollar cáncer mamario.
Individuos sometidos a terapia actual de reemplazo hormonal.
Personas con antecedente de hiperplasia atípica del endometrio.
Pacientes con riesgo de sufrir episodios tromboembólicos.
Sujetos con cataratas o sometidos a operaciones de éstas.
Mujeres que desean embarazarse.
Por otro lado, se encuentra en curso un gran número de estudios de quimioprevención con otros moduladores selectivos de la respuesta endocrina, así como inhibidores de aromatasa y otros fármacos, cuyos resultados estarán disponibles en los próximos años.
A pesar de los datos científicos descritos con anterioridad, la utilización de la quimioprevención primaria con tamoxifeno o raloxifeno no es todavía una práctica común entre los oncólogos de México y el resto del mundo; esto se debe en particular a que no existe una información suficientemente clara, tanto para el equipo médico como para las personas en riesgo. En consecuencia, es recomendable que las unidades de oncología cuenten con una guía de atención sobre prevención para poder recomendar su uso sólo después de analizar los riesgos y beneficios de cada caso particular.2
TRATAMIENTO INTERDISCIPLINARIO
El control del cáncer mamario es cada vez más complejo, razón por la cual es necesaria la participación de un equipo interdisciplinario, profesional y actualizado; el objetivo es ofrecer un tratamiento óptimo a las pacientes con ese diagnóstico. Cabe señalar que la totalidad de los oncólogos médicos participantes en esta reunión coincide en subrayar la importancia de esta cooperación entre las diferentes disciplinas.
¿ IV.REQUISITOS PARA DEFINIR EL TRATAMIENTO MÉDICO ÓPTIMO EN PACIENTES CON CÁNCER MAMARIO
El oncólogo clínico debe contar con una información completa del tumor, de tal manera que pueda establecer el mejor tratamiento individualizado de una paciente con cáncer mamario. En particular, la presencia o ausencia de los blancos terapéuticos, los receptores hormonales y el HER2/neu, son de una importancia trascendental para aplicar un tratamiento óptimo. Por lo tanto, el grupo reunido recomienda que los reportes del servicio de patología los expidan con toda oportunidad especialistas calificados; asimismo, es necesario un control de calidad estricto y frecuente de las pruebas para la determinación de receptores hormonales y HER2/neu.
Para elegir el mejor tratamiento médico, los datos más importantes que deben considerarse son los siguientes:
Historial clínico completo y dirigido (edad, estado menstrual, tiempo de evolución, enfermedades concomitantes, etc.)
Resultados de estudios de extensión (radiografía de tórax, tomografía o ultrasonido abdominal, rastreo óseo, exámenes de laboratorio, etc.)
Estadificación clínica de la enfermedad (TNM 2003)
Reporte de patología completo (tamaño del tumor, tipo y grado histológicos, invasión vascular, estado ganglionar, etc.)
Etapa patológica.
Determinación de receptores hormonales.
Determinación del HER2/neu.
TRATAMIENTO MÉDICO DEL CÁNCER MAMARIO EN LAS DIFERENTES ETAPAS DE LA ENFERMEDAD
El tratamiento médico del cáncer mamario se puede dividir, de acuerdo con el momento en que se instituye, de la siguiente manera:
Tratamiento médico adyuvante en pacientes operadas en fases tempranas.
Tratamiento médico inicial, primario o neoadyuvante, en personas en fases tempranas.
Tratamiento médico inicial, primario o neoadyuvante, en pacientes en estadio localmente avanzado.
Tratamiento médico en enfermedad metastásica o recurrente.
¿V. TRATAMIENTO ADYUVANTE EN EL CÁNCER MAMARIO OPERABLE
Se conoce como adyuvancia toda intervención antineoplásica que se administre después de un tratamiento quirúrgico y sus objetivos son incrementar el periodo libre de enfermedad, reducir las recurrencias locales y sistémicas y aumentar la sobrevivencia global, sin deterioro de la calidad de vida.
El tratamiento sistémico adyuvante debe valorarlo y administrarlo un oncólogo médico.
La terapia adyuvante en el cáncer mamario ha demostrado que prolonga el tiempo libre de recaída y la sobrevivencia, sea que los pacientes tengan ganglios positivos o negativos. Este beneficio, como se ha publicado en fecha reciente, se prolonga y es cada vez mayor, incluso 15 años después de su aplicación.
La terapia adyuvante está indicada en todas las pacientes que presentan metástasis a los ganglios axilares en la pieza quirúrgica y en aquéllas con ganglios negativos (pN0), pero con factores de mal pronóstico.
Pacientes con ganglios positivos. Debido al elevado riesgo de recaída en este grupo de enfermas, todas las pacientes deben recibir tratamiento sistémico adyuvante, cualquiera que sea el número de ganglios afectados.
Pacientes con ganglios negativos. A pesar del menor riesgo en general de este grupo, 20% a 30% de las enfermas experimenta una recurrencia de la neoplasia, en especial aquéllas con factores de mal pronóstico. Por consiguiente, los consensos internacionales recomiendan la institución de tratamiento adyuvante sistémico cuando exista al menos uno de los siguientes factores:
Tumor mayor de 1 cm (o mayor de 3 cm si la histología es favorable: mucinoso, tubular y medular)
Paciente con receptores hormonales negativos.
Tumoración con alto grado histológico.
Mujeres menores de 35 años.
Tumor con sobreexpresión del oncogén Her2/neu.
Tumoración con invasión vascular o linfática.
A. ELECCIÓN DEL TRATAMIENTO SISTÉMICO ADYUVANTE
La terapia sistémica debe iniciarse tan pronto como sea posible, de preferencia en la segunda a cuarta semanas después de la extirpación quirúrgica. No se recomienda la utilización simultánea de radioterapia y quimioterapia debido al incremento de la toxicidad. Cuando ambas están indicadas, se inicia primero la quimioterapia y al término de ésta se administra la radioterapia. Tampoco es aconsejable la quimioterapia y la hormonoterapia en forma conjunta; esta última se administra sólo hasta el término de la primera.
Para la elección del tratamiento sistémico, como ya se mencionó, deben considerarse la etapa clínica de la enfermedad, las características histopatológicas y biológicas del tumor, la edad y los factores de morbilidad del paciente, así como la valoración de los receptores hormonales y del oncogén HER2/neu. También es necesario tomar en cuenta el potencial beneficio respecto del riesgo de los efectos colaterales, además de la preferencia y elección de la paciente.
En la actualidad, el tratamiento adyuvante del cáncer mamario requiere de manera indispensable el estudio de los receptores hormonales y el oncogén HER2/neu. No debe escatimarse ningún esfuerzo para reconocer la presencia de estos importantes blancos terapéuticos.
Todas las pacientes con receptores hormonales positivos deben tratarse con hormonoterapia adyuvante, al margen de que se sometan a quimioterapia o no. La hormonoterapia no está indicada en personas con receptores hormonales negativos.
La quimioterapia se recomienda en todas las mujeres con indicación de tratamiento adyuvante, menores de 70 años y sin contraindicación alguna, sin importar cuál sea el resultado de los receptores hormonales. En pacientes mayores de 70 años no hay suficiente evidencia de su beneficio y es preciso individualizar cada caso, sin perder de vista los padecimientos concomitantes y la morbilidad del tratamiento.
Si bien el oncólogo médico debe valorar de forma individual a cada paciente, es recomendable en general lo siguiente en las mujeres elegibles para tratamiento sistémico adyuvante:
1. Pacientes en las que se recomienda quimioterapia adyuvante: menores de 70 años con receptores hormonales negativos.
2. Individuos en los que se recomienda hormonoterapia adyuvante: mayores de 70 años con receptores hormonales positivos.
3. Personas en las que se recomienda quimioterapia más hormonoterapia adyuvante: menores de 70 años con receptores hormonales positivos.
4. Todas las pacientes con sobreexpresión del oncogén Her2/neu por inmunohistoquímica +++ o FISH positivo, deben valorarse para recibir trastuzumab adyuvante, además de la quimioterapia u hormonoterapia.
B. TRATAMIENTO ADYUVANTE CON QUIMIOTERAPIA
La quimioterapia deberá ser indicada y debidamente vigilada por un oncólogo médico, en un área adecuada y con el auxilio de una enfermera especializada en oncología y aplicación de quimioterapia. Es necesario contar siempre con los antieméticos necesarios para reducir la toxicidad digestiva, así como los factores estimulantes de colonias para prevenir o tratar la neutropenia.
La elección del esquema de quimioterapia es todavía controversial; no obstante, las publicaciones más relevantes al respecto se inclinan por tomar decisiones basadas en resultados de meta-análisis recientes. De igual modo, es importante considerar la accesibilidad a los fármacos en cada caso e institución.
Un meta-análisis de múltiples estudios prospectivos de quimioterapia y hormonoterapia adyuvante, con seguimiento de 15 años, demostró el beneficio de la quimioterapia adyuvante, cualesquiera que fueran la edad, el estado de receptores hormonales, el estado menstrual, la afectación ganglionar u otras características.1,2
Los esquemas FAC (5-fluorouracilo, adriamicina y ciclofosfamida) o FEC (5-fluorouracilo, epirrubicina y ciclofosfamida) son aún de primera elección, siempre que no exista alguna contraindicación para el uso de las antraciclinas. Estas combinaciones muestran superioridad en sobrevivencia libre de enfermedad y supervivencia global al compararlas con esquemas previos, como el CMF (ciclofosfamida, metotretaxe y fluoruracilo). El beneficio es más notable en pacientes con ganglios positivos o ganglios negativos y factores de alto riesgo. Se deben administrar seis ciclos con las dosis y periodicidad óptimas.3,4
En cuanto a los combinaciones que incluyen taxanos, un meta-análisis de 13 estudios comparativos de esquemas de antraciclinas con y sin estos fármacos (paclitaxel o docetaxel) demostró un beneficio clínico en la sobrevivencia libre de enfermedad (HR, 0.83; p < 0.00001) y la sobrevivencia global (HR, 0.85; p < 0.00001) en favor de la combinación. El beneficio absoluto a cinco años de seguimiento es de 5% en la reducción del riesgo de recurrencia y de 3% en la sobrevivencia global. Estas reducciones del riesgo no las modificaron el tipo de taxano utilizado, la expresión de receptores estrogénicos, el número de ganglios axilares afectados (N1-3 frente a N4+) o el estado menstrual.5
Entre los esquemas secuenciales recomendados por este panel se encuentran el AC(adriamicina más ciclofosfamida), FAC o FEC por cuatro ciclos, seguidos de paclitaxel semanal por 12 semanas.6-7 También son útiles los esquemas FAC o FEC por tres ciclos, seguidos de docetaxel por tres ciclos más cada tres semanas; estos regímenes han demostrado un claro beneficio en el periodo libre de enfermedad y un modesto beneficio en la sobrevivencia global.8
Entre los esquemas de tratamiento combinados con antraciclinas y taxanos no secuenciales se encuentra el TAC (docetaxel, adriamicina y ciclofosfamida) por seis ciclos9 en aplicación cada tres semanas, el cual mostró mayor beneficio cuando se comparó con el esquema FAC convencional. Sin embargo, la toxicidad hematológica del esquema TAC es considerablemente mayor, por lo que las pacientes requieren apoyo con factores estimulantes de colonias.
Por último, el estudio que comparó el esquema TC (docetaxel más ciclofosfamida) por cuatro ciclos con AC (adriamicina más ciclofosfamida), también por cuatro ciclos mostró con siete años de seguimiento una diferencia en el periodo libre de enfermedad de 81% respecto del 75% y un beneficio en la supervivencia global del 87% frente a 82%, ambos resultados con relevancia estadística. Este esquema de tratamiento (TC) se puede utilizar por seis ciclos,10 siempre y cuando se cuente con factores estimulantes de colonias debido al mayor riesgo de ocasionar neutropenia.
En cuanto al uso de esquemas que contienen taxanos, los pacientes con receptores hormonales negativos o con débil expresión tienen mayor beneficio que las personas con receptores hormonales positivos. Asimismo, hay evidencia de que el cáncer mamario positivo a HER2/neu se vincula con un mayor beneficio clínico de la quimioterapia adyuvante, sea con esquemas que contienen antraciclinas o con taxanos.11
Como última consideración, es importante mencionar que se encuentran bajo valoración las firmas génicas y los predictores moleculares con microarreglos, que permitirán en un futuro elegir de modo más preciso la quimioterapia adyuvante óptima para una paciente en particular.12,13
C. TRATAMIENTO ADYUVANTE CON HORMONOTERAPIA
Premenopáusicas
El tamoxifeno (20 mg/día por cinco años) es el tratamiento de elección en mujeres premenopáusicas con receptores hormonales positivos o desconocidos. La práctica de la ablación o la supresión ovárica, sola o en combinación con tamoxifeno, no se recomienda como tratamiento estándar. El único subgrupo de pacientes que puede beneficiarse del tratamiento de supresión o ablación ovárica son las pacientes que no reciben tratamiento con tamoxifeno.
El uso combinado del inhibidor de la aromatasa más la supresión ovárica debe indicarse sólo en estudios de investigación.
El uso de inhibidores de aromatasa no se recomienda en mujeres premenopáusicas.
Posmenopáusicas
En los últimos años se han publicado diversos estudios multicéntricos multinacionales que comparan el tamoxifeno con los inhibidores de aromatasa en adyuvancia, ya sea de manera directa o en forma secuencial con este fármaco. Los resultados publicados hasta la fecha demuestran un beneficio de los inhibidores de la aromatasa en cuanto a la supervivencia libre de enfermedad de 3.9%, sin efecto sobre la supervivencia, excepto en los estudios secuenciales que demuestran un incremento de ésta de 1.6%. Por consiguiente, la recomendación del consenso consiste en administrar tamoxifeno por dos a tres años seguido de un inhibidor de aromatasa por dos a tres años más.
Por otra parte, a pesar de los resultados mencionados con los inhibidores de aromatasa, el uso de tamoxifeno durante cinco años aún puede considerarse un tratamiento estándar aceptable en mujeres posmenopáusicas con receptores hormonales positivos.
La hormonoterapia adyuvante extendida por más de cinco años (cinco años de tamoxifeno más cinco años de inhibidores de aromatasa) ha demostrado un incremento absoluto de la sobrevivencia libre de enfermedad de 2% a 6%, sin efecto sobre la supervivencia global, por lo que aún no puede considerarse un tratamiento estándar.
Los inhibidores de aromatasa son el tratamiento de elección en mujeres con contraindicación para recibir tamoxifeno, intolerancia a éste o aparición de complicaciones que contraindiquen la continuación de este tratamiento.
Los inhibidores de aromatasa también están indicados en pacientes con a HER2/neu positivo, grupo resistente al tamoxifeno. Por otro lado, en mujeres con intolerancia a los inhibidores de la aromatasa, el tamoxifeno es el tratamiento recomendado.
Se recomienda que las mujeres que reciban inhibidores de la aromatasa se sometan a una prueba de densitometría ósea basal para determinar su riesgo de fracturas, ya que este grupo de fármacos incrementa dicho riesgo.14-18
D. TRATAMIENTO ADYUVANTE CON TERAPIAS BLANCO
Las pacientes con tumores que presentan sobreexpresión de HER2/neu +++ por inmunohistoquímica o FISH positivo (entre 20% y 30% de los carcinomas mamarios) pertenecen a un subgrupo con mal pronóstico y mayor probabilidad de recaída. Sin embargo, la identificación de esta característica como blanco terapéutico ha permitido obtener con el uso del anticuerpo monoclonal trastuzumab por un año, en combinación con la quimioterapia adyuvante, un beneficio muy importante con una reducción del riesgo de recurrencia de 50%, así como de 30% del riesgo de muerte, cuando se compara con el tratamiento estándar de quimioterapia +/- hormonoterapia. Estos resultados se han demostrado ampliamente en cuatro estudios prospectivos multicéntricos internacionales de fase III.19-22
Se recomienda iniciar el trastuzumab adyuvante tempranamente junto con la quimioterapia, pues ha logrado mejores resultados, excepto en caso de utilizarse antraciclinas, ya que su uso simultáneo incrementa la cardiotoxicidad.23
En la actualidad se recomienda que la duración del tratamiento adyuvante con trastuzumab deba ser de un año, ya que las aplicaciones por menor o mayor tiempo no han demostrado mejores resultados o bien no se han publicado aún.24
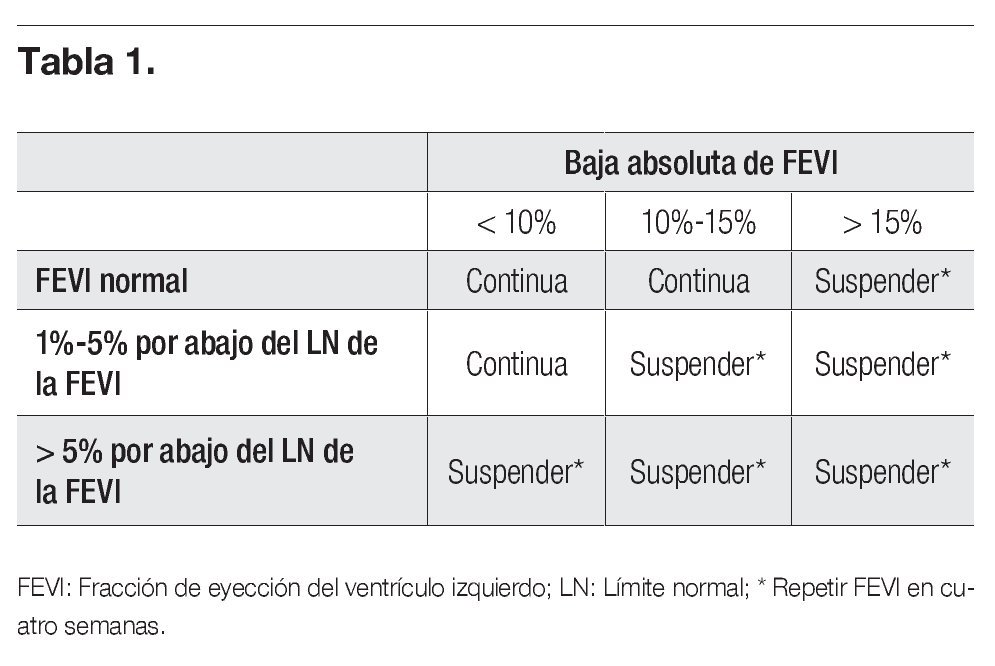
Las pacientes que reciben trastuzumab deben valorarse de forma cuidadosa debido al riesgo de cardiotoxicidad, en especial aquellas con antecedentes personales de enfermedad cardiaca o de alto riesgo. Todas las pacientes sometidas a este fármaco deben vigilarse por medio de ecocardiografía para detectar en fase temprana una disminución de la función ventricular.
En la Tabla 1 se describe la conducta a seguir para la vigilancia cardiológica y el ajuste posológico del fármaco.
¿ VI. REVISIÓN DE LAS GUÍAS INTERNACIONALES SOBRE TRATAMIENTO ADYUVANTE DEL CÁNCER DE MAMA TEMPRANO
Se revisaron las guías del National Comprehensive Cancer Network (NCCN) del año 2010, así como las conclusiones del consenso de St. Gallen 2009, dado que son las más conocidas y consultadas a nivel internacional.1,2 Las guías se basan fundamentalmente en información clínica, histopatológica y molecular del cáncer de mama, de tal manera que al conjuntarla es posible delinear una recomendación óptima.
Entre los elementos más importantes para considerar en el tratamiento adyuvante del cáncer mamario se encuentra el reporte histopatológico de la biopsia o la pieza quirúrgica, que debe contar con los siguientes elementos:
Tamaño de la lesión primaria.
Características histopatológicas completas del tumor.
Afectación ganglionar axilar.
Receptores para estrógenos y progesterona.
Expresión del HER2/neu.
Por otra parte, es de suma importancia la presencia o ausencia de blancos terapéuticos específicos, de forma tal que se pueda clasificar a las pacientes en cuatro grupos de la siguiente manera:
1. Receptores hormonales positivos con HER2/neu positivo.
2. Receptores hormonales positivos con HER2/neu negativo.
3. Receptores hormonales negativos con HER2/neu positivo.
4. Receptores hormonales negativos con HER2/neu negativo.
Con base en lo anterior, las guías internacionales recomiendan considerar el siguiente tratamiento de acuerdo con los diferentes grupos ya mencionados.
Grupo 1: Receptor hormonal positivo con HER2/neu positivo
Axila negativa
Los tumores microinvasores menores de 0.5 cm, o de 0.6 a 1 cm de grado 1, se excluyen del tratamiento adyuvante. En caso de pN1 microscópico es posible considerar la terapia hormonal .
En los tumores de 0.6 a 1 cm de grados 2 a 3 y hallazgos desfavorables se debe considerar hormonoterapia ± quimioterapia (categoría 1) ± trastuzumab (categoría 3).
En tumores mayores de 1 cm está indicada la quimioterapia adyuvante + trastuzumab + hormonoterapia (categoría 1).
Axila positiva
Este grupo las pacientes debe someterse a quimioterapia adyuvante + trastuzumab + hormonoterapia (categoría 1)
Grupo 2: Receptor hormonal positivo con HER2/neu negativo
Axila negativa
Los tumores microinvasores menores de 0.5 cm, o de 0.6 a 1 cm de grado 1, no son objeto de tratamiento adyuvante. En caso de pN1 microscópico, se puede considerar la terapia hormonal.
- En las tumoraciones de 0.6 a 1 cm de grados 2 a 3 y hallazgos desfavorables se debe considerar la hormonoterapia ± quimioterapia (categoría 1).
En tumores mayores de 1 cm está indicada la quimioterapia adyuvante + hormonoterapia (categoría 1).
Axila positiva
Este grupo de pacientes debe recibir quimioterapia + hormonoterapia adyuvante (categoría 1).
Grupo 3: Receptor hormonal negativo con HER2/neu positivo
Axila negativa
En tumores microinvasores menores de 0.5 cm, o de 0.6 a 1 cm de grado 1, se excluyen del tratamiento adyuvante. En caso de pN1 microscópico, puede considerarse la quimioterapia ± trastuzumab (categoría 3).
- En tumores de 0.6 a 1 cm de grados 2 a 3 y hallazgos desfavorables se recomienda la quimioterapia (categoría 1) ± trastuzumab (categoría 3).
En tumores mayores de 1 cm se recomienda la quimioterapia adyuvante + trastuzumab (categoría 1).
Axila positiva
Este grupo de pacientes debe recibir quimioterapia + trastuzumab (categoría 1).
Grupo 4: Receptor hormonal negativo con HER2/neu negativo
Axila negativa
En este grupo, los tumores microinvasores menores de 0.5 cm, o de 0.6 a 1 cm de grado 1, no reciben tratamiento adyuvante. En caso de pN1 microscópico, puede considerarse la quimioterapia.
- En tumores de 0.6 a 1 cm de grados 2 a 3 y hallazgos desfavorables se recomienda la quimioterapia (categoría 1).
En tumores mayores de 1 cm está indicada la quimioterapia adyuvante (categoría 1).
Axila positiva
Este grupo de pacientes debe someterse a quimioterapia adyuvante (categoría 1).
¿ VII. TRATAMIENTO SISTÉMICO NEOADYUVANTE EN PACIENTES CON ESTADIOS OPERABLES
El término neoadyuvancia se refiere al tratamiento sistémico inicial o primario que se administra antes de un tratamiento radical (cirugía o radioterapia).1 En los últimos años se han realizado estudios mediante la administración de quimioterapia como tratamiento inicial en mujeres con estadios operables (tumores mayores de 2.5 cm).2 Los primeros resultados demostraron una discreta mejoría de la sobrevivencia libre de enfermedad, sin efecto sobre la sobrevivencia global al compararla con la resección inicial.3-5 Sin embargo, se observaron algunas ventajas del tratamiento neoadyuvante que se mencionan a continuación:
Inicio temprano de la terapia sistémica.
Modelo in vivo para valorar la sensibilidad al tratamiento.
Se incrementan las posibilidades de practicar una cirugía conservadora.
La obtención de respuestas patológicas completas tras la terapia neoadyuvante tienen valor pronóstico, por lo que es un objetivo a seguir.
Es un modelo excelente para realizar estudios clínicos y valorar la mejor conducta en tratamientos novedosos y específicos.6
Toda paciente elegible para quimioterapia adyuvante es susceptible también de quimioterapia neoadyuvante.
Si bien el tratamiento de quimioterapia neoadyuvante se basa en el uso de antraciclinas, existe evidencia de que la adición de taxanos (docetaxel o paclitaxel) ha incrementado el número de operaciones conservadoras, así como el de respuestas patológicas completas (25% al 31%); siendo esto último un factor pronóstico favorable.7-11
Acerca de la duración de la quimioterapia neoadyuvante, estudios clínicos han señalado que un mayor número de ciclos se relaciona con mejores porcentajes de respuestas patológicas completas, razón por la cual se recomienda aplicar toda la quimioterapia programada (6 a 8 ciclos) antes de la resección.12-14
Por otra parte, se ha informado en fecha reciente que la adición del trastuzumab a la quimioterapia neoadyuvante en pacientes con tumores con sobreexpresión o amplificación del oncogén HER2 es segura e incrementa la tasa de respuestas patológicas completas (41% a 65%) y disminuye las recurrencias,15-17 por lo que se aconseja incorporarlo al tratamiento neoadyuvante por al menos nueve semanas antes de la intervención quirúrgica.15-17
El uso de la terapia endocrina neoadyuvante con tamoxifeno o inhibidores de la aromatasa se emplea casi siempre en mujeres de edad avanzada con tumores hormonosensibles.18 La duración óptima del tratamiento aún no se ha establecido a pesar de que los estudios publicados hasta ahora lo utilizan por tres a cuatro meses antes de la operación.19-21 En la actualidad se recomienda suministrar terapia endocrina neoadyuvante en mujeres con tumores con receptores para estrógeno y progesterona positivos, posmenopáusicas, pacientes con comorbilidades de importancia o personas que declinan la quimioterapia.18
Una vez instituido el tratamiento quirúrgico, y de acuerdo con el reporte histopatológico, se valora la mejor opción terapéutica adyuvante. En caso de pacientes con receptores hormonales positivos está indicada la hormonoterapia por al menos cinco años y, en el caso de los tumores positivos a HER2/neu, el trastuzumab se continúa hasta completar un año.
¿ VIII. TRATAMIENTO SISTÉMICO NEOADYUVANTE EN EL CÁNCER MAMARIO
Las etapas clínicas IIb, IIIa, IIIb y IIIc, incluido el carcinoma inflamatorio, se consideran estadios localmente avanzados. El abordaje diagnóstico incluye una biopsia con aguja de corte y, en caso de muestra insuficiente, biopsia incisional, de tal manera que sea posible realizar la determinación de receptores hormonales, HER2/neu y otros factores pronósticos. La valoración inicial debe incluir una telerradiografía de tórax, ultrasonido hepático y rastreo óseo para descartar enfermedad metastásica en esos sitios.
El tratamiento debe ser multidisciplinario e incluir quimioterapia, resección, radioterapia, hormonoterapia en caso de receptores hormonales positivos y trastuzumab en tumores positivos a HER2/neu.
Al igual que en los estadios operables, la quimioterapia neoadyuvante se basa en la administración de antraciclinas. La utilización de taxanos, ya sea en un esquema con antraciclinas o posterior a éstas, ha
incrementado el número de respuestas objetivas y patológicas completas; esto último es un factor pronóstico favorable para la recurrencia y sobrevida. Se recomienda aplicar toda la quimioterapia programada de forma neoadyuvante para obtener el máximo beneficio clínico.
En fecha reciente se ha comprobado que la administración del trastuzumab más quimioterapia como tratamiento neoadyuvante en pacientes con tumores positivos a HER2/ neu (IHQ +++ o FISH positivo) incrementa las respuestas patológicas completas y el beneficio clínico, por lo que se recomienda su empleo de manera temprana, sobre todo con esquemas que contengan taxanos.1,2
De acuerdo con la respuesta, una vez concluido el tratamiento de quimioterapia neoadyuvante, es posible decidirse por alguna de las siguientes opciones:
1. En las pacientes que presenten una respuesta clínica completa o parcial es necesario llevar a cabo una mastectomía radical modificada. En casos seleccionados en los que exista una respuesta satisfactoria a la quimioterapia de inducción, con reducción del tumor a menos de 3 cm corroborada por clínica e imágenes, puede ofrecerse tratamiento conservador.
2. Una vez aplicado el tratamiento quirúrgico, y con base en los informes del servicio de histopatología de la pieza, se valora la mejor opción terapéutica adyuvante para la paciente. En caso de personas con receptores hormonales positivos está indicada la hormonoterapia por al menos cinco años y, en el caso de tumores positivos a HER2/neu, el trastuzumab debe continuarse hasta completar un año.
3. En caso de enfermedad estable, si el tumor es resecable, debe efectuarse una mastectomía radical; en el caso contrario, se aplica un ciclo mamario completo de radioterapia y, según sea la respuesta, puede intentarse un tratamiento quirúrgico o continuar la terapia sistémica de segunda línea, incluidos la hormonoterapia y el trastuzumab si está indicado.
El uso de la hormonoterapia neoadyuvante con tamoxifeno o inhibidores de aromatasa en pacientes con enfermedad localmente avanzada es una opción que se recomienda sólo en mujeres con receptores hormonales positivos, enfermedad de lento crecimiento y toxicidad inaceptable de la quimioterapia, en particular en aquéllas de edad avanzada. En estos casos es posible iniciar con hormonoterapia y, si se consigue una respuesta objetiva, se instituye tratamiento local de ser posible. Se valora la posibilidad de continuar con hormonoterapia o quimioterapia adyuvante de acuerdo con el reporte del servicio de patología, la respuesta previa y las condiciones de la paciente.
En las mujeres con tumores triple negativo la quimioterapia neoadyuvante o adyuvante se aplica del mismo modo que en los otros tipos tumorales.
¿ IX. TRATAMIENTO SISTÉMICO DEL CÁNCER MAMARIO METASTÁSICO O RECURRENTE
El cáncer mamario metastásico es una enfermedad heterogénea con manifestaciones clínicas variables, cuyo tratamiento depende del sitio y el número de las metástasis, así como de las características del huésped incluidas la sensibilidad o la resistencia a los tratamientos médicos oncológicos previos. Desafortunadamente, esta etapa de la enfermedad aún no es curable; sin embargo, se ha observado en las dos últimas décadas una mejoría notable de la supervivencia coincidente con la introducción de novedosos y más eficaces tratamientos sistémicos.1-3
Los objetivos del tratamiento en el cáncer mamario metastásico son los siguientes:
1. Prolongar el intervalo libre de evolución y la sobrevivencia global.
2. Paliación de los síntomas relacionados con la enfermedad.
3. Mantener una adecuada calidad de vida con buen estado funcional.
El oncólogo médico debe seleccionar la mejor medida terapéutica y tomar en cuenta las características y la biología del tumor, además de los factores clínicos de la paciente, con lo cual es posible determinar el tratamiento más adecuado para cada caso en particular. Estos factores incluyen los siguientes:4-5
Edad.
Síntomas.
Estado funcional.
Enfermedades concomitantes.
Intervalo libre de enfermedad.
Agresividad de la tumoración.
Sitio, número y volumen de las metástasis.
Tratamiento previo y respuesta a él.
Receptores hormonales y sobreexpresión del HER2/neu.
Predilección del paciente.
De acuerdo con sus características, todas las pacientes con enfermedad metastásica deben recibir tratamiento sistémico.
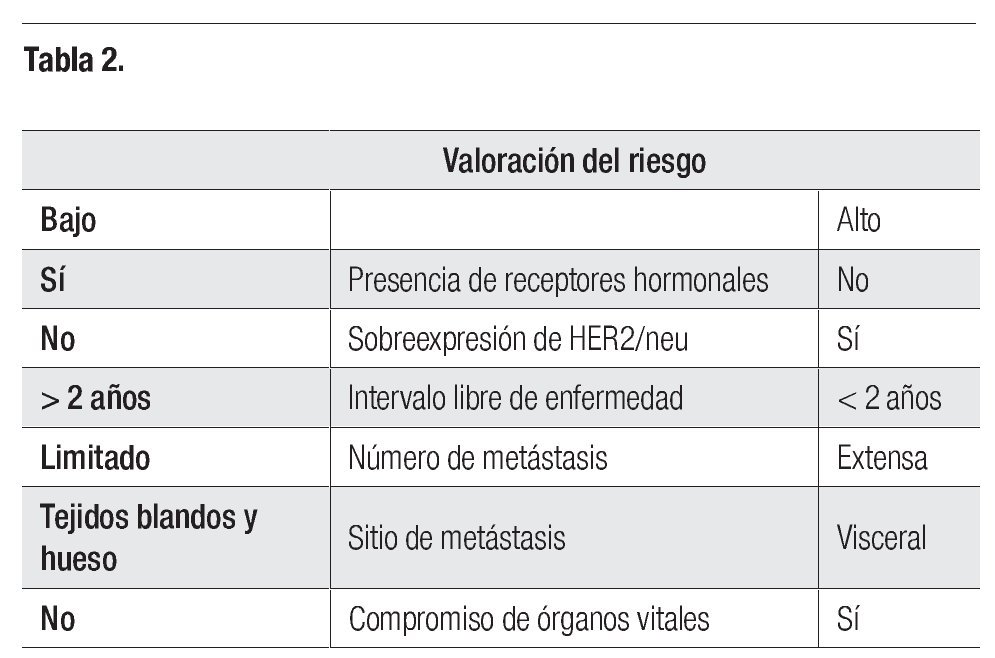
Si se considera la heterogeneidad del cáncer de mama metastásico, éste se puede presentar con diferentes factores de mayor o menor riesgo de agresividad, los cuales debe tomar en cuenta el oncólogo médico para elegir el tratamiento óptimo en cada caso (Tabla 2).
TRATAMIENTO DE ACUERDO CON EL RISGO
Las personas con bajo riesgo son casi siempre hormonosensibles, por lo que la hormonoterapia es la primera opción terapéutica. Esta recomendación se basa en una menor toxicidad, duración de la respuesta generalmente prolongada y falta de diferencias en la sobrevivencia global en comparación con la quimioterapia.6 Por el contrario, las de alto riesgo deben iniciar tratamiento con quimioterapia +/- terapia blanco.
1. Bajo riesgo. Las características de las pacientes elegibles para el tratamiento inicial con hormonoterapia son las siguientes:
Receptores hormonales positivos (condición obligada): RE + y/o RP+
Supervivencia libre de enfermedad prolongada (> 2 años).
Metástasis en tejidos blandos o hueso.
Sin metástasis viscerales (o limitadas)
Enfermedad metastásica de lenta evolución.
2. Alto riesgo. Las características de las pacientes aptas para el tratamiento inicial con quimioterapia +/- terapias blanco son:
Tumor Her2/neu +++ (o Fish+).
Receptores hormonales negativos.
Tumores hormonorresistentes.
Intervalo libre de enfermedad menor de 12 meses.
Presencia de metástasis viscerales.
Síntomas que exigen una rápida respuesta paliativa.
Hormonoterapia en el cáncer mamario metastásico (bajo riesgo)
El control con terapia hormonal, cuando está indicado, depende del estado menstrual, premenopausia o posmenopausia, sin perder de vista los siguientes criterios razonables de menopausia:7
Edad ≥ 60 años.
Edad < 60 años con amenorrea de 12 meses sin relación con QT/HT y con FSH y estradiol en niveles posmenopáusicos.
En el caso de la menopausia inducida por quimioterapia (30% a 80% de los casos) hay que verificar el estado hormonal por medio de cuantificación de estrógenos (estrógenos < 50 pg/ml; estradiol < 30 pg/ml). Esta medición debe repetirse para corroborar el estado menstrual a los seis y 12 meses.
TRATAMIENTO HORMONAL EN PACIENTES PREMENOPÁUSICAS
El tamoxifeno es el tratamiento de elección de primera línea en pacientes sin hormonoterapia previa. En caso de progresión a este fármaco, pero con respuesta inicial objetiva, o bien cuando las pacientes han recibido terapia adyuvante reciente con este agente, se puede indicar la ablación ovárica (química o quirúrgica) acompañada de inhibidores de aromatasa, siempre que sea posible.8-10
TRATAMIENTO HORMONAL EN PACIENTES POSMENOPÁUSICAS
El tratamiento de primera línea con tamoxifeno o inhibidores de aromatasa es la medida recomendada. La elección guarda relación con la disponibilidad de los fármacos y afecciones comórbidas de las pacientes; en el caso de una administración anterior de tamoxifeno, los inhibidores de aromatasa son la indicación de segunda línea.11-16 Si las pacientes ya recibieron tamoxifeno e inhibidores de aromatasa no esteroideos (anastrozol o letrozol), una opción terapéutica más con la que se cuenta son los inhibidores de aromatasa esteroideos (exemestano)17 o un antiestrógeno puro (fulvestrant).18-23
En las pacientes con respuesta o claro beneficio clínico inicial con hormonoterapia, y que progresan a una primera línea, debe intentarse una segunda e incluso tercera línea hormonal, según fuera la conducta terapéutica utilizada con anterioridad, ya que a menudo se obtiene de nueva cuenta una respuesta tumoral.17-23 En caso de resistencia comprobada al tratamiento hormonal se debe cambiar a la quimioterapia.
Por último, es necesario considerar la posibilidad de suministrar un inhibidor de aromatasa más trastuzumab o lapatinib en pacientes con receptores hormonales positivos y HER2/neu positivo, siempre que la quimioterapia esté contraindicada o la paciente no la acepte.24-25
En el caso de individuos de riesgo alto pero con receptores hormonales positivos sometidos antes a quimioterapia hasta un máximo beneficio, debe continuarse con la hormonoterapia de mantenimiento de acuerdo con el estado menstrual hasta la progresión.
Quimioterapia y terapias blanco en el cáncer mamario metastásico (alto riesgo)
Las pacientes de alto riesgo se clasifican en tres grupos:
1. Con Her2/neu negativo o desconocido.
2. Con Her/2 neu positivo (inmunohistoquímica +++ o FISH positivo).
3. Pacientes triple negativo (receptores de estrógenos, progesterona y HER2/neu negativos).
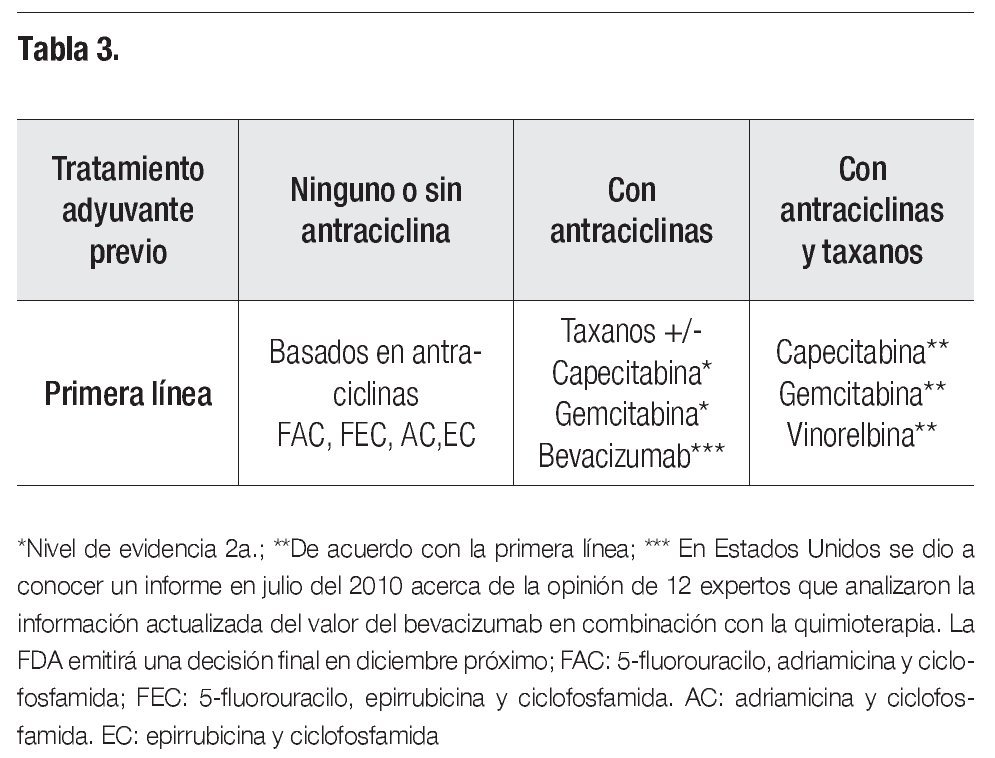
1. Tratamiento sistémico en pacientes con HER2/neu negativo o desconocido. (75-80% de los casos). A pesar de la gran experiencia de muchos años en el tratamiento con quimioterapia en el cáncer mamario metastásico, no existe un régimen estándar de primera línea para las pacientes con tumores negativos a Her2/neu no hormonosensibles. Para elegir el mejor tratamiento se deben considerar varios factores, entre ellos el tratamiento adyuvante previo si lo hubo (Tabla 3) y el intervalo de terminación de la adyuvancia (más o menos de un año), ya que en aquellas pacientes con recurrencia luego de un año, la primera línea de quimioterapia puede incluir fármacos suministrados en la adyuvancia.
Por otra parte, en las pacientes con síntomas evidentes o metástasis viscerales de progresión rápida, la terapia de elección es la combinación con mayores porcentajes de respuesta y paliación. El oncólogo médico debe tomar en cuenta las características de la paciente, anomalías comórbidas, síntomas a paliar y disponibilidad de los fármacos. La piedra angular de los esquemas de primera línea son los que contienen antraciclinas.26-28 Sin embargo, debido a que un porcentaje elevado de pacientes ya las recibieron con la adyuvancia es posible valorar otros esquemas, tres de los cuales están aprobados. En dos de ellos, los resultados produjeron mayor supervivencia global e intervalo libre de progresión (docetaxel/capecitabina y paclitaxel/gemcitabina), en comparación con el taxano solo,29-31 mientras que el tercero (la combinación de bevacizumab más paclitaxel o docetaxel) sólo prolongó el intervalo libre de progresión respecto del taxano en monoterapia.32-33
Si, por el contrario, no existen síntomas importantes a paliar, enfermedad no visceral o de lenta evolución, se puede elegir un tratamiento secuencial, de manera inicial con monoterapia (taxano)34-37 o capecitabina (en pacientes que recibieron el taxano en la adyuvancia).38-41
La duración del tratamiento no se ha definido bien.42 Sin embargo, por lo general se utiliza hasta un beneficio máximo y depende del fármaco aplicado (intravenoso frente a oral, dosis máximas acumuladas, etc.), toxicidad y calidad de vida de las pacientes.
2. Tratamiento sistémico en pacientes con HER2/neu positivo (IHQ+++ o FISH positivo). Éste es un grupo de pacientes (20% a 30% del total) que tiene como característica una pobre respuesta a algunos fármacos quimioterapéuticos y hormonales, así como una evolución más agresiva. Sin embargo, la presencia de este blanco terapéutico, el Her2/neu, permite un tratamiento dirigido.
El tratamiento recomendado de primera línea es la combinación de un taxano (docetaxel o paclitaxel) + trastuzumab. Este esquema ha demostrado mayor número de respuestas, así como una mayor sobrevivencia en comparación con la quimioterapia sola. Es importante mencionar que las antraciclinas no deben utilizarse de forma simultánea con el trastuzumab debido al evidente incremento reportado de cardiotoxicidad.
En pacientes con falla o progresión a una combinación de quimioterapia con trastuzumab, en el contexto de la enfermedad metastásica, se ha observado que el blanco terapéutico, el HER2/neu, es aún sensible, por lo que se puede valorar la continuación con lapatinib más capecitabina, combinación que demostró una reducción significativa del riesgo de progresión y un incremento del tiempo a ésta en comparación con la capecitabina sola.43 También es posible proseguir el trastuzumab al cambiar la quimioterapia (a capecitabina o vinorelbina) o bien al combinarlo con lapatinib (combinación sin quimioterapia).44
3. Pacientes "triple negativos" (receptores de estrógenos, progesterona y HER2/neu negativos). Este grupo se caracteriza por un pobre pronóstico, además de que la terapia antihormonal y los anticuerpos dirigidos al factor de crecimiento epidérmico no son útiles. En virtud de la importancia que significa desde el punto de vista terapéutico y pronóstico, es sumamente importante contar con estudios confiables de determinación de receptores y HER2/neu.
Las pacientes con tumores triple negativo tienen como única opción terapéutica la quimioterapia, pero en la actualidad no es posible recomendar un esquema específico. En múltiples estudios prospectivos actuales se han incluido esquemas que contienen platino y otros citotóxicos, así como terapias blanco (bevacizumab, cetuximab, erlotinib, desatinib, etc.), pero aún no se pueden recomendar más allá de un estudio clínico.
¿ X.TRATAMIENTO SISTÉMICO CON QUIMIOTERAPIA EN PACIENTES CON CÁNCER MAMARIO METASTÁSOCP RESISTENTE A ANTRACICLINAS Y TAXANOS
Las pacientes con indicación de tratamiento sistémico, y cuya enfermedad opone una resistencia probada a las antraciclinas y los taxanos, pueden recibir quimioterapia con alguno de los siguientes fármacos, los cuales en general tienen la misma posibilidad de respuesta (casi 30%):
Citotóxicos
Capecitabina
Gemcitabina
Vinorelbina
Doxorrubicina pegilada
Ixabepilona
Abraxano
Agentes biológicos
Bevacizumab
Es importante señalar que la enfermedad no es curable en estas condiciones clínicas y por lo tanto la relación riesgo-beneficio debe valorarse de manera cuidadosa y tomar en consideración la toxicidad y las posibilidades de respuesta.
Asimismo, se ha reconocido que al emplear combinaciones (dobletes) es posible alcanzar un aumento discreto en la respuesta, cercano a 35% a 44%, si bien a costa de un incremento notorio de la toxicidad en comparación con la monoterapia.1-7
¿ XI. BIFOSFONATOS
Los bifosfonatos son análogos del pirofosfato, inhibidores potentes de la resorción ósea por los osteoclastos. Son efectivos en el tratamiento de las metástasis óseas, la hipercalcemia relacionada con procesos malignos, así como la osteoporosis posmenopáusica.1-6
BIFOSFONATOS EN LAS METÁSTASIS ÓSEAS
En el caso de las metástasis óseas se recomienda el uso de bifosfonatos, con o sin radioterapia, quimioterapia u hormonoterapia, ya que han demostrado una reducción de los efectos esqueléticos en 14% y la hipercalcemia, además de una mejoría significativa del dolor y la calidad de vida, objetivo fundamental del tratamiento paliativo, a pesar de no modificar la sobrevivencia.7-10
Los pacientes con evidencia radiográfica de metástasis óseas deben recibir tratamiento, ya sea con ácido zoledrónico (4 mg IV en 15 min) o pamidronato (90 mg IV en 2 horas) cada tres a cuatro semanas por un periodo de dos años; la posibilidad de continuarlo depende de la presencia o ausencia de enfermedad ósea y la función renal.
A pesar de que existe una ventaja en favor del ácido zoledrónico sobre el pamidronato, no es suficiente para alcanzar relevancia estadística en un estudio de fase III (p = 0.058) por lo que la evidencia actual es insuficiente para apoyar la superioridad de un fármaco sobre otro en países en donde ambos están aprobados.8
BIFOSFONATOS EN LA ADYUVANCIA
El uso de los bifosfonatos como terapia adyuvante para prevenir metástasis óseas es inconsistente y su efectividad permanece incierta, por lo que en la actualidad no puede recomendarse.2-3
PÉRDIDA ÓSEA RELACIONADA CON LOS INHIBIDORES DE AROMATASA
Los inhibidores de aromatasa causan pérdida ósea, lo cual se ha demostrado en los diferentes estudios de hormonoterapia adyuvante en los cuales el índice de fracturas es mayor en comparación con el tamoxifeno. Los bifosfonatos han demostrado ser efectivos en la prevención de la pérdida mineral ósea relacionada con el tratamiento prolongado con inhibidores de la aromatasa en pacientes posmenopáusicas,4-6 por lo que se recomienda la aplicación del ácido zoledrónico cada seis meses.
¿ XII. TRATAMIENTO DEL CÁNCER MAMARIO EN PACIENTES DE EDAD AVANZADA
Este grupo de pacientes es cada vez más frecuente en México debido al envejecimiento de la población. Existe evidencia de que la enfermedad a esta edad es por lo general menos agresiva, ya que corresponde a tumores con baja tasa de proliferación, receptores positivos, alta frecuencia de diploidía, baja expresión de HER2/neu y baja frecuencia de mutación de p53. Sin embargo, existe también un grupo de pacientes en esta edad con receptores negativos o HER2/ neu positivo.
Por otra parte, en esta población de sujetos de edad avanzada, el estado funcional y las enfermedades concomitantes pueden dificultar un tratamiento agresivo, por lo que se recomienda valorar cada caso de acuerdo con escalas geriátricas validadas en pacientes oncológicos (ADL, Activities of Daily Living o CGA, Comprenhensive Geriatric Assessment)
TRATAMIENTO ADYUVANTE
La administración hormonal es el tratamiento de elección para pacientes con receptores positivos. En individuos con receptores negativos se recomiendan seis ciclos de quimioterapia con esquemas que contengan antraciclinas en ausencia de afección cardiaca. Se aconseja agregar taxanos a las antraciclinas en pacientes de alto riesgo.
La combinación de docetaxel y ciclofosfamida puede reemplazar a los esquemas con antraciclinas. En pacientes con HER2/neu +++ por IHQ o FISH positivo se debe valorar el posible beneficio del trastuzumab sin evitar su potencial cardiotoxicidad.
TRATAMIENTO PALIATIVO
El tratamiento hormonal es la indicación para pacientes con receptores hormonales positivos. En individuos con receptores hormonales negativos o resistentes a la hormonoterapia se recomienda la quimioterapia. Son preferibles los esquemas con monofármaco sobre la quimioterapia combinada.
Dado que la quimioterapia es paliativa, la calidad de vida es fundamental y, en consecuencia, debe evitarse una toxicidad excesiva. En pacientes con Her2/ neu +++ por IHQ o FISH positivo hay que valorar el posible beneficio del trastuzumab y considerar su cardiotoxicidad.1-6
¿ XIII.TRATAMIENTO SISTÉMICO DEL CÁNCER MAMARIO EN EL HOMBRE
El cáncer mamario en el hombre es una entidad poco frecuente. En Estados Unidos se diagnostican cada año alrededor de 1 000 casos y en México entre 50 y 60, lo cual representa en este último país el 0.44% de los cánceres mamarios con una proporción hombre:mujer de 1:228.1-3
Por lo regular, estos tumores corresponden a carcinomas ductales y sólo se han reportado carcinomas lobulillares en presencia de síndrome de Klinefelter.4 La gran mayoría (80% a 90%) tiene receptores estrogénicos positivos con porcentaje bajo (7%) de receptores de progesterona y mutación del HER2/neu (11%). La mitad muestra receptores androgénicos.4
La edad media de presentación es de 60 años en Estados Unidos y de 64 años en el Reino Unido. La mastografía y el ultrasonido tienen igual sensibilidad que en las mujeres.5 Se diagnostican en etapas localmente más avanzadas respecto de estas últimas y es frecuente que estén fijados a la piel o la parrilla costal, lo que representa un mayor riesgo de recurrencia local.1
El tratamiento consiste la mayoría de las veces en mastectomía radical modificada seguida de radioterapia.6 La quimioterapia y hormonoterapia tienen las mismas indicaciones que en el cáncer de mama de la mujer. El factor pronóstico más importante es la presencia de metástasis ganglionares y no hay diferencia en la sobrevivencia tras comparar etapa por etapa con las mujeres.7
Debido al elevado porcentaje de expresión de receptores hormonales, la hormonoterapia ocupa un papel importante en el tratamiento adyuvante. Al igual que en las mujeres, el tamoxifeno reduce el riesgo de recurrencia y muerte. Se desconoce el valor de los inhibidores de la aromatasa por lo que no se recomienda su uso.
El tratamiento neoadyuvante, al igual que en las mujeres, debe incluir quimioterapia y, de acuerdo con la respuesta clínica y patológica, pueden estar indicados la resección, la radioterapia y el tratamiento adyuvante. No obstante, en virtud del elevado porcentaje de receptores hormonales positivos, el tratamiento neoadyuvante con tamoxifeno puede considerarse sobre todo en pacientes de edad avanzada o con trastornos comórbidos de consideración.
En la enfermedad metastásica, debido a que la mayoría tiene receptores hormonales positivos, se considera que el tamoxifeno es el tratamiento de elección, excepto en los casos en que es más conveniente iniciar con quimioterapia debido a la agresividad o localización de la enfermedad. En pacientes hormonorrefractarios está indicada la quimioterapia con los mismos esquemas y dosis que los utilizados en la mujer.
En pacientes con tumores HER2/neu +++ por IHQ o FISH positivo no hay información suficiente para recomendar el uso del trastuzumab, razón por la cual su indicación queda a criterio del oncólogo médico.
¿ XIV. SEGUIMIENTO POSTERIOR AL TRATAMIENTO PRIMARIO
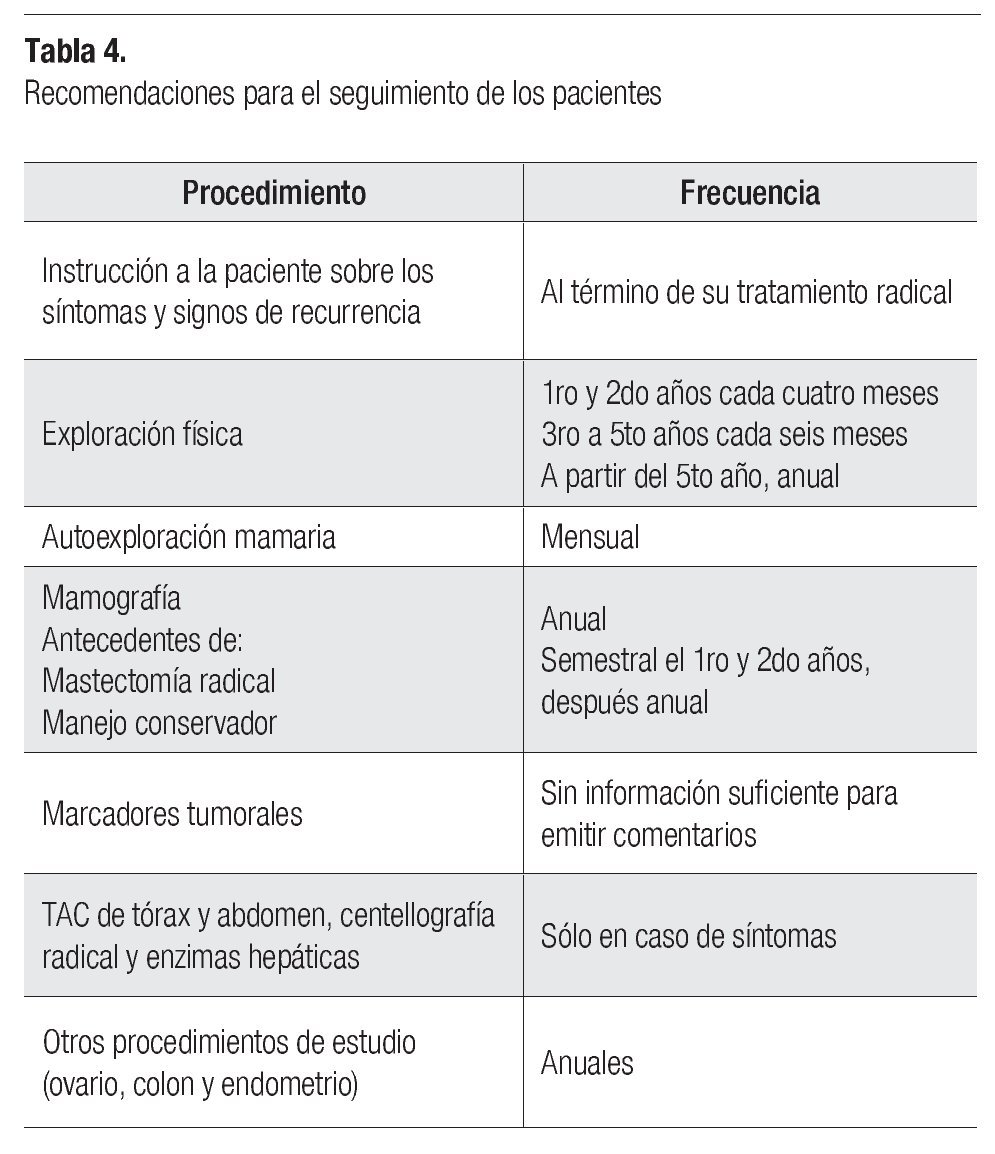
Al concluir el tratamiento primario para el cáncer mamario, por lo general por medios quirúrgicos, quimioterapia o radioterapia, inicia la etapa de vigilancia y control denominada "seguimiento". El objetivo principal en esta fase es diagnosticar en forma temprana las recurrencias locales o sistémicas de la enfermedad con la finalidad de instituir oportunamente un tratamiento adecuado.1-7
En la Tabla 4 se describen las recomendaciones aceptadas en el plano internacional para el seguimiento de estas pacientes.
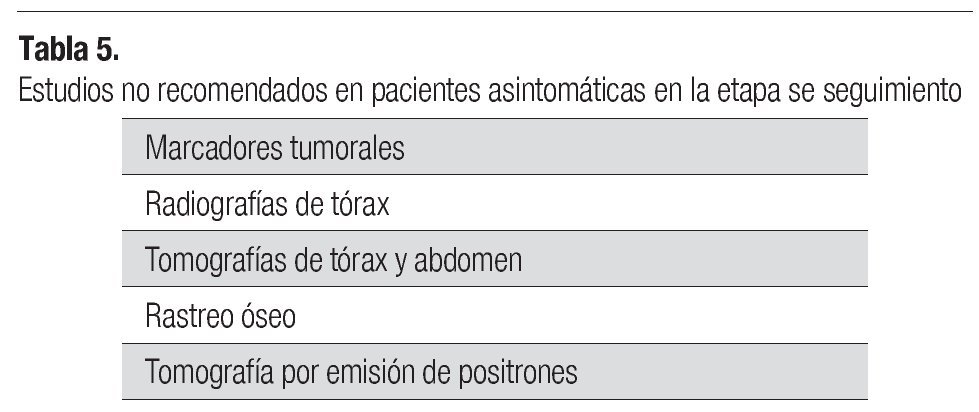
La aparición de metástasis luego del tratamiento primario adecuado escapa al control del médico y el establecimiento oportuno del diagnóstico no incrementa ni la sobrevivencia ni la calidad de vida. En la Tabla 5 se incluyen los estudios no recomendados en pacientes asintomáticas y en seguimiento.8-15
¿ XV. NUEVOS FÁRMACOS EN FASE DE INVESTIGACIÓN
El proceso de investigación clínica con nuevos fármacos en oncología clínica, en particular en el cáncer mamario, genera numerosas y variadas publicaciones que deben valorarse de modo cuidadoso, tanto en su metodología como en el correcto análisis e interpretación de resultados y conclusiones.1,2
En la actualidad se realizan estudios controlados de investigación clínica con nuevos fármacos; destacan, por sus resultados iniciales promisorios, los siguientes: abraxano, ixabepilona, patupilona, inhibidores de PARP, inhibidores de la tirosinacinasa HER1 y 2 y anti-VEGF, e inhibidores de la dimerización de HER2 como anticuerpos bioespecíficos, inhibidores HSP-90, inhibidores IGF-R, inhibidores de la histona deacetilasa (HDAC), inhibidores de la cinasa P-13, inhibidores de la proteínquinasa (AKT) e inhibidores m-TOR.3,4
A continuación se mencionan de forma sinóptica algunos ejemplos dentro de un gran espectro de fármacos nuevos:
- El abraxano es una nanopartícula del paclitaxel unida a albúmina que produce menor toxicidad y cuyos resultados de eficacia son muy alentadores.
- La ixabepilona es un agente antineoplásico antimicrotúbulo utilizado a razón de 40 mg/m2 cada tres semanas. Varios estudios de fase III ya han demostrado su efectividad (TITAN BRE 145, PACS 08) y está aprobado en México para el tratamiento del cáncer de mama metastático después de la falla de las antraciclinas y los taxanos en combinación con capecitabina y después del fracaso de las antraciclinas, taxanos y capecitabina como monoterapia.5,6
- La patupilona, a razón de 10 mg/m2 semanal, se ha reportado en un estudio de fase II en pacientes con cáncer mamario que ha emitido metástasis al sistema nervioso central (SNC).
- En cuanto a los inhibidores de PARP, destaca el olaparib, sustancia poli-(ADP-ribosa) polimerasa-1 (PARP-1) que produce enlace entre DNA y proteínas; su función consiste en bloquear la reparación del DNA con la finalidad central de potenciar el efecto de la quimioterapia (estudio BSI-201).
- El sorafenid es un inhibidor de tirosinacinasa y en el estudio SOLTI-0701 multinacional se comparó el sorafenib + capecitabina frente a la capecitabina sola.
¿ XVI.FIRMAS GENÓMICAS EN EL CÁNCER MAMARIO
La heterogeneidad biológica del cáncer mamario tiene implicaciones para el pronóstico y las decisiones terapéuticas. Hoy en día, tanto el pronóstico como el tratamiento se basan en una serie de parámetros clínicos y patológicos: edad, estado de los ganglios linfáticos axilares, tipo y grado histológicos, tamaño del tumor, estado de los receptores hormonales y del oncogén HER2, entre otros más.
Un nuevo campo de estudio es la clasificación del cáncer mamario mediante el análisis de expresión de múltiples genes en tumores individuales, con el objeto de obtener una mejor información pronóstica y predictiva, lo cual puede ayudar al médico tratante a tomar decisiones terapéuticas personalizadas.
En esencia, existen dos metodologías para la valoración de los perfiles génicos: un perfil de expresión génica por medio de microarreglos de DNA, que requiere tejido congelado o fresco y el uso de RT-PCR para cuantificar la expresión de los genes seleccionados de manera prospectiva sobre el tumor en parafina.
EL MAMMAPRINT O FIRMA DE ÁMSTERDAM
En la serie publicada hasta la fecha se analizó de forma inicial una serie de 117 tumores que después se validaron en una cohorte de 295 carcinomas de mama en estadios I-II con arreglo al perfil pronóstico de 70 genes relacionados con el ciclo celular, la angiogénesis y la invasividad. Este conjunto de genes permitió clasificar a los tumores en malformaciones de mal pronóstico (n = 180) o buen pronóstico (n = 195).1,2 El perfil genético mostró a 10 años diferencias entre los grupos de bueno y mal pronóstico en la sobrevivencia global (95% frente a 55%) y sobrevivencia libre de metástasis (85% frente a 51%), respectivamente. En el análisis multivariado, el perfil de expresión génica tumoral fue un indicador evolutivo más poderoso que los criterios pronósticos clínicos e histológicos. Este perfil génico de 70 genes se ha validado con posterioridad en una serie de pacientes sin afectación ganglionar axilar.1-13
LA FIRMA DE ROTTERDAM
La denominada firma de Rotterdam (índice de grado genómico) se describió en una serie inicial de 286 carcinomas de mama con ganglios negativos que no habían recibido quimioterapia adyuvante.14 Se obtuvo una firma molecular constituida por un conjunto de 76 genes relacionados con ciclo celular, progresión tumoral y proliferación. Estos 76 genes se dividieron en un conjunto de 60 genes con valor pronóstico en tumores RE+ y otro conjunto de 16 genes con valor pronóstico en los carcinomas RE-. Los resultados se han validado en un ensayo multicéntrico que incluyó a 180 pacientes.15 Tras corregirse por los factores pronósticos habituales, permitió distinguir a grupos de pacientes que desarrollaron metástasis a 10 años: 94% frente a 65%.
ONCOTYPE-DX
En la actualidad, una limitación importante en los estudios de expresión génica es la obtención de un número suficiente de tumores en fresco o congelados. La utilización de muestras fijadas en formol e incluidas en parafina, tal y como se conservan de forma sistemática en los servicios de anatomía patológica, tiene como principal ventaja el acceso a grandes series de pacientes, lo que hace posible seleccionar retrospectivamente una casuística cuyo seguimiento y desenlace se conocen.
Un trabajo pionero en la utilización de muestras parafinadas fue el de Cronin y colaboradores,16 en el que se analizaron especímenes de cáncer de mama fijados en formol e incluidos en parafina mediante la técnica de RT-PCR. En una base de los resultados obtenidos en este estudio, Paik y colaboradores11 analizaron 651 muestras de pacientes con carcinoma de mama con ganglios positivos y receptores hormonales también positivos. En este trabajo, los autores identificaron un perfil de expresión que predice el riesgo no sólo de recurrencia sino tambien el beneficio de la hormonoterapia (tamoxifeno) o quimioterapia (CMF) en el cáncer mamario.
En base con estos resultados se ha diseñado una prueba que incluye 21 genes (16 genes objetivo participantes del desarrollo del cáncer de mama y cinco genes de referencia) que se han patentado con el nombre de Oncotype-DX y que ha posibilitado el diseño de un algoritmo predictivo de riesgo basado en tres grados de pronóstico: alto (>30% de riesgo de recurrencia), intermedio (≥ 18% y ≤ 30%) y bajo ( <18 la expresión elevada de genes favorables como el grupo los regulados por receptor estrógenos gstm1 o bag1 resulta en una puntuación recurrencia baja mientras que desfavorables her2 relacionados con invasión y cd68 genera 17
El Oncotype-DX, ya accesible comercialmente en México hoy día, ha mostrado no sólo la capacidad pronóstica sino también predictiva del beneficio obtenido con el tamoxifeno. Para el caso de la hormonoterapia, el estudio de su comportamiento en el brazo de control (tamoxifeno solo) del ensayo B-14 mostró que las pacientes con recurrencia de puntuación alta no se beneficiaban del tratamiento con este fármaco, en tanto que los grupos de puntuación baja o intermedia obtenían un beneficio sustancial.18
Aún más importante es la capacidad de la prueba de predecir el beneficio de la quimioterapia adyuvante en las pacientes con una puntuación de recurrencia alta. Este aspecto se ha estudiado en los casos del protocolo NSABP B-20 que incluyó a pacientes sin afectación ganglionar y receptores hormonales positivos tratadas con tamoxifeno, con o sin quimioterapia adicional (CMF o MF). Los datos obtenidos en un subgrupo de 651 individuos con bloques de parafina disponibles mostraron que los casos con una puntuación alta presentaban un notorio beneficio de la quimioterapia adyuvante (HR: 0.26, disminución de la recurrencia a 10 años: 27%), mientras que aquéllos con una puntuación de recurrencia baja no consiguieron ninguna ventaja con la utilización de la quimioterapia. Por otro lado, en el importante subgrupo con puntuación intermedia no fue posible inferir conclusiones.19,20
En la actualidad se lleva a cabo un ensayo clínico prospectivo que emplea el Oncotype-DX para decidir el tratamiento adyuvante y que incluye a mas de 10 mil pacientes con cáncer temprano, receptores hormonales positivos, ganglios axilares negativos y HER2/neu negativo (TAILORx). Las pacientes con riesgo bajo recibirán sólo tamoxifeno, las de riesgo alto quimioterapia más tamoxifeno y las de riesgo intermedio se aleatorizarán para someterse a tamoxifeno o quimioterapia más tamoxifeno, dado que es el grupo cuyo beneficio del estudio aún no se ha definido. 21-26
Derivado de los múltiples ensayos en curso actual, en los próximos años estará disponible información sobre el verdadero alcance clínico de estas nuevas herramientas moleculares, las cuales están enfocadas en el pronóstico y la selección del tratamiento adyuvante personalizado más efectivo.27
¿ XVII. AVANCES Y FUTURO DEL TRATAMIENTO MÉDICO DEL CÁNCER MAMARIO
En el área de oncológica médica, la década pasada permitió observar el desarrollo de nuevos agentes quimioterapéuticos muy importantes, incluidos los taxanos y las epotilonas, así como la modernización de agentes ya conocidos como los inhibidores de pirimidinas (capecitabina y gemcitabina). Por otra parte, en los últimos años se dispone ya de cinco nuevos agentes hormonales: goserelina, anastrozol, letrozol, exemestano y fulvestrano. Éstos, junto con el tamoxifeno, son el pilar del tratamiento en pacientes con tumores con receptores hormonales positivos y su utilización ha mejorado en forma significativa los resultados logrados con anterioridad.
Quizá uno de los avances más importantes es que la comprensión de la biología y la genética tumoral ha aumentado de manera exponencial. A fines de la década pasada y principios de ésta se incorporaron a los tratamientos con quimioterapia y hormonales, tratamientos blanco y biológicos, como las nuevas terapias en cáncer mamario. Estos agentes se sintetizan en el laboratorio y se dividen en anticuerpos monoclonales humanizados o quiméricos (trastuzumab y bevacizumab), inhibidores de la tirosinacinasa (lapatinib, sorafenid, sunitinib) o inhibidores de la formación de microtúbulos resistentes a la glucoproteína P (ixabepilona), caracterizados por contrarrestar uno o varios mecanismos que emplea la célula tumoral para reproducirse, movilizarse, invadir o crear nuevos vasos sanguíneos. Los inhibidores de poli(ADP-ribosa) polimerasa (PARP) son el último grupo de fármacos biológicos Estos agentes se han incorporado de forma paulatina al tratamiento del cáncer mamario hereditario y representan un gran potencial en la atención de los pacientes con tumores "triple negativos".1
Los avances en biología tumoral han permitido la disección del genoma humano con la finalidad de identificar los genes que ocasionan la enfermedad. Esta información se encuentra en aproximadamente 25 000 genes, 300 000 polimorfismos mononucleotídicos (SNP) y en 1.5 millones de proteínas; ahora se estudia la manera de identificar las firmas que se relacionan con ciertos tipos o estadios de cáncer, así como el pronóstico y la posibilidad de respuesta al tratamiento propuesto. La identificación de estos biomarcadores genéticos o proteínicos en los pacientes con cáncer podría conducir a la prevención y el diagnóstico temprano del trastorno, además de la selección de tratamientos más efectivos para un paciente en particular.
En el cáncer mamario, mediante agrupaciones de firmas genéticas, es posible reunir genes de acuerdo con su activación o falta de ésta. Este ordenamiento permite describir cuatro o cinco fenotipos y clasificarlos en diferentes subgrupos que, mediante distintos tratamientos para cada uno, han sentado las bases de la "medicina personalizada". Esta selección de tratamientos basados en la firma o sello genético se encuentra ya comercializada (Mammaprint y Oncotype-DX). El Oncotype-DX no sólo ha demostrado capacidad pronóstica, sino también predictiva del beneficio obtenido con el tamoxifeno, ya que por ejemplo en el brazo de control (tamoxifeno solo) del ensayo B-14 las pacientes con riesgo de recurrencia alto no se beneficiaron del tratamiento con este fármaco, mientras que los grupos con riesgo bajo o intermedio obtuvieron un beneficio sustancial
La identificación de moléculas que cumplen una función en el crecimiento y la progresión de las células malignas o en su respuesta al tratamiento es sólo el primer paso en el proceso de desarrollar aplicaciones terapéuticas relevantes. El lapso que media entre el laboratorio y la clínica es muchas veces largo y complicado, pero este gran desafío seguramente significará un incremento terapéutico de la enfermedad y el mejoramiento de la calidad de vida de las pacientes con esta neoplasia.
Se espera que en los próximos años, además de lograr la identificación de nuevas firmas genómicas o proteómicas relacionadas con el riesgo de recurrencia y la respuesta al tratamiento, también se logren conocer otros blancos terapéuticos basados en la biología tumoral y se desarrollen nuevas terapias blanco o dirigidas cada vez más efectivas, de tal modo que sea posible convertir la medicina personalizada en una práctica común en el tratamiento del cáncer.2
CONCLUSIONES
De nueva cuenta, la reunión de los oncólogos médicos de las instituciones más representativas del país, con el fin de revisar y consensuar los últimos avances en el tratamiento médico del cáncer mamario, resultó una experiencia sumamente valiosa y enriquecedora. Las conclusiones obtenidas, y presentadas en el actual documento, pretenden formar parte de la información que pueden consultar los oncólogos en general y los oncólogos médicos en particular; la finalidad es ofrecerle a la paciente con diagnóstico de cáncer mamario el mejor tratamiento actual individualizado.
La estandarización de los tratamientos adyuvantes con hormonoterapia y quimioterapia, así como el control regular con terapia neoadyuvante en estadios operables o localmente avanzados, son algunos de los capítulos revisados. También la terapia para la recurrencia o la enfermedad metastásica es parte importante de esta revisión. Las terapias blanco, los nuevos fármacos, las firmas genéticas y los avances futuros constituyeron parte medular del programa de la reunión para integrarse en un sólo documento.
Es la intención que las conclusiones descritas en cada uno de los temas se revisen y publiquen de manera periódica con la finalidad de mantener actualizados los conocimientos sobre el tratamiento médico del cáncer mamario.
Asimismo, se espera que la información presentada sea de ayuda para los médicos especialistas, las instituciones, los servicios oncológicos y las autoridades administrativas para tomar mejores decisiones y ofrecer una terapia óptima con un mejor aprovechamiento de los recursos disponibles.
COORDINADORES
Dr. Jesús Cárdenas Sánchez
Oncólogo médico
Centro Estatal de Cancerología. Colima, Colima.
Dra. Aura Erazo Valle
Oncólogo médico
Centro Médico Nacional 20 de Noviembre, ISSSTE.
México, D.F.
PARTICIPANTES
Dr. Fernando Aldaco Sarvide
Oncólogo médico
Centro Médico Nacional 20 de Noviembre, ISSSTE. México, D.F.
Dr. Alberto Alvarado Miranda
Oncólogo médico
Instituto Nacional de Cancerología, SSA. México, D.F.
Dra. Claudia Arce Salinas
Oncólogo médico
Instituto Nacional de Cancerología, SSA. México, D.F.
Dr. Héctor Benítez Arroyo
Oncólogo médico
Centro Médico de Occidente, IMSS. Guadalajara, Jalisco.
Dra. Paula Anel Cabrera Galeana
Oncólogo médico
Centro Oncológico Estatal, ISSEMYM. Toluca, Estado de México.
Dr. Daniel Capdeville García
Oncólogo médico
Hospital Aranda de la Parra. León, Guanajuato. Dra. Guadalupe Cervantes Sánchez
Oncólogo médico
Centro Médico Nacional 20 de Noviembre, ISSSTE. México, D.F.
Dra. Yanin Chavarri Guerra
Oncólogo médico
Instituto Nacional de la Nutrición, SSA. México, D.F.
Dr. Jaime de la Garza Salazar
Oncólogo médico
Instituto Nacional de Cancerología, SSA. México, D.F.
Dr. Homero Fuentes de la Peña
Oncólogo médico
Hospital Fray Junípero Serra, ISSSTE. Tijuana, B.C.
Dra. Georgina Garnica Jaliffe
Oncólogo médico
Hospital General de México, O.D. México, D.F.
Dra. Raquel Gerson Cwilich
Oncólogo médico
Hospital ABC. México, D.F.
Dra. Xóchitl Gómez Ruel Oncólogo médico
Opción Oncología. Monterrey, N.L.
Dr. Juan Francisco González Guerrero
Oncólogo médico
Centro Universitario contra el Cáncer. Monterrey, N.L.
Dr. José Luis González Vela
Oncólogo médico
Clínica Regional, ISSSTE. Monterrey, N.L.
Dr. Alejandro Juárez Ramiro
Oncólogo médico
Centro Médico Nacional 20 de Noviembre, ISSSTE. México, D.F.
Dr. Fernando Lara Medina
Oncólogo médico
Instituto Nacional de Cancerología, SSA. México, D.F.
Dr. Miguel Lázaro León
Oncólogo médico
Hospital General de México, O.D. México, D.F.
Dr. Eucario León Rodríguez
Oncólogo médico
Instituto Nacional de la Nutrición, SSA. México, D.F.
Dr. Víctor M. Lira Puerto >
Oncólogo médico
Hospital ABC. México, D.F.
Dra. Flavia Morales Vásquez
Oncólogo médico
Instituto Nacional de Cancerología, SSA. México, D.F.
Dr. Gilberto Morgan Villela
Oncólogo médico
Centro Médico de Occidente, IMSS. Guadalajara, Jalisco.
Dr. Guillermo Olivares Beltrán
Oncólogo médico
Centro Médico La Raza, IMSS. México, D.F.
Dr. Mario Pérez Martínez
Oncólogo médico
Centro Médico Nacional Siglo XXI, IMSS. México, D.F.
Dr. Efraín Salas González
Oncólogo médico
Centro Médico de Occidente, IMSS. Guadalajara, Jalisco.
Dr. Benito Sánchez Llamas
Oncólogo médico
Centro Médico de Occidente, IMSS. Guadalajara, Jalisco.
Dr. Pedro Solano Murillo
Oncólogo médico
Centro Médico de Occidente, IMSS. Guadalajara, Jalisco.
Dr. Juan Alejandro Silva
Oncólogo médico
Hospital de Oncología, CMN Siglo XXI, IMSS. México, D.F.
Dra. Laura Torrecillas Torres
Oncólogo médico
Centro Médico Nacional 20 de Noviembre, ISSSTE. México, D.F.
Dr. Vicente Valero Castillo
Oncólogo médico
MD Anderson Cancer Center, Houston, Texas.
REFERENCIAS
INTRODUCCIÓN
1. Primer Consenso Nacional sobre Tratamiento del Cáncer Mamario. Rev Inst Nal Cancerol (Mex) 1995;41(3):136-145.
2. Primera Revisión del Consenso Nacional sobre Tratamiento del Cáncer Mamario. Rev Ginecol Obstet Méx 2002;(70):349-358.
3. Segunda Revisión del Consenso Nacional sobre el Diagnóstico y Tratamiento del Cáncer Mamario. Rev Gamo 2006;5(suppl 2).
4. Tercera revisión del Consenso Nacional sobre el Diagnóstico y Tratamiento del Cáncer Mamario. Rev Gamo 2008;7(suppl 6).
5. Norma Oficial Mexicana NOM-041-SSA-2-2002 para la Prevención, Diagnóstico, Tratamiento, Control y Vigilancia Epidemiológica del Cáncer de Mama. México: Secretaría de Salud, 2003:6-7.
6. Primera Reunión sobre Tratamiento Médico del Cáncer Mamario. Rev Gamo 2007;6(suppl 1).
BASES MOLECULARES DEL CÁNCER MAMARIO
1. Cardoso F, Castiglione M. Locally recurrent or metastatic breast cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009; 20 (Suppl 4): iv15-iv18.
2. Network NCC. 2008. NCCN Clinical Practice Guidelines in Oncology: Breast Cancer, Version 2. In Edition 2009.
3. Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumors. Nature 406:747-752, 2000.
4. Voduc KD, Cheang M, Tyldesley S. Breast cancer subtypes and the risk of local and regional relapse. JCO 2010;28(10): 1684-1691.
5. Colozza M, Azambuja E, Personeni N, et al. Achievements in systemic therapies in the pregenomic era in metastatic breast cancer. Oncologist 2007; 12: 253-270.
6. Van de Vijver MJ, He YD, Van'veer LJ, et al. A gene expression signature as a predictive of survival in breast cancer. N Engl J Med 2002; 347: 1999-2009.
QUIMIOPREVENCIÓN PRIMARIA DEL CÁNCER MAMARIO
1. Fisher B, Costantino JP, Wickerham DL, et al Tamoxifen for prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 Study. J Nat Can Inst 2005;97(22).
2. Vogel VG, Costantino JP; for the National Surgical Adjuvant Breast and Bowel Project (NSABP). Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: The NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 Trial. JAMA 2006;295:2727-2741.
TRATAMIENTO ADYUVANTE EN EL CÁNCER MAMARIO OPERABLE
1. Goldhirsch A, Ingle JN. Gelber RD, et al. Thresholds for therapies: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2009. Ann Oncol 2009; 19:1319-1329.
2. EBCTCG: Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005;365:1687-1717.
3. Kataja V, Castiglione M. Primary breast cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009;20(suppl 4):iv10-iv14.
4. Gianni L, Norton L, Wolmark N. Rol of anthracyclines in the treatment of early breast cancer. J Clin Oncol 2009;27(28): 4798-4808.
5. De Laurentiis M, Cancello G, D'Agostino D, et al. Taxane-based combinations as adjuvant chemotherapy of early breast cancer: meta-analysis of randomized trials. J Clin Oncol 2008; 26(1):44-53.
6. Sparano JA, Wang M, Martino S, et al. Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med 358 (16): 1663-71, 2008.
7. Mamounas EP, Bryant J, Lembersky B, et al. Paclitaxel after doxorubicin plus cyclophosphamide as adjuvant chemotherapy for node-positive breast cancer: results from NSABP B-28. J Clin Oncol 2005; 23(16):3686-96.
8. Roché H, Fumoleau P, Spielman M, Canon JL, et al. Secuential adjuvant epirubicin-based and docetaxel chemotherapy for node-positive breast cancer patients. The FNCLCC PACS 01 Trial. J Clin Oncol 2006; 24:5664-5671.
9. Martin M, Pienkowski T, Mackey J, Pawlicky M, Guastalla JP, et al. Adjuvant docetaxel for node-positive breast cancer. N Engl J Med 2005; 352:2302-2313.
10. Jones SE, Holmes FA, O´Shaughnessy J, et al. Docetaxel with cyclophosphamide is associated an overal survival benefit compared with doxorubicin and cyclophosphamide: 7 years follow-up US Oncology Research Trial 9735. J Clin Oncol 2009; 24(27):1177-1183.
11. Hayes DF, Thor AD, Dressler LG, et al. HER2 and response to paclitaxel in node-positive breast cancer. N Engl J Med 2007; 357:1496-1506.
12. Paik S, Tang G, Shak S, et al. Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer. J Clin Oncol 2006; 24(23):3726-3734.
13. Sotiriou C, Phil D, Pusztai L. Gene-expression signatures in breast cancer. N Engl J Med 2009; 360:790-800.
14. Joerger M, Thürlimann B. Update of the BIG 1-98 Trial: where do we stand?" Breast 2009 18(Suppl 3):S78-S82.
15. Mouridsen H, Giobbie-Hurder A, Goldhirsch A, on behalf of the BIG 1-98 Collaborative Group. Letrozole therapy alone or in sequence with tamoxifen in women with breast cancer. N Engl J Med 2009;361(8):766-776.
16. Howell A, Cuzick J, Baum M, on behalf of the ATAC Trialists' Group. Results of the ATAC (Arimidex, Tamoxifen, Alone or in Combination) trial after completion of 5 years' adjuvant treatment for breast cancer. Lancet 2005;365(9453):60-62.
17. Goss PE, Ingle JN, Martino S, et al. A randomized trial of letrozole in postmenopausal women after five years of tamoxifen therapy for early stage breast cancer. N Engl J Med 2003;349(19):1793-1802.
18. Bertelli G, Hall E, Ireland E, et al. Long-term endometrial effects in postmenopausal women with early breast cancer participating in the intergroup Exemestane Study (IES)a randomized controlled trial of exemestane versus continued tamoxifen after 2-3 years tamoxifen. Ann Oncol 2010;21(3):498-505.
19. Jahanzeb M. Adjuvant trastuzumab therapy for HER2-positive breast cancer. Clin Breast Cancer 2008;8:324 -333.
20. Romond EH, Perez EA, Bryant J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005; 353:1673-1684.
21. Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005;353:1659 -1672.
22. Smith I, Procter M, Gelber RD, et al. 2-year follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer: a randomized controlled trial. Lancet 2007;369(9555):29-36.
23. Slamon D, Eiermann W, Robert N, Pienkowsky T, et al. Phase III ranrandomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel (ACT) with doxorubicin and cyclophosphamide followed by docetaxel and trastuzumab (ACTH) with docetaxel, carboplatin and trastuzumab (TCH) in Her2neu positive early breast cancer patients: BCIRG 006 Study. Cancer Res 2009;69(24 Suppl):Abstract nr 62.
24. Spielmann M, Roché H, Delozier T, Canon JL, et al. Trastuzumab for patients with axillary-node-positive breast cancer: results of the FNCLCCPACS 04 trial. J Clin Oncol 2009;27(36):6129-34.
REVISIÓN DE LAS GUÍAS INTERNACIONALES SOBRE TRATAMIENTO ADYUVANTE DEL CÁNCER MAMARIO TEMPRANO
1. Goldhirsch A, Ingle JN, Gelber ND, et al thresholds for therapies: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2009. Ann Oncol (2009) 20 (8): 1319-1329. Disponible en: http://annonc.oxfordjournals.org/content/20/8/1319.full - aff-1
2. NCCN Practice Guidelines in Oncology, Breast Cancer v. 1. 2010.
TRATAMIENTO SISTÉMICO NEOADYUVANTE EN PACIENTES CON ESTADIOS OPERABLES
1. Kaufamann M, von Minckwitz G, Smith R, et al. International expert panel on the use of primary (preoperative) systemic treatment of operable breast cancer: review and recommendations. J Clin Oncol 2003;21:2600-8
2. Bonadonna G, Zambetti M, Bumma C, et al. Multimodal treatment with primary single-agent epirubicin in operable breast cancer: 5-year experience of the Michalangelo Cooperative Group. Ann Oncol 2002:13;1049-58.
3. Jakesz R, for the ABCSG. Comparison of pre- vs. postoperative chemotherapy in breast cancer patients: four-year results of Austrian Breast, Colorectal Cancer Study Group (ABCSG) trial 7. Proc Am Soc Clin Oncol 2001; 20: 125.
4. Scholl SM, Fourquet A, Asselain B, et al. Neoadjuvant versus adjuvant chemotherapy in premenopausal patients with tumours considered too large for breast conserving surgery. Preliminary results of a randomised trial. Eur J Cancer 30A. 1994; 645-652
5. Broet P, Scholl SM, de la Rochefordiere A, et al. Short and long-term effects on survival in breast cancer patients treated by primary chemotherapy: an updated analysis of a randomized trial. Breast Cancer Res Treat 1999; 58: 151-156.
6. Maur M, Guarneri V, Frassoldati A, et al. Primary systemic therapy in operable breast cancer: clinical data and biological fall-out. Ann Oncol 2006;suppl 5:158-64
7. Dieras V, Fumoleau P, Romieu G, et al. Randomized parallel study of doxorubicin plus paclitaxel and doxorubicin plus cyclophosphamide as neoadjuvant treatment of patients with breast cancer. J Clin Oncol 2004 22: 4958-65.
8. Buzdar AU, Singletary SE, Theriault RL, et al. Prospective evaluation of paclitaxel versus combination chemotherapy with fluorouracil, doxorubicin, and cyclophosphamide as neoadjuvant therapy in patients with operable breast cancer. J Clin Oncol 1999; 17: 3412-341
9. Luporsi E, Vanlemmens L, Coudert B, et al. 6 cycles of FEC 100 vs 6 cycles of epirubicin-docetaxel (ED) as neoadjuvant chemotherapy in operable breast cancer patients (pts): preliminary results of a randomized phase II trial of Girec S01. Proc Am Soc Clin Oncol 2000; 19: 355.
10. Heys SD, Hutcheon AW, Sarkar TK, et al. Neoadjuvant docetaxel in breast cancer: 3-year survival results from the Aberdeen trial. Clin Breast Cancer 2002; 3(Suppl 2): S69-S74.
11. von Minckwitz G, Blohmer JU, Raab G, et al. In vivo chemosensitivity-adapted preoperative chemotherapy in patients with early-stage breast cancer: the GEPARTRIO pilot study. Ann Oncol 2005; 16: 56-63
12. Reitsamer R, Peintinger F, Prokop, E et al. Pathological complete response rates comparing 3 versus 6 cycles of epidoxorubicin and docetaxel in the neoadjuvant setting of patients with stage II and III breast cancer. Anticancer Drugs 2005; 16(8): 867-870
13. Roumieu G, Tubiana-Hulin M, Fumoleau P, et al. A multicenter randomized phase II study of 4 or 6 cycles of adriamycin/taxol (paclitaxel) (AT) as neoadjuvant treatment of breast cancer (BC). Ann Oncol 2002; 13(Suppl 5): 33.
14. Steger G, Galid A, Gnant M, et al. Pathologic complete response with six compared with three cycles of neoadjuvant epirubicin plus docetaxel and granulocyte colony-stimulating factor in operable breast cancer: results of ABCSG-15. J Clin Oncol 2007;25:2012-18
15. Penault-Llorca F, Abrial C, Mouret-Reynier, et al. Achieving higher pathological complete response rates in HER2 positives patients with induction chemotherapy without trastuzumab in operable breast cancer. The Oncolo-gist 2007;12:390-96
16. Buzdar AU, Ibrahim NK, Francis D, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol 2005;23;3676-85
17. Limentani SA, Brufsky AM, Erban JK, et al. Phase II study of neoadjuvant docetaxel, vinorelbine, and trastuzumab followed by surgery and adjuvant doxorubicin plus cyclophosphamide in women with human epidermal growth factor receptor 2-overexpressing locally advanced breast cancer. J Clin Oncol 2007;25:1232-8
18. Baresford MJ, Ravichandran D, Makris A. Neoadjuvant endocrine therapy in breast cancer. Cancer Treat Rev 2007;33:48-57.
19. Smith IE, Dowsett M, Ebbs SR, et al. Neoadjuvant treatment of postmenopausal breast cancer with anastrozole, tamoxifen, or both in combination: the Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen (IMPACT) multicenter double-blind randomized trial. J Clin Oncol 2005;23:5108-16.
20. Cataliotti L, Buzdar AU, Noguchi S, et al. Comparison of anastrozole versus tamoxifen as preoperative therapy in postmenopausal women with hormone receptor-positive breast cancer: the pre-operative ''Arimidex'' compared to tamoxifen (PROACT) trial. Cancer 2006;106:2095-103.
21. Eiermann W, Paepke S, Appfelstaedt J, et al. Preoperative treatment of postmenopausal breast cancer patients with letrozole: a randomized double-blind multicenter study. Ann Oncol 2001;12:1527-32.
TRATAMIENTO SISTÉMICO NEOADYUVANTE EN EL CÁNCER MAMARIO LOCALMENTE AVANZADO
1. Gianni L, Eiermann W, Semiglazov V, Manikhas A et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010; 375(9712):377-384.
2. Untch M, Rezai M, Loibl S, Fasching PA, Huober J, et al. Neoadjuvant treatment with trastuzumab in HER2-positive breast cancer: results from the GeparQuattro study. J Clin Oncol 2010; 28(12):2024-31.
TRATAMIENTO SISTÉMICO DEL CÁNCER MAMARIO METASTÁSICO O RECURRENTE1. Chia SK, Speers CH, D'yachkova Y, et al. The impact of new chemotherapeutic and hormone agents on survival in a population-based cohort of women with metastatic breast cancer. Cancer 2007; 110:973.
2. Giordano SH, Buzdar AU, Smith TL, et al. Is breast cancer survival improving? Cancer 2004; 100:44.
3. Gennari A, Conte P, Rosso R, et al. Survival of metastatic breast carcinoma patients over a 20-year period. Cancer 2005; 104:1742.
4. Consenso Nacional sobre Diagnóstico y Tratamiento del Cáncer Mamario. Gamo 2008; 7(Suppl 6).
5. Beslija S, Boneterre H, Burstein J, et al. Third consensus on medical treatment of metastatic breast cancer. Ann Oncol 2009; 20: 1771-85.
6. Wilcken N, Hombuckle J, Ghersi D. Chemotherapy alone versus endocrine therapy alone for metastatic breast cancer. Cochrane Database Syst Rev 2003; Issue 2. Art. No: CD002747. DOI: 10.1002/14651858 CD002747.
7. Soules MR, Sherman S, Parrott E, Rebar R. Executive summary: Stages of Reproductive Aging Workshop (STRAW). Fertil Steril 2001; 76:874.
8. Kent Osborne C. Tamoxifen in the treatment of breast cancer. N Engl J Med 1998;339:1609-18.
9. Boccardo F, Rubagotti A, Perrota A, et al. Ovarian ablation versus goserelin with or without tamoxifen in pre-perimenopausal patients with advanced breast cancer: results of multicentric Italian Study. Ann Oncol 1994; 5: 337-342.
10. Klijn J, Blamey RW, Boccardo F, et al. Combined tamoxifen and luteinizing hormone- releasing hormone (LHRH) agonist alone in premenopausal advanced breast cancer: a meta-analysis of four randomized trials. J Clin Oncol 2001; 19: 343-353.
11. Ellis MJ. Aromatase inhibitors for the treatment of breast cancer ED. CMP United Business Media Oncology Publishes Group, 2005.
12. Early Breast Cancer Trialists' Collaborative Group Effects of chemotherapy and hormonal therapy breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005;365:1687-717.
13. Clemons M, Goss P. Estrogen and the risk of breast cancer [mechanism of disease]. N Engl J Med 2001;344:276-285.
14. Nabholtz JM, Buzdar A, Pollak M, et al. Anastrozole is superior to tamoxifen as first-line therapy for advanced breast carcinoma is postmenopausal women: results of a North America multicenter randomized trial. J Clin Oncol 2000;18:3758-3767.
15. Bonaterre J,Thurlimann B, Robertson JFR, et al. Anastrozole versus tamoxifen as first-line therapy for advanced breast cancer in 668 postmenopausal woman: results of the Tamoxifen or Arimidex Randomized Group Efficacy and tolerability Study. J Clin Oncol 2000;18:3748-3757.
16. Mouridsen H, Gersanovich M, Sun Y, et al. Phase III study of ietrozol versus tamoxifen as first-line therapy of advanced breast cancer in postmenopausal women: analysis of survival and update of efficacy from the International Letrozol Breast Group. J Clin Oncol 2003;21:2101-2109.
17. Lonning PE, Bajetta E, Murray R, et al. Acivity of exemestane in metastatic breast cancer after failure of nonsteroideal aromatase inhibitors: a phase II trials. J Clin Oncol 2000; 18: 2234-44.
18. Watanabe T, Sano M, Ohno S, et al. Fulvestrant for the treatment of advanced breast cancer in postmenopausal women: a Japanese study. Anticancer Res 2004; 24:1275.
19. Howell A, Pippen J, Elledge RM, et al. Fulvestrant versus anastrozole for the treatment of advanced breast carcinoma. Cancer 2005; 104:236.
20. Osborne CK, Pippen J, Jones SE, et al. Double-blind, randomized trial comparing the efficacy and tolerability of fulvestrant versus anastrozole in postmenopausal women with advanced breast cancer progressing on prior endocrine therapy: results of a North American trial. J Clin Oncol 2002; 20:3386.
21. Howell A, Robertson JF, Quaresma Albano J, et al. Fulvestrant, formerly ICI 182,780, is as effective as anastrozole in postmenopausal women with advanced breast cancer progressing after prior endocrine treatment. J Clin Oncol 2002; 20:3396.
22. Ingle JN, Suman VJ, Rowland KM, et al. Fulvestrant in women with advanced breast cancer after progression on prior aromatase inhibitor therapy: North Central Cancer Treatment Group Trial N0032. J Clin Oncol 2006; 24:1052.
23. Chia S, Gradishar W, Mauriac L, et al. Double-blind, randomized placebo controlled trial of fulvestrant compared with exemestane after prior nonsteroidal aromatase inhibitor therapy in postmenopausal women with hormone receptor-positive, advanced breast cancer: results from EFECT. J Clin Oncol 2008; 26:1664.
24. Kaufman B, Mackey JR, Clemens, M, et al. Trastuzumab prolongs progression-free survival in hormone-dependent and HER2-positive metastatic breast cancer: results from the Randomized Phase III TAnDEM Study. J Clin Oncol 2009; 27: 5529-37.
25. Johnston S, Pergram M, Press M, et al. Lapatinib combined with letrozole vs. letrozole alone for front line postmenopausal hormone receptor positive (HR+) metastatic breast cancer (MBC). J Clin Oncol 2009; 27: 5538-46.
26. Hortobagyi GN, Yap HY, Kau SW, et al. A comparative study of doxorubicin and epirubicin in patients with metastatic breast cancer. Am J Clin Oncol 1989; 12:57.
27. Falkson G, Tormey DC, Carey P, et al. Long-term survival of patients treated with combination chemotherapy for metastatic breast cancer. Eur J Cancer 1991; 27:973.
28. Hortobagyi GN, Bodey GP, Buzdar AU, et al. Evaluation of high-dose versus standard FAC chemotherapy for advanced breast cancer in protected environment units: a prospective randomized study. J Clin Oncol 1987; 5:354.
29. O´Shaughnnessy J. Superior survival with capecitabine plus docetaxel. Combination therapy in antracicline-pretreatment patients with advanced breast cancer. Phase III Trial Result. J Clin Oncol 2002;12:2812-23.
30. Albain KS, Nag SM, Calderillo-Ruiz, G, et al. Gemcitabine plus paclitaxel versus Paclitaxel monotherapy in patients with metastatic breast cancer and prior anthracycline treatment. J Clin Oncol 2008; 26:3950.
31. Chan S, Romieu G, Huober J, et al. Gemcitabine plus docetaxel (GD) versus capecitabine plus docetaxel (CD) for anthracycline-pretreated metastatic breast cancer patients: results of a european phase III study. J Clin Oncol 2009; 27: 1753-60.
32. Miller K, Wang, M Gralow J, et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N Engl J Med 2007; 357:2666.
33. Miles D, Chan A, Romieu G, et al. Randomised, double-blind, placebo-controlled phase III study of bevacizumab with docetaxel or docetaxel with placebo as first-line therapy for patients with locally recurrent or metastatic breast cancer: AVADO(abstract 41). Data presented at the 32th Annual San Antonio Breast Cancer Symposium, December, 2009.
34. Soto C, Torrecillas L, Reyes S, et al. Capecitabine (X) and taxanes in patients with anthracycline-pretreated metastatic breast cancer: sequential vs. combined therapy results from a MOSG randomized phase III trial (abstract). J Clin Oncol 2006; 24:20s.
35. Sledge GW, Neuberg D, Bernardo P, et al. Phase III trial of doxorubicin, paclitaxel, and the combination of doxorubicin and paclitaxel as front-line chemotherapy for metastatic breast cancer. J Clin Oncol Vol 21, Issue 4 (February), 2003: 588-592.
36. Carrick S, Parker S, Wilcken N, et al. Single agent versus combination chemotherapy for metastatic breast cancer. Cochrane Database Syst Rev 2005; :CD003372.
37. Conte PF, Guarneri V, Bruzzi P, et al. Concomitant versus sequential administration of epirubicin and paclitaxel as first-line therapy in metastatic breast carcinoma: results for the Gruppo Oncologico Nord Ovest randomized trial. Cancer 2004; 101:704.
38. Blum JL, Dieras V, Lo Russo PM, et al. Multicenter, phase II study of capecitabine in taxane-pretreated metastatic breast carcinoma patients. Cancer 2001; 92:1759.
39. Fumoleau P, Largillier R, Clippe C, et al. Multicentre, phase II study evaluating capecitabine monotherapy in patients with anthracycline- and taxane-pretreated metastatic breast cancer. Eur J Cancer 2004; 40:536.
40. Reichardt P, Von Minckwitz G, Thuss-Patience PC, et al. Multicenter phase II study of oral capecitabine (Xeloda(")) in patients with metastatic breast cancer relapsing after treatment with a taxane-containing therapy. Ann Oncol 2003; 14:1227.
41. Venturini M, Paridaens R, Rossner D, et al. An open-label, multicenter study of outpatient capecitabine monotherapy in 631 patients with pretreated advanced breast cancer. Oncology 2007; 72:51.
42. Gennari A, Sormani M, Bruzi P, et al. A meta-analysis of chemotherapy duration in metastatic breast cancer. J Clin Oncol 2008: 26 (Abstr 1067).
43. Geyer CE, Forster J, Lindquist D, Chan S, Romieu CG, et al. Lapatinib plus capecitabine for Her- 2 positive advanced breast cancer. N Eng J Med 2006;233-43
44. NCCN Practice Guidelines in Oncology, Breast Cancer v. 1. 2010.
TRATAMIENTO SISTÉMICO CON QUIMIOTERAPIA EN PACIENTES CON CÁNCER MAMARIO METASTÁSICO RESISTENTE A ANTRACICLINAS Y TAXANOS
1. Blum JL. Multicenter, phase II study of capecitabine in taxane-pretreated metastatic breast carcinoma patients. Cancer 2001;92:1759-1768.
2. O'Shaughnessy J. Superior survival with capecitabine and docetaxel combination chemotherapy in anthracycline-pretreated patients with advanced breast cancer. J Clin Oncol 2002;20:2812-2823.
3. Schaller G, Fuchs I, Gonsch T, et al. Phase II study of capecitabine plus trastuzumab in human epidermal growth factor receptor 2 overexpressing metastatic breast cancer pretreated with anthracyclines or taxanes. J Clin Oncol 25(22):3246-50.
4. Sparano JA, Vrdoljak E, Rixe O, et al. Randomized phase III trial of ixabepilone plus capecitabine versus capecitabine in patients with metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol 2010; 28:3256-3263.
5. Perez EA, Lerzo G, Pivot X, et al. Efficacy and safety of ixabepilone (BMS-247550) in a phase II study of patients with advanced breast cancer resistant to an anthracycline, a taxane, and capecitabine. J Clin Oncol 2007;25:3407-3414.
6. Gradishar WJ, Krasnojon D, Cheporov S. Significantly longer progression-free survival with nab-paclitaxel compared with docetaxel as first-line therapy for metastatic breast cancer. J Clin Oncol 2009; 27(22):3611-3619.
7. Martin M, Ruiz A, Muñoz M. Gemcitabine plus vinorelbine versus vinorelbine monotherapy in patients with metastatic breast cancer previously treated with anthracyclines and taxanes: final results of the phase III Spanish Breast Cancer Research Group (GEICAM) trial. Lancet Oncol 2007;8(3):219-25.
BIFOSFONATOS
1. Coleman RE. Bisphosphonates in breast cancer. Ann Oncol 2005;16:687- 695.
2. Winter MC, Coleman RE. Bisphosphonates in breast cancer: teaching an old dog new tricks. Curr Opin Oncol 2009;21:499-506.
3. Meta-analysis of clodronate and breast cancer survival. Brit J Can 2007;96:1796-1801.
4. Coleman RE. Adjuvant bisphosphonates in breast cancer: are we witnessing the emergence of a new therapeutic strategy? R Eur J Cancer 2009;10;1016/j.
5. Eidtmann H, Bundred NJ, DeBoer R. The effect of zoledronic acid on aromatase inhibitor associated bone loss in postmenopausal women with early breast cancer receiving adjuvant letrozole: 36 months follow-up of ZO-FAST. Cancer Res 2008;69(Suppl. 2) San Antonio breast cancer symposium, abstract 44
6. Gnant M, Mlineritsch B, Schippinger W, et al. Endocrine therapy plus zoledronic acid in premenopausal breast cancer. N Engl J Med 2009;360(7):679-91
7. Cochrane data base Sys tRev 2005 jul20;(3):CD003474.
8. Rosen LS, Gordon DH, Dugan W. Zoledronic acid is superior to pamidro-nate for the treatment of bone metastases in breast carcinoma patients with at least one osteolytic lesion. Cancer 2004;100:36-43.
9. NCCN Task Force Report: Bone Health in Cancer Care. JNCCN 2009;7(Suppl 3):1-32.
10. Coleman RE. Risks and benefits of bisphosphonates. Brit J Can 2008;98:1736-1740.
TRATAMIENTO DEL CÁNCER MAMARIO EN PACIENTES DE EDAD AVANZADA
1. Aaldriks AA, Maartense E, Cessie S, et al. Predictive value of geriatric assess-Predictive value of geriatric assessment for patients older than 70 years, treated with chemotherapy. Crit Rev Oncol Hematol 2010;Aug 13.
2. Taylor WC, Muss HB. Recent advances:adjuvant therapy for older women with breast cancer. Cancej J 2010;16(4):289-293.
3. Wedding U, R¨hrig B, Klippstein A, et al. Age, severe comorbidity and functional impairment independently contribuye to poor survival in cancer patients. J Cancer Res Clin Oncol 2007;133(12):945-950.
4. Taylor WC, Muss HB. Adjuvant chemotherapy of breast cancer in the older patient. Oncology (Williston Park) 2010;24(7):608-13.
5. Taira N, Sawaki M, Takahashi M, et al. Comprehensive geriatric assessment in ederly breast cancer patients. Breast Cancer 2010;17(3):183-9.
6. Brunello A, Sandri R, Extermann M. Multidimensional geriatric evaluation for older cancer patients as a clinical and research tool. Cancer Treat Rev 2009;35(6):487-492.
TRATAMIENTO SISTÉMICO DEL CÁNCER MAMARIO EN EL HOMBRE
1. Anderson WF. Male breast cancer: a population-based comparison with female breast cancer. J Clin Oncol 2010;28:232-239.
2. Giordano SH. Male breast cancer: It´s time for evidence instead of extrapolation. Onkologie 2008;31:505-506.
3. Goodman MT, Tung KH, Wilkens LR: Comparative epidemiology of breast cancer among men and women in the US, 1996 to 2000. Cancer Causes Control 2006;17:127-136.
4. Bashman VM, Lipscombe JM, Ward JM, et al. BCRA1 and BCRA2 mutations in a population-based study of male breast cancer. Breast Cancer Res 2002;4:R2.
5. Giordano SH, Cohen DS, Buzdar AU, et al. Breast carcinoma in men: a population-based study. Cancer 2004;101:51-57.
6. Pant K, Dutta U. Understanding and management of male breast cancer: a critical review. Med Oncol 2008;25:294-298.
7. Perkins GH, Middleton LP, Garcia SM, et al. Male breast carcinoma outcomes and predictors of local-regional failure in patients treated without radiation therapy. Breast Cancer Re Treat 2002;76:121.
SEGUIMIENTO POSTERIOR AL TRATAMIENTO PRIMARIO CON INTENCIÓN TERAPÉUTICO
1. Rosselli del Turco M, Palli D, Cariddi A, et al. Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council Project on Breast Cancer follow-up. JAMA 1994; 271:1593-7.
2. Joseph E, Hyacinthe M, lyman GH, et al. Evaluation of an intensive strategy for follow up and surveillance of primary breast cancer. Ann Surg Oncol 1998; 5: 522-528.
3. Smith TJ. American Society of Clinical Oncology 1998 update of recommended breast cancer surveillance guidelines. J Clin Oncol 1999; 17(3): 1080.
4. NCCN Practice Guidelines in Oncology, Breast Cancer v. 1. 2010.
5. De Bock GH, Bonnema J, Van Der Hage J, et al. Effectiveness of routine visits and routine tests in detecting isolated locoregional recurrences after treatment for early stage invasive breast cancer. A meta-analysis and systematic review. J Clin Oncol 2004;22:4010-18.
6. Grunfeld E, Levine M, Julian J, et al. A randomized controlled trial (RCT) of routine follow-up for early stage breast cancer: a comparison of primary care versus specialist care. J Clin Oncol 2004; 22 (suppl): 665 (abstract).
7. Heys SD, Chaturvedi S, Hutcheon AW, Sarkar TK. Guidelines, guidelines and more guidelines: and we still do not know how to follow-up patients with breast cancer. World J Surg Oncol 2005; 3:54.
8. Peppercorn J, Partridge A, Burnstein HJ, Winer EP. Standards for follow-up care of patients with breast cancer. The Breast 2005;14:500-508.
9. Pestalozzi BC, Luporsi-Gely E, Jost LM, Bergh J. ESMO minimum clinical recommendations for diagnosis, adjuvant treatment and follow-up of primary breast cancer. Ann Oncol 2005; 16(suppl 1).
10. Smith TJ. The American Society of Clinical Oncology recommended breast cancer surveillance guidelines can be done in a routine office visit. J Clin Oncol 2005; 23(27): 6807.
11. Rojas MP, Telaro E, Russo A, et al. Follow-up strategies for women treated for early breast cancer. The Cochrane Library Issue 2, 2006.
12. Grunfeld E, Levine M, Julian J, et al. Randomized trial of long term follow-up for early stage breast cancer. A comparison of family physician versus specialist care. J Clin Oncol 2006; 24(6): 848-855.
13. Eckert R. Recommendations for follow-up of malignant diseases. Schweiz Rundsch Med Prax 2006 Apr 12; 95(15):567-73.
14. Lah TL, Fox MP, Silliman RA. Reduced mortality rate associated with an-Reduced mortality rate associated with annual mammograms after breast cancer therapy. Breast J 2006;12(1): 2-6.
15. Winer E, Tolaney S (Dana-Farber Ca.Inst.- Mass.). Role of baseline staging and follow-up: between reassurance and economic constraints, 10th International Conference on Primary Therapy of Early Breast Cancer, St. Gallen (Switzerland), March 2007.
NUEVOS FÁRMACOS EN FASE DE INVESTIGACIÓN CLÍNICA
1. Tutt A, Robson M, Garber JE, et al. Phase II trial of the oral parp inhibitor olaparib in BRCA-deficient advanced breast cancer. J Clin Oncol 2009:27 suppl; abstr 501.
2. O'Shaughnessy J, Osborne C, Pippen J, et al. Efficacy of BSI-201, A POLY (adp-ribosa) npolymerase-1 (PARP1) inhibitor, in combination wtth gemcitabine/carboplatin (G/C) in patiens with metastatic triple-negative breast cancer (TNBC): results of a randomized phase II trial. J Clin Oncol 2009; 27:Suppl;abstract 3.
3. Baselga J, Semiglazov V, van Dam P, et al. Phase II randomized study of neoadjuvant everolimus plus letrozole compared with placebo plus letrozole in patients with estrogen receptor-positive breast cancer. J Clin Oncol 2009; 27:2630-2637.
4. Thomas ES, Gomez HL, Li RK, et al. Ixabepilone plus capecitabine for metastatic breast cancer progressing after anthracycline and taxane treatment. J Clin Oncol 2007;25:5210-5217.
5. Sparano JA, Vrdoljak E, Rixe O, et al. Randomized phase III trial of ixabepi-Randomized phase III trial of ixabepi-lone plus capecitabine versus capecitabine in patients with metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol 2010; 28:3256-3263.
6. Perez EA, Lerzo G, Pivot X, et al. Efficacy and safety of ixabepilone (BMS-247550) in a phase II study of patients with advanced breast cancer resistant to an anthracycline, a taxane, and capecitabine. J Clin Oncol 2007;25:3407-3414.
FIRMAS GENÓMICAS EN EL CÁNCER MAMARIO
1. Iwao Koizumi K, Matoba R, Ueno N, et al. Prediction of docetaxel reresponse in human breast cancer by gene expression profiling. J Clin Oncol 2005; 23:422-431.
2. Rouzier R, Perou CM, Symmans WF, et al. Breast cancer molecular sub-types respond differently to preoperative chemotherapy. Clin Cancer Res 2005;11:5678-5685.
3. Hess KR, Anderson K, Symmans WF, et al. Pharmacogenomic predictor of sensitivity to preoperative chemotherapy with paclitaxel and fluorouracil, doxorubicin, and cyclophosphamide in breast cancer. J Clin Oncol 2006; 24:4236-4244.
4. van de Vijver MJ, El YD, van 't Veer LJ, et al. A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 2002; 347:1999-2009.
5. Wang Y, Klijn JG, Zhang Y, et al. Gene-expression profiles to predict distant metastasis of lymph-node-negative primary breast cancer. Lancet 2005;365:671-679.
6. Glinsky GV, Higashiyama T, Glinskii AB. Classification of human breast cancer using gene expression profiling as a component of the survival predictor algorithm. Clin Cancer Res 2004; 10:2272-2283.
7. van `t Veer LJ, Dai H, van de Vijver MJ, et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature 2002; 415:530-536.
8. Sotiriou C, P Wirapati, Loi S, et al. Gene expression profiling in breast cancer: understanding the molecular basis of histological grade to improve prognosis. J Natl Cancer Inst 2006; 98:262-272.
9. Brenton JD, Carey LA, Ahmed AA, Caldas C. Molecular classification and molecular forecasting of breast cancer: ready for clinical application? J Clin Oncol 2005;23:7350-7360.
10. Wooster R, Weber BL. Breast and ovarian cancer. N Engl J Med 2003; 348:2339-2347.
11. Paik S, Shak S, Tang G, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med 2004; 351:2817-2826.
12. van de Vijver MJ, El YD, van 't Veer LJ, et al. A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 2002; 347:1999-2009.
13. Buyse M, Loi S, Van `t Veer L, Viale G, et al. Validation and clinical utility of a 70-gene prognostic signature for women with node-negative breast cancer. J Natl Cancer Inst 2006; 98:1183-1192.
14 Wang Y, Klijn JG, Zhang Y, et al. Gene-expression profiles to predict distant metastasis of lymph-node-negative primary breast cancer. Lancet 2005; 365:671-679.
15. Foekens JA, Atkins D, Zhang Y, et al. Multicenter validation of a gene expression-based prognostic signature in lymph node-negative primary breast cancer. J Clin Oncol 2006; 24:1665-1671.
16. Cronin M, Pho M, Dutta D, et al. Measurement of gene expression in archival paraffin-embedded tissues: development and performance of a 92-gene reverse transcriptase-polymerase chain reaction assay. Am J Pathol 2004; 164:35-42.
17. Harris L, Fritsche H, Mennel R, et al. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer. J Clin Oncol 2007; 25:5827-5312.
18. Paik S, Shak S, Tang G, et al. Expression of the 21 genes in the Recurrence Score assay and tamoxifen clinical benefit in the NSABP study B-14 of node negative, estrogen receptor positive breast cancer. J Clin Oncol 2005; 23: (Suppl): abstr 510.
19. Habel LA, Shak S, Jacobs MK, et al. A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients. Breast Cancer Res 2006; 8: 1-15.
20. Paik S, Tang G, Shak S, et al. Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer. J Clin Oncol 2006; 24:3726-3734.
21. Simon R, Radmacher MD, Dobbin K, et al. Pitfalls in the use of DNA microarray data for diagnostic and prognostic classification. J Natl Cancer Inst 2003; 95:14-18.
22. Ransohoff DF. Rules of evidence for cancer molecular-marker discovery and validation. Nat Rev Cancer 2004; 4:309-314.
23. Michiels S, Koscielny S, Hill C. Prediction of cancer outcome with microarrays: a multiple random validation strategy. Lancet 2005; 365:1684-1685.
24. Eden P, Ritz C, Rose C, et al. "Good Old" clinical markers have similar power in breast cancer prognosis as microarray gene expression profilers. Eur J Cancer 2004; 40:1837-1841.
25. Ein-Dor L, Kela I, Getz G, et al. Outcome signature genes in breast cancer: is there a unique set? Bioinformatics 2005; 21:171-178.
26. Michiels S, Koscielny S, Hill C. Prediction of cancer outcome with microarrays: a multiple random validation strategy. Lancet 2005; 365:488-492.
27. Sotiriou CH, Pusztai L. Gene-expression signatures in breast cancer. N Engl J Med 2009,360:790-800.
AVANCES Y FUTURO DEL TRATAMIENTO MÉDICO DEL CÁNCER DE MAMA
1. Alvarez RH, Valero V, Hortobagyi GN. Emerging targeted therapies for breast cancer. J Clin Oncol 2010; 28:3366-3379.
2. González-Angulo AM, Hennessy B, Mills G. Biology of neoplasia: future of personalized medicine in oncology: a systems biology approach. J Clin Oncol 2010;28:2777-2783.