Introducción: El ipilimumab, un anticuerpo monoclonal bloqueador de antígeno 4 de linfocito-T citotóxico (CTLA-4), es un nuevo medicamento en el tratamiento de pacientes con melanoma metastásico. Es novedoso en cuanto a su mecanismo de acción, además cuenta con un perfil toxicológico especial. En estudios fase III ha demostrado aumentar la supervivencia global de pacientes con melanoma metastásico. La dosis aprobada es de 3 mg/Kg cada 3 semanas, para un total de 4 aplicaciones.
Objetivo: Describir las características clínicas, supervivencia libre de progresión, supervivencia global y efectos adversos del uso de ipilimumab en el Hospital Médica Sur, México D.F.
Material y método: Se revisaron expedientes de enero de 2012 hasta marzo de 2013, de pacientes atendidos en el Centro Oncológico Integral de Médica Sur con diagnóstico de melanoma metastásico y tratados con ipilimumab.
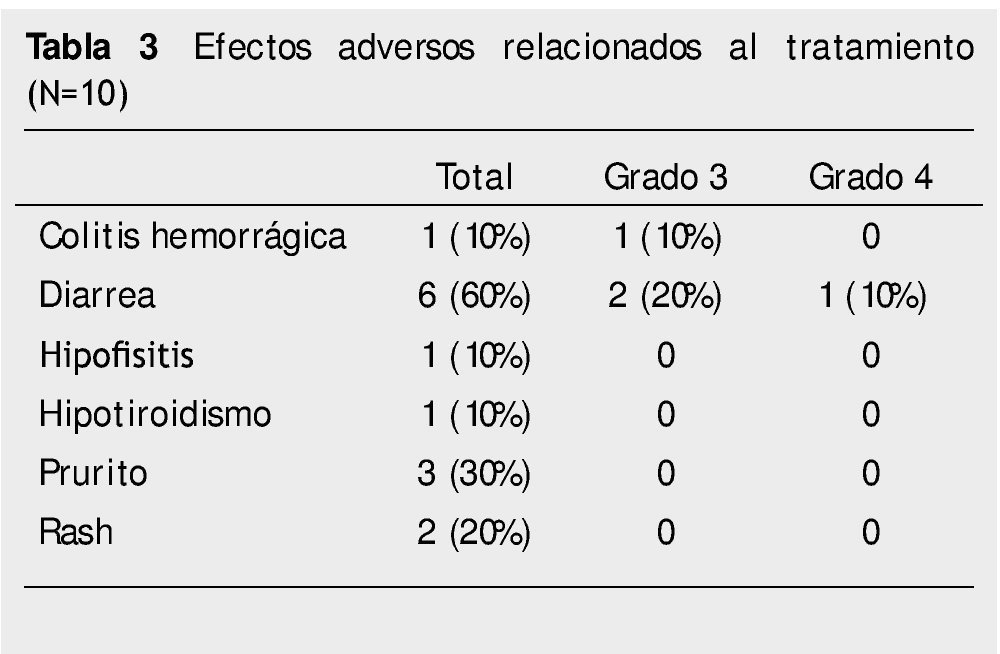
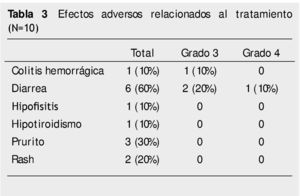
Resultados: Se lograron identificar 10 pacientes con los criterios antes descritos. De ellos, se logró una respuesta completa (10%) y 4 respuestas parciales (40%). La supervivencia mediana fue de 40 semanas y la supervivencia libre de progresión fue de 31 semanas. La mayoría de los efectos adversos fueron mediados inmunológicamente, leves y reversibles, desde prurito (30%), rash (20%), diarrea (60%) y colitis hemorrágica (10%).
Conclusión: La respuesta al tratamiento fue adecuada y correlaciona con otras series.
Introduction: Ipilimumab, a cytotoxic T-lymphocyte antigen-4 (CTLA-4)-blocking monoclonal antibody, is a new drug in the treatment of patients with metastatic melanoma. It is novel with regard to its mechanism of action and it has a special toxiciological profile as well. In phase III studies, it has been shown to increase overall survival of patients with metastatic melanoma. The approved dose is 3 mg/kg every 3 weeks, for a total of 4 applications.
Objective: To describe the clinical features, progression-free survival, overall survival, and adverse events associated with the use of ipilimumab at the Médica Sur Hospital in Mexico City.
Materials and method: Medical charts of patients diagnosed with metastatic melanoma and treated with ipilimumab at the Médica Sur Comprehensive Cancer Center were reviewed from January 2012 to March 2013.
Results: Ten patients could be identified meeting the above-described criteria. Of them, a complete response (10%) and 4 partial responses (40%) were achieved. Median survival was 40 weeks, and progression-free survival was 31 weeks. Most adverse effects were immunologically mediated, mild and reversible, and included pruritus (30%), rash (20%), diarrhea (60%), and hemorrhagic colitis (10%).
Conclusion: Treatment response was adequate and correlates with other series.
Introducción
Aunque la incidencia del melanoma maligno está en aumento, la mayoría de los casos se diagnostican en una etapa temprana. En estas situaciones, la resección quirúrgica es cu- rativa en la mayoría de pacientes; además, en pacientes con ganglios positivos la administración de interferón alfa ha demostrado disminución en la recurrencia1.
El tratamiento de pacientes con enfermedad metastásica ha variado con el transcurso de los años. Varias modalidades de tratamiento han demostrado beneficio en supervivencia, como la inmunoterapia con dosis altas de interleucina 2 (IL-2), ipilimumab (un anticuerpo monoclonal dirigido contra el antígeno 4 de linfocito-T citotóxico, CTLA-4) y los anticuerpos monoclonales dirigidos contra la proteína 1 de muerte programada (PD-1) o su ligando (PD-L1)2. De forma alternativa, la inhibición de la vía de la cinasa MAP también tiene un papel importante, sin embargo el beneficio se limita en pacientes que tienen la mutación V600 en el gen BRAF3. No existen estudios controlados con designación al azar que comparen las diferentes aproximaciones terapéuticas entre sí, ni tampoco análisis que evalúen el tratamiento secuencial entre cada una de ellas.
La activación de la inmunidad celular inicia cuando el linfocito-T reconoce los fragmentos peptídicos de proteínas intracelulares que se expresan en la superficie de las células presentadoras de antígeno (CPA), unidas al complejo mayor de histocompatibilidad. Esta interacción requiere la presencia de una molécula coestimuladora (B7) y esto resulta en la regulación a la alza del CTLA-4. El receptor de CTLA-4 es un regulador negativo de la activación de los linfocitos-T, que compite con CD28 por la unión a B7 en las CPA. Por lo tanto, CTLA-4 sirve como un "freno" fisiológico de la activación del sistema inmune4. Además el prevenir esta retroalimentación, produce una pérdida en la tolerancia a otros tejidos del huésped, que puede provocar eventos adversos severos o fatales autoinmunes.
El ipilimumab es novedoso en cuanto a su mecanismo de acción, con un perfil toxicológico particular; es un anticuerpo monoclonal dirigido contra CTLA-4 que previene esta retroalimentación negativa, lo que produce un aumento en la respuesta inmune en contra de las células tumorales. En estudios prospectivos mejoró la supervivencia global de pacientes con melanoma metastásico. Su dosis aprobada es de 3 mg/Kg cada 3 semanas, para un total de 4 aplicaciones. La mayoría de estos estudios fueron realizados con un porcenta- je menor de población latinoamericana y específicamen- te de México. Debido a lo anterior, realizamos un estudio descriptivo para conocer las características de los pacien- tes tratados en nuestro país, con la experiencia de un solo centro hospitalario en México.
Material y método
Se revisaron los expedientes clínicos de todos los pacientes que han recibido tratamiento con ipilimumab en el Centro Oncológico Integral del Hospital Médica Sur. Se incluyeron pacientes mayores de 18 años de edad, con el diagnóstico de melanoma metastásico y con expediente completo para poder evaluar supervivencia libre de progresión, supervivencia global y toxicidad por el tratamiento. Se excluyeron aquellos con información incompleta.
Los pacientes recibieron ipilimumab a dosis de 3 mg/Kg intravenoso, durante infusión de 90 minutos de duración cada 3 semanas, con un total de 4 dosis programadas. Fueron premedicados exclusivamente con clorfenamina 10 mg y ranitidina 50 mg intravenosas, el día de la aplicación. Los efectos adversos fueron clasificados de acuerdo al CTCAE versión 4.05. Los pacientes no fueron evaluados con los criterios RECIST, sino con los de tratamiento inmune en tumores sólidos publicados en 20096.
Resultados
Se identificaron 10 pacientes con las particulares antes mencionadas. Las características basales se encuentran especificadas en la tabla 1. El promedio de edad fue de 49 ± 25 años. No hubo diferencia entre distribución de sexos. El 90% de los pacientes contaban con un estado funcional Eastern Cooperative Oncology Group (ECOG, por sus siglas en inglés) ≤ 1. Siete pacientes tuvieron melanoma variedad acral lentiginoso. La mayoría de los pacientes tenían una enfermedad metastásica avanzada (M1c en el 70% de los pacientes). De éstos, 7 pacientes tenían enfermedad en sistema nervioso central, todos ellos tratados con radioterapia a cráneo total. Treinta por ciento de los pacientes no había recibido tratamiento sistémico previo, 50% uno y 20% 2 tratamientos previos. En 9 pacientes se logró determinar mu- tación BRAF (V600E en ambos), que fue mutado sólo en 2 pacientes. Cabe aclarar, que este par de pacientes no recibieron tratamiento con vemurafenib como primera línea, ni concomitante con ipilimumab.
Ocho de los 10 pacientes completaron las 4 aplicaciones de ipilimumab programadas. El seguimiento total fue de 19 meses.
Eficacia
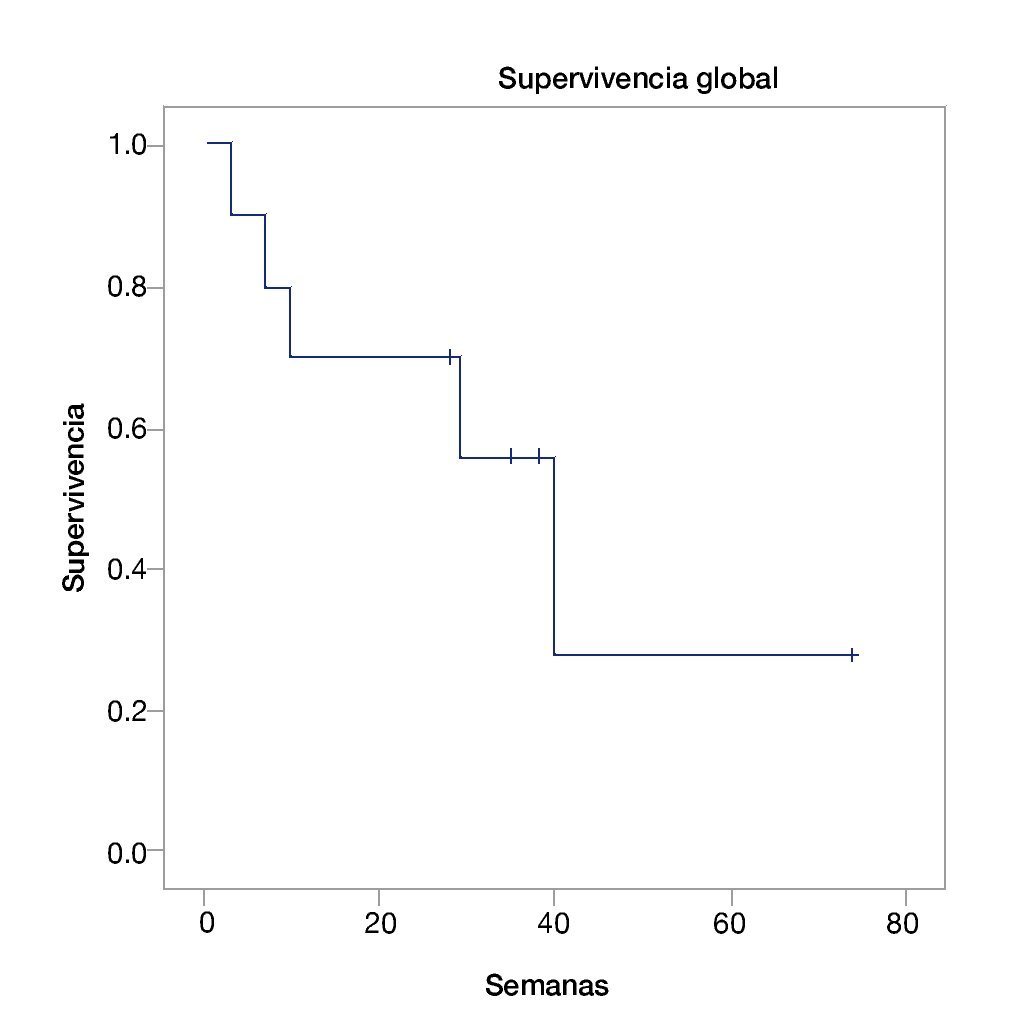
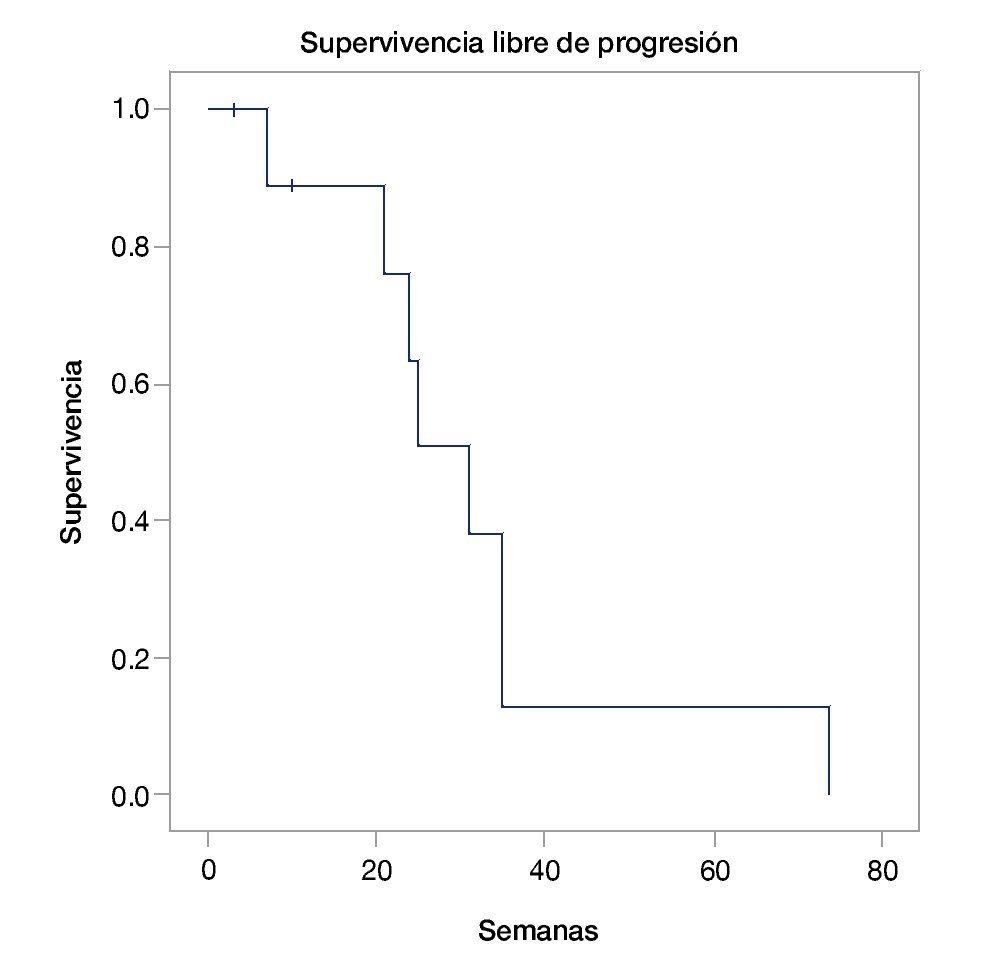
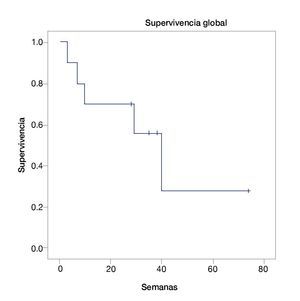
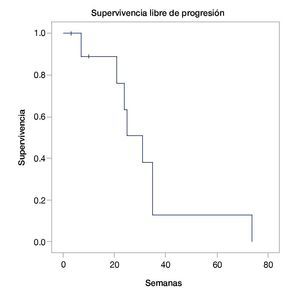
La mediana de supervivencia global fue de 40 semanas (intervalo de confianza, IC 95%=23.3-56-6) (fig. 1). La mediana de supervivencia libre de progresión fue de 31 semanas (IC 95%=21.6-40.3) (fig. 2). Se encontró sólo una respuesta completa, 4 respuestas parciales, 2 enfermedades estables y 3 pacientes con progresión de la enfermedad (tabla 2). Ninguno de los pacientes tuvo reinducción de ipilimumab.
Figura 1 Supervivencia global.
Figura 2 Supervivencia libre de progresión.
Efectos adversos
Los efectos adversos del tratamiento se encuentran listados en la tabla 3. El 20% de los pacientes tuvieron toxicidad secundaria a quimioterapia grado 3 y el 6% grado 4, siendo más comunes los relacionados a la inmunidad, específicamente aquellos relacionados a piel y tracto gastrointestinal. El tiempo promedio de resolución de estos efectos adversos fue de 3 semanas. El más común de los efectos adversos inmunes fue la diarrea, la cual se presentó en el 60% del total los pacientes y el 30% fue grado 3 o mayor. Posterior a la administración de esteroides en pacientes con diarrea grado 3 o mayor, el tiempo de resolución de este efecto adverso fue de 2.5 semanas. Ninguno de los pacientes con diarrea requirió el uso de infliximab (anticuerpo monoclonal dirigido contra el factor de necrosis tumoral alfa) para resolución de la misma. Uno de los pacientes posterior a una aplica- ción del medicamento, presentó colitis hemorrágica que requirió uso de esteroides orales y suspensión del medicamento. Un paciente tuvo hipofisitis autoinmune posterior a la tercera aplicación de ipilimumab, la cual fue controlada adecuadamente y no requirió la suspensión de la cuarta aplicación. Dos pacientes tuvieron rash grado 2 o menos, el cual fue controlado de forma adecuada con tratamiento tópico. No se encontraron defunciones relacionadas a la administración de ipilimumab.
Discusión
Dos grandes estudios fase III demostraron que ipilimumab mejoró significativamente la supervivencia global de pacientes con melanoma avanzado. En pacientes previamente tratados, en un ensayo controlado con placebo, 676 pacientes fueron asignados al azar en un rango de 3:1:1 a ipilimumab más la vacuna glucoproteína 100 (gp100), ipilimumab solo o gp100 sola. Todos los pacientes eran HLA-A*0201 positivos y tenían melanoma metastásico irresecable. Se limitó el reclutamiento a pacientes con este haplotipo debido al uso de la vacuna gp100. Todos los pacientes recibieron tratamiento sistémico previo para enfermedad avanzada, ya sea quimioterapia citotóxica o IL-27. El ipilimumab (3 mg/ Kg) y/o vacuna se administró cada 3 semanas por 4 dosis. Los pacientes con respuestas parciales, completas o enfermedad estable por 3 meses o más posterior al tiempo de inducción de 12 semanas, se les permitió recibir reinducción con el tratamiento original, si subsecuentemente se documentaba progresión de la enfermedad. El desenlace prima-rio fue supervivencia global, los autores encontraron una mejoría en supervivencia global mediana de 10 meses (IC 95%=8.5-11.5) en el grupo de ipilimumab más gp100 vs. gp100 sola, la cual fue de 6.4 meses (IC 95%=5.5-8.7; HR para muerte 0.68; p<0.001). Las supervivencia a un año en los grupos ipilimumab más gp100, ipilimumab y gp100 solos fueron de 44%, 46% y 25%, respectivamente; y a 2 años de 22%, 24% y 14%, respectivamente. Cuatro estudios fase II subsecuentes han demostrado actividad de ipilimumab independiente del haplotipo HLA8.
El segundo estudio fase III, evaluó el efecto de ipilimumab en pacientes con melanoma metastásico sin tratamiento previo. Se designaron al azar 502 pacientes a ipilimumab más dacarbazina vs. placebo más dacarbazina. Aproximadamente un cuarto de los pacientes recibieron tratamiento adyuvante previo por enfermedad localmente avanzada. Se excluyeron aquellos con enfermedad metastásica a sistema nervioso central, melanoma ocular, melanoma de mucosas o enfermedades autoinmunes. Todos los pacientes recibieron dacarbazina (850 mg/m2 intravenoso) cada 3 semanas por 8 ciclos, ante ausencia de progresión de la enfermedad o toxicidad significativa. Se designó al azar recibir ipilimumab a dosis de 10 mg/Kg o placebo en las semanas uno, 4, 7 y 10. En la semana número 24, los pacientes con enfermedad es-table o con respuesta objetiva fueron considerados pa- ra terapia de mantenimiento con ipilimumab a 10 mg/Kg o placebo administrado cada 12 semanas. Los autores lograron su desenlace primario con una mejoría en la super- vivencia global en el grupo asignado a ipilimumab más dacarbazina vs. dacarbazina más placebo, con una mediana de 11.2 meses (IC 95%=9.4-13.6) vs. 9.1 meses (IC 95%=7.8-10.5). Las supervivencias a uno, 2 y 3 años también favorecieron al tratamiento con ipilimumab (47% vs. 36%, 29% vs. 18% y 21% vs. 12%, respectivamente; HR para muerte 0.72; p<0.001). La tasa de control de la enfermedad (respuesta objetiva más enfermedad estable) no difirió entre ambos grupos (33% vs. 30%; p=0.41), ni la mejor tasa de respuesta (15% vs. 10%; p=0.09). La incidencia de toxicidad grado 3-4 fue mayor en el grupo de ipilimumab (56% vs. 28%), sobre todo del tipo autoinmune (colitis, rash, hipofisitis). El patrón de toxicidad y eficacia encontrado en este estudio no apoya el uso de dacarbazina con ipilimumab en combinación, ni el uso de este último a dosis de 10 mg/Kg comparado con la dosis aprobada de 3 mg/Kg9. Los resultados de nuestro estudio descriptivo en cuanto a supervivencia global, supervivencia libre de progresión y perfil de toxicidad son similares a estos 2 ensayos previamente publicados. No encontramos muertes relacionadas al uso de ipilimumab en los pacientes de nuestro Hospital y los efectos adversos fueron manejados de forma satisfactoria por el grupo médico.
Es importante recordar que los patrones de respuesta al tratamiento con los agentes moduladores de la respuesta inmune como ipilimumab, son muy diferentes a los de los agentes moleculares o la quimioterapia citotóxica, que son valorados con los criterios RECIST10. Los pacientes pueden presentar un empeoramiento transitorio de la enfermedad, manifestada como progresión de las lesiones conocidas o la aparición de nuevas lesiones antes de que la enfermedad se estabilice o el tumor desaparezca. Por lo tanto, se debe tener precaución ante el abandono temprano del tratamiento, lo cual no ocurrió en nuestro grupo de pacientes. Además, las respuestas pueden tomar más tiempo para que sean aparentes a diferencia de la terapia citotóxica. Algunos pacientes por lo tanto que no cumplen los criterios de respuesta objetiva pueden tener periodos prolongados de enfermedad estable que clínicamente son significativos11. Debido a lo anterior, en el presente estudio descriptivo la evaluación de los pacientes se hizo con estos criterios modificados para el tratamiento inmune de las neoplasias sólidas.
En un futuro tendremos más información de la utilidad del ipilimumab en otros contextos del melanoma. El grupo EORTC de melanoma está conduciendo un estudio fase III en pacientes con estadio III de alto riesgo (EORTC 18071, NCT00636168), en el cual posterior a resección quirúrgica completa, por designación al azar se asignó ipilimumab a dosis de 10 mg/Kg cada 3 semanas por 4 ciclos y posterior-mente, cada 12 semanas por un total de 3 años vs. placebo. Esto con la finalidad de determinar si este tratamiento previene recurrencia. El estudio ya completó reclutamiento y sus resultados están aún pendientes12.
Otro estudio está comparando ipilimumab vs. interferón alfa a altas dosis, en pacientes con melanoma resecado estadios IIIB, IIIC o IV, éste aún está reclutando pacientes (NCT01274338)13. Actualmente se requieren estudios clínicos que determinen la secuencia óptima de ipilimumab y terapias blanco, específicamente aquellos pacientes con mutaciones en BRAF, en los cuales ciertos subgrupos se pueden beneficiar primero de la administración de ipilimumab seguido de vemurafenib o dabrafenib14.
Una segunda vía inhibitoria es la del receptor PD-1, el cual es de retroalimentación negativa, expresándose en la superficie de los linfocitos-T activados. Cuando PD-1 se une a su ligando (PD-L1, generalmente presente en la superficie de las células tumorales), disminuye la capacidad de los linfocitos-T de montar una respuesta inmune efectiva. Existen anticuerpos dirigidos en contra de PD-1 (lambro- lizumab15) y PD-L1 (nivolumab16), que pueden aumentar la respuesta inmune del huésped en contra de las células malignas del melanoma. En la actualidad, ambos anticuerpos monoclonales contra PD-1 se están evaluando en estu- dios clínicos con designación al azar, tanto como monodrogas como en combinación con ipilimumab para el tratamiento del melanoma avanzado. La participación de los pacientes en estos ensayos clínicos se mantiene como una prioridad para este grupo, con el fin de mejorar sus desenlaces.
Conclusión
El uso de ipilimumab en pacientes con melanoma metastásico en el Hospital Médica Sur fue bien tolerado por los pacientes, con un perfil tóxico aceptable y tasas de respuesta con beneficio clínico similar a otras series publicadas previamente.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Centro Oncológico Integral "Diana Laura Riojas de Colosio",
Sótano de Hospital Médica Sur. Puente de Piedra N° 150,
Colonia Toriello Guerra, Delegación Tlalpan,
C.P. 14050, México D.F., México.
Teléfono: (0155) 54247282. Celular: (044) 5543658104.
Correo electrónico: ruiz82@gmail.com (José Manuel Ruiz-Morales).