Los antiinflamatorios no esteroideos (AINE) son uno de los grupos de fármacos más frecuentemente utilizados en la actualidad. Su uso implica riesgo de toxicidad gastrointestinal, que puede afectar tanto al tracto superior (úlcera péptica) como al inferior (gastroenteropatía por AINE).
La toma de AINE se ha relacionado con un empeoramiento clínico en pacientes con enfermedad inflamatoria intestinal. En este artículo realizamos una revisión acerca de la toxicidad gastrointestinal alta y baja de los AINE, centrada especialmente en los riesgos y datos característicos de estos fármacos en pacientes con enfermedad inflamatoria intestinal y establecemos recomendaciones para su uso en la práctica clínica. Aunque la evidencia es limitada, pautas cortas a dosis bajas de AINE parecen seguras y los datos indican que los inhibidores selectivos de la COX-2 son la opción más segura. Se debe evitar su uso a largo plazo o a dosis altas, sobre todo en pacientes con inflamación activa.
Non-steroidal antiinflammatory drugs (NSAIDs) are currently one of the most widely used drugs. The use of NSAIDs is associated with gastrointestinal toxicity, affecting both upper gastrointestinal tract (peptic ulcer disease) and lower gastrointestinal tract (NSAID-induced enteropathy).
NSAIDs use has been associated with an increased risk of clinical relapse in inflammatory bowel disease patients. In this article, we review the upper and lower gastrointestinal toxicity of NSAIDs, with a focus on the risks and specific data of these drugs in inflammatory bowel disease patients, giving recommendations for its appropriate use in the clinical practice. Although evidence is scarce, short-term use of NSAIDs appears to be safe, and the data available suggest that selective COX-2 inhibitors are the safer option. NSAIDs should be avoided as long-term treatment or with high doses, especially in patients with active inflammation.
Los antiinflamatorios no esteroideos (AINE) son una de las familias de fármacos más frecuentemente utilizadas en la actualidad, debido a su efecto antiinflamatorio, analgésico y antipirético. Los AINE engloban múltiples fármacos con estructura química heterogénea, que tienen en común su mecanismo de acción, basado en la inhibición de la enzima ciclooxigenasa (COX), que cataliza la síntesis de prostaglandinas a partir del ácido araquidónico. La COX tiene 2isoformas principales: COX-1, expresada en la mayoría de los tejidos de forma constitutiva, está implicada en el mantenimiento de la homeostasis, mediando la protección de la mucosa gástrica, la agregación plaquetaria y la regulación de la microcirculación renal; COX-2 es una isoenzima expresada en pocos tejidos, pero que es inducible por varios factores, sobre todo citocinas proinflamatorias. La distinción entre las funciones que median ambas isoenzimas no está muy definida. En este sentido, se cree que COX-1 tiene un papel importante en fases iniciales de la inflamación, previas a la inducción de COX-2.
Los AINE se suelen dividir en 2subclases: los clásicos o no selectivos y los inhibidores selectivos de la COX-2 (COXIB). Esta clasificación, útil desde un punto de vista práctico, es cuestionable, ya que todos los AINE inhiben hasta cierto punto ambas isoformas. De hecho, algunos AINE clásicos presentan una inhibición selectiva de COX-2 similar a la de los COXIB. Además, dentro de este grupo de fármacos se engloban moléculas con una estructura química heterogénea, lo que condiciona que cada fármaco tenga unos efectos particulares en función de sus características fisicoquímicas, influidos también por la susceptibilidad individual y las diferencias en cada tejido1.
Los AINE presentan principalmente efectos adversos gastrointestinales, cardiovasculares, renales y hepáticos. En relación con la toxicidad gastrointestinal, esta puede aparecer en cualquier tramo del tubo digestivo y se ha atribuido de forma habitual a la inhibición de la COX-1. Esta inhibición produce una reducción en la síntesis de prostaglandinas en el aparato gastrointestinal, inhibe la producción de moco y bicarbonato gástrico, la proliferación celular y el flujo sanguíneo mucoso. Sin embargo, este no es el único factor implicado en el daño gastrointestinal asociado a los AINE. Cada vez hay más evidencia disponible acerca de los mecanismos de acción independientes de la inhibición de las COX2. Estos factores se resumen en la tabla 1.
Mecanismos de toxicidad gastrointestinal de los AINE independientes de la inhibición de las COX
| Disrupción de capas de fosfolípidos | Presentes en el moco que recubre el epitelio gastrointestinal y en las membranas celulares --> Aumento de permeabilidad y exposición a sustancias presentes en la luz intestinal |
| Interacción con la fosforilación oxidativa mitocondrial | Atrapamiento iónico: son ácidos orgánicos débiles liposolubles, difunden a las células epiteliales y se ionizan en su citosol --> La forma ionizada interacciona con la membrana mitocondrial (aspecto hinchado en microscopía electrónica), mediando pérdida de integridad de uniones intercelulares y apoptosis |
| Secreción gástrica y biliar | Inhibición de secreción ácida se asocia a menor toxicidad gastrointestinal altaMuchos AINE y sus metabolitos presentan circulación enterohepática, con toxicidad también con uso parenteral. AINE sin este fenómeno apenas tienen toxicidad sobre intestino delgado |
| Microbiota intestinal | Relación bidereccional y cambiante: AINE modifican la microbiota y esta modula su toxicidadβ-glucuronidasa bacteriana deconjuga metabolitos de los AINE y aumenta su toxicidadLipopolisacárido de bacterias gramnegativas activa el TLR-4, implicado en el proceso inflamatorio y desarrollo de lesiones mucosas |
AINE: antiinflamatorios no esteroideos; COX: ciclooxigenasa; TLR-4: toll-like receptor 4.
Basada en Bjarnason et al.2.
En resumen, los mecanismos por los que los AINE producen lesiones sobre la mucosa gastrointestinal son complejos y no conocidos por completo. Esto está dando lugar a nuevas vías de investigación con el objetivo tanto de encontrar nuevas dianas terapéuticas como de comprender el efecto que ejercen los AINE sobre las vías de respuesta inflamatoria en la mucosa gastrointestinal, que pueden influir sobre enfermedades propias, como la enfermedad inflamatoria intestinal (EII).
Datos clínicosLesiones asociadas a AINE en tracto gastrointestinal superiorEn consumidores crónicos, el riesgo de úlcera péptica y complicaciones está aumentado en torno a 4 veces3. Lesiones como petequias y equimosis pueden encontrarse hasta en el 50% de los pacientes, aunque la mayoría no se detectan, al ser asintomáticas. La correlación clínica-endoscópica es baja, de tal forma que un gran porcentaje de pacientes consumidores de AINE presentan síntomas gastrointestinales sin lesiones detectables y, en ocasiones, una complicación es la forma de inicio de la enfermedad ulcerosa asociada a AINE1.
Los factores de riesgo para la aparición de lesiones en el tracto digestivo superior están bien establecidos4 y se resumen en la tabla 2.
Factores de riesgo de daño gastrointestinal alto asociado a AINE
| Edad avanzada | Especialmente>60 años. Aumenta alrededor de un 4% al año |
| Antecedente de úlcera péptica gastroduodenal | Tanto complicada como no complicadaFactor de riesgo más importante, con RR>10 |
| Combinación de AINE | Incluyendo COXIB y AAS a dosis bajas |
| Combinación con otros fármacos | Otros antiagregantesAnticoagulantes: no hay evidencia firme de que aumente el riesgo de desarrollar úlcera, sí de hemorragia, especialmente dabigatrán y rivaroxabánCorticoides: aumentan riesgo de úlcera y complicacionesInhibidores selectivos de recaptación de serotonina |
| Dosis alta de AINE | Relación dosis-dependiente |
| Tipo específico de AINE | RR muy variable, que oscila entre<2 con celecoxib o ibuprofeno hasta>5 con piroxicam o ketorolaco |
| Comorbilidad grave | Factor de riesgo independiente |
En consumidores crónicos, se ha detectado afectación mucosa de intestino delgado en hasta un 70% (petequias, pliegues eritematosos y áreas denudadas), con presencia de úlceras o erosiones en un 30-40%. En los últimos años, se ha producido un aumento significativo de ingresos por complicaciones en el tracto digestivo inferior en comparación con las del superior. Esto probablemente se deba a la existencia de estrategias de prevención bien definidas para las lesiones altas junto a una mayor disponibilidad de técnicas diagnósticas para el tracto digestivo inferior5.
La forma de presentación de la afectación de intestino delgado y colon por AINE es inespecífica y su patogenia no está tan bien establecida como la afectación gastroduodenal5,6. Las principales manifestaciones clínicas se resumen en la tabla 3.
Manifestaciones clínicas de la afectación del tracto digestivo inferior por AINE
| Inflamación o aumento de permeabilidad intestinal | Hallazgo más frecuente (60-70%). Fase inicial, generalmente asintomáticaSe puede detectar mediante test no invasivos: excreción urinaria de EDTA marcado con 51Cr, gammagrafía con leucocitos marcados con 111In (actualmente muy poco utilizadas), calprotectina fecalEn consumidores crónicos, puede persistir 1-3 años tras abandonar el consumo |
| Anemia ferropénica | Prevalencia en torno a un 30%Aumento del volumen de sangre en heces y mayor tasa de positividad de los test de SOHi (no parece afectar el rendimiento diagnóstico para detectar adenoma avanzado o CCR) |
| Enteropatía pierde proteínas o malabsorción | Escasa incidencia de casos clínicamente significativosSospechar en hipoalbuminemia no filiada en pacientes consumidores crónicosTambién se asocian a déficit de vitamina B12 |
| Úlceras mucosas | 30-40% de consumidores crónicosPueden aparecer tanto en intestino delgado como en colon (úlceras solitarias, colitis difusa o estenosis inflamatorias); también descritas con supositorios de AINE tópicos |
| Complicaciones graves | Hemorragia: riesgo de hemorragia digestiva baja aumentado 2,6 veces respecto a no consumidores. Es una de las etiologías más frecuentes de la hemorragia digestiva de origen oscuroPerforación intestinalObstrucción intestinal: se asocian a estenosis inflamatorias o fibróticas (cicatriciales) |
| Otras manifestaciones | Estenosis diafragmáticas: poco frecuentes (2%) pero muy características. Pueden aparecer en intestino delgado o colon, lo más habitual es en intestino delgado distal en forma de estenosis múltiples. Si son sintomáticas, puede ser preciso dilatación endoscópica o cirugíaEnfermedad diverticular sintomática y diverticulitis complicada: datos observacionales |
Los factores de riesgo en esta localización no son superponibles a los del tracto superior, aunque algunos (edad avanzada, toma concomitante de AAS o antiagregantes) aumentan el riesgo en ambas localizaciones. Un estudio realizado en pacientes sintomáticos diagnosticados de enteropatía asociada a AINE identificó como factores de riesgo la presencia de comorbilidad (OR=2,97), el uso de diclofenaco (OR=7,05) y de oxicams (OR=2,97). También se encontró asociación entre polimorfismos genéticos del citocromo P450 y la presencia de lesiones, en concreto de CYP2C9*3 con estenosis diafragmáticas7.
Cómo actuar en la prácticaAntiinflamatorios no esteroideos, inhibidores selectivos de la COX-2 y riesgo cardiovascularTras la aparición de los COXIB, se detectó un aumento del riesgo cardiovascular asociado a estos fármacos, lo que motivó la retirada del mercado de rofecoxib en 2004. Sin embargo, los AINE clásicos también se asocian a un aumento del riesgo cardiovascular. En un metaanálisis publicado en 2014, el riesgo de eventos cardiovasculares fue similar para diclofenaco a dosis altas, ibuprofeno y COXIB; el naproxeno fue el AINE de menor riesgo cardiovascular y celecoxib, el COXIB más seguro3.
Datos de un ensayo clínico (que incluía a más de 20.000 pacientes con enfermedad reumatológica que precisaban tratamiento a largo plazo con AINE y con factores de riesgo cardiovascular) avalan esta seguridad cardiovascular del celecoxib. Se concluyó que a dosis bajas (200mg diarios) no se asocia a un riesgo cardiovascular mayor que ibuprofeno o, incluso, que naproxeno. En esta misma cohorte, la frecuencia de complicaciones gastrointestinales y anemia ferropénica fue menor en el grupo de celecoxib que en los otros 2AINE, aunque con una frecuencia baja en los 3grupos (<1%), posiblemente debido a que se incluyó a pacientes con riesgo gastrointestinal bajo8. En otro ensayo clínico con diseño similar pero que incluía a pacientes que además tenían alto riesgo gastrointestinal (hemorragia ulcerosa previa), la tasa de recidiva hemorrágica fue del 6% con celecoxib combinado con un inhibidor de la bomba de protones (IBP) frente al 12% de naproxeno+IBP9. Así pues, celecoxib a dosis bajas podría ser la opción más segura en pacientes con alto riesgo tanto cardiovascular como gastrointestinal.
Tratamiento de lesiones del tracto gastrointestinal superiorRespecto a la prevención de lesiones altas, son posibles 2principales estrategias:
- •
Combinar AINE con un fármaco gastroprotector: el tratamiento de elección son los IBP, ya que han demostrado ser superiores a los antagonistas del receptor-2 de la histamina en la prevención de úlceras asociadas a AINE y sus complicaciones. La eficacia del misoprostol es comparable a la de los IBP, pero la alta frecuencia de efectos adversos gastrointestinales hace que sea habitual la retirada del fármaco, lo que limita su uso10.
- •
Utilización de COXIB: los COXIB se asocian a menor riesgo de úlcera péptica, complicaciones ulcerosas y síntomas gastrointestinales. La combinación de COXIB+IBP se ha asociado al menor riesgo de complicaciones gastrointestinales altas. El riesgo es mayor en pacientes tratados con COXIB aislados y aún mayor con AINE cásicos+IBP10.
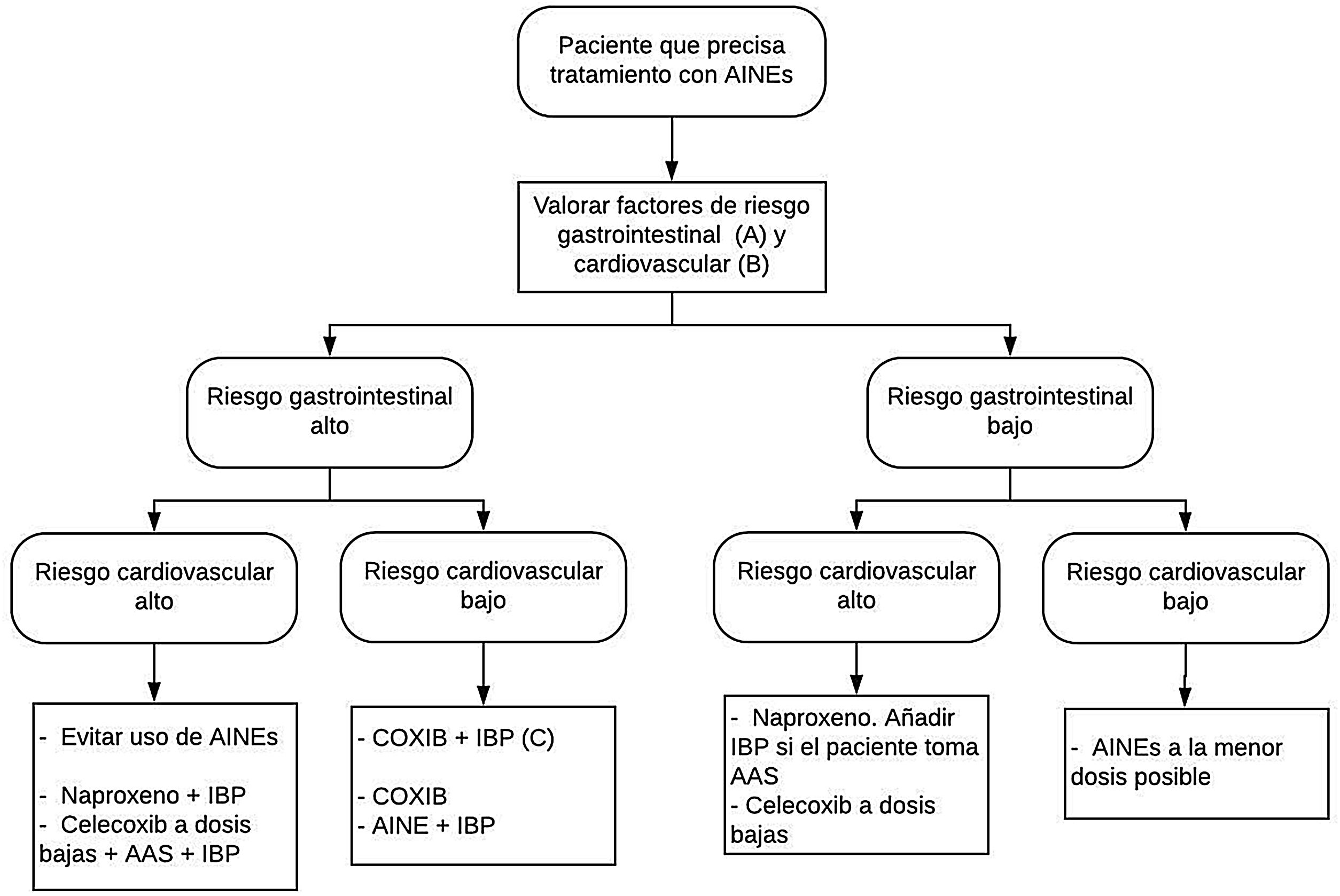
En función del riesgo cardiovascular y gastrointestinal de cada paciente, la elección de la estrategia más adecuada se resume en la figura 1.
Estrategias de tratamiento con AINE según el riesgo cardiovascular y gastrointestinal. Modificado de Sostres et al.4.
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; COXIB: inhibidores selectivos de la COX-2.
A) Riesgo gastrointestinal alto: presencia de factores de riesgo (edad ≥ 60 años, patología ulcerosa previa, tratamiento concomitante con antiagregantes/anticoagulantes/corticoides/varios AINE/AAS).
B) Riesgo cardiovascular alto: emplear escalas validadas (Framingham, SCORE). Antecedentes de diabetes mellitus o de eventos cardiovasculares.
C) COXIB+IBP en pacientes de muy alto riesgo gastrointestinal (antecedente de hemorragia digestiva por úlcera péptica o múltiples factores de riesgo).
El tratamiento de las lesiones en tracto digestivo inferior está menos establecido. La única medida claramente eficaz es suspender la toma de AINE11.
Es importante destacar que los IBP no previenen las lesiones ulcerosas más allá del duodeno. Incluso algunos estudios señalan que el tratamiento con IBP podría agravarlas, en posible relación con los cambios en la microbiota asociados a los IBP12. La evidencia existente acerca del aumento del daño mucoso en el intestino delgado por la toma concomitante de AINE/AAS con IBP se basa en estudios experimentales en modelos animales y en datos de estudios observacionales sujetos a sesgos, por lo que son necesarios nuevos estudios específicamente diseñados a responder esta pregunta para dar una recomendación sólida.
Misoprostol es el fármaco con mayor evidencia para el tratamiento de las lesiones de intestino delgado asociadas a AINE, al haber demostrado en ensayos clínicos una mayor tasa de curación mucosa y recuperación de la anemia11. La alta frecuencia de efectos secundarios limita su utilización, pero con la evidencia disponible se trata del fármaco de primera línea en la actualidad. Su mala tolerancia es especialmente relevante en pacientes con EII, donde la aparición de diarrea como efecto secundario puede ser en ocasiones indistinguible de un brote real de la enfermedad.
La seguridad de los COXIB en el tracto gastrointestinal inferior es controvertida. En algunos ensayos clínicos se ha reportado una menor frecuencia de lesiones en intestino delgado y colon, con una diferencia de riesgo similar a la del tracto digestivo alto, mientras que en otros no se encontraron diferencias significativas entre AINE clásicos y COXIB5,11. Las discrepancias presentes entre estudios se deben, en parte, a no incluir los mismos AINE y a sus dosis, no siempre equivalentes.
Se han propuesto otros tratamientos que, a día de hoy, disponen de menos evidencia. Rebamipide, un fármaco que estimula la producción de prostaglandinas y moco en el epitelio gastrointestinal, ha demostrado en ensayos clínicos que disminuye la frecuencia de úlceras en el intestino delgado. Se debe tener en cuenta el pequeño tamaño muestral de estos ensayos y que los datos de este fármaco provienen en su totalidad de población asiática11. En relación con el papel de la microbiota en la patogenia de estas lesiones, el tratamiento con rifaximina o con el probiótico Lactobacillus casei se han asociado a una disminución en el número de erosiones y úlceras12. También se han postulado tratamientos inmunosupresores y antiinflamatorios. Datos observacionales en pacientes con artritis reumatoide indican que el tratamiento con anti-TNF podría disminuir las lesiones en intestino delgado asociadas a AINE13. Estos datos provenientes de estudios en animales o ensayos no controlados tienen un valor relativo: son útiles para establecer hipótesis o aportar información acerca de la fisiopatología del daño intestinal mediado por AINE, pero hasta que no se confirmen en ensayos controlados no se pueden establecer recomendaciones al respecto.
Antiinflamatorios no esteroideos y enfermedad inflamatoria intestinalFisiopatología y datos clínicosExisten varios puntos que tener en cuenta cuando se valora la influencia de los AINE en la EII. En primer lugar, y como ya se ha mencionado, la heterogeneidad de las lesiones asociadas a AINE en el tracto digestivo inferior hace que en ocasiones sea difícil el diagnóstico diferencial entre enteropatía/colitis por AINE y EII, ya que los hallazgos endoscópicos en muchas veces son indistinguibles. En casos dudosos, la histología y la evolución tras la retirada del fármaco ayudan al diagnóstico definitivo14.
Por otra parte, existe controversia acerca de si los AINE pueden estar relacionados tanto con el inicio como con la aparición de brotes de la enfermedad, en relación con la modulación de la respuesta inmune en la mucosa intestinal que producen estos fármacos.
Antiinflamatorios no esteroideos como factor de riesgo de enfermedad inflamatoria intestinalVarios estudios vinculan el tratamiento crónico con AINE con un mayor riesgo de inicio de EII. Un estudio de cohortes publicado en 2012 en el que se siguió durante 18 años a más de 72.000 mujeres estadounidenses de entre 40 y 73 años, con unos 120 casos incidentes de enfermedad de Crohn (EC) y colitis ulcerosa (CU), detectó entre otros factores de riesgo que la toma de AINE durante más de 15 días al mes se asoció a un mayor riesgo de diagnóstico de ambas enfermedades, con unos RR de 1,59 para EC (IC 95%: 0,99-2,56) y 1,87 (1,16-2,99) para CU. Dosis más bajas o el consumo de AAS no se asociaron a un mayor riesgo15.
Sin embargo, otro estudio que siguió durante más de 10 años a una cohorte de más de 130.000 personas (hombres y mujeres) en Europa, tras 35 casos incidentes de EC y 84 de UC reportó un aumento de riesgo de EC de hasta 6 veces (OR 6,14; IC 95%: 1,76-21,3) en pacientes consumidores crónicos de AAS, pero sin encontrar asociación entre AAS y CU16.
Una limitación de este estudio que podría justificar la discordancia entre asociaciones es que el cuestionario que emplearon solo recogía información acerca de sexo, edad, hábito tabáquico y tratamiento con AAS (sin recoger su indicación ni información clínica previa), por lo podría haber un sesgo, de tal forma que el consumo de AAS fuera un marcador de manifestaciones clínicas cardiovasculares o articulares previas al diagnóstico de la EC.
En conclusión, aunque sí parece haber cierta relación entre el tratamiento con AINE y el riesgo de inicio de EII, la evidencia respecto al AAS como factor de riesgo de EII no es firme.
Antiinflamatorios no esteroideos y riesgo de brote de enfermedad inflamatoria intestinalLa evidencia acerca de si el tratamiento con AINE aumenta el riesgo de brote de EII es también controvertida. Un estudio de cohortes publicado en 2016 siguió a 791 casos de EII en remisión durante 6 meses, de los cuales 247 con EC y 89 con CU consumían de forma frecuente AINE. En este estudio, los pacientes con EC que consumían 5 o más dosis de AINE al mes tenían un mayor riesgo de brote (RR 1,65; IC 95%: 1,12-2,44), mientras que en pacientes con CU no aumentaba el riesgo. Dosis menores no aumentaban el riesgo de brote de CU o EC. Los autores concluyen que la toma frecuente de AINE a largo plazo puede ser un factor de riesgo de exacerbación de EC17.
Los datos de una cohorte de 629 pacientes con EII seguidos durante 5 años indican que tratamientos cortos con dosis bajas de AINE son bien tolerados, mientras que el uso de dosis altas de AINE se asoció a un empeoramiento en las escalas clínicas en pacientes con EC con afectación de colon, aunque sin un aumento significativo en el riesgo de brote. No se encontraron diferencias en pacientes con CU ni en pacientes con EC con afectación ileal aislada18.
La evidencia más firme proviene de un metaanálisis publicado en 2018, que incluyó 24 estudios (la mayoría observacionales y con una heterogeneidad moderada-alta) y concluyó que no hay relación entre la toma de AINE y el riesgo de brote tanto de EC (RR 1,42; IC 95%: 0,65-3,09) como de CU (RR 1,52; IC 95%: 0,87-2,63). Se debe señalar que cuando se analizaron solo los estudios con bajo riesgo de sesgos (heterogeneidad baja), sí que se detectó un sutil pero significativo aumento de riesgo de brote de EC en pacientes consumidores de AINE (RR 1,53; IC 95%: 1,08-2,16), mientras que no se encontraron diferencias significativas para el riesgo de brote de CU ni para todos los casos de EII en general. Al contrario de lo ocurrido con los AINE, sí que reportó un aumento de riesgo de brote de EII significativo en pacientes en tratamiento con paracetamol (RR 1,56; IC 95%: 1,22-1,99), aunque este metaanálisis incluyó solo 2 estudios19.
Long et al., en el estudio de cohortes mencionado, también encontraron una asociación entre el tratamiento con paracetamol y el riesgo de brote de EC (RR 1,72; IC 95%: 1,11-2,68)17. Sin embargo, hay que señalar que estos riesgos relativos son bajos y pueden estar sujetos a sesgos (la toma de paracetamol/AINE puede estar motivada por inflamación mal controlada o dolor articular previos al brote de EII).
En contraste con estos resultados, en otro estudio en el que se incluyó a 209 pacientes con EII en fase de remisión y a los que se les administró tratamiento durante 4 semanas con diferentes AINE o paracetamol, la tasa de brotes fue del 28% en los tratados con naproxeno, 24% en los tratados con indometacina, 17% en los tratados con diclofenaco, mientras que ningún caso tratado con AAS o paracetamol sufrió un brote. En este estudio, la mayoría de los brotes tuvieron lugar durante los 2-9 primeros días tras haber iniciado el tratamiento20.
Respecto al COXIB, los estudios que aportan una evidencia de mayor calidad señalan que el tratamiento con COXIB no aumenta el riesgo de exacerbación de EII. Un ensayo clínico doble ciego publicado en 2006 incluyó a 222 pacientes con CU en fase quiescente (controlados con 5-ASA o inmunosupresores) que requerían tratamiento con AINE. A estos pacientes se les aleatorizó a recibir celecoxib 200mg o placebo 2 veces al día durante 14 días. El tratamiento con celecoxib no aumentó el riesgo de exacerbaciones (RR 0,73; IC 95%: 0,17-3,18)21. En otro ensayo clínico se incluyó a 146 pacientes con EII (tanto EC como CU) con actividad inflamatoria variable y que precisaban tratamiento antiinflamatorio por clínica articular. Fueron aleatorizados a recibir etoricoxib o placebo durante 3 meses y, de nuevo, no se encontraron diferencias significativas entre ambos grupos (RR 0,92; IC 95%: 0,37-2,32)22. Estos datos contrastan con los de otros estudios en los que sí se encontró asociación entre el uso de COXIB y el riesgo de brote, aunque la mayoría de estos estudios son observacionales y con menor tamaño muestral. Tanto la revisión sistemática citada19 como una revisión Cochrane publicada en 201423 concluyen que no hay evidencia suficiente respecto a la seguridad de los COXIB en pacientes con EII, ya que, aunque datos de ensayos clínicos parecen indicar que no aumentan el riesgo de brote, el número de eventos fue bajo y el tiempo de seguimiento, corto.
Los mecanismos por los que los AINE podrían inducir brotes o empeoramiento clínico en los pacientes con EII son superponibles a los que producen el daño gastrointestinal en pacientes con mucosa previamente sana. En este sentido, un estudio en el que se administraron AINE con diferentes mecanismos de acción a pacientes con EII indica que es precisa la inhibición tanto de COX-1 como de COX-2 para que aumente el riesgo de brote (no aumentado al administrar inhibidores específicos de COX-1 o COX-2)20. Estos hallazgos se correlacionan con los de otro estudio en modelo animal, en el que ratones nockout sin actividad COX-1 presentaban todos ellos descenso en las prostaglandinas de la mucosa intestinal en torno al 95-97%, pero solo presentaban lesiones si también se inhibía la COX-2.
La inhibición aislada de COX-2 a largo plazo también se asoció con úlceras en intestino delgado, pese a niveles de prostaglandinas normales24. Se cree que COX-2 tiene un papel relevante en los mecanismos de inflamación y reparación de la mucosa intestinal en pacientes con EII. En biopsias de pacientes con EII, la concentración de ARNm COX-2 es mayor que en controles sanos, y aumenta conforme aumenta la actividad, mientras que no hay diferencias en la de ARNm COX-1.
Estos hallazgos son superponibles a los de otro estudio en el que se analiza material de piezas quirúrgicas de pacientes intervenidos de EII con hallazgo de niveles significativamente mayores de COX-2 y prostaglandina E2 (PGE2) en comparación con pacientes intervenidos por enfermedad diverticular25.
Influencia de los antiinflamatorios no esteroideos en la respuesta a los tratamiento en la enfermedad inflamatoria intestinalOtro aspecto que tener en cuenta es si los AINE pueden influir en la respuesta de la EII al tratamiento específico de esta enfermedad. Se ha postulado que la actividad COX-2 en el epitelio intestinal puede, además de modular la respuesta inflamatoria, influir en la respuesta al tratamiento con anti-TNF.
En un estudio se evaluó la actividad COX-2 en biopsias de colon y en monocitos en sangre periférica de pacientes con CU tratados con infliximab al inicio del tratamiento y en la semana 14, diferenciando entre respondedores, no respondedores o controles (voluntarios sanos). Se observó que en monocitos de pacientes no respondedores la activación basal de COX-2 era más alta y no se modificaba con anti-TNF, pero que en pacientes respondedores había un aumento de la actividad COX-2 transitorio tras el tratamiento anti-TNF. La activación constante de COX-2 en no respondedores induce una producción continua de PGE2 que se relaciona con persistencia de inflamación en la mucosa. Concluyen que una incapacidad de regular la actividad COX-2-PGE2 podría ser un marcador de mala respuesta a anti-TNF e inflamación mantenida, de forma que la actividad inducible COX-2 con un aumento de síntesis puntual de PGE2 favorece la cicatrización mucosa, mientras que la activación mantenida perpetúa la inflamación. Así pues, la expresión basal de COX-2 en los monocitos de pacientes con CU podría ser un marcador para determinar qué pacientes tienen más posibilidades de responder al tratamiento con anti-TNF26.
La disrupción de las capas de fosfolípidos es uno de los mecanismos mediante los que los AINE dañan el epitelio gastrointestinal2. En la mucosa de pacientes diagnosticados de CU se ha observado que los niveles de fosfolípidos están reducidos hasta un 70%. Por tanto, se ha postulado que el tratamiento con fosfolípidos podría ser una alternativa terapéutica en estos pacientes. Sin embargo, en los ensayos clínicos realizados hasta la fecha, no han demostrado diferencias significativas en la tasa de curación de la mucosa respecto a placebo, aunque sí se han asociado a mejoría de las escalas clínicas27.
Cómo pueden estos mecanismos (actividad COX-2, fosfolípidos) verse modulados por la toma de AINE y, por tanto, modificar el curso de la EII deberá evaluarse en futuros estudios.
Uno de los principales marcadores no invasivos para el seguimiento de la actividad inflamatoria en pacientes con EII es la calprotectina fecal. La toma de AINE por sí sola se asocia a un aumento en el nivel de este marcardor, por lo que en pacientes con EII se debe siempre tener en cuenta la toma de estos fármacos a la hora de interpretar los resultados. Se ha observado que, tras 2 semanas de retirada de los AINE, el nivel de calprotectina fecal se normaliza28.
Cómo actuar en la prácticaLos documentos de consenso vigentes, con base en esta evidencia, reconocen que no hay prueba que avale que no se deban prescribir AINE en pacientes con EII en caso necesario y que una pauta corta es poco probable que sea perjudicial29. De forma similar, las guías que marcan el manejo de la artropatía asociada a EII también recomiendan el tratamiento con pautas cortas de AINE para la espondiloartropatía asociada a EII (junto con fisioterapia). No recomiendan el uso de AINE a largo plazo y dejan como segundo escalón el tratamiento precoz con anti-TNF en aquellos pacientes intolerantes o refractarios a AINE. En los casos de artritis periférica, el control de la actividad inflamatoria intestinal suele ser suficiente, pero también se pueden emplear pautas cortas de AINE para lograr alivio sintomático30.
Se debe tener en cuenta que la mayoría de los datos disponibles provienen de estudios observacionales, o con pequeño tamaño muestral, lo que aporta evidencia poco sólida que no permite extraer conclusiones muy fundadas. Por otra parte, existe importante variabilidad interindividual e intraindividual en los efectos terapéuticos y tóxicos de los AINE, lo que todavía dificulta más la obtención de evidencia de calidad. Esta variabilidad parece relacionada con factores genéticos (polimorfismos en genes que codifican el citocromo P450 y las isoformas de COX) y con otros factores, como la interacción bidireccional de los AINE con la microbiota intestinal12.
Como conclusión, actualmente no hay evidencia suficiente para afirmar que los AINE (ya sean clásicos o COXIB) inducen un aumento del riesgo de brote de EII. Parece que podría haber un leve aumento de riesgo de brote, en especial, en pacientes con EC que consumen con frecuencia AINE. De igual forma, los COXIB parecen una alternativa más segura, sin que existan estudios con alta fiabilidad que reporten un aumento de riesgo de brote. Pautas cortas a dosis bajas de AINE son seguras y no se deben evitar en pacientes con EII si se consideran necesarios, pero hasta que no aparezca evidencia más sólida que avale su seguridad se debe evitar su uso a largo plazo o a dosis altas en pacientes con EII, sobre todo en pacientes con EC o con actividad inflamatoria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.