INTRODUCCION
Las bacterias ácido lácticas se utilizan para la elaboración de alimentos fermentados desde hace más de 4.000 años, tanto por su capacidad para la preservación de los alimentos como por las características de sabor y textura que les confieren. Además, durante siglos se les han atribuido diversas cualidades profilácticas y terapéuticas, que van desde la mejora del bienestar hasta el aumento de la longevidad1. Este tipo de alimentos que contienen microorganismos vivos y con efectos sobre la salud son referidos actualmente como probióticos2.
En este sentido, numerosas evidencias demuestran de manera inequívoca que el yogur reduce tanto la maldigestión como la intolerancia a la lactosa. Sin embargo, los mecanismos que dan lugar a la mejora de la tolerancia a la lactosa, así como las diferentes respuestas fisiológicas originadas por los distintos tipos de leche fermentada, no son bien conocidos3,4.
LA ENZIMA LACTASA
La lactosa es un disacárido constituido por galactosa y glucosa unidos por un enlace β1,4 (O-β-D-galactopiranosil-[1,4]- β-D-piranósido). Este azúcar se encuentra en la leche de los mamíferos y su concentración está inversamente relacionada con el contenido graso y proteico de la misma5. La leche humana es la de mayor concentración en este azúcar, con aproximadamente 7 g/100 ml6.
La utilización nutritiva de la lactosa requiere una hidrólisis previa realizada por la enzima lactasa (lactosa-phlorizin-hidrolasa [LPH]) en sus monosacáridos constituyentes, galactosa y glucosa, que con posterioridad serán activamente absorbidos en el intestino delgado7. El gen que codifica la LPH se ha localizado en el brazo largo del cromosoma 2 abarcando 17 exones8 y se expresa de manera específica en los enterocitos diferenciados del intestino delgado9.
La enzima responsable de la hidrólisis de la lactosa presente en la leche y otros productos lácteos, la lactasa, presenta un típico patrón de actividad a lo largo de la vida de los mamíferos10. Así, la actividad enzimática se detecta en el intestino fetal a partir de la octava semana de gestación, aumentando gradualmente hasta la semana 34 y con mucha mayor velocidad hasta el momento del nacimiento, donde alcanza su máxima expresión. En este sentido, se observa que la actividad enzimática es entre 2 y 4 veces mayor en el neonato que en los niños de entre 2 y 11 meses de edad, y permanece alta hasta el destete, cuando la leche es el principal alimento, comenzando a declinar hasta resultar muy baja en la edad adulta11.
Los mecanismos que regulan el descenso de la actividad lactasa han sido objeto de interés científico durante mucho tiempo. La explicación más obvia residiría en la dependencia de la actividad enzimática de la disponibilidad de sustrato y, así, a menores cantidades de lactosa en la dieta les corresponderían menores actividades lactasa10. Sin embargo, los datos disponibles hasta el momento sobre la estructura, función, tamaño y glucosilación de la enzima parecen señalar que no existe esta dependencia, ya que una reducida actividad enzimática estaría causada por un descenso en la expresión del gen de la lactasa implicado en la síntesis de lactasa, y no por la presencia de diferentes formas activas o inactivas de la enzima en la mucosa intestinal12,13.
Las evidencias disponibles indican que la persistencia o la no persistencia de la actividad lactasa en los adultos depende de un polimorfismo genético que determina elevadas o bajas expresiones del ARNm. Así, la «no persistencia de actividad lactasa» se debería a un rasgo autosómico recesivo y la «persistencia de la actividad lactasa» sería de carácter dominante, determinado tanto por un genotipo heterocigótico como homocigótico para el alelo dominante14.
TERMINOLOGIA Y ANTECEDENTES RELACIONADOS CON LA INTOLERANCIA A LA LACTOSA
El término «hipolactasia» implica una muy baja actividad enzimática en la mucosa yeyunal15, mientras que la «deficiencia de lactasa» y «alactasia» implican una ausencia total de actividad lactasa16. El límite entre baja y adecuada actividad lactasa difiere entre los diferentes laboratorios y centros sanitarios. Sin embargo, la clasificación implica dos categorías: la de los individuos con hipolactasia y la de aquellas personas con moderada o alta actividad («normal») enzimática17.
Los términos «malabsorción» y «maldigestión» de lactosa describen una escasa capacidad hidrolítica de lactosa, que puede ser identificada por diferentes métodos diagnósticos (tabla I)18 y que casi siempre implica hipolactasia, utilizándose indistintamente en la literatura científica.
La «intolerancia a la lactosa» es la respuesta sintomática al consumo de lactosa y, aunque la hipolactasia es una situación que no produce malestar per se, a menudo los episodios gastrointestinales, de diferente consideración e intensidad, aparecen en individuos malabsorbedores tras la ingesta de este disacárido19.
La existencia de hipolactasia no se había relacionado con manifestación clínica alguna hasta hace unos años, aunque inicialmente se encontró que, en ocasiones, la ingesta de lactosa causaba diarrea en los niños. En 1959, un grupo de investigadores describía a 2 hermanos con diarreas acuosas desde el nacimiento y con muy baja actividad lactasa en el intestino delgado, que podrían deberse a la lactosa no absorbida20. Posteriormente, este hallazgo permitió que se documentara un gran número de casos de niños con baja actividad lactasa congénita. Así, en 1963, dos grupos de investigadores describían independientemente a adultos con muy baja actividad lactasa intestinal, pero cuyas historias clínicas no reflejaban deficiencias congénitas, concluyendo así que la actividad enzimática habría descendido con posterioridad al nacimiento21,22.
La mayor parte de las investigaciones sobre maldigestión de lactosa en humanos estaba basada en procedimientos de determinación directa de la actividad disacaridasa en las biopsias intestinales, y condujo a la observación de que la actividad lactasa en el intestino delgado podía estar prácticamente ausente en adultos con mucosas histológicamente normales23. Estas observaciones confirmaron que la prevalencia de hipolactasia en la edad adulta es alta en diferentes poblaciones; y además, que las áreas geográficas de mayor prevalencia se corresponden con zonas donde los adultos apenas consumen leche, y viceversa24.
ETIOLOGIA
La deficiencia de lactasa se puede clasificar en tres tipos en función de su origen: congénita, primaria y secundaria.
La deficiencia congénita de lactasa es un error metabólico muy poco frecuente y está determinada por una alteración autosómico-recesiva extensamente descrita25. Ésta se caracteriza por la ausencia total o la reducción importante de la enzima desde el nacimiento y que permanecerá a lo largo de toda la vida. Las diarreas acuosas que desarrollan los niños recién nacidos tras la ingesta de leche u otros productos que contienen lactosa son un síntoma típico de la deficiencia congénita26.
La deficiencia primaria de lactasa, también llamada no persistencia de lactasa, es la más común de los tres tipos y aparece a los pocos años del nacimiento, por lo que se la denomina la hipolactasia del adulto. El momento o la edad en la que la actividad enzimática comienza a declinar podría estar genéticamente determinado15. En este sentido, se observa que en las poblaciones en las que la prevalencia entre la población adulta es elevada (más del 80%) comienza a manifestarse entre los 2 y los 7 años de vida, mientras que en las poblaciones en las que las cifras de hipolactasia son menores (50-70%) podría prolongarse hasta los 11-14 años24.
En algunos grupos poblacionales de raza blanca en los que la prevalencia no supera el 25%, la actividad lactasa continúa hasta los 20 años de vida, comenzando el descenso más tarde que en otras poblaciones, aunque nunca antes de los 4-5 años15,27.
La deficiencia secundaria de lactasa es una condición que aparece en diferentes situaciones que afectan a la mucosa intestinal en individuos cuya actividad enzimática es normalmente activa. Así, las deficiencias importantes en la ingesta de proteínas, el consumo de determinados fármacos y otras condiciones patológicas podrían causar daños de diversa consideración en los enterocitos del yeyuno28. El desarrollo de hipolactasia secundaria dependerá de la gravedad y duración del daño originado en la mucosa29. Algunas de estas situaciones son de carácter reversible y, una vez resuelto el origen de la malabsorción, ésta desaparece, mientras que en otros el daño podría ser de carácter permanente30.
EPIDEMIOLOGIA DE LA HIPOLACTASIA
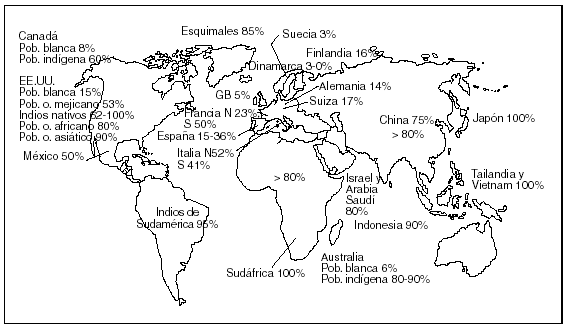
La prevalencia de la hipolactasia del adulto varía considerablemente entre diferentes razas y áreas geográficas, e incluso entre subpoblaciones y tribus (fig. 1)31. En general, se puede afirmar que entre los europeos blancos y sus descendientes (norteamericanos y australianos), la prevalencia de malabsorción es habitualmente inferior del 30%, y sólo en algunos casos supera el 60%, mientras que entre las poblaciones asiáticas y africanas, con la excepción de determinadas subpoblaciones (beduinos en Jordania, algunas tribus nómadas africanas o Arabia Saudí), las cifras superan el 70%, incluso llegan al 100% de la población en algunos casos28.
Fig. 1. Prevalencia de malabsorción de lactosa. Pob. o.: población de origen; N: norte; S: sur; GB: Gran Bretaña. Adaptada de Bourlioux y Pochart (1988)31 y actualizada con la bibliografía citada.
Por otra parte, diferentes estudios han demostrado que la prevalencia de malabsorción entre los inmigrantes de los EE.UU. refleja la frecuencia de hipolactasia de las áreas geográficas de las que emigraron, y en las poblaciones mixtas, la prevalencia es intermedia entre los dos grupos parentales28. En general, la prevalencia de maldigestión se estima en el 15% de la población de raza blanca, el 53% en los estadounidenses de origen mexicano, desde el 62 hasta el 100% entre los nativos norteamericanos, el 80% entre los afroamericanos y el 90% entre los asiáticos-americanos32.
Los factores que determinan las diversas cifras de prevalencia parecen estar en relación con el consumo de leche, la única fuente natural que aporta lactosa, favoreciendo una selección natural en favor del gen de persistencia de lactasa en los lugares de elevado consumo. En este sentido, si se comparan las áreas «consumidoras de leche» y las «no consumidoras de leche» en el mundo, con el mapa de persistencia/deficiencia de lactasa, se observa que las áreas no consumidoras de leche coinciden con las de deficiencia de la enzima, y viceversa10.
La frecuencia de individuos malabsorbedores de lactosa en Europa parece aumentar en dirección sur y este28, alcanzando cifras cercanas al 70% en las regiones del sur de países mediterráneos como Turquía e Italia33; esta frecuencia de hipolactasia es muy similar a la de los países del otro lado del Mediterráneo, con la excepción de España. Así, se han encontrado con frecuencias del 28% en Valencia34, del 32,5% en Galicia35, del 13-15% en Barcelona36, del 36% en un estudio realizado en una pequeña población de ancianos en Madrid37 y del 17% en una población de estudiantes universitarios en Navarra38.
Por debajo del 10% se encuentran englobados, además de los países escandinavos, que presentan cifras de entre el 1 y el 3%, Inglaterra39, Irlanda, Holanda o el noroeste de Alemania. Por otra parte, en el sector central y en dirección norte, la prevalencia no supera el 25% en regiones como la ribera del Loira en Francia, los Alpes o los márgenes del este de países o regiones como Austria, Bohemia y Alemania40.
En Francia, la prevalencia aumenta de norte (23%) a sur (50%), y de oeste (23%) a este (42%), en consonancia con los resultados obtenidos, asimismo, en un reducido estudio con 55 sujetos en el área geográfica de los Alpes41.
METABOLISMO DE LA LACTOSA EN LA HIPOLACTASIA E INTOLERANCIA A LA LACTOSA
En la hipolactasia, la mayor parte de la lactosa permanece sin hidrolizar en el yeyuno y, posteriormente, alcanza el colon, donde las bacterias de la flora intestinal la fermentan produciendo ácidos grasos de cadena corta y gases42.
La degradación in vitro de lactosa produce ácidos acético, butírico, propiónico, succínico, láctico y fórmico, entre otros43. Estos resultados son difícilmente trasladables a situaciones in vivo, debido a que estos productos de fermentación pueden volver a ser metabolizados por la flora bacteriana o ser rápidamente absorbidos por el intestino grueso44. En este sentido, algunos productos, como los ácidos pirúvico y succínico, son sólo productos intermedios en la formación de otras sustancias, mientras que otros, como el acético, butírico y propiónico, se absorben en el ciego y el colon ascendente para ser utilizados por diferentes tejidos6,45.
Los principales gases resultantes de la fermentación bacteriana son el dióxido de carbono, el hidrógeno y, tras una reutilización de estos sustratos por la flora metanogénica, el metano. La mayor parte de estos gases será absorbida de forma activa desde el intestino hacia la sangre y excretadas parcialmente por los pulmones, mientras que una cierta cantidad dará lugar a flatulencias46.
La eficiencia en la metabolización de la lactosa en el intestino se encuentra determinada no sólo por la actividad lactasa en la mucosa, sino también por otros factores, entre los que se encuentran: la cantidad de lactosa en el intestino, los tiempos de vaciamiento gástrico y tránsito intestinal, la capacidad de la microflora intestinal de fermentar lactosa, y la respuesta del intestino grueso al efecto osmótico producido, además de las posibles interacciones entre todos ellos19. Así, la cantidad de lactosa que llega al intestino depende de la dosis ingerida y de la velocidad de vaciamiento gástrico, pudiendo dar lugar, a su vez, a mayores efectos osmóticos en el intestino grueso40.
La hipolactasia y la malabsorción de lactosa consiguiente no siempre dan lugar a intolerancia a la lactosa, esto es, la respuesta sintomática a esta maldigestión, aunque se trata probablemente de una causa dietética muy frecuente de síntomas abdominales inespecíficos47.
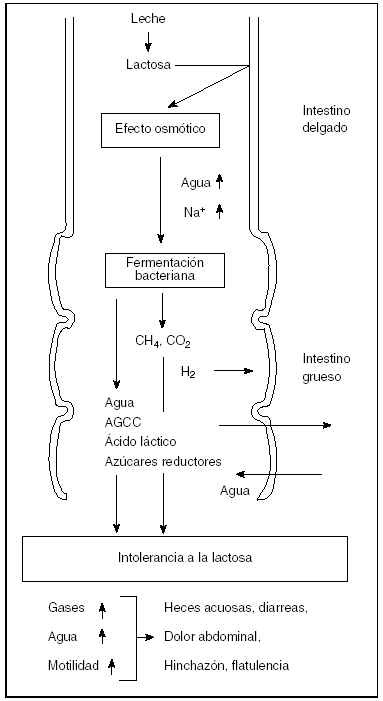
Los mecanismos por los que la lactosa no digerida causa los síntomas de intolerancia no se conocen con exactitud (fig. 2). Así, parece ser que las diarreas osmóticas y los dolores abdominales que se producen en algunos malabsorbedores se deben a la concentración de lactosa o de los metabolitos de ésta en el colon6, y más concretamente, de la eficacia en la absorción de los ácidos grasos de cadena corta (AGCC) producidos en la luz intestinal44. Algunos estudios recientes han relacionado la formación de ACCG y ácido láctico con la aparición de diarreas en individuos con malabsorción debido al incremento de la presión osmótica en el colon, que conduciría a un aumento de la secreción acuosa a la luz intestinal. Sin embargo, el posible papel de estos ácidos precisa de nuevos estudios que determinen su implicación definitiva en este proceso48.
Fig. 2. Desarrollo de síntomas de intolerancia tras la ingesta de leche o lactosa en sujetos con hipolactasia. AGCC: ácidos grasos de cadena corta.
La flatulencia e hinchazón abdominal, por otra parte, parecen ocurrir cuando la velocidad en la producción de gases excede la capacidad de utilización y absorción por diferentes bacterias de la flora y mucosa intestinal, respectivamente49.
Por último, el aumento en la velocidad del vaciamiento gástrico y del tránsito intestinal parece estar relacionado con la aparición de síntomas gastrointestinales en los individuos con malabsorción47,50.
Tratamiento dietético de la intolerancia a la lactosa
La lactosa está presente en considerables cantidades en la fase acuosa de productos lácteos como los helados, el requesón, los yogures o la leche, y se incluye, además, como excipiente en la composición de una amplia gama de medicamentos. Estos alimentos constituyen la más importante fuente de calcio y aportan, además, otros nutrientes de interés en la alimentación51. Por otra parte, algunos trabajos han demostrado que la absorción de calcio en individuos intolerantes a la lactosa era bastante reducida. Además, cuando éstos consumían productos lácteos que contenían lactosa, la absorción del mineral era normal, sugiriendo que el disacárido podría estimular su absorción en el intestino52.
El frecuente consumo de estos alimentos, junto a la elevada prevalencia de hipolactasia, representaría teóricamente un apreciable problema de salud pública; sin embargo, la malabsorción no siempre conduce a intolerancia a la lactosa53. Además, algunos estudios recientes han observado que la ingesta de una taza de leche o de la cantidad equivalente de lactosa no desencadena manifestaciones sintomáticas en las personas malabsorbedoras54-56.
El tratamiento dependerá no sólo de la gravedad de la intolerancia, sino también de la edad del sujeto57. Así, en los niños menores de 5 años, la malabsorción es casi siempre secundaria, generalmente causada por gastroenteritis, observándose que son pocos los que precisan de dietas bajas en lactosa, debido a la elevada velocidad de renovación de las células del epitelio intestinal. Las diarreas persistentes, por el contrario, se tratan con reducciones en el aporte de lactosa, y se obtienen generalmente mejores resultados mezclando la leche con cereales o leches fermentadas que diluyéndola con agua o retirándola. En los niños mayores de 5 años, la malabsorción puede deberse al descenso genéticamente determinado de la actividad enzimática (hipolactasia del adulto), o a hipolactasia secundaria, y son muy variables las cantidades de lactosa que se toleran, sin que aparezcan síntomas gastrointestinales13.
Las estrategias que se contemplan en el tratamiento dietético de la intolerancia a la lactosa incluyen: en algunos casos, restricciones en el consumo de leche y su sustitución por fuentes alternativas de calcio, entre otros, la adición de lactasa comercial a la leche y su posterior incubación durante varias horas, y en otros, la ingestión de lactasa con estabilidad suficiente para superar la acidez gástrica58. Por otra parte, la adición de diferentes sustancias sólidas a la leche o la ingesta de ésta durante una comida también han resultado ser métodos eficaces en la mejora de la digestión del disacárido59,60. Finalmente, los productos lácteos fermentados38,61 y los no fermentados que contienen cultivos activos con una fuente exógena de lactasa62,63 han sido recomendados como sustitutivos de la leche para las personas intolerantes a la lactosa, ya que, además de mejorar la digestión de la lactosa, son una importante fuente de proteínas, energía, riboflavina y calcio64.
LAS LECHES FERMENTADAS E INTOLERANCIA A LA LACTOSA
Los productos lácteos acidificados proceden de Oriente Próximo y se extendieron en Europa central y oriental, aunque el aumento de la popularidad de las leches fermentadas, y especialmente del yogur, se debió en un principio al interés que despertó su supuesta capacidad para prolongar la vida65. La validez de los puntos de vista de Metchnikoff se debatirán durante muchos años, pero un efecto indudable de su publicación fue el llamativo aumento de la popularidad del yogur en Europa.
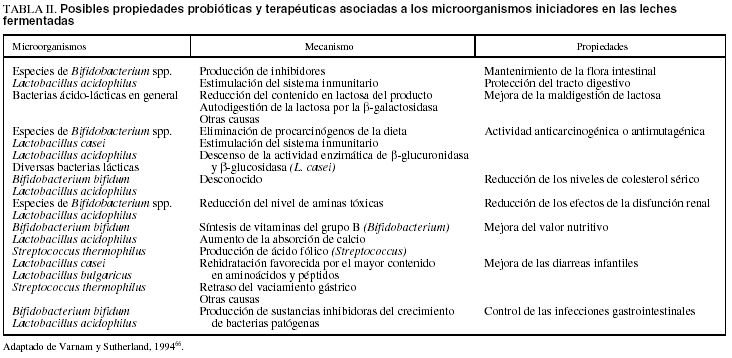
Los microorganismos que se emplean con más frecuencia como cultivos iniciadores pertenecen al grupo conocido genéricamente como bacterias ácido-lácticas (tabla II)66, aunque en algunos casos se utilicen también otras67. En este sentido, el renovado interés sobre las propiedades de las leches fermentadas ha llevado a la inclusión de las bacterias intestinales Bifidobacterium en los cultivos iniciadores. Por otra parte, en la fermentación de algunos productos, como el koumis o el kefir, intervienen también las levaduras, estableciéndose intensas relaciones interdependientes entre los microorganismos presentes considerados probióticos1,63,68.
El yogur es un producto de leche coagulada obtenido por fermentación láctica mediante la acción de Lactobacillus bulgaricus y Streptococcus thermophilus a partir de leche pasteurizada, leche concentrada pasteurizada, leche total o parcialmente desnatada, con o sin adición de nata pasteurizada, leche en polvo entera, semidesnatada o desnatada, suero en polvo, proteínas de leche y otros productos procedentes del fraccionamiento de la leche (CAE, 1994).
La mejor tolerancia hacia los productos lácteos fermentados manifestada por las personas malabsorbedoras de lactosa es un hecho ampliamente descrito y reconocido69-71. Sin embargo, la cantidad de lactosa contenida en la leche y el yogur es muy similar. Esta aparente paradoja encontró su explicación a principios de los años ochenta cuando, mediante el test de hidrógeno en aire espirado, se demostró que los sujetos con hipolactasia absorbían mejor la lactosa aportada por el yogur que por la leche72-74.
La información disponible acerca de la capacidad de los productos lácteos fermentados para aumentar la digestión de lactosa es mucho más extensa en el caso de las leches fermentadas y yogures que en el de las leches con cultivos activos75,76. No obstante, los mecanismos por los que la lactosa contenida en el yogur sufre una mejor digestión y absorción permanecen sin estar totalmente esclarecidos. La β-galactosidasa microbiana encontrada en su forma activa en muestras de aspirados duodenales realizados en algunos estudios parece ser responsable, al menos en parte, de este incremento en la absorción del disacárido77. La presencia y actividad de la enzima en el intestino delgado indican que ésta no se desnaturaliza totalmente durante su tránsito en un medio ácido. En la supervivencia y liberación de la β-galactosidasa del yogur en el duodeno podrían intervenir varios factores: a) la excelente capacidad tampón del yogur78; b) la protección de la enzima por la membrana y pared celular microbiana; c) la capacidad individual de secreción ácida y el tiempo de vaciamiento gástrico79; d) la cantidad de yogur ingerido, o e) los alimentos tomados junto con el yogur80,81. Además, otros factores gastrointestinales también podrían estar implicados en esta supervivencia y expresión de la disacaridasa, como la acción de enzimas y secreciones pancreáticas e intestinales, el mayor tiempo de tránsito intestinal observado con el yogur con relación al de la leche, y la emulsión lipídica formada por las sales biliares82.
Además, durante muchos años, el tratamiento de la maldigestión de lactosa ha contemplado la utilización satisfactoria de los productos lácteos con bacterias vivas que aporten capacidad degradativa del disacárido61, por lo que parece razonable suponer que la β-galactosidasa microbiana sobrevive a la acidez gástrica y ejerce su función de digestión de la lactosa en el intestino delgado humano81. Así, un grupo de investigadores diseñó un estudio nutricional en el que se examinaba esta hipótesis y en el que evaluaban la tolerancia a diferentes dosis controladas de lactosa, en 10 malabsorbedores sanos alimentados con leche, lactosa disuelta en agua, lactulosa disuelta en agua y yogur83. El trabajo evidenció que el consumo de yogur reducía la malabsorción de lactosa hasta la tercera parte de la observada con los otros productos, y que las muestras duodenales obtenidas tras la ingesta de yogur contenían valores significativos de actividad β-galactosidasa que previamente no se detectaban.
No todos los mecanismos implicados en la actividad lactosa-hidrolasa son bien conocidos. Algunos trabajos han sugerido dos hipótesis que explicarían el aumento en la actividad lactasa yeyunal: a) la estimulación directa de la enzima intestinal, y b) la adherencia al epitelio de la β-galactosidasa aportada por el yogur84.
La actividad enzimática no requiere que las células permanezcan vivas durante el tránsito gastrointestinal para ejercer su función, aunque el paso a través de la acidez gástrica exige un mecanismo de protección proporcionado por células y paredes bacterianas intactas85.
Por otra parte, el yogur prorpociona una excelente mejora de la capacidad tampón favorecida por la formación de micelas de caseína, el fosfato cálcico y el ácido láctico86. Algunos estudios de sensibilidad al pH de la β-galactosidasa microbiana realizados in vitro indican que su actividad enzimática se mantiene estable a pH 4 y que una parte significativa de la misma sobrevive a la acidificación hasta pH 3 durante 60 min78. La función lactosa-hidrolasa se pierde rápida e irreversiblemente cuando el yogur se incuba a pH 2, a pesar de la protección mecánica proporcionada por la estructura celular, mientras que, sin esta salvaguardia, el descenso por debajo de 4 en el pH causa la inactivación virtual de la enzima81. En este sentido, parece que tanto la protección de la pared celular como el característico efecto tampón del yogur podrían estar involucrados en el resguardo de la β-galactosidasa intracelular bacteriana de la digestión gástrica86. La modificación en el tiempo de vaciamiento gástrico también ha sido involucrada en los efectos sobre la actividad lactasa87. Los mecanismos que determinan esta mejor respuesta tras la ingesta de las leches fermentadas podrían deberse a su composición semisólida y, posiblemente, al retardo de la fase líquida del vaciamiento88. Así, la leche no tratada coagularía en el estómago formando dos fases: una sólida que evacuaría el estómago lentamente, y otra acuosa, en la que se encontraría disuelto el disacárido, caracterizada por un vaciamiento más acelerado y que originaría la rápida llegada de la lactosa al intestino delgado, ocasionando diferentes síntomas gastrointestinales. El aumento de la viscosidad, por otra parte, daría lugar a la formación de una fase con una velocidad de vaciamiento más lenta que las soluciones acuosas60.
Además del retraso en el tiempo de vaciamiento gástrico, la reducción de la velocidad de tránsito intestinal sugerida por los picos más tardíos que se obtienen en la excreción de hidrógeno tras el consumo de yogur podría ser otra de las causas de la mejor tolerancia de las personas malabsorbedoras a los productos lácteos fermentados73. En este sentido, un trabajo en el que se comparaba el vaciamiento gástrico y el tránsito intestinal, así como la digestión y tolerancia a la lactosa, en un grupo de malabsorbedores tras la ingesta de yogur fresco y pasteurizado a medio plazo (15 días), encontró una mejor digestión y tolerancia al disacárido y un tránsito intestinal más prolongado tras la ingesta del yogur fresco89. Además, la severidad y frecuencia de los síntomas gastrointestinles dependían del tiempo de tránsito en el intestino delgado90.
La importancia relativa de los ácidos biliares en la facilitación de la digestión de lactosa no se conoce con claridad, ya que las bacterias iniciadoras del yogur no son resistentes a las sales biliares y, por tanto, no podrían sobrevivir y crecer en el intestino. Sin embargo, las sales biliares aumentan la permeabilidad de las células bacterianas; así, por una parte podría facilitar la entrada e hidrólisis del disacárido en las células o, alternativamente, posibilitar la liberación de la enzima desde el espacio intracelular a la luz intestinal91.
Las concentraciones elevadas de β-galactosidasa en el producto lácteo no son, en ningún caso, una condición suficiente que garantice una eficiente digestión de lactosa. Así, algunas especies de Lactobacilli que presentan una relativamente baja concentración de la enzima en el producto estimulan la digestión de lactosa con tanta efectividad como L. bulgaricus, cuya concentración enzimática en el producto es superior. En este sentido, L. delbrueckii spp. bulgaricus demostró una actividad 5 veces superior en los productos lácteos fermentados que otras cepas de L. delbrueckii spp. ctis, aunque el incremento posterior de la actividad en las muestras intestinales fue muy similar. Por otra parte, las diferentes especies microbianas presentan sensibilidades muy variables al medio gástrico, a la influencia de las secreciones intestinales, al efecto de las sales biliares, etc.92.
Los diferentes tipos de yogur comercialmente disponibles difieren en sus propiedades, particularmente respecto a la actividad β-galactosidasa, al pH y a las concentraciones relativas de lactosa. Numerosos investigadores han descrito la diversidad existente entre las diferentes especies y cepas, e incluso entre los cultivos de S. thermophilus y L. bulgaricus empleados en la elaboración del yogur en términos de actividad enzimática93, sugiriendo que no todos los inóculos comerciales proporcionan la suficiente cantidad enzimática capaz de mejorar la malabsorción de lactosa94.
CONCLUSION
El empleo de microorganismos vivos como probióticos en el marco de la generación de alimentos funcionales puede ser de enorme utilidad con fines terapéuticos, no solamente en el tratamiento de la intolerancia a la lactosa, sino también en procesos alérgicos, situaciones leves de inmunodeficiencia, prevención de cáncer, etc.95-97.