INTRODUCCIÓN
La incidencia del carcinoma hepatocelular (CHC) se ha duplicado en las últimas 4 décadas en Estados Unidos y Europa. Esta dramática tendencia, atribuida al incremento de pacientes infectados por el virus de la hepatitis C (VHC)1, ha suscitado un mayor interés de la comunidad científica por esta neoplasia. Globalmente, es el quinto tumor con mayor incidencia, y la tercera causa de muerte atribuida al cáncer en el mundo2. En los países occidentales, alrededor del 40% de los pacientes puede beneficiarse de tratamientos potencialmente curativos (cirugía, trasplante, ablación percutánea). En tumores avanzados, la quimioterapia sistémica no ha mostrado un beneficio en términos de supervivencia en ensayos clínicos aleatorizados, acompañándose de cifras inaceptables de toxicidad y de muertes asociadas al tratamiento2,3. Por tanto, el conocimiento de las bases moleculares del CHC mediante estudios genómicos permitirá diseñar nuevas estrategias terapéuticas para afrontar esta devastadora enfermedad.
La utilidad de los estudios publicados acerca de la patogenia molecular del CHC esta limitada por diversos factores. En primer lugar, el análisis conjunto de tumores con distintas etiologías y aparentemente distinta patogenia puede dificultar la interpretación de los resultados, particularmente en estudios con tamaños de muestra modestos. En segundo lugar, el análisis genómico debe considerar los distintos estadios evolutivos en los que se han recogido las muestras, considerando que, aun con una patogenia común, la evolución de la neoplasia induce alteraciones estructurales y desregulaciones de las vías de señalización no presentes en estadios iniciales. El 80% de los CHC asientan sobre el hígado cirrótico, por lo que es fundamental llevar a cabo un análisis metódico de la expresión génica en el tejido normal, el tejido cirrótico, el nódulo displásico y el cáncer. La caracterización precisa de la secuencia de eventos moleculares que suceden en los diferentes estadios ayudará a distinguir los eventos tempranos y cruciales de los daños colaterales.
Finalmente, el número limitado de estudios hace difícil obtener una información genómica consistente. A pesar de estas dificultades, algunos estudios recientes han postulado una clasificación molecular preliminar del CHC, que tendrá que ser debidamente validada en cohortes independientes de pacientes.
Esta revisión analiza el conocimiento actual del daño estructural y del espectro mutacional del CHC, así como de las vías de señalización más relevantes implicadas en esta neoplasia, y evalúa la hipótesis actual sobre el origen celular del CHC. Se pretende integrar la discusión de las alteraciones estructurales del ADN y su resultado fenotípicoa nivel del transcriptoma y a nivel proteico con parámetros clínico-evolutivos.
ALTERACIONES GENÉTICAS EN EL CARCINOMA HEPATOCELULAR
Diversos factores etiológicos provocan continuos ciclos de daño y reparación de los hepatocitos que culminan en la enfermedad crónica del hígado. Los nódulos de regeneración hepáticos tienen características citológicas normales en los que la desregulación de vías de señalización mitogénicas puede llevar a la selección de ciertos clones de células displásicas. Estos clones, organizados en nódulos displásicos y rodeados de un septo fibroso de tejido conectivo, tras ser expuestos a alteraciones genómicas adicionales, adquieren un fenotipo maligno4. Los mecanismos moleculares exactos implicados en este proceso aún se desconocen. Es más, las alteraciones genéticas entre individuos con CHC, y a veces incluso en diferentes nódulos presentes en el mismo individuo, son distintas5.
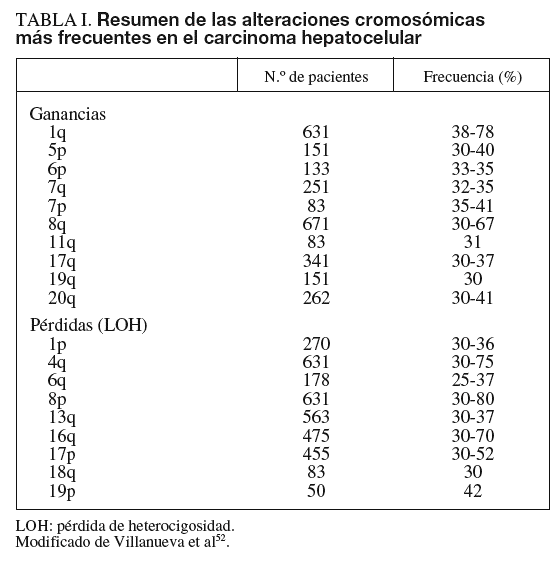
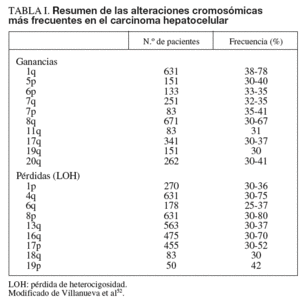
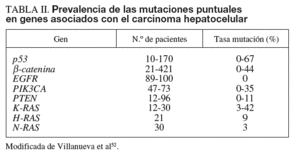
Las alteraciones genéticas pueden variar desde mutaciones puntuales hasta la pérdida o la ganancia de brazos cromosómicos. En el cáncer de hígado se han identificado alteraciones estructurales en áreas del genoma que incluyen algunos genes, como c-myc (8q), Ciclina A2 (4q), Ciclina D1 (11q), Rb1 (13q), AXIN1 (16p), p53 (17p), IGFR-II/M6PR (6q), p16 (9p), E-Cadherina (16q), SOCS (16p) y PTEN (10q)4-9. Los genes más frecuentemente mutados en CHC son p53 y ß-catenina4. Las alteraciones cromosómicas en el CHC se han analizado mediante hibridación genómica comparativa (HGC), que detecta cambios en el número de copias entre genomas. Esta técnica es capaz de detectar amplificaciones/deleciones mayores de 10 Mb. Para el estudio de las alteraciones del genoma que afecten a áreas menores actualmente se dispone de los high-density single nucleotide polymorphism (SNP) arrays (Affymetrix 500K array®).
Alteraciones en el número de copias en el carcinoma hepatocelular
La alteración cromosómica más habitual en el CHC afecta al cromosoma 1q, con frecuencias de amplificación que oscilan entre el 58 y el 78%. Otros brazos de cromosomas afectados con amplificaciones son 6p, 8q, 17q, y 20q, y con deleciones 4q, 8p, 13q, 16q y 17p. Las observaciones derivadas de estudios más extensos se resumen en la ta-bla I4-9.
Es preciso destacar que incluso las modificaciones del número de copias en áreas pequeñas del genoma pueden incluir decenas de genes candidatos. Una manera de filtrar la lista de genes para evaluar y, a su vez, conferir consistencia a los candidatos obtenidos por HGC, consiste en realizar un análisis integrado del transcriptoma y las alteraciones estructurales. Conceptualmente, los genes situados en regiones de ganancia cromosómica con niveles de expresión incrementados suelen ser oncogenes, mientras que los genes localizados en regiones de pérdida cromosómica son genes supresores de tumores. Como ejemplo, Patil et al6 evaluaron la correlación entre 48 genes altamente expresados en el cromosoma 8q y su número de copias en 49 muestras de CHC. Entre éstos, un gen con alta correlación fue COPS5/JAB1/CSN5, una subunidad del signalosoma COP9 que interacciona con ubiquitin-ligasas E3. El estudio y la manipulación de COPS5 en líneas celulares sugiere un papel como potencial oncogén activado por la ganancia de material genético en 8q6. Es necesario destacar que para que un gen candidato se considere un oncogén o un gen supresor, se precisa el cumplimiento de unos estrictos criterios claramente establecidos10.
El potencial valor predictivo de las alteraciones genéticas y su correlación con otros parámetros clínicos, como pronóstico, recurrencia o estadio tumoral, no está claramente establecido. Raidl et al9 mostraron un incremento progresivo de las aberraciones genéticas acorde con el patrón evolutivo de la enfermedad (desde nódulos displásicos a CHC avanzado).
Desequilibrio alélico
Las regiones cromosómicas que presentan una pérdida de heterocigosidad (LOH) pueden contener genes supresores de tumores que tras una posterior mutación quedan anulados. Esto constituye la base del modelo double-hit propuesto por Knudson11 hace 30 años. Los estudios para analizar LOH requieren marcadores moleculares como microsatélites, o SNP, que permitan distinguir entre los cromosomas parentales. Los microsatélites, microsatellite marker analysis (MSA), son pequeñas secuencias repetidas en tándem distribuidas por todo el genoma y que pueden variar debido a errores en los sistemas de reparación, un fenómeno habitual en los tumores.
El análisis del desequilibrio alélico en uno o más de los 18 loci estudiados en el CHC mostró LOH en un 70% de los cánceres frente a un 3% en hígados no tumorales. Estas pérdidas de heterocigosidad se observaban principalmente en 1p, 4q, 6q, 8p, 9p, 16q y 17p, con un incremento significativo de LOH en 1p en tumores pequeños bien diferenciados, mientras que la LOH en 16p y 17q fue más frecuente en lesiones metastásicas12.
Mutaciones puntuales
La mayoría de las mutaciones descritas en el CHC son somáticas, y entre éstas la más estudiada es, sin duda, p53 (tabla II). Este gen supresor, cuyo papel en la carcinogénesis es incuestionable, está implicado en el control del ciclo celular, la reparación de ADN, la apoptosis y la diferenciación. Numerosos estudios sobre el CHC han analizado mutaciones en p53. En ellos se constata que la tasa de mutación de p53 es especialmente elevada en regiones de África y Asia, donde la exposición a aflatoxina es endémica. Diversos estudios han mostrado correlación entre las elevadas tasas de mutación en p53 en el codón 249 y la exposición a aflatoxina13,14. En los países occidentales, donde la ingesta de aflatoxina no es endémica, sólo se observan altas tasas de mutación de p53 en pacientes con CHC asociado a hemocromatosis13.
En cuanto a la relación entre mutaciones en p53 y las características clinicopatológicas del CHC, varios estudios sugieren que la pérdida de p53 es un evento tardío en la hepatocarcinogénesis. Por ejemplo, se han encontrado tasas de mutación diferenciales según el grado histológico de las lesiones (p. ej., el 0 frente al 60% en tumores con Edmondson grados I y IV, respectivamente)14,15. En un estudio reciente, se ha analizado la relación entre las mutaciones de p53 en la línea germinal y la disfunción de la telomerasa en un modelo knockout murino. En animales con telómeros intactos, la mutación en p53 no mostró efectos sobre la carcinogénesis, mientras que en el contexto de disfunción de la telomerasa favoreció la oncogénesis16.
ALTERACIONES GENÓMICAS FUNCIONALES EN EL CARCINOMA HEPATOCELULAR
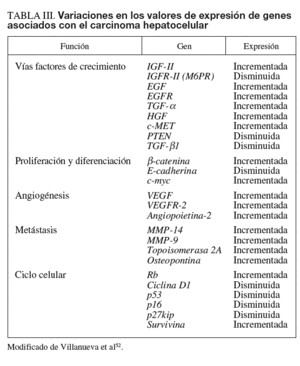
Los perfiles de expresión génica derivados de estudios realizados con tecnología de alto rendimiento (microarray) y análisis selectivo de ARNm por reacción en cadena de la polimerasa (PCR) cuantitativa a tiempo real (qRT-PCR) han revolucionado el modo de abordar el estudio del cáncer (tabla III). Sus aplicaciones en el ámbito de las enfermedades hepáticas y el CHC se han revisado recientemente de forma exhaustiva17. Los estudios pioneros con microarrays en CHC ya mostraron una desregulación en la activación de los receptores de crecimiento, las vías de señalización de Ras/MAPK y el ciclo celular18. La agrupación de estos genes desregulados en clústers permite la clasificación de muestras en función de su perfil de expresión génica. Estos clústers, organizados en grupos de genes (gene signatures) pueden utilizarse con fines diagnósticos o pronósticos, así como para evaluar la respuesta al tratamiento19. No obstante, recientemente se ha puesto en tela de juicio el diseño de algunos de estos estudios, por lo que se impone una revisión de la metodología. A pesar de ello, es previsible que la información derivada de los estudios con microarrays se incorpore progresivamente en la práctica clínica.
En el CHC, algunos estudios de expresión génica se han focalizado en el papel que potencialmente tendrían las gene signatures para establecer clasificaciones moleculares y como predictores de recurrencia y supervivencia. En el estudio más relevante, realizado en 120 pacientes con CHC, se identificaron 3 subgrupos de tumores con distinta gene signature asociados con distinta supervivencia. Estos genes codificaban proteínas asociadas con la proliferación, la diferenciación, la apoptosis, la modificación de histonas y la ubiquitinación, mientras que otros definían un subgrupo derivado de células progenitoras con un pronóstico especialmente adverso19. De forma análoga, otros estudios basados en microarrays han permitido discriminar poblaciones con diferentes tasas de supervivencia y predecir una recurrencia en el CHC20,21.
Los intentos de integrar los resultados de microarrays con los del análisis HGC son escasos y muestran sólo una correlación parcial. La variabilidad experimental en los resultados de microarrays, al igual que las modificaciones epigenéticas que interfieren en los valores transcripcionales de extensas regiones cromosómicas pueden explicar esas diferencias.
La qRT-PCR es una técnica claramente más sensible que los microarrays para el análisis del transcriptoma, aunque sólo es aplicable al análisis de un número relativamente reducido de genes. Esta técnica se ha utilizado con frecuencia para validar el resultado obtenido en perfiles de expresión génica con microarrays o para correlacionar variaciones en los valores de expresión de ARNm con anomalías en la estructura del ADN de genes implicados en ciertos procesos, como proliferación, diferenciación, angiogénesis, apoptosis, ciclo celular y metástasis17,22. Sin embargo, hay que tener en cuenta que las variaciones en los valores de ARNm pueden no deberse a aberraciones en la estructura del ADN, sino a mecanismos de regulación transcripcional (ARN de interferencia, estabilidad de ARNm tras modificaciones en poliadenilación, etc.) y modificaciones postranslacionales (fosforilización, glucosilación, etc.). En cuanto a la utilidad de la qRT-PCR en el diagnóstico, un estudio reciente ha investigado la expresión de 55 genes para diferenciar lesiones preneoplásicas (nódulos displásicos) y CHC precoz (< 2 cm), identificando una gene signature constituida por 3 genes (GPC3, LYVE1 y survivina) capaz de distinguir ambas entidades con una precisión del 94%23.
Metilación de genes relevantes
El silenciamiento epigenético de la expresión de genes clave en la regulación de la proliferación, diferenciación y apoptosis es un fenómeno habitual en el cáncer. Se han observado patrones de metilación aberrantes durante el proceso de la carcinogénesis hepática. Una característica de las células cancerosas es la presencia en el ADN de discretas áreas de densa hipermetilación sobre un fondo global de hipometilación. La hipermetilación afecta a islas CpG localizadas en las regiones promotoras y a intrones reguladores, particularmente, en genes supresores de tumores como p16INK4a, IGFR-II/MP6, BRCA1 y E-cadherina. El tratamiento con agentes desmetilantes que inhiben la metilación de islas CpG y permiten la reexpresión del gen supresor de tumores puede resultar un tratamiento prometedor en la inhibición del crecimiento tumoral24,25.
Inestabilidad genómica. Telómeros y telomerasa
El envejecimiento de las células somáticas se asocia con la reducción de la longitud de los telómeros debido a la incapacidad de las ADN polimerasas para replicar completamente el final del ADN cromosomal. El acortamiento de los telómeros es una característica clave durante la progresión de las enfermedades crónicas del hígado. Afecta especialmente al compartimiento de los hepatocitos y, en último término, provoca inestabilidad cromosómica, fusiones entre extremos de cromosomas y muerte celular. La reactivación de la telomerasa restablece la longitud de los telómeros e inmortaliza el fenotipo de las células25.
En un 90% de los CHC humanos se ha observado una reactivación de la actividad telomerasa24. Éste es un evento asociado a estadios avanzados de la enfermedad y diversos mecanismos intervendrían en el aumento en los valores de ARNm de la telomerasa. Por un lado, el oncogén
c-myc activaría el promotor del gen de la telomerasa, TERT. Por otro lado, se ha descrito que el virus de la hepatitis B (VHB) se integra en la región promotora del gen TERT incrementando su expresión. Además, se han descrito amplificaciones en la región en la que reside el gen TERC (el componente ARN de la telomerasa) y una pérdida de heterocigosidad del cromosoma 10p, en una región que contiene un represor de la telomerasa24.
VÍAS DE SEÑALIZACIÓN EN EL CARCINOMA HEPATOCELULAR
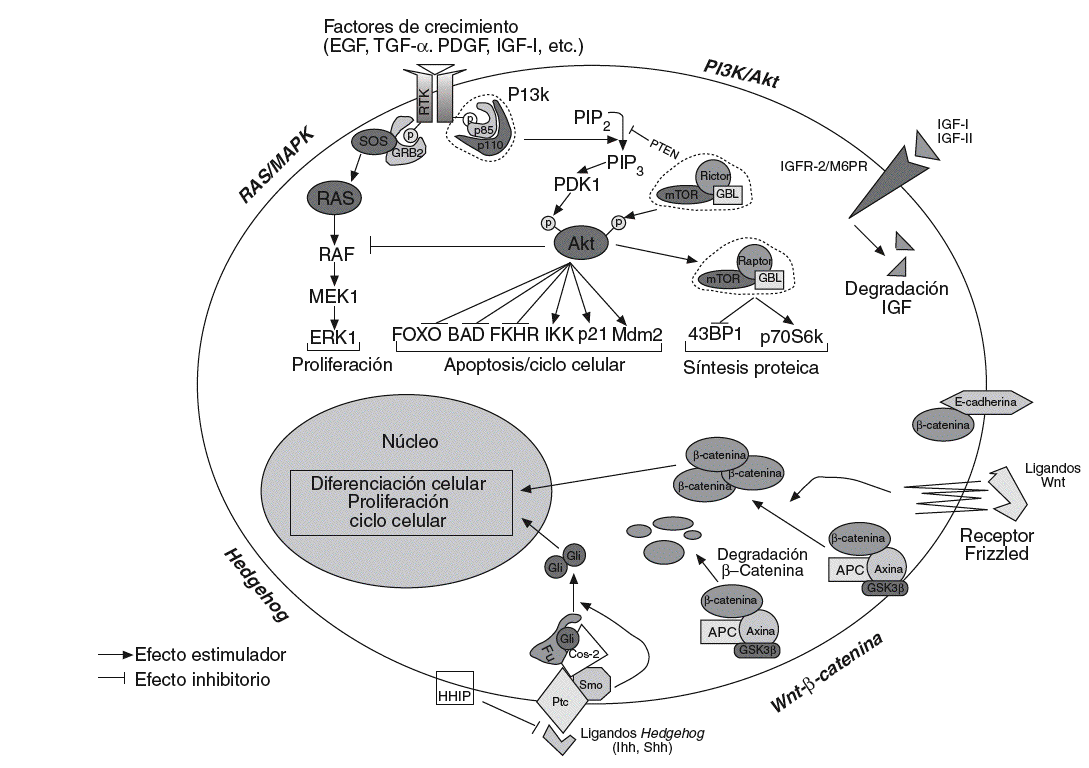
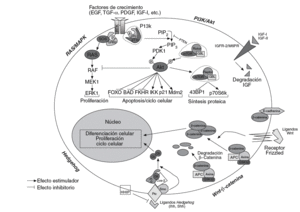
En los últimos años se ha hecho un gran progreso para determinar la función de los mecanismos de señalización en la carcinogénesis hepática. La desregulación de esas vías de señalización y de sus componentes se ha asociado con propiedades esenciales de los tumores, como la proliferación celular, la evasión de apoptosis, la invasión tisular y la diseminación. No obstante, la secuencia de eventos moleculares que desembocan en el cáncer de hígado no está aún claramente establecida. El conocimiento de estos eventos moleculares y de las cascadas de señalización intracelular implicadas puede proporcionar la identificación de nuevas dianas terapéuticas. A continuación se revisan los conocimientos actuales sobre la implicación de las vías de señalización del CHC (fig. 1).
Fig. 1. Esquematización de las principales vías de señalización implicadas en el desarrollo y la progresión de la carcinogénesis hepática. Wnt/ß-catenina: en presencia de ligandos Wnt,ß-catenina se acumula en el citoplasma y transloca al núcleo, modificando la expresión de numerosos genes relacionados con el ciclo celular, la proliferación, la diferenciación y la apoptosis. En ausencia del ligando, la ß-catenina citosólica es degradada por el sistema del proteosoma tras ser previamente fosforilada por el complejo APC/AXIN/GSK3ß. Hedgehog: en ausencia de ligando Hh, Ptc inhibe Smo, y forma un complejo que impide la translocación al nucleo de Gli. De forma similar aß-catenina, en presencia de ligandos Hh, Gli puede translocar al núcleo donde actúa sobre sus genes diana. HIIP bloquearía la interacción entre ligando y receptor. PI3k/Akt: la señalización a través de los receptores de diversos factores de crecimiento converge en 2 vías principales; PI3K/Akt, que interactúa con varios genes diana (FOXO, BAD, FKHR, IKK, p21, etc.) y generaría principalmente señales de supervivencia, y Ras/MAPK, que daría lugar a señales de proliferación.
Vías de señalización de diferenciación
Wnt-ß-catenina. La vía de señalización de Wnt es una vía muy conservada durante la evolución, implicada en la regulación de la proliferación, la motilidad, la interacción entre células, la organogénesis y la autorrenovación de células troncales pluripotentes. Se ha visto ampliamente implicada en la oncogénesis26 y se ha sugerido que desempeñaría un papel en el mantenimiento de las células troncales cancerosas, por lo que los componentes de esta vía constituirían dianas ideales para la terapia contra el cáncer. Se han descrito 19 ligandos Wnt y 11 receptores transmembrana (FZD). En células normales, ß-catenina se asocia con E-cadherina en la membrana celular, uniendo E-cadherina al citosqueleto de actina. En la vía canónica de Wnt la cascada de señalización se inicia cuando los ligandos estimulan el receptor, Frizzled, y la señal desencadenada provoca la disociación de ß-catenina de E-cadherina. Las proteínas supresoras AXIN1/2 y APC forman un complejo con la cinasa GSK-3ß en el citoplasma, promoviendo que ß-catenina sea fosforilada, poliubiquitinilada y, posteriormente, degradada por el proteosoma27.
Diversos factores, como las mutaciones somáticas en APC, AXIN1/2, GSK-3ß o la sobreexpresión del receptor FZD-7, pueden provocar un aumento de la biodisponibilidad de ß-catenina, que transloca al núcleo y actúa como coactivator de factores de transcripción de la familia TCF/LEF, regulando la actividad de genes de proliferación (c-myc), antiapoptosis (survivina), angiogénesis (VEGF), metástasis (MMP) y ciclo celular (ciclina D)27. El 90% de los cánceres de colón presenta mutaciones en el gen APC, y en las neoplasias en que APC no está mutado casi un 50% presenta mutaciones en el gen ß-catenina28. En el CHC, la tasa de mutación de ß-catenina es del 0-44%, mientras que las mutaciones en APC son raras (tabla II). Además, se han descrito mutaciones que afectan a otros genes de la vía de señalización Wnt, que incluyen AXIN1 y AXIN229. La activación de esta vía es evidente en al menos un tercio de los tumores, en los que se observa una acumulación nuclear de ß-catenina (un 17-40% de los casos)30 o sobreexpresión del receptor FZD-7 en un 90% de las muestras de CHC analizadas30.
Hedgehog. Esta vía de señalización es fundamental en procesos de diferenciación celular, regeneración y biología de las células troncales. Hay 3 ligandos potenciales Indian, Sonic y Desert Hedgehog y el primero predomina en el hígado31. En ausencia de activación, el re ceptor Patched (Ptc) ejerce un efecto inhibitorio sobre Smoothened (Smo), que en asociación con Cos-2 bloquea la translocación al núcleo de Gli. Tras la estimulación del ligando, Gli se acumula en el núcleo e induce la transcripción de genes relacionados con el ciclo celular y la proliferación31 (fig. 1).
Numerosos indicios sugieren un rol preponderante de Hedgehog en un subtipo de neoplasias. La activación de la vía Hedghehog se ha asociado con el desarrollo de diversos tumores sólidos esporádicos (p. ej., páncreas, pulmón, próstata y meduloblastoma). Asimismo, la mutación de Ptc en la línea germinal da lugar al síndrome de Gorlin, que predispone a diversos tumores31. La estructura de la vía es similar a la de Wnt. Algunos estudios recientes sugieren un posible papel de esta vía en el CHC: se ha descrito una expresión de Sonic Hedgehog en CHC humanos y una infraexpresión de genes diana asociados a Gli tras el bloqueo específico de la vía32. Además, la actividad de Smo puede provocar una sobreexpresión de c-myc, que desempeña un papel importante en la carcinogénesis hepática. Todos estos datos sugieren la potencial relevancia de la terapia molecular dirigida específicamente al bloqueo de la vía de señalización de Hedgehog en el tratamiento del CHC33.
Vías de señalización dependientes de receptores tirosina cinasa
Insulin-like growth factor (IGF). Es uno de los mensajeros secundarios más importantes de la hormona del crecimiento durante la infancia y la adolescencia34. Su relevancia en el control de la renovación celular y de la proliferación en el cáncer ha generado gran interés. La familia del IGF comprende 2 ligandos (IGF-I y IGF-II), 2 receptores (IGFR-I y IGFR-II/M6P) y 6 proteínas de unión (IGFBP1-6). La unión de ligandos de alta afinidad a las subunidades * de IGFR-I provoca la rápida transautofosforilación de residuos aminoacídicos tirosina específicos localizados en las subunidades ß del receptor, lo que induce la fosforilización del sustrato del receptor de la insulina (IRS-1 y IRS-2) y Shc. Estos eventos inducen la activación de las vías de señalización MAPK, y PI3K/Akt/GSK-3ß y la activación transcripcional de diferentes genes diana, como p27kip1, myc, fos, ciclina B y VEGF34. La evidencia acumulada sugiere que el sistema IGF está implicado en el desarrollo y la progresión de una amplia variedad de tumores, ya que afecta a la transformación, la proliferación, la supervivencia, la motilidad y la migración celular, tanto en cultivos celulares como en modelos de cáncer murinos. Los modelos transgénicos sugieren que los oncogenes clave de la vía son IGFR-I e IGF-II, puesto que su sobreexpresión específica de tejido induce tumores de mama y de pulmón.
Las IGFBP modulan la biodisponibilidad de los IGF en el microambiente celular. El 70% del IGF-II está unido a IGFBP-3, la más abundante de las IGFBP. En el CHC se ha descrito que la expresión de IGFBP-1, IGFBP-3 e IGFBP-4 está reducida. Hay estudios que muestran efectos paradójicos de las IGFBP bajo diferentes condiciones, lo que sugiere que pueden tener acciones divergentes según las condiciones microambientales en las que desarrollan su actividad. IGF-II se puede unir a IGFR-I y IGFR-II/M6P, pero su afinidad por IGFR-I es significativamente menor que la de IGF-I35,36. La expresión del gen IGF-II está aumentado en muchas neoplasias, entre ellas el CHC. El 16-40% de los CHC humanos sobreexpresan este factor de crecimiento. Su compleja regulación transcripcional implica 4 promotores específicos de tejido regulados epigenéticamente (P1-P4). La sobreexpresión de IGF-II se produce cuando hay una pérdida del imprinting genómico o por reactivación del promotor fetal (P2-P4). El receptor IGFR-II/MP6 no tiene actividad tirosina cinasa, su función consiste en unir y degradar IGF-II, y se considera un gen supresor de tumores. En un 25% de los casos de CHC se observa una pérdida de heterocigosidad en el locus igfr-2 (6q), junto con mutaciones que inactivan el segundo alelo. En cuanto a IRS-1 e IRS-2 se ha observado la fosforilación de IRS-1 e IRS-2 en carcinogénesis hepática en humanos y en ratones. Recientemente, algunos estudios han sugerido que IRS-1 también sería capaz de modular la expresión de genes que o celular34-36.
Transforming growth factor-*/epidermal growth factor. El receptor del factor de crecimiento epidérmico (EGFR) es miembro de una familia de 4 receptores relacionados (ErbB1-ErbB4) que tras interaccionar con el ligando desencadenan una actividad tirosina cinasa y el inicio de una cascada de transducción de señales intracelulares. Los receptores EGF participan en la compleja regulación de procesos biológicos esenciales, como la proliferación celular y la superviviencia35.
Diversos datos sugieren una activación de la vía de EGFR en el CHC, ya sea por sobreexpresión de los ligandos específicos o de sus receptores24 u otros mecanismos, como amplificaciones estructurales. Se han descrito ganancias en 17p, cromosoma en el que reside el locus HER2/neu. La sobreexpresión de EGFR y HER2, que se ha constatado que está correlacionada con un fenotipo tumoral más agresivo con altos valores de proliferación, metástasis intrahepáticas y desdiferenciación tumoral35, ha sido el punto de partida para el desarrollo de diversos antagonistas de EGFR, algunos de los cuales (erlotinib, etc.) se han aprobado para la práctica clínica. El uso de antagonistas de EGFR (erlotinib) en el CHC ha demostrado una inhibición significativa de la proliferación y un incremento de la apoptosis37. Estos resultados se han confirmado en modelos animales, con el inhibidor tirosina cinasa gefitinib, que disminuyó el número de nódulos displásicos en ratas cirróticas38.
TGF-* y EGF, ligandos de los receptores ErbB, actúan como potentes mitógenos. Se han detectado valores elevados de TGF-* en el suero de pacientes con CHC34-35. TGF-* actuaría en estadios iniciales de la oncogénesis hepática, y su expresión se correlaciona con la prolife ración y la diferenciación celular. El factor TGF-* promueve neoangiogénesis, supervivencia y proliferación de las células tumorales indirectamente a través de la inducción del factor de crecimiento del endotelio vascular (VEGF)35. Los CHC son tumores muy vascularizados que muestran sobreexpresión de VEGFR, en los que su bloqueo se ha probado efectivo in vitro. Asimismo, la inhibición de EGFR mediante anticuerpos monoclonales reduce la expresión de VEGF en líneas tumorales epiteliales y provoca una disminución del crecimiento tumoral y de la angiogénesis asociada en un modelo de xenoinjerto de células tumorales humanas39.
Hepatocyte growth factor (HGF) es el factor de crecimiento más potente de los hepatocitos, esencial en la regeneración hepática. Su único receptor de alta afinidad conocido es c-MET. Se expresa predominantemente en células epiteliales y endoteliales, y su actividad regula las funciones de proliferación, migración, supervivencia, morfogénesis, angiogénesis y regeneración24,35. Se ha descrito que un 20-48% de los CHC sobreexpresan c-MET; sin embargo, el receptor se detecta en un 70% de los CHC, diferencia que se debería a la participación, entre otros mecanismos moleculares, de alteraciones genómicas (un 16% de ganancia en 7q)40. HGF también está sobreexpresado en el CHC; sin embargo, son las células estrelladas y los miofibroblastos, en lugar de las células tumorales, los que expresan el factor, al ser estimulados por productos tumorales. El HGF secretado por estas células es una molécula inactiva que tras ser procesada proteolíticamente estimula la invasión celular35. El papel de estas moléculas en la patogenia del CHC no está aún claro, puesto que algunos estudios recientes sugieren roles de c-Met opuestos a los previamente descritos41.
Vía de señalización de PI3K/AKT/mTOR
Muchos factores de crecimiento celular y citocinas activan esta vía de señalización, cuyo mensajero secundario principal, fosfatidilinositol-3,4,5-trifosfato (PIP3) activa Akt/proteína cinasa B (PKB). Akt fosforila a su vez numerosos genes diana, como BAD, proteína proapoptótica a la que inactiva mediante fosforilización, o mTOR, que activa a la cinasa p70 S6 y al represor translacional 4E-BP. Estas proteínas regulan la translación de proteínas reguladoras del ciclo celular y, por tanto, promueven la progresión del ciclo celular24,35.
PI3K es un heterodímero que consta de una subunidad catalítica (p110*, p110ß, o p110*), asociada a una subunidad reguladora (p85*, p85ß o p55*). PIK3CA, que codifica p110, está frecuentemente mutado en el cáncer; sin embargo, en el CHC los datos obtenidos no son concluyentes42.
PTEN es una fosfatasa que inhibe la síntesis de PIP3, bloqueando la activación de Akt. Es un gen supresor de tumores mutado o delecionado en muchos cánceres, cuya expresión está disminuida en tumores avanzados. Al igual que en otras neoplasias, en la inactivación de PTEN pueden estar implicados mecanismos epigenéticos (metilación de islas CpG)43, así como pérdidas de heterocigosidad en 10q, la región cromosómica en la que reside PTEN.
Un mediador importante de la vía de señalización de PI3K/Akt es mTOR, que actúa como regulador en el crecimiento celular y la proliferación; es el sensor del estatus nutricional y permite la progresión de la fase G1 a S. En situaciones de privación de nutrientes, la actividad de mTOR disminuye. Sahin et al44 han descrito una sobreexpresión de la vía de señalización de mTOR en una proporción de CHC.
ORIGEN CELULAR DEL CARCINOMA HEPATOCELULAR: DEL HEPATOCITO A LA CÉLULA STEM CANCEROSA
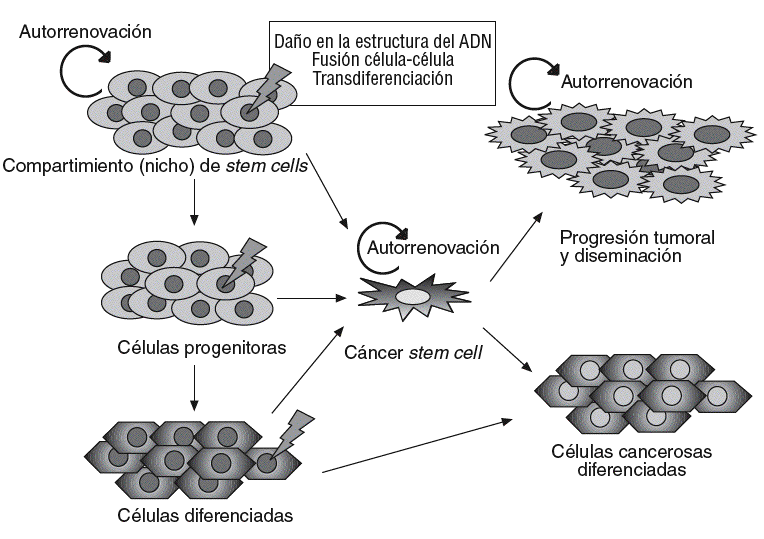
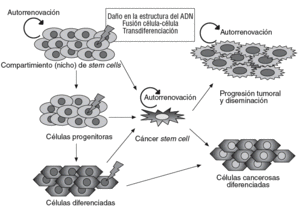
Un concepto emergente en oncología es el papel esencial que podrían desempeñar las células troncales, o stem cells, en el origen y el desarrollo del cáncer45. Según este concepto, los cánceres se desarrollarían a partir de un subgrupo de células con capacidad de autorrenovación análoga a las células troncales o stem cells normales. Estas células, denominadas células madre cancerosas (cancer stem cells [CSC]), pueden proceder de células stem normales, que mantienen una capacidad de autorrenovarse, pero que adquieren cambios genéticos o epigenéticos que transforman su fenotipo, o bien de células somáticas desdiferenciadas que adquieren una capacidad de autorrenovación (fig. 2).
Fig. 2. Modelo del origen celular y progresión del cáncer. Diversos fenómenos sobre la célula stem normal o progenitores muy tempranos (p. ej., mutaciones) provocarían la aparición de células stem del cáncer (CSC), que dan lugar a una progenie capaz de autorrenovarse y ser responsable de la progresión tumoral y la diseminación, o que evoluciona hacia un fenotipo diferenciado maligno con capacidad tumorogénica limitada. La hipótesis de las CSC sostiene que estas células podrían originarse también a partir de células diferenciadas.
La célula stem cancerosa se definiría como la célula del tumor que posee la capacidad de autorrenovación y que puede originar todos los linajes celulares que comprende el tumor. Por tanto, las células stem cancerosas pueden definirse sólo de forma experimental por su habilidad para recapitular la generación de un tumor en continuo crecimiento. El modelo de la CSC propone que las neoplasias están constituidas por 2 poblaciones celulares diferentes originadas por una división asimétrica: por un lado, las células troncales malignas con capacidad de autorrenovación, responsables ante todo de la progresión tumoral y la diseminación, y una segunda población de células tumorales, parcialmente diferenciadas, no tumorogénicas que constituyen la mayor parte de la masa tumoral46,47 (fig. 2). Alternativamente, se ha especulado que las células somáticas maduras podrían desdiferenciarse hacia células stem-like capaces de autorrenovarse46.
La hipótesis de la célula stem tumoral sostiene que esta población celular minoritaria, que se autorrenueva e impulsa el crecimiento y la diseminación tumoral, es refractaria al tratamiento con agentes quimioterapéuticos convencionales dirigidos contra el grueso de las células tumorales que se dividen rápidamente. Por tanto, la erradicación efectiva del tumor implica identificar agentes que eliminen la CSC del cáncer sin afectar a las células stem normales y el diseño de nuevas terapias capaces de discriminar entre células stem cancerosas y células stem normales. Para ello, es necesario conocer mejor la biología de las células troncales normales, así como la genética y la epigenética de la progresión tumoral. En este sentido, se ha conseguido identificar algunos agentes efectivos contra células stem de leucemia, por ejemplo, el phartenolide, que es un potente inhibidor del factor nuclear-*B, que ha demostrado promover la apoptosis en células stem de AML e inhibir el crecimiento tumoral en ratones NOD/SCID. Algunos agentes convencionales, como la antraciclina han mostrado una sinergia con inhibidores del proteosoma reduciendo drásticamente la viabilidad celular de las células stem AML47.
Los hepatocitos tienen una capacidad extraordinaria de dividirse, y permiten la regeneración en respuesta a agresiones agudas. En condiciones normales, el hígado adulto apenas prolifera. Sin embargo, en respuesta al daño provocado por la inflamación crónica/necrosis el compartimiento reserva de células progenitoras se activa; en este proceso intervienen diferentes tipos celulares, (p. ej., células estrelladas) y factores de crecimiento48-50. Este compartimiento, que contiene las llamadas células ovales o células progenitoras, está situado en las ramas más periféricas del árbol biliar, los conductos ductulares y los canales de Hering. Se ha especulado que una subpoblación de células progenitoras hepáticas podrían tener un origen hematopoyético; sin embargo, estudios recientes51 no han respaldado esta teoría. En las lesiones displásicas, auténticos precursores neoplásicos, se han descrito características de células progenitoras49. Asimismo, en algunos CHC iniciales se observa una proliferación de células ovales en el centro de las lesiones, lo que indica la presencia de células stem. El papel de las células stem cancerosas en la hepatocarcinogénesis debe establecerse mediante marcadores específicos que reconozcan el linaje dentro de las fronteras de los tumores, ya que, hasta ahora, los marcadores de CSC para CHC (p. ej., CD34) y la comparación de los perfiles de expresión génica con hepatoblastos fetales de rata han generado resultados contradictorios. Conseguir una opción terapéutica efectiva en el cáncer de hígado requiere profundizar en el conocimiento de las vías de señalización implicadas en la autorrenovación de las células stem, como Notch, Wnt-ß-catenina y Hedgehog y sus conexiones con vías clásicamente asociadas a cáncer.
En conclusión, la integración de la información derivada de estudios sobre alteraciones genéticas, variaciones en los perfiles de expresión génica y señalización aberrante que cubren el patrón evolutivo completo del CHC humano (desde la cirrosis, pasando por los nódulos displásicos hasta el cáncer avanzado) es imprescindible para la identificación de nuevas dianas con las que desarrollar terapias efectivas contra cáncer de hígado. Asimismo, el conocimiento de la biología tumoral, incluida la identificación y el aislamiento de la célula madre cancerosa, es el reto científico más complejo en esta área de investigación.