Existe escasa información sobre la precisión diagnóstica oncológica de la elevación del antígeno carcinoembrionario (CEA) más de tres veces por encima del valor normal.
Objetivos Determinar la prevalencia de procesos oncológicos del rango establecido del CEA y el coste medio que supone el estudio.
MétodosEstudio retrospectivo de todos los pacientes derivados a consultas externas de Aparato Digestivo o Medicina Interna para estudio de patología tumoral en relación con un CEA entre 3 y 10ng/ml desde 2.001 a 2.007.
ResultadosCien pacientes (60 hombres y 40 mujeres), 67,4±14,2 años, y con nivel basal de 5,8±1,7ng/ml. Los síntomas/signos guía más relevantes fueron alteraciones analíticas (19, 19%). Se diagnosticaron 4 cánceres (uno gástrico, 2 de pulmón y uno de colon). En cuanto a la patología no oncológica, en 49 pacientes (49%) no se detectó ningún proceso relacionado, y en 47 (47%) se confirmaron otros diagnósticos asociados a aumento de dicho marcador. En el seguimiento (54,3±24,6 meses) se detectó un cáncer laríngeo, una leucemia aguda mieloide y un cáncer de colon. El CEA basal de los pacientes con cáncer no tuvo diferencias con respecto a aquellos sin patología oncológica (6,6±2,4 vs. 5,8±1,7ng/ml; p=0,2). El gasto medio por paciente fue de 503,6±257,6 €.
ConclusionesExiste una baja proporción (7%) de pacientes con proceso oncológico en relación con la elevación leve del CEA. Existe un gasto económico no desdeñable asociado directa e indirectamente al estudio de estos pacientes.
There is little information on the oncologic diagnostic accuracy of carcinoembryonic antigen (CEA) levels more than 3-fold above normal.
ObjetivesTo determine the prevalence of underlying cancer in patients with mild CEA elevation and the mean cost per patient of CEA determination.
MethodsA retrospective study was carried out in all patients with CEA elevation (3-10ng/ml) and suspicion of cancer referred to the gastroenterology or internal medicine outpatient units from 2001 to 2007.
ResultsWe studied 100 patients (60 men and 40 women), with a mean age of 67.4±14.2 years and baseline CEA of 5.8±1.7ng/ml. The most important symptoms and signs were laboratory abnormalities (19 patients [19%]). Cancer was diagnosed in 4 patients (one gastric, 2 lung and one colon). Among patients without malignancies, 49 patients (49%) had no related processes, and 47 (47%) had benign diseases. During follow-up, one laryngeal cancer, one acute myeloid leukemia, and one colon cancer were detected (54.3±24.6 months). We found no differences between baseline CEA levels in patients with and without cancer (6.6±2.4 vs. 5.8±1.7ng/ml, p=0.2). The mean cost per patient was 503.6±257.6 €.
ConclusionsCancer was detected in a small proportion (7%) of patients with mild CEA elevation. The study of these patients is directly and indirectly associated with a not inconsiderable cost.
El marcador tumoral antígeno carcinoembrionario (CEA) contribuye de forma útil en un contexto clínico adecuado al manejo del paciente con diagnóstico establecido de cáncer colorrectal, pues efectivamente aquellos pacientes con un CEA sérico preoperatorio >5ng/ml presentan un peor pronóstico, independientemente del estadio tumoral. Asímismo, también es útil en el seguimiento, ya que un CEA elevado que no se normaliza tras la resección quirúrgica implica la presencia de enfermedad residual, y un aumento del mismo tras la cirugía denota recurrencia tumoral1. Al margen de estos hechos es necesario y crucial tomar conciencia de las limitaciones de la elevación del CEA en particular y de los marcadores tumorales en general.
En primer lugar y de forma más importante no tienen la suficiente precisión como para confirmar o excluir un diagnóstico, y de hecho existe una escasez de datos en la literatura en este sentido1–7.
Por otro lado, los estudios complementarios derivados de la alteración del marcador tumoral generan un gasto económico secundario trascendente8.
En tercer lugar es importante el estrés y la ansiedad que se genera en el paciente al conocer que tiene un marcador tumoral elevado, y que exploraciones o técnicas innecesarias, como biopsias o endoscopias, podrían producir graves complicaciones y retrasar un diagnóstico certero y su tratamiento correspondiente9.
Sin embargo, es frecuente la derivación desde Atención Primaria sobre todo, o desde otras especialidades, del paciente con una elevación leve de marcadores tumorales a la consulta de Aparato Digestivo y/o de Medicina Interna para su valoración y estudio. Estos pacientes, en general, suelen presentar síntomas inespecíficos o, incluso, están asintomáticos.
Objetivos- •
Determinar la prevalencia de procesos oncológicos subyacentes en pacientes que consultan por una elevación leve del CEA a lo largo del tiempo.
- •
Comprobar cuáles son los procesos relevantes no oncológicos asociados con mayor frecuencia a la elevación leve del CEA en nuestra población.
- •
Cuantificar el costo medio por paciente derivado del estudio por dicho hallazgo analítico.
El presente trabajo se ha realizado en el Hospital Alto Guadalquivir (Andújar, Jaén) y el Hospital Sierra de Segura (Puente Génave, Jaén), ambos pertenecientes a la Agencia Sanitaria Alto Guadalquivir (Consejería de Salud, Junta de Andalucía).
Se trata de un estudio observacional analítico retrospectivo, en el que se revisaron las historias clínicas de los pacientes seleccionados que cumplían todos los criterios de inclusión:
- 1.
Edad ≥ 18 años.
- 2.
Derivación a la consulta especializada de Digestivo y Medicina Interna por Atención Primaria o por otras especialidades para despistaje de un proceso tumoral, con la realización de anamnesis, exploración física y pruebas complementarias que permitiesen elaborar un diagnóstico final.
- 3.
Elevación leve de CEA en el rango de 3 a 10ng/ml.
- 4.
Ausencia de antecedente oncológico en la historia personal, independientemente del tipo, localización, grado de extensión y tratamiento realizado.
- 5.
Seguimiento mínimo de 12 meses del paciente tras la finalización del estudio específico.
Se excluyeron aquellos pacientes fumadores que presentaron niveles del CEA en el rango de 3 a 5ng/ml, según las recomendaciones del fabricante.
Se calculó el tamaño de la población mediante el programa Epidat 3.1 sobrestimando la cifra con el fin de compensar posibles pérdidas. Para alcanzar el tamaño muestral necesario, se evaluaron a todos los pacientes que consultaron durante el periodo comprendido entre el 1 de enero de 2.001 hasta el 31 de diciembre de 2.007 (Hospital Alto Guadalquivir) y desde el 1 de enero al 31 de diciembre de 2.007 (Hospital Sierra de Segura).
Las variables epidemiológicas, clínicas, analíticas y técnicas complementarias se han obtenido a través de la historia clínica electrónica.
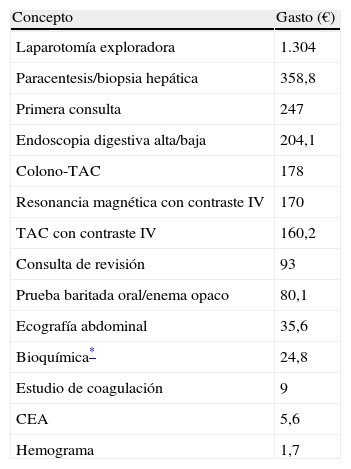
Asímismo se estudiaron los costes de los actos médicos (primera visita y consulta sucesiva/revisión) y de las técnicas empleadas utilizados en el presente estudio, que se detallan en la tabla 1.
Costes de los actos médicos y técnicas diagnósticas empleadas
| Concepto | Gasto (€) |
| Laparotomía exploradora | 1.304 |
| Paracentesis/biopsia hepática | 358,8 |
| Primera consulta | 247 |
| Endoscopia digestiva alta/baja | 204,1 |
| Colono-TAC | 178 |
| Resonancia magnética con contraste IV | 170 |
| TAC con contraste IV | 160,2 |
| Consulta de revisión | 93 |
| Prueba baritada oral/enema opaco | 80,1 |
| Ecografía abdominal | 35,6 |
| Bioquímica* | 24,8 |
| Estudio de coagulación | 9 |
| CEA | 5,6 |
| Hemograma | 1,7 |
Fuente: Área de Control de Gestión de la Agencia Sanitaria Alto Guadalquivir, Dirección Económico-Financiera.
Para la determinación del CEA se utilizó el inmunoanalizador Cobas e411 (Roche Diagnostics GmbH, Sanfhofer Strasse 116, D-68305 Mannheim, Alemania), basado en un test inmunológico in vitro para la determinación cuantitativa del CEA. La tasa de variabilidad individual establecida por el fabricante es de un 4,7%. El rango normal de medición por este método es de 0,2 a 3ng/ml. Se estableció como valor de corte para la selección de los pacientes más del triple de los valores considerados como normales por el método utilizado para no fumadores (3 y 10ng/ml), y el doble para fumadores (5 y 10ng/ml10). Se ha considerado que para que exista un cambio significativo en el nivel del marcador, los incrementos o decrementos han de superar el 20%, fuera del intervalo de referencia. Se ha tenido en cuenta la tasa de variabilidad inherente del método de medición por otro lado11,12.
En todos los tests utilizados, el nivel de significación estadística se estableció para todo valor de p <0,05. La comparación entre dos medias procedentes de muestras independientes se realizó utilizando el test de la t de Student, previa comprobación del ajuste de la población a una distribución normal (prueba de Kolmogorov-Smirnov de una muestra). Las variables cuantitativas se expresaron en media±desviación estándar. Para el estudio de dos variables cuantitativas se utilizó el coeficiente de correlación lineal de Pearson. Se calculó el coeficiente de determinación (R2) como indicador del porcentaje de la variabilidad de los datos que se explica por la asociación entre las dos variables. Para el análisis de las variables cualitativas se utilizó la comparación de proporciones mediante la prueba de la χ2 de Pearson. Para el procesamiento de los datos y su posterior análisis estadístico, se utilizó el paquete informático SPSS® versión 20.0 (SPSS Inc. Chicago, Illinois, Estados Unidos).
El estudio fue aprobado para su realización por el Comité de Ética e Investigación Sanitaria de la Empresa Pública Hospital Alto Guadalquivir el 7 de julio de 2.010.
ResultadosInicialmente se revisaron un total de 187 pacientes, de los que se excluyeron 87 pacientes (46,5%) en relación con:
- -
Desconocimiento del proceso diagnóstico motivo de estudio: Únicamente se contaba con el marcador tumoral elevado, y no se halló ningún acto médico asociado a esta alteración, 49; 26,2%.
- -
Estudio evolutivo inferior a 12 meses: 28; 14,9%.
- -
Fumador y CEA 3-5ng/ml: 10; 5,3%.
Finalmente, se incluyeron en el análisis estadístico 100 pacientes, de los que 60 eran hombres (60%) y 40 mujeres (40%). La edad media fue de 67,4±14,2 años, con un rango de edades comprendido entre 23 y 95 años. No existieron diferencias estadísticamente significativas entre la edad del grupo femenino y del masculino (67,6±14,4 vs. 67,2±14,2 años; p=0,9).
En relación a la primera determinación realizada previamente a su derivación, el nivel medio del CEA fue de 5,8±1,7ng/ml, con un mínimo de 3,1 y un máximo de 10. No se detectaron diferencias estadísticamente significativas entre el nivel medio del CEA de las mujeres y el de los hombres (5,8±1,8 vs. 5,8±1,7ng/ml; p=0,8). Tampoco se encontró una asociación estadísticamente significativa entre el nivel basal del CEA y la edad de los pacientes (R2=0,025; p=0,1).
Desde un punto de vista clínico, los síntomas o signos que sirvieron de sospecha para establecer el procedimiento diagnóstico se reflejan en la tabla 2. De los 13 pacientes con síntomas y signos de alarma digestivos, 8 pacientes presentaban alteración del tránsito intestinal, 3 hemorragia digestiva (2 bajas y una alta), un paciente con disfagia a sólidos y líquidos, y un paciente con síndrome emético. Las imágenes patológicas en pruebas diagnósticas radiológicas hacen referencia a la presencia de lesiones en tomografía axial computadorizada (TAC) (quistes hepáticos [2%], pseudotumor inflamatorio [1%], suboclusión intestinal [1%], y pseudoquiste pancreático tras episodio de pancreatitis [1%]), o en ecografía abdominal (adenopatías [1%]).
Síntomas/signos guía en el proceso diagnóstico
| Alteraciones analíticas | 19% |
| Disnea | 13% |
| Dolor abdominal | 13% |
| Signos de alarma digestivos | 13% |
| Síndrome constitucional | 10% |
| Deterioro cognitivo | 10% |
| Ascitis | 6% |
| Técnicas de imagen patológicas | 6% |
| Lesiones dérmicas | 4% |
| Trombosis venosa profunda | 3% |
| Neuropatía sensitivo-motora | 3% |
| Total | 100% |
En la tabla 3 se resumen las técnicas realizadas durante el estudio de todos los pacientes analizados. Se realizaron un total de 31 TAC (18 abdomen-pelvis, 7 torácicos, 5 craneales y una colono-TAC). De las resonancias magnéticas realizadas, 4 eran craneales y una abdominal. Las «pruebas baritadas orales», incluyen la realización de una seriada esófago-gastro-duodenal y/o de un tránsito intestinal, mientras que las «otras técnicas invasivas» incluyen la realización de una laparoscopia (1), una paracentesis diagnóstico-evacuadora (1) y una biopsia hepática percutánea (1).
Una vez que finalizó el proceso diagnóstico de los pacientes se detectaron 4 procesos oncológicos (4%): un estudio baritado oral sugerente de neoplasia gástrica, un cáncer de pulmón, un cáncer de colon, y por último una radiografía torácica sugerente de neoplasia pulmonar. No se continuaron los estudios de neoplasia sugerentes porque el deterioro físico no aconsejó la realización de otras técnicas diagnósticas invasivas. En ninguno de estos procesos existió una clínica previa que justificase per se la elevación del marcador tumoral.
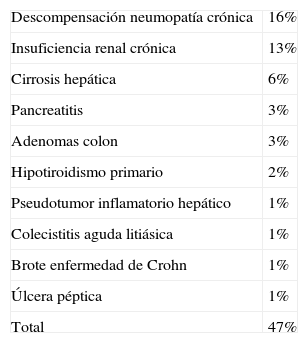
De los 96 pacientes sin diagnóstico oncológico, en 47 pacientes (47%) se estableció como diagnóstico definitivo una serie de patologías ya descritas como causas no neoplásicas de la elevación del CEA (tabla 4). Por otro lado, en 49 (49%) no se detectó ninguna patología que justificase la elevación del CEA. Estos pacientes presentaron un CEA basal de 5,5±1,5ng/ml, con mínimo de 3,3 y máximo de 10ng/ml, y con edad de 68,1±12,9 años, con mínimo de 40 y máximo de 89. La sintomatología que motivó el estudio fue: ausencia de la misma (13; 26,5%), dolor abdominal (8; 16,3%), síndrome constitucional (7; 14,2%), síndrome vertiginoso (7; 14,2%), alteración del tránsito intestinal (6; 12,2%), urticaria (2; 4%), dispepsia (2; 4%) y varios (trombosis venosa profunda, dolor torácico, emesis y tenesmo rectal [4; 8,1%]). Existieron 2 determinaciones de CEA en 14 pacientes (28,5%), con 4 pacientes con disminución del CEA (8,1%), 5 con estabilidad (10,2%) y 4 con crecimiento (8,1%). El diagnóstico final de los 96 pacientes con patología no oncológica se estableció tras 2,3±0,7 visitas, con un mínimo de 2 y un máximo de 6. Una vez establecido el diagnóstico final, se realizó un seguimiento del paciente durante 54,3±24,6 meses, con un mínimo de 12 y máximo de 132.
Diagnósticos definitivos no oncológicos tras el estudio inicial
| Descompensación neumopatía crónica | 16% |
| Insuficiencia renal crónica | 13% |
| Cirrosis hepática | 6% |
| Pancreatitis | 3% |
| Adenomas colon | 3% |
| Hipotiroidismo primario | 2% |
| Pseudotumor inflamatorio hepático | 1% |
| Colecistitis aguda litiásica | 1% |
| Brote enfermedad de Crohn | 1% |
| Úlcera péptica | 1% |
| Total | 47% |
Respecto al número de determinaciones del CEA, en 32 pacientes (32%) se realizaron dos mediciones del nivel del CEA y en 21 (21%) tres. El tiempo medio transcurrido desde la primera medición del CEA (basal) hasta la final (segunda o tercera) fue de 20,6±21,3 meses, con un rango entre 2 y 70 meses. No existieron diferencias estadísticamente significativas entre el nivel basal medio del CEA y el control (5,9±1,7 vs. 6,8±5,5ng/ml; p=0,5). La evolución del CEA fue a decrecer en 14 pacientes (43,7%). En este grupo, 6 pacientes (18,7%) normalizaron los valores del CEA mientras que los otros 8 (25%) aunque más bajos permanecieron patológicos. En 10 pacientes (31,2%) aumentaron los niveles y se observó un mantenimiento de las cifras del CEA en 8 pacientes (25%).
En el grupo de pacientes con normalización de los valores del CEA, se efectuó un seguimiento clínico durante 54±6,5 meses (rango 48-60). Un paciente (16,7%) presentó en la evolución cáncer laríngeo a los 48 meses. En los pacientes con descenso sin normalización del CEA se efectuó un seguimiento durante 58,5±30,3 meses (rango 24-96). Un paciente (12,5%) presentó leucemia aguda mieloide a los 31 meses de seguimiento. En el grupo de pacientes con niveles estables del CEA se efectuó un seguimiento de 67,5±40 meses (rango 24-132). No se detectaron neoplasias en la evolución. Por último, en el grupo de pacientes con crecimiento del CEA se efectuó un seguimiento durante 58,8±26,8 meses (rango 24-96). Se diagnosticó un cáncer de colon (10%) a los 48 meses. No se observaron diferencias estadísticamente significativas en el porcentaje de neoplasias encontradas en función de la evolución del marcador (p=0,7).
En el análisis del subgrupo de los 7 pacientes con cáncer diagnosticados durante el estudio inicial o durante la evolución clínica, no se encontraron diferencias estadísticamente significativas entre sus niveles del CEA basal respecto a los 93 pacientes sin patologías oncológicas (6,6±2,4 vs. 5,8±1,7ng/ml; p=0,2).
El gasto medio por paciente que generó el despistaje de un tumor oculto en función de la elevación del marcador tumoral fue de 503,6±257,6 € con un mínimo de 288,3 y un máximo de 1.923,2. No existieron diferencias estadísticamente significativas entre el gasto medio de los pacientes con cáncer (en el estudio inicial y durante el seguimiento) y los que no lo presentaron (664,4±277 vs. 491,5±253,6 €; p=0,09).
DiscusiónEn nuestro estudio hemos detectado un total de 7 pacientes (7%) con procesos oncológicos asociados a una elevación leve del CEA: 4 durante el proceso diagnóstico y los 3 restantes durante un amplio seguimiento de los pacientes de más de 4 años.
Está demostrado que los cánceres de colon, de pulmón, gástrico y de laringe cursan con niveles elevados de dicho marcador, debido a que son neoplasias malignas de origen epitelial, y la proliferación aberrante de este epitelio refleja la elevación de dicho marcador. Otros cánceres relacionados son páncreas, mama, tiroides, vías urinarias y aparato reproductor9,13–15. Sin embargo, uno de los cánceres hallados en la evolución, el cáncer laríngeo, fue diagnosticado en un paciente con decrecimiento del CEA hasta la normalización, lo que añade un dato más de inespecificidad de este marcador. Similar cuestión existe en el paciente con diagnóstico de leucemia aguda mieloide por disminución del CEA (sin normalización). En teoría, al tratarse de una neoplasia maligna hematológica no produciría elevación del CEA, pero en concreto, Wysocki et al. correlacionan de modo descriptivo la elevación del CEA en niños con leucemia aguda y su relación con una recidiva precoz16.
En el presente estudio, en casi la mitad de los pacientes no se encontró una patología o estado fisiológico en relación con la elevación del CEA leve. La sintomatología presentada por este grupo no explicó per se la elevación del marcador. Convendría barajar la posibilidad hipotética de que existan otros factores que en determinados pacientes no se deban obviar, como por ejemplo la presencia de sustancias circulantes similares al CEA (CEA-like), esto es, autoanticuerpos e inmunocomplejos que puedan elevar levemente este marcador17, por lo cual y en estos casos, se deberían considerar como falsos positivos. Por otro lado y de manera interesante, se ha apuntado en diferentes estudios la posibilidad de que la propia edad e incluso la realización de una colonoscopia pueda elevar la concentración del CEA18,19. En nuestro estudio no hemos hallado relación entre la edad y los niveles elevados del CEA. Ninguno de los pacientes se realizó una colonoscopia previa a la determinación del CEA.
En nuestro estudio, el grupo de pacientes con procesos no oncológicos que sí explicarían la elevación del CEA representa un porcentaje relevante (47%). Es preciso denotar que la mucosa no maligna en estado de hiperproliferación tiene la capacidad de expresar el CEA. Así, desde una perspectiva práctica, el nivel del CEA se encuentra elevado en una diversidad de afecciones inflamatorias asociadas con aceleración del recambio celular, agudas o crónicas, y en otras condiciones patológicas benignas, encontradas en nuestros pacientes como infección pulmonar, insuficiencia renal crónica, hipotiroidismo, adenomas de colon, colecistitis, enfermedad inflamatoria intestinal, pancreatitis y úlcera péptica9,13–15, además de diabetes por otro lado. Conviene, en este sentido y por otro lado, considerar algunas patologías que tendrían una explicación menos clara según esta cuestión. En primer lugar, la elevación del CEA en relación con insuficiencia renal crónica (13%). Esta es una de las causas más frecuentes halladas de las patologías benignas en relación con la elevación del CEA. La disminución de la tasa de filtración glomerular de este marcador implica una elevación en el mismo en su nivel sanguíneo, lo que hace que este marcador, entre otros, no sea fiable en la monitorización de tumores en pacientes urémicos debido a la alta tasa de falsos positivos20.
En segundo lugar, la cirrosis hepática descompensada (hidrópica, 6%). Sin embargo, no es la ascitis, ni cualquier descompensación como tal, la que puede provocar la elevación del marcador, sino más bien el estado de cirrosis hepática (estado inflamatorio permanente). Se estima que se debe a una alteración en el procesamiento metabólico causado por la disfunción celular, en mayor o menor medida, existente21.
En tercer lugar, hipotiroidismo primario (2%). Existen varias publicaciones que asocian la existencia de rabdomiólisis y elevación extrema de creatinquinasa con el hipotiroidismo, lo que podría favorecer la elevación del CEA22, si bien es verdad que la causa real de la elevación en este proceso permanece incierta23. Existen varios estudios que implican además en la causalidad una disminución en la degradación o excreción (hepática) del CEA circulante24,25, de igual manera que el comportamiento de otras enzimas en esta patología, tales como la aspartato aminotransferasa y lactato deshidrogenasa, así como del colesterol26. Por otro lado, y de forma trascendente, existen también otras publicaciones que indican que en ocasiones se ignora el diagnóstico de hipotiroidismo como causa de la elevación del marcador, por lo cual se debiera siempre de barajar en el diagnóstico27, y de hecho estas alteraciones normalmente son transitorias una vez que se controla el proceso tiroideo28. En estos 2 casos solo tenemos una medición del CEA (4 y 4,6ng/ml, pacientes no fumadores), por lo que no sabemos si estos valores regresaron a la normalidad una vez controlado el proceso tiroideo.
Nos ha llamado la atención el caso de un paciente con pseudotumor inflamatorio hepático (1%). Este es un tumor benigno raro de etiología desconocida compuesto por tejido fibroso con infiltración de células inflamatorias29. Forman lesiones visibles en las técnicas de imagen que pueden considerarse a priori como malignas, por lo cual en ocasiones precisa de técnicas con mayor invasividad como por ejemplo biopsia hepática percutánea (este caso en concreto) o por laparoscopia para poder realizar un estudio histopatológico. Etiopatológicamente se podría especular con que la elevación del CEA en este caso se debiera a la inflamación producida por la lesión, sin embargo no se ha hallado en la literatura médica ninguna mención a la relación entre estas lesiones y la elevación del CEA, por lo cual no deja de ser una hipótesis.
En nuestro estudio no se han apreciado diferencias estadísticamente significativas entre los niveles medios del CEA de los pacientes que han presentado un tumor, tanto en el proceso diagnóstico como en la evolución, y en los que no lo presentaron. Esta circunstancia no hace más que resaltar el carácter inespecífico de este marcador cuando se encuentra levemente elevado en el diagnóstico de sendos procesos.
El gasto medio por paciente generado por el estudio para el despistaje de un tumor oculto en relación con la elevación del CEA fue de 503,6±257,6 €. En la literatura médica existe escasez de estudios que comuniquen el gasto realizado en relación con la elevación de marcadores tumorales solicitados de manera indebida, de manera directa y también indirecta. Ntaios et al. realizaron un estudio descriptivo y retrospectivo realizado en un hospital de Tesalónica (Grecia) para auditar la adecuación de las peticiones de algunos de los marcadores tumorales. Se realizaron un total de 10.921 peticiones de marcadores tumorales en un total de 1.944 pacientes. De estos, solo un 20,1% (391) presentaron cáncer. La determinación del CEA presentó un grado de adecuación tan solo del 25,8%, considerando que el coste total de las peticiones del CEA fue de 23.299 €, sin incluir los costes indirectos ni las exploraciones posteriormente realizadas8. Una de las consecuencias que se pueden vislumbrar es que, quizás por la desconfianza que otorga la elevación de un marcador tumoral en relación con una patología benigna productora, o entendido de otra manera por la confianza en su precisión diagnóstica oncológica (que es baja), estos pacientes probablemente se realizaron más técnicas complementarias y por ende más revisiones en las consultas.
En otro orden conviene comentar el efecto estresante y preocupante que provoca la elevación de un marcador tumoral en el paciente sin haber sido diagnosticado de un proceso oncológico, palpable en la práctica clínica diaria, además de que algunas de las técnicas complementarias derivadas son invasivas y por ello no están exentas de riesgos, algunos graves9.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.