El descubrimiento de los cambios moleculares de los adenomas ha dado lugar a un renovado interés en este tipo de tumor. En la última edición de la OMS de los tumores del tracto gastrointestinal (2010) se incluyen 4 tipos de adenomas hepáticos, bien caracterizados inmunohistoquímicamente, genotípicamente y fenotípicamente, en los que tienen un papel importante los antecedentes clínicos y su comportamiento morfológico para determinar el posterior riesgo de malignidad, fundamentalmente en aquellos con mutación de la b-catenina.
La presencia de esteatosis, inflamación y cambios vasculares, unidos a la respuesta frente a la FABP, el amiloide sérico A y la glutamina sintetasa nos permite clasificarlos en 4 grupos: con mutación de HNF1A (H-HCA), con mutación de b-catenina (b-HCA), inflamatorios (IHCA) y sin marcadores.
La ausencia de expresión frente al glypican 3, el HSP 70 y el mapeo perivenular frente a la glutamina sintetasa ayuda a excluirlos frente a los hepatocarcinomas bien diferenciados.
En este trabajo describimos el comportamiento clínico, morfológico e inmunofenotípico de 3 casos de pacientes diagnosticados de adenomas hepáticos en un período de 2 años.
Interest in adenomas has been renewed by the discovery of the molecular changes in these tumors. The latest World Health Organization publication on gastrointestinal tract tumors (2010) includes four types of hepatic adenomas, which are well characterized immunohistochemically, genotypically and phenotypically. In these tumors, medical history and morphological behavior play an important role in determining the risk of malignancy, mainly in adenomas with a b-catenin mutation.
The presence of steatosis, inflammation, vascular changes linked to response to L-FABP, serum amyloid A, and glutamyl synthetase help to classify these tumors into four groups: hepatocellular adenomas with the HNF1A mutation (H-HCA), those with the b-catenin mutation (b-HCA), inflammatory HCA (IHCA), and HCA without markers.
The absence of glypican 3 expression, HSP 70 and perivenular mapping of glutamyl synthetase helps to distinguish these tumors from well differentiated hepatocellular carcinoma.
We describe the clinical, morphological and immunophenotypic features of three patients diagnosed with hepatic adenomas in a 2-year period.
El adenoma hepatocelular es una neoplasia benigna que se presenta en el hígado sano y se compone de células semejantes a los hepatocitos normales. Cuando hay varios, por lo general más de 10, se ha denominado adenomatosis hepática1,2.
Antiguamente, el adenoma hepatocelular se desarrollaba por lo general en mujeres en el grupo de edad reproductiva entre (15 y 45 años), casi siempre asociado con el uso de anticonceptivos3,4. El descubrimiento de los cambios moleculares en los adenomas ha dado lugar a un renovado interés en este tipo de tumor. En 2 grandes series recopiladas en la década de 1970, la edad media fue de 30 años y la mayoría de los pacientes tenían entre 20 y 39 años5,6.
Aunque el riesgo absoluto era muy bajo, estudios epidemiológicos de casos descritos en la década de 1970 reportaron una incidencia anual de cerca de 3-4 casos/100.000 consumidores de anticonceptivos orales por más de 5 años, pero solo 1/1.000.000 en aquellas mujeres no consumidoras o las expuestas a anticonceptivos en un tiempo menor a 2 años7.
La incidencia de adenoma secundario a estrógenos ha disminuido en los últimos años debido al uso de dosis más bajas8. El mecanismo exacto no se conoce, pero se piensa que los esteroides tienen un papel como agentes promotores más que iniciadores en la formación de estos tumores hepatocelulares9,10. Varios adenomas no resecables han regresado después de la suspensión de los esteroides, apoyando así la hipótesis anterior11,12.
Asimismo, otras hormonas esteroideas, como los estrógenos no anticonceptivos13 y anabólicos/androgénicos esteroideos, se han asociado con los adenomas hepatocelulares14.
Recientemente, se han descrito 3 condiciones clínicas en las que la incidencia de adenomas hepatocelulares no está implicada con la ingestión de anticonceptivos. Una de ellas son las enfermedades por almacenamiento de glucógeno15,16. Los pacientes con estos trastornos pueden desarrollar adenomas múltiples.
Otra condición clínica son las formas de herencia autosómica dominante de la diabetes mellitus familiar, denominada MODY317,18. Los pacientes con este trastorno también desarrollan adenomas múltiples y se han asociado con la mutación en la línea germinal del gen TCF1, que codifica el factor nuclear hepatocitario 1α (HNF1α)19.
Existe una tercera condición clínica asociada a los adenomas que está aumentando su incidencia en los últimos años y es el caso de los adenomas inflamatorios asociados a la obesidad, teniendo igual incidencia tanto en hombres como en mujeres20–22.
La escisión quirúrgica sigue siendo el tratamiento de elección. Hay casos publicados de hepatocarcinomas que surgen después de adenomas múltiples resecados, considerándose que representan focos de hepatocarcinomas resecados dentro de adenomas. También se ha comunicado la regresión de estos tumores con la suspensión de los esteroides por vía oral11. Los casos asociados con la enfermedad por almacenamiento de glucógeno pueden regresar con la terapia dietética. Los tumores no resecables o los casos de adenomatosis pueden ser tratados mediante trasplante hepático, pero de forma general se recomienda el tratamiento conservador23–26.
En los últimos años y según lo publicado en el libro de la OMS de 2010, se han tratado de enmarcar los adenomas en 4 grupos según su expresión genética e inmunofenotípica y las características típicas desde el punto de vista morfológico5,27–30 para su mejor tratamiento y seguimiento clínico. Estos grupos son: adenomas asociados a mutación de HNF1A (H-HCA), a mutación de b-catenina (b-HCA), los de tipo inflamatorio (IHCA) y los que no tienen marcadores31,32.
Pacientes y métodosSe estudiaron 4 casos, 3 con diagnóstico radiológico de lesión ocupante de espacio (LOE) hepática. Se procesó la pieza fijada previamente en formol. Se realizaron cortes de hematoxilina/eosina del tumor y zonas de transición con tejido no tumoral y técnica histoquímica de fibras de reticulina.
En cada corte del tumor se realizaron estudios inmunohistoquímicos de FABP (polyclonal de abcam, incubación 20’×, dilución 1/50), amiloide sérico A (monoclonal de ratón, clone mc 1 de DAKO), glutamina sintetasa (monoclonal de Millipore, incubación 10’×, dilución 1/5.000 μl) y CD 34.
Además se realizaron estudios inmunohistoquímicos de glypican 3 (monoclonal de ratón, clon 1G12 «monosam», HSP 70 [monoclonal de ratón HSC 70 {w27 «Santa Cruz»], incubación 20’× dilución 1/500) en el caso n.o 3 con el objetivo de excluir el hepatocarcinoma.
Caso 1Paciente mujer de 22 años de edad, obesa, que ingresa para intervención programada por LOE en segmento 6 compatible con adenoma. Antecedentes de hipercolesterolemia actualmente tratada con dieta y usuaria, durante varios años, de anticonceptivos orales.
La ecografía abdominal revela imagen nodular única de 54 × 45mm en el segmento 6, bien definida, que capta contraste en face arterial y un lavado relativamente rápido. Diagnóstico: adenoma vs. hiperplasia.
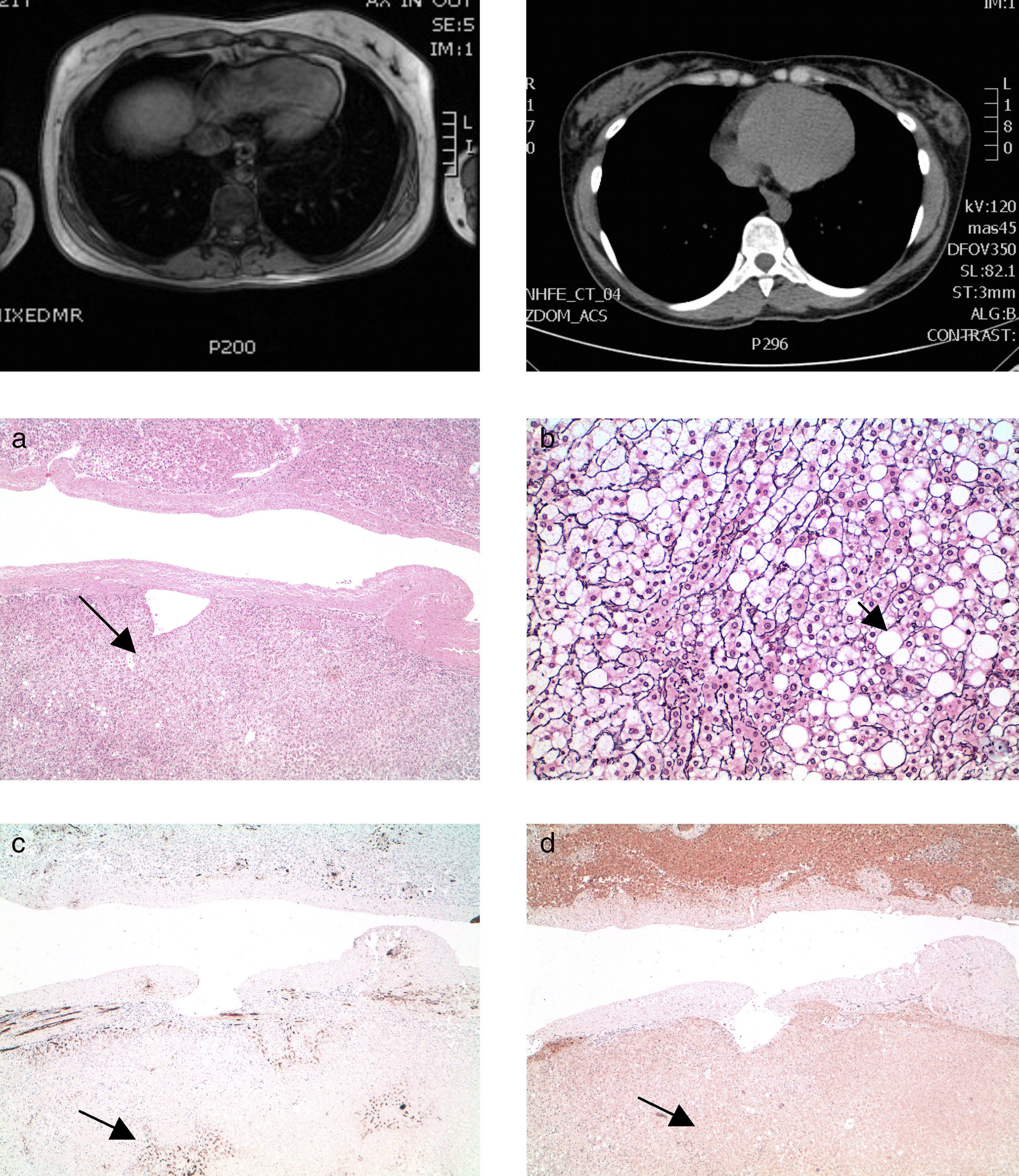
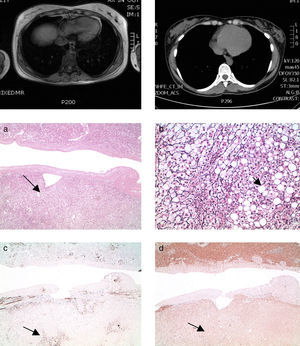
Los estudios de imagen (RM) mostraron una tumoración sólida de 38 × 48 × 47mm en el segmento 6 hepático, presentando unos bordes bien delimitados del parénquima vecino, aunque sin identificarse cápsula. Esta tumoración contenía un componente graso y no se advertía cicatriz central (fig. 1a). El diagnóstico clínico-radiológico indicativo de adenoma hepatocelular.
Caso 2Paciente mujer de 32 años, obesa, asintomática, con diagnóstico de tumor hepático incidental en ecografía de control y usuaria de anticonceptivos orales durante varios años hasta hace 2. En la analítica, los marcadores tumorales fueron negativos.
La RM mostró un hígado no cirrótico con LOE de 8×7×6cm, que ocupa la porción central del hígado englobando segmento 4, 1 y 8, con efecto de masa sobre las ramas portales y suprahepáticas.
En la fase arterial se comporta como una masa hipercaptante, homogénea, mostrando lavado (hipodenso) en fase tardía (fig. 1b).
Diagnóstico: adenoma hepatocelular a descartar hiperplasia nodular focal (ausencia de cicatriz), menos probable hepatocarcinoma.
Caso 3Paciente de sexo masculino, de 46 años edad, con antecedentes de hepatitis B a los 15 años y hepatitis C diagnosticada hace 11 años sin controles. Presentaba hábito enólico y síndrome de apnea obstructiva del sueño. Fue enviado a consulta procedente de otro hospital por detectar 2 LOE hepáticas que radiológicamente indican hepatocarcinoma con biopsias previas negativas para tumor, indicando la del lóbulo hepático izquierdo HNF.
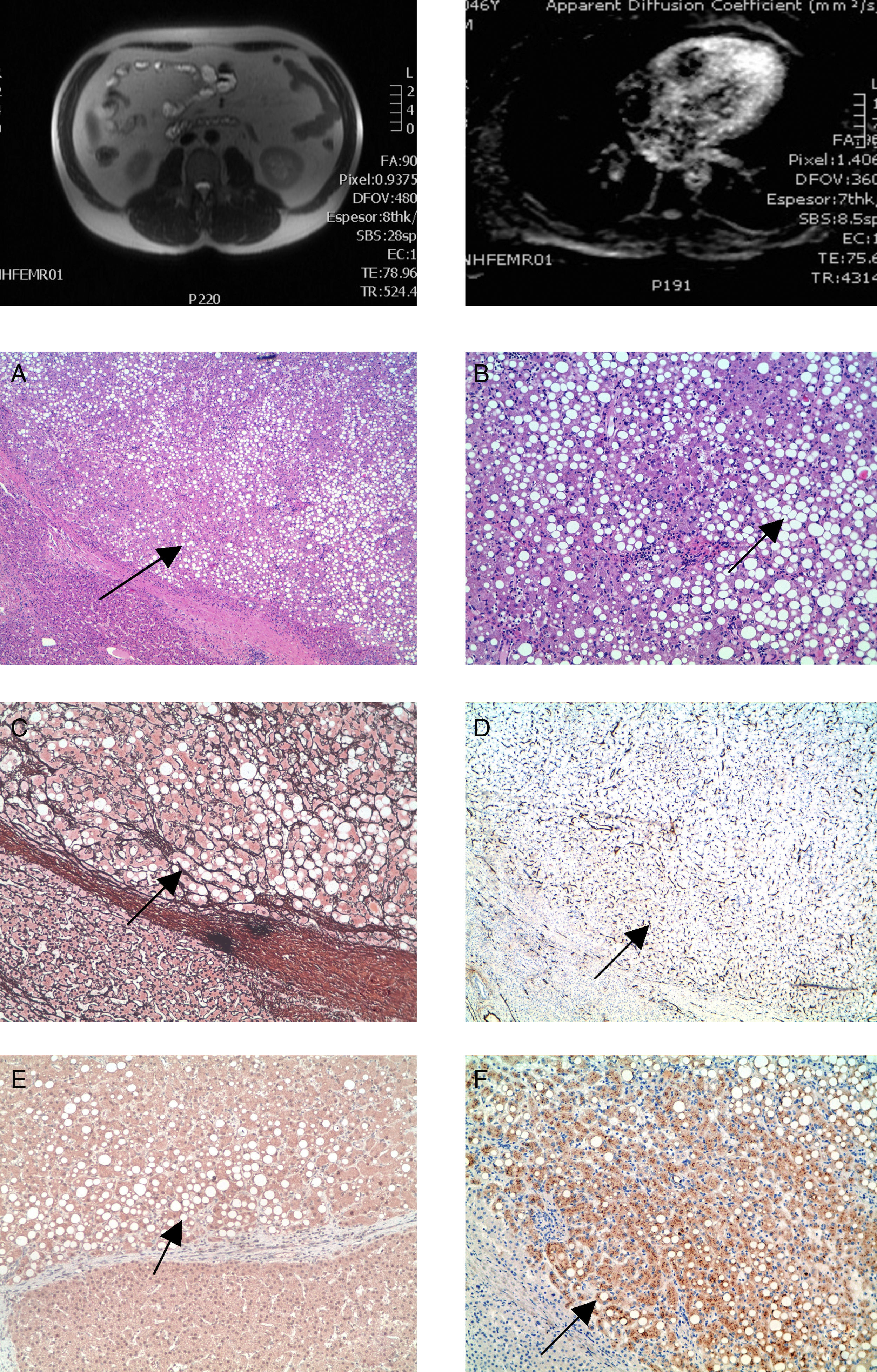
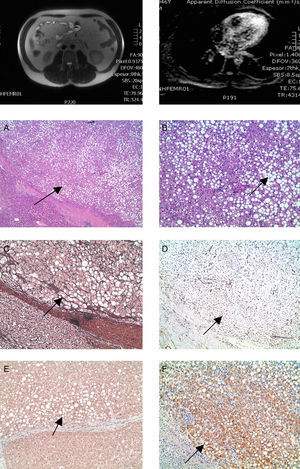
La RM mostró una lesión nodular en el lóbulo hepático izquierdo de 52 × 50mm, bien delimitada, que presenta en su interior contenido graso y nivel grasa-líquido con hemorragia intralesional. Tras la administración de contraste se presenta como una lesión predominantemente hipocaptante con cápsula fina, bien delimitada que sí capta contraste.
Una segunda lesión nodular en el segmento 7, de 15mm de diámetro máximo, asimismo con un contenido de aspecto graso y con halo periférico captante en fase arterial que se mantenía en las fases sucesivas, no siendo este comportamiento típico de hepatocarcinomas.
Otros 2 pequeños nódulos, existentes ya en la exploraciones previas, de 10mm, localizados en segmentos 7 y 6, de naturaleza inespecífica, que captaban en fase arterial y se homogeneizaban posteriormente.
Esteatosis hepática difusa y captación del parénquima parcheada en fase arterial por trastornos de perfusión asociados (fig. 2a y b).
Caso 4Paciente varón de 39 años de edad que ingresa, procedente de otro centro, por presentar LOE hepática clínicamente indicativa de adenoma en segmento 2-3. No refería síntomas ni existían antecedentes de interés conocidos. Radiología no realizada en el centro.
ResultadosCaso 1 y 2El estudio histológico de ambos casos mostró una proliferación hepatocelular benigna que se disponía en forma trabecular, con esteatosis macrovesicular y aislados focos inflamatorios mononucleares, así como capilarización sinusoidal focal.
El comportamiento inmunohistoquímico del área tumoral mostró ausencia de expresión de L-FABP (fig. 1). El amiloide A y la glutamina sintetasa resultaron negativos en ambos casos.
La anatomía patológica de los casos 1 y 2 reveló adenoma hepatocelular con esteatosis, indicativo de inactivación del HNF1α.
Caso 3El estudio de la pieza quirúrgica presentó varios nódulos tumorales (en número de 3), con esteatosis macrovesicular difusa, frecuentes focos inflamatorios mononucleares y vasos congestivos ectásicos. No se apreciaba cicatriz central. Los nódulos estaban bien delimitados, sin cápsula fibrosa. Las células tumorales se disponían en forma trabecular, sin atipia nuclear, ni alteración arquitectural o citológica indicativa de malignidad (fig. 2).
Las técnicas de inmunohistoquímica frente al glypican 3, el HSP 70 y la glutamina sintetasa resultaron negativas, aunque la capilarización sinusoidal fue de un 100%. Estos datos inmunohistoquímicos frente a la morfología descartaban el diagnóstico de hepatocarcinoma en un paciente con hepatopatía crónica (VHC, VHB y alcohol). La inmunorreactividad frente a L-FABP fue positiva, tanto en la zona tumoral como en la no lesional, no constatándose su ausencia en tejido tumoral como los 2 casos anteriores. Sin embargo, se demostró positividad citoplasmática granular frente al amiloide A, lo que ayudó a detectar otros nódulos tumorales de menor tamaño, no visibles microscópicamente.
Anatomía patológica: adenomas telangiectásicos inflamatorios, hepatitis crónica (VHC), con grado de actividad necroinflamatoria leve (IP 2/4, IL 2/4), según esquema de Scheuer y Batts. Expansión fibrosa periportal (Ishak 2/6), aunque esta valoración fue de valor limitado por tratarse de una biopsia subcapsular.
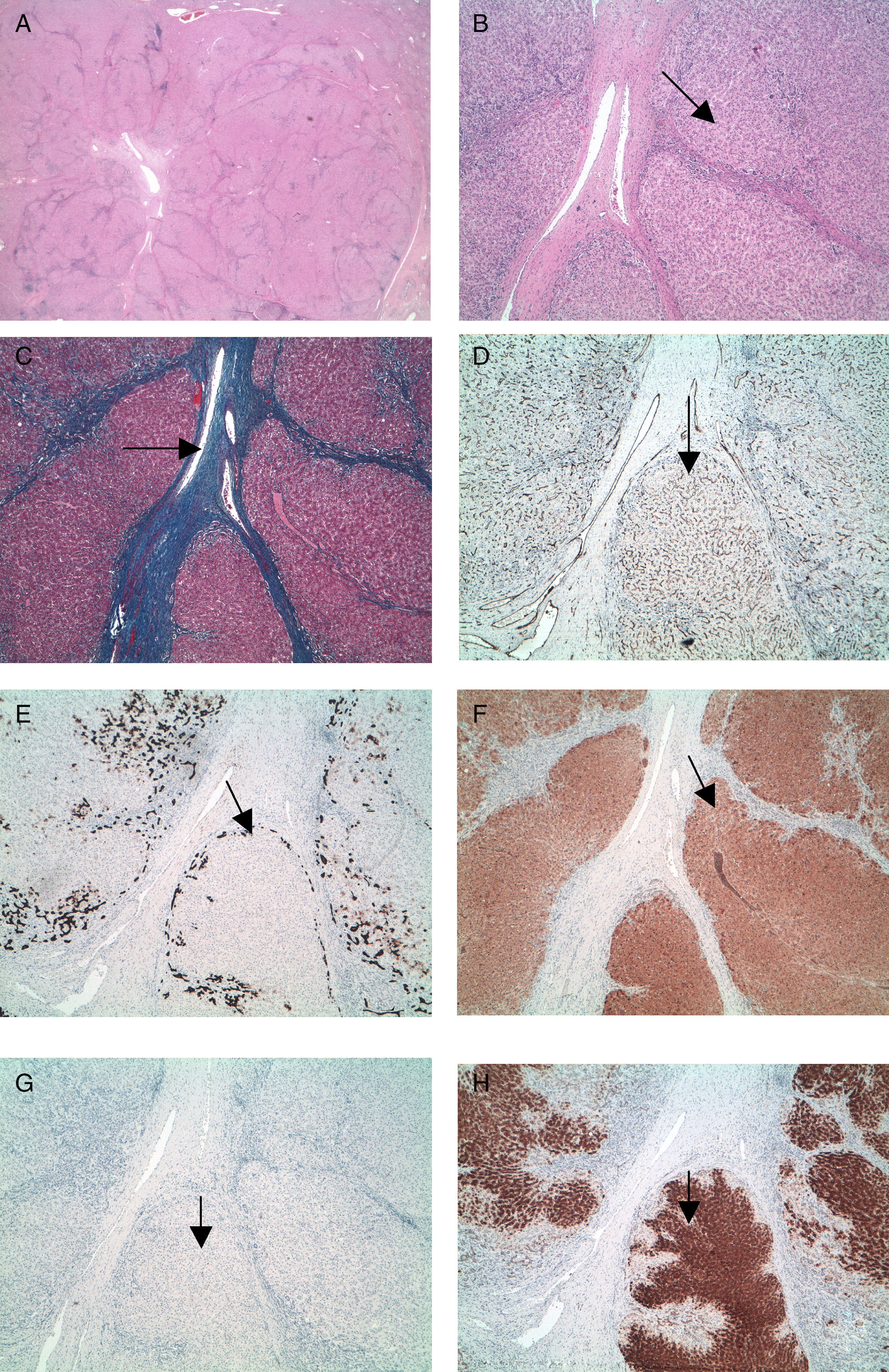
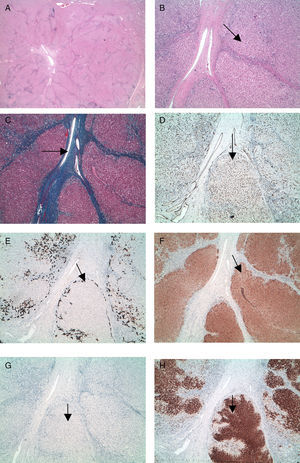
Caso 4El estudio de anatomía patológica reveló la presencia de nódulos de aspecto regenerativos con existencia de una cicatriz central con vasos neoformados anómalos. Existían ligeros signos inflamatorios mononucleares portales, sin áreas de esteatosis hepática.
Con las técnicas de inmunohistoquímica apreciamos una reacción ductular periférica reactiva frente a CK 7, típica de estas lesiones, así como ausencia de expresión inmunofenotípica frente al amiloide A y positividad difusa granular frente a L-FABP, tanto en el hígado tumoral como en el no lesional.
Lo más llamativo fue la ausencia de mapeo perivenular normal frente a la glutamil sintetasa, característica de los hígados normales y de la hiperplasia nodular focal, mostrando una positividad intensa difusa granular en las células tumorales (fig. 3). Sin embargo, la inmunorreactividad frente a la b-catenina fue membranosa, sin sobreexpresión nuclear citoplasmática que nos podría indicar mutación de la vía.
Anatomía patológica: hiperplasia nodular focal.
DiscusiónLos casos 1 y 2 eran mujeres jóvenes, con antecedentes de ingestión de anticonceptivos orales y con factores clínicos de obesidad (tabla 1). El comportamiento inmunohistoquímico de ambos casos de adenomas señala el estudio de la mutación del HNF1α presente no solo en pacientes con diabetes mellitus familiar, sino también en un 35-50% de las formas esporádicas de adenomas y los asociados con la ingesta de anticonceptivos orales. El tratamiento, a pesar de la cirugía, radica en la suspensión del anticonceptivo oral y el tratamiento dietético. De ahí su importancia clínico-patológica32.
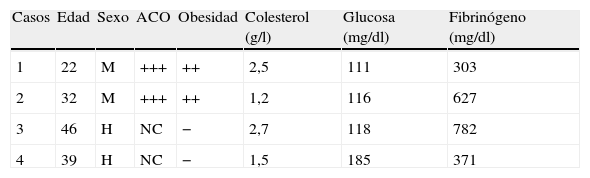
Resumen de los datos clínicos
| Casos | Edad | Sexo | ACO | Obesidad | Colesterol (g/l) | Glucosa (mg/dl) | Fibrinógeno (mg/dl) |
| 1 | 22 | M | +++ | ++ | 2,5 | 111 | 303 |
| 2 | 32 | M | +++ | ++ | 1,2 | 116 | 627 |
| 3 | 46 | H | NC | − | 2,7 | 118 | 782 |
| 4 | 39 | H | NC | − | 1,5 | 185 | 371 |
ACO: anticonceptivo oral.
Valores de referencia: colesterol (< 2g/l); glucosa (76-110mg/dl); fibrinógeno (170-437mg/dl).
El caso 3 es un caso muy interesante y complicado. Se trataba de un paciente con antecedentes de hepatopatía crónica en estado no cirrótico con varias LOE. El diagnóstico diferencial principal era frente a los hepatocarcinomas bien diferenciados.
Estos adenomas reclasificados actualmente como de tipo telangiectásico o adenomas inflamatorios es frecuente que aparezcan en personas con sobrepeso, con niveles altos de proteína C reactiva o fibrinógeno. Aproximadamente, el 60% de estos casos se han asociado a mutaciones gp13032, aunque un 10% puede asociarse con mutación de b-catenina.
Por otra parte, la distinción entre adenomas y hepatocarcinomas bien diferenciados puede ser difícil desde el punto de vista radiológico y más en un paciente portador de una hepatopatía crónica. La morfología y la inmunohistoquímica ayudarán a diferenciarlos. El reconocimiento de un patrón de crecimiento trabecular y características citológicas de malignidad son características de los hepatocarcinomas. Una sobreexpresión nuclear-citoplasmática frente a la b-catenina, positividad difusa granular intensa frente a la glutamil sintetasa y al glypican 3 y la positividad nuclear frente al HSP-70 apuntan el diagnóstico de hepatocarcinoma. El índice de proliferación nuclear es más alto en los tumores malignos hepatocelulares que en los benignos, aunque, ocasionalmente, tumores malignos pueden mostrar índices de proliferación bajos. Los marcadores de diferenciación endotelial, como CD34, que expresan capilarización sinusoidal, es generalmente fuertemente expresado en los hepatocarcinomas, pero algunos adenomas pueden tener expresión focal o difusa frente al CD 34 como en este tercer caso.
En el caso 4, con un diagnóstico clínico indicativo de adenoma, el estudio de la pieza reveló una lesión nodular, no encapsulada y con presencia de un área de cicatriz central, característica clásica de las hiperplasias nodulares focales.
En ocasiones suele ser difícil de distinguir de los adenomas hepáticos, sobre todo en biopsias pequeñas. El hallazgo de áreas de cicatrización que contienen las grandes arterias y la presencia de características crónicas colestásicas en los hepatocitos de la lesión nos orienta a favor del diagnóstico de la hiperplasia nodular focal.
La determinación del estudio de clonalidad sería lo que nos confirmaría en este caso reportado que se tratara de un proceso reactivo secundario a una malformación vascular (hiperplasia nodular focal) o un proceso monoclonal neoplásico benigno (adenoma) y entonces se clasificaría como de causa indeterminada al no presentar características histológicas específicas, ni conocerse mutación genética asociada (OMS, 2010).
El tercer tipo de adenoma, que corresponde a una minoría de casos en las series publicadas, está asociado a mutaciones de la b-catenina y se cree que tiene un potencial de malignidad mucho mayor que los otros tipos de adenomas.
En nuestra publicación no presentamos ningún caso de este grupo.
ConclusiónEl diagnóstico de los adenomas hepatocelulares debe llevarse a cabo con el conjunto de criterios clínicos, morfológicos, inmunofenotípicos y moleculares, con el objetivo de evaluar su conducta terapéutica, así como el riesgo de malignización según su tipificación fenotípica (tabla 2).
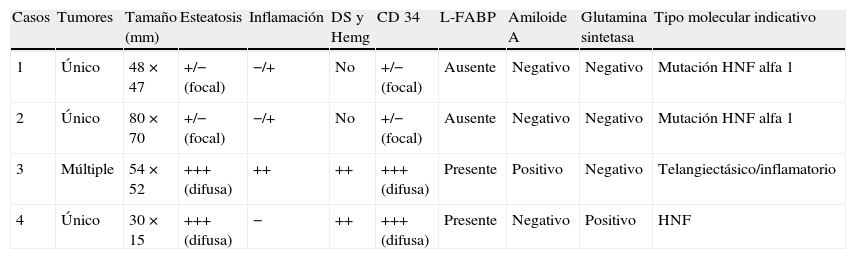
Resumen de estudio anatomopatológico de la pieza quirúrgica
| Casos | Tumores | Tamaño (mm) | Esteatosis | Inflamación | DS y Hemg | CD 34 | L-FABP | Amiloide A | Glutamina sintetasa | Tipo molecular indicativo |
| 1 | Único | 48×47 | +/− (focal) | −/+ | No | +/− (focal) | Ausente | Negativo | Negativo | Mutación HNF alfa 1 |
| 2 | Único | 80×70 | +/− (focal) | −/+ | No | +/− (focal) | Ausente | Negativo | Negativo | Mutación HNF alfa 1 |
| 3 | Múltiple | 54×52 | +++ (difusa) | ++ | ++ | +++ (difusa) | Presente | Positivo | Negativo | Telangiectásico/inflamatorio |
| 4 | Único | 30×15 | +++ (difusa) | − | ++ | +++ (difusa) | Presente | Negativo | Positivo | HNF |
DS: dilatación sinusoidal; Hemg: hemorragia; HNF: hiperplasia nodular focal.