La colitis seudomembranosa (CSM) es una afectación inflamatoria de la mucosa del intestino grueso, caracterizada por la formación de unas placas blanquecinas de aspecto histológico (fig. 1) y endoscópico (fig. 2) característicos y similares: la imagen microscópica y macroscópica se parecen1. Se trata de un término descriptivo que, aunque característicamente se asocia en la actualidad a la infección por Clostridium difficile (CD), puede relacionarse con otras infecciones, con otras patologías no infecciosas y sin causa conocida. Desde el punto de vista contrario, la CSM no es sino el cuadro más característico y clásico, conocido desde hace más de un siglo, dentro del espectro clínico originado por CD, que incluye desde portadores asintomáticos hasta CSM fulminantes pasando por cuadros diarreicos de muy variable significación clínica. La incidencia de la infección con consecuencias clínicas por este microorganismo ha aumentado en las últimas décadas relacionándose, posiblemente, con el elevado consumo de antibióticos, convirtiéndose en un problema de salud importante. Es probablemente la causa más frecuente de diarrea nosocomial, con importantes consecuencias clínicas e incluso económicas, particularmente por alargar de forma significativa la estancia hospitalaria2.
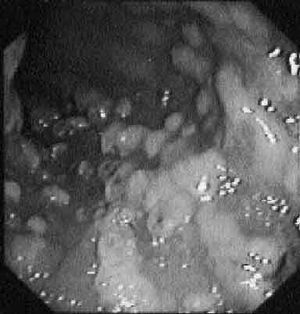
Fig. 1. Imagen histológica típica observada en un caso de colitis seudomembranosa (cortesía del Dr. Ramiro Álvarez).
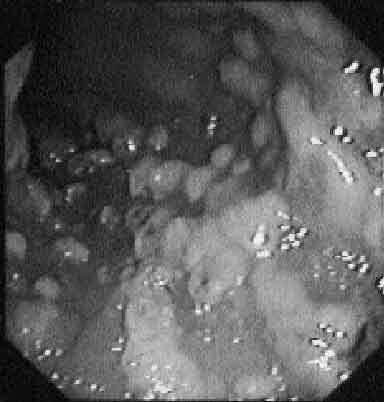
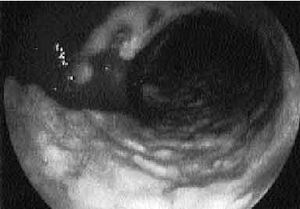
Fig. 2. Aspecto endoscópico de una colitis por Clostridium difficile con formación de las características lesiones blanquecinas sobreelevadas.
En esta revisión escogemos como punto de referencia la infección por CD, reconociendo de antemano que sólo una minoría de las llamadas «diarreas postantibióticas», como máximo del 15 al 20%, se asocian claramente con este germen, y que la CSM sólo es el extremo clínicamente más llamativo de la infección. A pesar de ser la minoría, los casos más graves de diarrea postantibiótica con mayor repercusión clínica se concentran en el grupo asociado a CD, siendo la gran mayoría de los casos idiopáticos autolimitados, lo que justifica también concentrar una mayor atención en el subgrupo de pacientes afectados por CD3.
PERSPECTIVA HISTÓRICA
La afectación intestinal con formación de lesiones seudomembranosas es una entidad conocida desde hace más de un siglo, siendo el primer caso publicado4 en 1893. Se trataba de una paciente intervenida quirúrgicamente de una neoplasia gástrica, que en el postoperatorio desarrolló un cuadro diarreico que le condujo finalmente al fallecimiento. La autopsia reveló la existencia de unas membranas de aspecto «difteriforme» en el intestino delgado. Se trataba de un cuadro poco frecuente en la era preantibiótica, por ejemplo, con cifras de 4 casos/año en la Clínica Mayo5, asociado fundamentalmente a la cirugía y con un alto índice de mortalidad. Posteriormente, y tras la introducción de los antibióticos, se observó un aumento en su frecuencia, publicándose en estudios quirúrgicos cifras de incidencia de hasta el 27%6. Inicialmente se involucró a S. aureus en la patogenia de la enfermedad, dado que se encontraba como organismo predominante en las heces7, denominándose esta entidad enterocolitis estafilocócica, al afectar con frecuencia al intestino delgado. Posteriormente, se pensó en fenómenos de isquemia tisular o infección viral latente como posibles etiologías.
CD es un bacilo grampositivo, anaerobio, de difícil y lento crecimiento en cultivo que fue descrito por primera vez en 1935 por Hall y O'Toole, denominándolo Bacillusdifficilis8. Su aislamiento a partir de neonatos sanos motivó que fuera considerado como comensal a pesar de la producción de una toxina extraordinariamente letal en el animal de experimentación al ser administrada de forma intravenosa9. Su significación clínica pasó desapercibida a los investigadores hasta muchos años después. En los años setenta se relaciona el uso de clindamicina, antibiótico de referencia para el tratamiento de las infecciones por gérmenes anaerobios en los Estados Unidos, con la aparición de diarrea asociada a antibióticos. Así, en un trabajo prospectivo sobre 200 enfermos tratados con este antibiótico, el 21% desarrollaron diarrea y en un 10% se evidenció la presencia de CSM en la endoscopia10. Posteriormente, en 1977, Larson11 demostró la presencia de una toxina en las heces de los enfermos con CSM que producía cambios citopáticos en los cultivos en líneas celulares. De forma simultánea, estudios en ratones demostraron la reproducción de la lesión al inocular en animales sanos la toxina intracecalmente12. Hasta un año después no se implicó a CD en la producción de dicha toxina, demostrándose la existencia del microorganismo y su toxina citopática en casi todos los pacientes con CSM, mientras que no se encontró en ninguno de los controles sanos13,14. Los postulados de Koch se cumplieron y se le asignó a CD el papel principal en la génesis de la CSM.
EPIDEMIOLOGÍA
Se trata de una entidad de distribución universal, de carácter eminentemente nosocomial, con incidencia variable en las distintas series publicadas. La abundante presencia de este microorganismo en el ambiente hospitalario, unido a una población sometida a tratamiento con antibióticos hacen de los enfermos ingresados el principal objetivo de la infección por CD. Este germen está considerado actualmente como el agente causal más frecuente de la diarrea nosocomial, originando casi la totalidad de las CSM, y del 15 al 20% de los casos de diarrea postantibiótica sin colitis. Puede presentarse, además de casos esporádicos, en forma de brotes nosocomiales de difícil control15-19. En los últimos años se ha registrado un incremento muy importante en la incidencia de la infección intestinal por CD. En un estudio realizado en el Reino Unido (Inglaterra y Gales), se reveló como el primer patógeno intestinal en pacientes ancianos hospitalizados, por delante de agentes como Salmonella y Campylobacter, con un incremento de los casos registrados entre 1990 y 1994 de ocho veces20. Este impresionante aumento de la incidencia puede ser debido en parte a una mejora en el diagnóstico y a una mayor comunicación de los casos, pero indudablemente también refleja un aumento real en la magnitud del problema. El incremento en el número de ancianos atendidos en los hospitales, muchos de ellos afectados de patologías graves y sometidos a tratamientos quirúrgicos, y sobre todo el empleo masivo y muchas veces indiscriminado de los antibióticos son, probablemente, factores implicados en esta nueva situación. Estudios previos prospectivos revelan que hasta un 21% de los pacientes con cultivo negativo en el momento del ingreso hospitalario son colonizados por CD durante la estancia18, aunque esta cifra puede ser variable. La mayoría de estos enfermos ingresados e infectados por CD se mantienen asintomáticos18-21. Sin embargo, se ha estimado que hasta un 1% de los pacientes ingresados tratados con antibióticos podrían presentar diarrea secundaria a la infección por CD22.
La incidencia de la infección por CD adquirida en la comunidad no es bien conocida, dado que su investigación no se realiza de forma rutinaria en los casos de diarrea consultados al médico de atención primaria. De todas formas, se ha señalado que la incidencia de portadores en adultos sanos en la comunidad puede variar entre el 3 y el 11% según las áreas geográficas23, incrementándose mucho esta cifra tras recibir antibióticos24. Se ha estimado que entre 1 y 3 de cada 100.000 sujetos tratados con antibióticos en la comunidad desarrollarían enfermedad por CD22, aunque no existen datos fiables.
La CSM y la infección con repercusión clínica por CD son mucho más frecuentes en ancianos, un hecho común en todas las series clínicas. La edad se comporta como un factor de riesgo independiente en el desarrollo de CSM y se correlaciona con el aumento de la expresividad clínica25. Por el contrario, hasta un 50% de los neonatos sanos estarían colonizados de manera transitoria por cepas toxigénicas de CD26 sin producir patología. Es sólo a partir del año de edad cuando parecen ser susceptibles a presentar enfermedad por CD; hasta entonces se ha postulado que la inmadurez en los receptores de membrana de los enterocitos para la toxina del CD les haría invulnerables27. En algunos estudios la estancia hospitalaria prolongada también parece ser un factor de riesgo para la infección.
En España se trata de una entidad sorprendentemente poco descrita, habiéndose comunicado sobre todo casos aislados28-33, y un brote epidémico intrahospitalario de escasa trascendencia que afectó a 6 enfermos34. Esto llevó a la consideración de que se trataba de una entidad infrecuente, por motivos poco claros, en nuestro medio. Sin embargo, en un artículo reciente Bouza et al35 presentan 129 casos de diarrea asociada a CD, diagnosticados por citotoxicidad en cultivo, en un año, lo cual supone una elevada tasa de incidencia, con cifras en torno al 2,5% de incidencia global (casos/ingresos/año), que ascendía al 3% (30 casos por cada 1.000 ingresos) en los pacientes con infección por VIH. En la discusión los autores no atribuyen los pocos casos comunicados a una escasa alerta clínica, sino más probablemente a la no disponibilidad o no utilización de los métodos diagnósticos adecuados. Indudablemente, son necesarios más estudios epidemiológicos que determinen en nuestro país la situación real de esta entidad, puesto que el único estudio riguroso disponible describe una situación similar a la de la bibliografía norteamericana o europea.
PATOGENIA
Para que el ser humano padezca la infección por CD requiere de la concurrencia de una serie de factores que permitan la interacción de microorganismo y huésped potencialmente susceptible, cumpliendo la denominada «cadena epidemiológica».
CD es un bacilo grampositivo anaerobio con capacidad de formar esporas resistentes al calor y desecación que se mantienen viables durante meses, por lo que se encuentra, como otros microorganismos del género Clostridium, ampliamente distribuido en la naturaleza36-39. La contaminación ambiental por CD es especialmente frecuente en el ámbito hospitalario. Ha sido cultivado en diferentes muestras, fundamentalmente en suelos, servicios, asientos de inodoros, «cuñas», ropa de cama y mobiliario del hospital, especialmente en áreas donde un paciente con infección ha sido previamente tratado16-18. Como hemos señalado, un porcentaje importante de personas que ingresan en un centro sanitario se colonizan por CD, permaneciendo la mayor parte asintomáticos. Éstos se convierten a su vez en reservorio y fuente de infección muy importante para el resto de los ingresados, dado que al no presentar clínica no se toman las medidas de control adecuadas. Desde la fuente de infección o desde el reservorio, a través de mecanismo de transmisión directo paciente a paciente (fecal-oral) o indirecto a través de fomites, CD alcanza al huésped potencialmente susceptible. El personal sanitario contribuye a la diseminación de la infección, habiéndose aislado el microorganismo en sus manos, anillos y fonendoscopios, aunque la eliminación digestiva por parte del personal sanitario no es muy frecuente16,17. En los pacientes previamente portadores, la modificación de la flora bacteriana permitiría la proliferación de este microorganismo conduciendo al posterior desarrollo de patología.
La puerta de entrada del germen es digestiva. Las esporas son ingeridas y, gracias a su carácter ácido-resistente, atraviesan la barrera ácida gástrica y adoptan la forma vegetativa en el colon. Los mecanismos íntimos en la interacción micoorganismo/huésped que determinan la colonización y el desarrollo o no de patología posterior no son bien conocidos. La riquísima flora bacteriana del colon desempeña un papel protector, por mecanismos poco conocidos, que dificulta la colonización por CD. En este sentido, se ha atribuido a microorganismos como Bacteroides, E. coli, Peptoestreptococcus e incluso otras especies del género Clostridium cierto carácter protector, posiblemente relacionado con la producción de bacteriocinas u otras sustancias como ácidos grasos de cadena corta modificando el medio ambiente bacteriano40-42. La alteración de dicha microflora, especialmente de la anaerobia, por los antibióticos se considera el factor predisponente clave. Prácticamente todos los agentes antimicrobianos han sido implicados, al menos ocasionalmente, en el desarrollo de diarrea o CSM asociadas a CD, en especial aquellos de amplio espectro con actividad frente a la flora entérica. En los años setenta, se destacó el papel de la clindamicina con incidencias variables, pero que parecía tener una especial capacidad para conducir a la colonización por CD10. Posteriormente, el grupo de las cefalosporinas, especialmente de tercera generación, se ha considerado el grupo de fármacos más relacionado43-49, quizá reflejando su amplio y a veces indiscriminado uso, aunque tal vez su particular espectro pueda influir en la génesis del cuadro50. Agentes antineoplásicos con actividad antibacteriana, como el metotrexato y el fluorouacilo, han sido también asociados con el desarrollo de CSM51,52. Las quinolonas, ureidopenicilinas, aminoglucósidos y el trimetropim-sulfametoxazol parecen tener menor efecto predisponente53,54. No conocemos casos de CSM que pueda ser claramente atribuida a aminoglucósidos intravenosos, vancomicina intravenosa, sulfonamidas o agentes con espectro sólo antimicobacteriano, antifúngico o antiparasitario. Así, casi todos los casos descritos en las pasadas cuatro décadas han sido en asociación a antibióticos55. En la era preantibiótica otros factores de riesgo fueron implicados en el desarrollo de la enterocolitis seudomembranosa, fundamentalmente la cirugía56-58. De forma excepcional, se publican casos de CSM por CD en los que no parece existir exposición antibiótica previa ni otros posibles factores de riesgo reconocidos, incidiendo además sobre sujetos previamente sanos59-61.
Una vez en el colon, las esporas de CD adoptan la forma vegetativa, se multiplican y las cepas con capacidad para hacerlo producen dos tipos conocidos de exotoxinas que le confieren su virulencia. Se considera un germen habitualmente no invasivo, no detectable en la mucosa ni en los hemocultivos. Ambas toxinas son letales si se administran de forma intravenosa en animales de experimentación. La toxina A es una proteína con un peso molecular de 308 kD con efectos fundamentalmente enterotóxicos en los estudios en modelos animales62. Su mecanismo de acción, aunque no totalmente esclarecido, parece secundario a la unión a receptores específicos de membrana situados en el borde en cepillo del enterocito63. Posteriormente, penetra en el interior de la célula donde produce un daño en el citosqueleto celular, al despolimerizar los filamentos de actina con liberación de calcio intracelular64. Tiene además efectos proinflamatorios, activando la liberación de citocinas por parte de los macrófagos humanos, y de hecho se ha demostrado su efecto en la liberación de interleucina 865, favoreciendo la quimiotaxis de neutrófilos in vitro66, posiblemente críticos en el daño mucoso. Algunos experimentos recientes confirman no sólo la inhibición de la exocitosis de la mucina de la célula epielial por la toxina A sino que, además, confirmando hallazgos descritos en otros modelos como la enfermedad inflamatoria intestinal, demuestran que la célula epitelial puede desempeñar un papel central en la activación de la respuesta inmunológica. La toxina A a dosis bajas indujo la producción por un cultivo puro de células epiteliales humanas del colon de interleucina 867. Este modelo confirma que la célula epitelial participa en la génesis inicial de la respuesta inmune en la mucosa, fenómeno de gran trascendencia en la comprensión de la fisiopatología de otras enfermedades infecciosas e inflamatorias intestinales.
La toxina B es una citotoxina que carece de efectos enterotóxicos en animales. Por este motivo se le había atribuido un escaso valor patogénico en la producción de colitis. Sin embargo, un estudio reciente evidencia que se comporta también como una potente enterotoxina necrosante, con un poder 10 veces superior a la toxina A para dañar la mucosa colónica humana in vitro68. De hecho, estudios muy recientes demuestran que dada su mayor actividad enzimática esta toxina es en realidad entre 100 y 1.000 veces más potente que la A, según el método de ensayo y la línea celular estudiada69. Se usa fundamentalmente con fines diagnósticos, al producir cambios citopáticos característicos en los cultivos de fibroblastos. Su mecanismo de acción intracelular es menos conocido, aunque se ha sugerido que podrá ser muy similar al de la toxina A. Quizá podría ser también la causante de los efectos sistémicos al ser absorbida tras el daño mucoso originado por la acción sinérgica de ambas toxinas40. Generalmente, las cepas toxigénicas producen ambas toxinas. Se ha sugerido que un serogrupo de CD, el «F», podría tener un carácter protector en el desarrollo de la enfermedad70.
El hecho de que existan casos publicados de CSM producida por cepas no toxigénicas y la existencia de un número importante de portadores asintomáticos, en los que se detectan cepas toxigénicas comportándose como saprofitos71, sugiere la existencia de otros mecanismos patogénicos desconocidos. En este sentido, factores dependientes del huésped, fundamentalmente inmunitarios, no bien estudiados, podrían ser cruciales, modulando la expresión clínica. De hecho, en un detallado estudio reciente, ni la presencia o no de toxinas, ni la ribotipificación de las cepas se asociaba con la repercusión clínica, que parecía ser mucho más determinada por las circunstancias del huésped: cuantas más enfermedades asociadas y cuanta mayor la duración del tratamiento antibiótico mayor repercusión de la infección72.
A pesar de que la presencia de seudomembranas es prácticamente patognomónica de la infección por CD, existen algunos casos publicados de CSM secundarios a otras etiologías. Así, otras infecciones como Shigella73-75, E. coli76-78, Plesiomonas79, hongos80, citomegalovirus81 y otros procesos de naturaleza no infecciosa como la enfermedad inflamatoria intestinal55, la isquemia82,83 o fármacos como el oro84 y el diclofenaco85 pueden ser origen de colitis con formación de seudomembranas. Estos procesos deben ser tenidos en cuenta, sobre todo en ciertos contextos clínicos, en el diagnóstico diferencial de la CSM, existiendo criterios diferenciales histológicos que permiten en la mayor parte de los casos el diagnóstico1.
CLÍNICA
La infección por CD da lugar a un espectro clínico muy amplio, que oscila desde el portador asintomático hasta la colitis fulminante, siendo el síntoma más frecuente la diarrea. La CSM es el cuadro más típico y clásico pero por fortuna no es el más frecuente.
Portador asintomático
A pesar de la existencia de un porcentaje no bien establecido de portadores en la comunidad, CD se contagia fundamentalmente en los hospitales. La gran mayoría de estos enfermos que se colonizan de forma nosocomial por CD no desarrollan la enfermedad18. Ya hemos señalado la gran incidencia de portadores asintomáticos entre neonatos sanos, con cifras que superan el 50%.
Diarrea asociada a antibióticos sin colitis
El síntoma clínico más frecuente de la infección por CD es la diarrea. Ésta se suele presentar en el contexto de un tratamiento antibiótico, aunque en un tercio de los pacientes se produce tras la retirada del mismo, con un período de latencia que puede ser de hasta 6-8 semanas. Es muy importante recoger en la anamnesis este antecedente. La diarrea suele ser de leve a moderada, acuosa, de color verdoso y mal olor. Puede contener moco pero es infrecuente la presencia de sangre. Puede estar acompañada de discreto dolor abdominal de localización hipogástrica y esporádicamente de febrícula. Los síntomas generales suelen estar ausentes y la exploración física es prácticamente normal o sólo pone de manifiesto cierto dolor abdominal a la palpación. En estos pacientes la mucosa del colon suele ser normal por lo que la endoscopia carece de utilidad en el diagnóstico. El cuadro clínico suele ceder con la retirada del antibiótico causante o de forma espontánea.
Colitis por CD sin seudomembranas
Algunos enfermos padecen un cuadro clínico más florido, con diarrea severa, dolor y distensión abdominal y presencia de síntomas sistémicos como fiebre, náuseas y deshidratación. Las heces suelen contener leucocitos y sangrado microscópico pero la presencia de sangre macroscópica es infrecuente. La existencia de síntomas extraintestinales en forma de poliartritis de grandes articula ciones han sido descritos en algún caso86,87. En la colonoscopia se observa afectación inflamatoria difusa o parcheada de la mucosa del colon sin formación de seudomembranas.
Colitis seudomembranosa
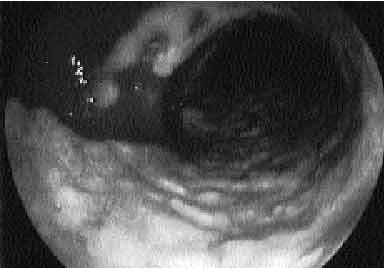
Se trata de un cuadro clínico similar pero, generalmente, la diarrea, el dolor abdominal y los síntomas sistémicos son más acusados. La exploración física suele ser mucho más florida pero habitualmente sin signos de irritación peritoneal. La fiebre suele ser más elevada, entre 39 y 40 oC y la leucocitosis, describiéndose a veces auténticas reacciones leucemoides, es la norma. La colonoscopia, procedimiento seguro realizado por manos expertas, revela la existencia de las típicas seudomembranas, prácticamente patognomónicas de la infección por CD. Se trata de placas sobreelevadas de coloración crema-amarillenta, cuyo tamaño habitual oscila entre 2-8 mm de diámetro (fig. 2), aunque ocasionalmente coalescen formando grandes placas que pueden desprenderse dejando áreas de mucosa denudada (fig. 3). La mucosa circundante sobre la que asientan puede ser normal o presentar signos inflamatorios en forma de eritema, edema y friabilidad. Aunque habitualmente la mucosa está afectada de forma continua, incluyendo recto y sigma, existe un 10% de casos en los que éstos están respetados por lo que la sigmoidoscopia nos daría un «falso negativo» que retrasaría el diagnóstico y el tratamiento. Este subgrupo no infrecuente de pacientes con colitis restringida al lado derecho, tienden a aparecer de forma atípica en el sentido de que son el dolor abdominal y los síntomas sistémicos los que predominan en el cuadro clínico, con diarrea mínima o inexistente. El retraso en el diagnóstico puede permitir la progresión de la enfermedad y requerir laparotomía. Debemos tener en cuenta que en enfermos neutropénicos la falta de leucocitos imposibilita la formación de las características seudomembranas. Además, es importante destacar que existen otras etiologías posibles de la formación de seudomembranas en la mucosa del colon distintas a CD.
Fig. 3. Ocasionalmente las lesiones seudomembranosas coalescen formando grandes placas que al desprenderse dejan áreas de mucosa denudada.
Colitis fulminante
Ocasionalmente, la colitis por CD se presenta como un cuadro fulminante con afectación muy importante del estado general, con presencia de síntomas sistémicos graves, dolor abdominal y distensión en el que la afectación inflamatoria transmural del intestino ocasione una paresia del mismo y conduzca a la dilatación del colon e íleo paralítico con la desaparición de la diarrea. Los hallazgos radiológicos pueden ser variables, desde la dilatación aislada del colon o del ID hasta una distensión combinada de ambos, simulando otras entidades como vólvulo, íleo de intestino delgado, síndrome de Ogilvie o isquemia intestinal. Por tanto, la CSM debe ser tenida en cuenta en el diagnóstico diferencial del abdomen agudo incluso si no existe diarrea. En estos casos el uso temprano de la endoscopia (proctosigmoidoscopia sin preparación) permite realizar un diagnóstico diferencial instaurando el tratamiento médico adecuado y evitando así en algunos enfermos una laparotomía. Establecido el tratamiento, la respuesta debe ser evidente en 48 h; si no es así, la cirugía es necesaria.
Diarrea crónica
La forma típica de presentación es la reaparición de la diarrea, con o sin fiebre, leucocitosis y dolor abdominal de 3 a 10 días tras finalizar el tratamiento antibiótico. No se requiere el concurso de un nuevo tratamiento antibiótico desencadenante. Se observan, con frecuencia variable, cuadros de reactivación de la clínica original, a veces durante meses.
Otros cuadros no intestinales
CD ha sido aislado ocasionalmente en heridas y en infecciones pleuropulmonares. También se le ha relacionado con la enterocolitis de la enfermedad de Hirschsprung y la enterocolitis necrosante del recién nacido88-90, muerte súbita del niño y con las reactivaciones de enfermedad inflamatoria intestinal, pero su relación real no está demostrada.
Diarrea «simple» o «benigna» asociada a antibióticos
Un elevado número de pacientes sometidos a tratamiento antibiótico desarrollan diarrea. CD parece ser el causante en un porcentaje no desdeñable de casos, detectándose su toxina en un 15-20% de los casos y obteniéndose positividad en el cultivo en el 40% de los especímenes40. Sin embargo, en el resto de enfermos, que porcentualmente constituyen la mayoría, la etiología permanece desconocida. En estos casos de diarrea asociada a antibióticos no atribuible al CD, la presentación clínica suele ser banal, con diarrea leve, autolimitada, fácilmente tratable con medidas generales y sin existencia de lesiones en la endoscopia.
DIAGNÓSTICO Y DIAGNÓSTICO DIFERENCIAL
El diagnóstico de la infección por CD está basado en la clínica y en datos de laboratorio que confirmen la presencia de la toxina en las heces del enfermo. Lo más frecuente es la aparición súbita de una diarrea acuosa, sin productos patológicos en el contexto de un tratamiento antibiótico. No debemos olvidar su amplio espectro clínico y que incluso debe ser considerada en el diagnóstico diferencial del abdomen agudo aun en ausencia de diarrea.
La base del diagnóstico de la infección por CD está en las pruebas de laboratorio. El método ideal es la detección de la toxina B en las heces del enfermo dada su elevada sensibilidad y especificidad. Este test persigue no sólo la demostración de la presencia de CD sino también, simultáneamente, que se trata de una cepa toxigénica, y consiste en la demostración de los efectos citopáticos de esta toxina en los cultivos de fibroblastos humanos in vitro, neutralizados al añadir la antitoxina de C. sordelii. Su resultado se expresa como positivo o negativo dado que no parece existir correlación entre gravedad clínica y concentraciones de toxina. Desafortunadamente, presenta varios inconvenientes; es lenta (requiere 48-72 h), cara y compleja, requiriendo el mantenimiento de líneas celulares de cultivo, técnica que no está al alcance de todos los laboratorios. Por todo ello se han desarrollado técnicas alternativas que persiguen una mayor rapidez a menor coste. Inicialmente se diseñó una prueba de aglutinación con látex, dirigida teóricamente a detectar la toxina A en las heces. Esta técnica realmente detecta la existencia de otra proteína sin actividad biológica (glutamato deshidrogenasa), presente en cepas toxigénicas o no y en otras especies bacterianas, por lo que carece de especificidad, aunque en la mayoría de los estudios mantiene una alta sensibilidad. Aunque su sencillez y rapidez (30 min aproximadamente) han llevado a su generalización, su uso no es aconsejable por su baja especificidad, al menos como test de referencia. Una alternativa más reciente y mucho más aconsejable es la utilización de los métodos basados en la técnica ELISA para la detección de la toxina A o B. Este método tiene una elevada especificidad (próxima a la obtenida por el cultivo celular) con una aceptable sensibilidad (variable entre diferentes estudios, oscilando entre el 70 y el 95%3) lo que, unido a ventajas como su facilidad y rapidez (2-4 h), la hacen una técnica diagnóstica muy útil, y probablemente la de elección en la actualidad. Analizar dos muestras aumenta la sensibilidad de la técnica desde un 85,3 al 97,1%91. En el mismo estudio se demostró cómo incluso las técnicas que detectan toxina tienen un menor rendimiento diagnóstico si el paciente está recibiendo tratamiento con algunos antibióticos cuando se recoge la muestra, por lo que ante la sospecha en estos casos parecería recomendable insistir en hacer al menos dos, y tal vez tres, determinaciones si la primera es negativa91.
El coprocultivo en medios específicos es quizá el método más sensible para la detección de CD. A pesar de ello, su utilidad diagnóstica en la práctica diaria es escasa por su dificultad, lentitud y baja especificidad. No distingue entre portadores y enfermos y si las cepas son o no productoras de toxinas. Su papel fundamental tiene lugar en la tipificación de las cepas como parte del estudio epidemiológico para distinguir entre casos esporádicos y epidémicos causados por una misma cepa bacteriana. Además, permite determinar la producción o no de toxina en enfermos con cultivo positivo y toxina no detectable en las heces. Actualmente no se realiza casi en ningún laboratorio la determinación de sensibilidad antibiótica del germen, algo que en el futuro podría ser necesario por la hipotética aparición de resistencias al metronidazol y sus implicaciones terapéuticas.
Otros tests diagnósticos que se emplean en el contexto de una diarrea en el hospital son la determinación de leucocitos fecales y el cultivo para patógenos habituales. La determinación de leucocitos fecales es un test absolutamente inespecífico cuya utilidad podrá ser descartar una diarrea «simple» asociada a antibióticos en el contexto de un tratamiento antibiótico; la presencia de más de 5 leucocitos por campo excluye una diarrea del tipo «benigno» por antibióticos3. También nos permitiría realizar un diagnóstico de sospecha de colitis por S. aureus. El coprocultivo para patógenos habituales como Salmonella, Sighella, E. coli o Campylobacter debe ser realizado en enfermos con colitis asociada a antibióticos en los que no se consigue poner de manifiesto una infección por CD, dado que éstos y algunos otros han sido implicados en la etiología. En estos enfermos con colitis postantibiótica y determinación para CD negativa también debe realizarse un cultivo de las heces en medio específico para S. aureus.
Técnicas de reacción en cadena de la polimerasa están siendo utilizadas en la detección del CD en las heces92 y para identificar cepas toxigénicas en los cultivos mediante la determinación de los genes de ambas toxinas A y B93. Estas técnicas han evidenciado resultados muy prometedores pero hacen falta estudios comparativos para establecer su utilidad real en la práctica clínica rutinaria, teniendo en cuenta además su coste potencialmente muy elevado.
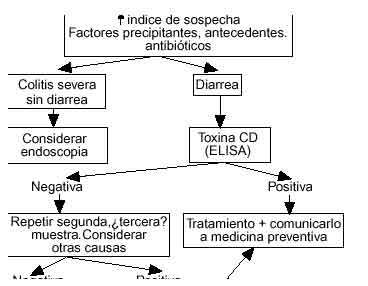
La endoscopia es la técnica morfológica de elección que permite además la toma de biopsia para el estudio histológico. Debe ser reservada para enfermos con cuadro clínico grave en los que existen dudas diagnósticas, realizándola en estos casos sin preparación. El cuadro clásico ya descrito de CSM es característico (figs. 2 y 3). A veces existe gran cantidad de moco que debe ser cuidadosamente retirado mediante lavados antes de poder apreciar la existencia de las típicas seudomembranas. La afectación rectal es habitual, por lo que la proctosigmoidoscopia suele ser diagnóstica excepto en el grupo de pacientes con lesiones limitadas al colon derecho en los que es necesario explorar la totalidad de la mucosa colónica, seguro por otra parte en manos expertas, para realizar el diagnóstico. A veces, la existencia de seudomembranas de pequeño tamaño puede hacernos dudar con una enfermedad de Crohn en fase incipiente o colitis por enfermedad de Behçet. Es importante tener en cuenta que, si bien la presencia de las típicas seudomembranas es prácticamente patognomónica de la enfermedad, su ausencia no excluye en absoluto el diagnóstico de diarrea asociada a CD, ya que son frecuentes otros patrones endoscópicos, en relación a los diferentes grados de severidad clínica, que oscilan desde la existencia de una mucosa totalmente normal hasta otras formas de colitis sin formación de seudomembranas. En los casos clínicamente leves la mucosa suele ser normal o con mínimos signos inflamatorios no específicos. En casos más severos puede observarse eritema, edema, friabilidad y úlceras que ocasionalmente pueden hacer difícil el diagnóstico diferencial con la colitis ulcerosa, incluso en el estudio anatomopatológico. Cuando las típicas lesiones están presentes, un endoscopista experimentado puede prácticamente hacer un diagnóstico de certeza, pero la toma de biopsias es aconsejable, sobre todo en casos con signos inflamatorios no específicos donde la histología puede poner de manifiesto la presencia de seudomembranas no visibles macroscópicamente. Histológicamente se han descrito 3 grados de lesión94 (fig. 1). En el tipo I, lesión inicial, se pueden apreciar acumulaciones focales de polimorfonucleares con áreas de necrosis epitelial parcheadas y exudación de fibrina y neutrófilos en la luz colónica. La lesión tipo II, también denominado «tipo volcán», presenta un exudado más prominente que se origina de un área de ulceración epitelial, manteniéndose intacta la mucosa circundante. Finalmente, el grado III consiste en la necrosis epitelial difusa (no focal como sucedía en los tipos anteriores), cubierta por una seudomembrana formada por polimorfonucleares, fibrina y detritus celulares. La curación clínica del proceso suele ir acompañada de la resolución histológica, persistiendo sólo cierta irregularidad en la arquitectura glandular.
Los hallazgos radiológicos pueden, ocasionalmente, aportar datos, pero generalmente son inespecíficos. En la radiología simple se puede observar edema de pared en el colon con impresiones digitales y veces distensión, todo ello en casos graves. Tampoco la radiología baritada es de gran utilidad; puede demostrar hallazgos indicativos pero no definitivos. La técnica de doble contraste mejora la rentabilidad diagnóstica pero no es recomendable por la necesidad de insuflación de aire que podría resultar peligrosa. La tomografía axial computarizada también en casos graves puede poner de manifiesto un edema de pared pero sin especificidad diagnóstica. Estos hallazgos pueden ser útiles en enfermos con afectación del colon derecho en los que la enfermedad se inicia con un abdomen agudo sin diarrea. Las técnicas de medicina nuclear son, asimismo, inespecíficas y de escasa utilidad práctica.
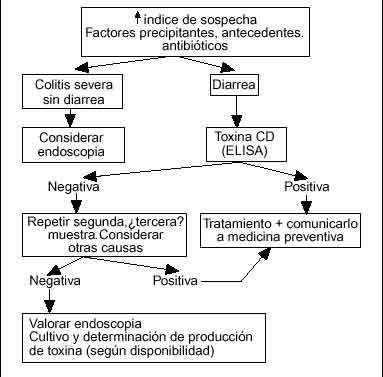
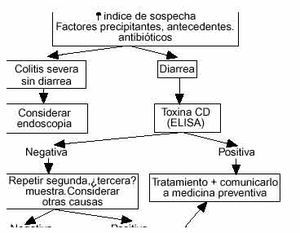
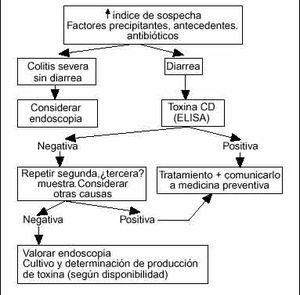
Con estas premisas parece que la estrategia más razonable, en la mayoría de los centros, consiste en: a) mantener un alto índice de sospecha especialmente en pacientes ancianos, debilitados, hospitalizados o institucionalizados recordando que el antecedente de toma del antimicrobiano puede tener 8 semanas de antigüedad, y b) indicar una de terminación de toxina mediante ELISA en las heces. Si la determinación es positiva se debe tratar al paciente, y declarar el caso al servicio de medicina preventiva del centro. Si es negativa pero se mantiene la sospecha lo más rentable es enviar una o dos nuevas muestras, y si el caso es clínicamente significativo llevar a cabo una colonoscopia completa con toma de biopsias si el estado del paciente lo permite. En algunos centros la estrategia puede variar según las disponibilidades técnicas: por ejemplo, una técnica de látex puede ser de extraordinario interés a pesar de su baja especificidad si se interpreta en un contexto clínico de alta probabilidad. Una simple rectoscopia con un proctoscopio desechable puede proporcionar evidencia definitiva en algunos pacientes por lo que, aunque su negatividad no excluiría el diagnóstico, su positividad podría confirmarlo. Son sólo algunos ejemplos que indican que la aproximación más eficiente al diagnóstico debe adaptarse a cada medio concreto95. El algoritmo (fig. 4) refleja una posible pauta de actuación.
Fig. 4. Algoritmo de actuación en caso de sospecha de CSM. Valorar cada caso individualmente; sujeto a variación según disponibilidades diagnósticas.
TRATAMIENTO
El tratamiento de la diarrea por CD se basa en la retirada del antibiótico causante cuando es posible, acompañado de una adecuada rehidratación y aportación de electrólitos, y sólo en algunos casos, tratamiento específico anti-CD. En algún caso aislado se precisará del tratamiento quirúrgico. Un porcentaje importante de pacientes presenta recaídas, ocasionalmente frecuentes, una vez suspendido el tratamiento antibiótico inicial, constituyendo un problema de muy difícil enfoque terapéutico.
Un aspecto importante en el tratamiento de estos pacientes es el control de la infección evitando la diseminación con la aparición de brotes epidémicos en el hospital. Por tanto, estos enfermos deben ser aislados y poner en marcha medidas de protección entérica.
Episodio inicial
Una vez establecido el diagnóstico de diarrea asociada a infección por CD, la primera medida es, en aquellos casos donde la importancia de la infección original lo permita, la retirada del antibiótico causante. Con esta sola medida, asociada a una correcta rehidratación, se consigue la mejoría de muchos pacientes con cuadro clínico leve. En estos casos no debemos indicar la administración de tratamiento específico, dado que éste está relacionado con la aparición de recaídas posteriores. Debemos evitar el empleo de fármacos antiperistálticos, como la loperamida, por el riesgo, al menos teórico, de precipitar el desarrollo de megacolon.
Cuando el cuadro clínico es más grave o si no es posible suprimir el tratamiento antibiótico, debemos indicar el tratamiento específico anti-CD. En este último caso se aconseja, si es posible, cambiar el tratamiento antibiótico inicial por aquellos agentes, como aminoglucósidos, quinolonas, trimetoprim-sulfametoxazol, metronidazol o vancomicina, que tienen un menor riesgo de promover la infección por CD. Disponemos fundamentalmente de dos agentes con eficacia probada en tratamiento de la infección por CD: el metronidazol y la vancomicina. La vancomicina administrada por vía oral no presenta absorción significativa ni es metabolizada, siendo excretada por las heces de forma inalterada. Por ello alcanza en el colon concentraciones muy superiores a la concentración inhibitoria mínima (CIM) para el microorganismo, y carece prácticamente de efectos secundarios sistémicos, aparte de su sabor desagradable y amargo. Su eficacia ha sido claramente puesta de manifiesto en ensayos clínicos, con índices de respuesta que superan casi siempre el 95%. Los estudios in vitro no han demostrado, hasta el momento, la presencia de cepas resistentes. La vancomicina no debería ser empleada de forma intravenosa en el tratamiento de la CSM, porque no se excreta a la luz intestinal, no alcanzando en el colon concentraciones significativas96. Su empleo tópico de forma indiscriminada podría conllevar un aumento en la aparición de resistencias por parte de ciertos gérmenes, como algunos del género Enterococcus97,98. También puede emplearse por vía rectal. La alternativa al tratamiento con vancomicina es el metronidazol. Este fármaco, administrado por vía oral, se absorbe en tramos digestivos altos, y posteriormente es excretado de nuevo a la luz intestinal a través de la bilis. Además, la exudación de una mucosa inflamada contiene metronidazol. Es eficaz en administración tanto oral como intravenosa. Administrado de forma intravenosa su efectividad es buena aunque se han publicado fracasos terapéuticos. Una explicación podría ser que administrado de esta forma no alcanza concentraciones colónicas superiores a la CIM in vitro para el CD99. De todas formas, aunque las concentraciones fecales del fármaco tras la administración oral son también bajas e impredecibles, la experiencia clínica hace indudable su efectividad, algo para lo que no disponemos de una adecuada explicación. La absorción del fármaco, aunque en general es bien tolerado, hace que pueda tener efectos secundarios sistémicos como náuseas, diarrea, dolor abdominal, neutropenia reversible y cefalea, además de las potenciales reacciones alérgicas y una reacción tipo antabus tras la ingesta de alcohol. No debería utilizarse, en principio, en mujeres embarazadas ni en niños. Se han descrito cepas resistentes e incluso algunos casos de CSM inducida por metronidazol. A pesar de las teóricas ventajas de la vancomicina, los estudios realizados indican una eficacia clínica similar de ambos fármacos. En el único estudio prospectivo aleatorizado que compara ambos antibióticos en el tratamiento de la infección por CD no se observan diferencias significativas100. Por ello y fundamentalmente debido a la gran diferencia de precio en favor del metronidazol, éste es el fármaco a utilizar inicialmente. El tratamiento con vancomicina oral debería reservarse a enfermos alérgicos o que no toleren o no respondan al metronidazol, mujeres embarazadas o niños de edad inferior a los 10 años, o para aquellos casos graves que van a ser tratados por vía oral. Una forma de economizar es el empleo por vía oral de la solución destinada al uso intravenoso. La vía de administración debe ser la oral siempre que sea posible. Aquellos pacientes en los que está contraindicada la administración oral, por la presencia de íleo o cirugía reciente, deberán recibir tratamiento intravenoso con metronidazol, y en ningún caso con vancomicina. Las dosis aconsejadas de éstos y otros fármacos están reflejadas en la tabla I.
Otros fármacos que han sido empleados en el tratamiento del episodio agudo son la colestiramina, bacitracina, teicoplanina, ácido fusídico y tetraciclina. En general, la experiencia clínica con estos fármacos es menor y los resultados peores. La colestiramina, resina de intercambio aniónico, actúa uniéndose a la toxina A y B del CD impidiendo que ejerzan su acción. Los resultados publicados son muy diferentes entre los distintos ensayos clínicos, desde tasas de respuesta muy buenas a otras realmente desalentadoras. En el modelo animal su eficacia es claramente inferior a la de la vancomicina101. Es un fármaco barato y parece que las recidivas tras emplear colestiramina en el tratamiento de la diarrea asociada a CD son infrecuentes. La bacitracina es otro antibiótico no absorbible activo frente al CD. Presenta una tasa de respuesta clínica inferior a la vancomicina y las recidivas son, cuando menos, tan frecuentes102 que todo ello unido a su elevado coste la hacen poco recomendable en el tratamiento.
Tras la instauración del tratamiento específico la respuesta clínica debe obtenerse de forma rápida, en las primeras 24-48 h, con resolución de la colitis en más del 25% de los enfermos en 10 días102. La falta de respuesta debe hacernos considerar la existencia de una complicación o en la presencia concomitante de otra causa de la clínica del paciente. La duración aconsejada del tratamiento antibiótico es de 7-10 días, a menos que la gravedad del cuadro clínico o la persistencia de la diarrea aconsejen prolongar el tratamiento. Una vez finalizado el tratamiento con vancomicina o metronidazol no es necesario realizar nuevos cultivos o la determinación de toxinas en el seguimiento de estos pacientes dado que muchos de los enfermos con resultados positivos nunca tendrán una recaída clínica103.
La necesidad de recurrir a la cirugía en el tratamiento de estos pacientes es relativamente infrecuente. Aquellos enfermos que presentan colitis fulminante, e incluso megacolon, pueden ser inicialmente tratados con antibióticos, aunque la efectividad real del tratamiento médico en estas circunstancias no se conoce. El paciente debe ser estrechamente monitorizado y la falta de respuesta en 48-72 h aconseja la rápida intervención del cirujano. La existencia de una perforación obliga también a realizar una intervención quirúrgica. La técnica más frecuentemente realizada es la colectomía subtotal con ileostomía.
Tratamiento de las recaídas
La mayoría de los pacientes que han presentado un episodio de diarrea asociada a CD responden muy bien al tratamiento específico pero un número importante de ellos presentará nuevas recaídas tras finalizar el tratamiento. Las cifras de recidiva publicadas en diferentes estudios son muy variables, pero parecen ser superiores al 20%. Muchos de los enfermos que sufren una recaída tendrán más episodios, no siendo infrecuente la aparición de entre 5-10 episodios en un año104. Es importante destacar el hecho de que las recidivas tras un primer episodio están invariablemente relacionadas con la administración de tratamiento antibiótico anti-CD. Estudios comparativos ponen de manifiesto tasas de recaída y gravedad de los episodios similares con los diferentes fármacos utilizados, independientemente de la dosis y tiempo de administración, mientras que aquellos enfermos que superan el primer episodio de forma espontánea no presentarán recidivas105.
Los posibles mecanismos patogénicos que podrían explicar la aparición de recidivas son la reinfección por la misma o distinta cepa o la no erradicación del microorganismo en el colon. Diversas observaciones, tanto clínicas como en el animal de experimentación, sugieren que la persistencia de las esporas de CD en el intestino grueso, no eliminadas por el antibiótico, es el mecanismo patogénico más probable. De hecho, parece que el tratamiento con antibióticos aumenta la aparición de formas esporuladas en el colon106. Éstas, una vez interrumpido el tratamiento antibiótico, adoptarían la forma vegetativa con producción de toxinas y desarrollo de enfermedad. La posibilidad de resistencias al tratamiento antibiótico inicial no parece tener un papel importante en la persistencia del microorganismo en el colon. El resto de mecanismos patogénicos que determinan la aparición de recaídas en algunos pacientes no está claro. No se han demostrado claramente factores dependientes del huésped, excepto casos aislados de déficit específicos de inmunoglobulinas107,108.
El diagnóstico debe ser confirmado con los métodos anteriormente descritos teniendo en cuenta otras causas de diarrea. Como ya hemos comentado, la determinación de la toxina en las heces suele ser positiva tras el primer episodio, incluso entre enfermos sin evidencias clínicas; por ello la decisión de tratar o no con antibióticos a un paciente concreto debe basarse en criterios clínicos. Los casos leves no deberían ser tratados, dado que la evolución espontánea suele ser favorable y que el tratamiento con antibióticos podría hacer más probable la aparición de nuevas recidivas. Los enfermos con diarrea más importante o persistente o con colitis en la endoscopia sí deben ser tratados. Puede administrarse metronidazol o vancomicina, también durante 7-10 días, independientemente del tratamiento empleado en el episodio inicial, dado que la resistencia antibiótica no parece desempeñar un papel en la aparición de recidivas. Con ambos fármacos la respuesta clínica es la norma. El auténtico problema terapéutico es el enfermo que presenta episodios continuos de diarrea por CD. En estos casos existen varias propuestas terapéuticas realizadas por diferentes expertos pero ninguna ha demostrado su efectividad en ensayos clínicos controlados, aleatorizados y a doble ciego, por lo que el tratamiento óptimo dista mucho de estar establecido. Se ha propuesto el uso de diferentes pautas de antibióticos, entre ellas la retirada lenta de la vancomicina109, la administración conjunta de vancomicina y rifampicina110 y el empleo «a pulsos» del antibiótico, lo que permitiría el paso a forma vegetativa de las esporas residuales siendo así destruidas. Otros tratamientos empleados persiguen la regeneración de la flora colónica, mecanismo esencial en el control de la infección por CD. En este sentido se ha empleado la administración oral de Saccharomyces boulardii, que alcanzó casi la significación estadística en un ensayo clínico aleatorizado111, Lactobacillus spp.112 o cepas no toxigénicas de CD113. Otros investigadores han empleado la administración por vía rectal, utilizando mezclas bacterianas en soluciones salinas estériles114. En el trabajo de McFarland se empleó un régimen combinado consistente en la administración oral de Saccharomyces boulardii (50 mg/12 h), durante 4 semanas, comenzando 4 días antes de terminar el tratamiento antibiótico convencional. Otros autores han sugerido el empleo inicial de metronidazol o vancomicina durante 10-14 días, seguido de un tratamiento durante 3 semanas que consistiría en colestiramina (4 g, tres veces al día), Lactobacillus (1-2 mg, cuatro veces al día) o vancomicina administrada a pulsos (125 mg cada 2 días). La combinación de estas medidas en esta segunda fase del tratamiento es complicada, dado que la colestiramina se une a la vancomicina, y que ésta destruye a Lactobacillus. Se está estudiando también la posibilidad de utilizar secuencias de oligosacáridos unidos a soportes inertes que son capaces de adsorber la toxina A en el intestino, impidiendo su unión al receptor115. El tratamiento con inmunoglobulinas intravenosas, en niños con inmunodeficiencias documentadas, podría ser también eficaz en la prevención de recurrencias107,108.
CONTROL
Las medidas de control deben ir encaminadas a disminuir la colonización hospitalaria de los enfermos que ingresan y a evitar la diseminación de la infección.
Es esencial la política antibiótica, tanto en la comunidad como en el ámbito hospitalario. Evitar la administración innecesaria de antibióticos es fundamental en el control de la infección por CD. El uso de antibióticos con aparente menor riesgo, siempre que el espectro lo permita, es una política adecuada dentro de áreas donde la incidencia de infección por CD es elevada.
Por otra parte, es fundamental la detección temprana de los casos. Aquellos pacientes con diarrea sospechosa de etiología infecciosa deben ser aislados en habitaciones individuales, poniéndose en marcha medidas de protección entérica dirigidas a prevenir la contaminación fecal-oral hasta identificar el agente causal. Indudablemente, los pacientes con diarrea son importantes pero también lo son los enfermos portadores, ya que aunque «menos contaminantes», no son aislados y se convierten en una fuente de infección que pasa desapercibida. Las medidas más importantes para evitar la transmisión son el lavado de manos y el uso de guantes por parte del personal que atiende a estos pacientes. La descontaminación ambiental con desinfectantes apropiados contribuye disminuyendo la «carga» de esporas de CD.
En caso de brote epidémico es aconsejable agrupar a estos pacientes y que sean atendidos por personal exclusivo para ellos, extremando las medidas y realizando si es posible estudios epidemiológicos identificando portadores y tipificando cepas. Sin embargo, estos métodos no están a disposición de la mayoría de los laboratorios.
El desarrollo de una vacuna está siendo investigado. En este sentido parece que los anticuerpos del tipo IgA secretados a la luz intestinal podrían conferir carácter protector, al impedir la fijación de la toxina A a su receptor. Si esto fuera así la inmunización frente a las toxinas de CD podría conferir inmunidad frente a CD.
La inmunización pasiva se podría conseguir utilizando antisuero antitoxina A y la inmunización activa utilizando secuencias específicas de dicha toxina que, administradas de forma adecuada, estimulasen una potente inmunidad local.
Correspondencia: Dr. F. Gomollón García. Condes de Aragón, 18, 2.o B. 50009 Zaragoza. Recibido el 20-11-97; aceptado para su publicación el 20-11-97.