El cáncer colorrectal constituye el paradigma de las neoplasias susceptibles de medidas preventivas, en especial de cribado. Para ello, en el momento actual, se dispone de diversas estrategias que han demostrado su eficacia y eficiencia, entre las que destacan la detección de sangre oculta en heces y las pruebas endoscópicas. Además, en los últimos años han ido apareciendo nuevas modalidades que podrían llegar a constituir alternativas viables en un futuro próximo. En el presente artículo se revisan las comunicaciones más relevantes presentadas en el Congreso Anual de la American Gastroenterological Association, celebrado en Orlando en mayo de 2013, en relación con el cribado del cáncer colorrectal, haciendo especial hincapié en los resultados a medio y largo plazo de las estrategias de detección de sangre oculta en heces y sigmoidoscopia flexible, así como en las primeras experiencias con el uso de nuevos biomarcadores.
Colorectal cancer is the paradigm of tumoral growth that is susceptible to preventive measures, especially screening. Various screening strategies with demonstrated efficacy and efficiency are currently available, notable examples being the fecal occult blood test and endoscopic tests. In addition, new modalities have appeared in the last few years that could become viable alternatives in the near future. The present article reviews the most important presentations on colorectal screening at the annual congress of the American Gastroenterological Association held in Orlando in May 2013, with special emphasis on the medium- and long-term results of strategies using the fecal occult blood test and flexible sigmoidoscopy, as well as initial experiences with the use of new biomarkers.
El cáncer colorrectal (CCR) constituye la neoplasia más frecuente en los países desarrollados. Además, a pesar de los importantes avances en su tratamiento, continúa siendo la segunda causa de muerte por cáncer1. La mayoría de los tumores son esporádicos (70–80%), mientras que una pequeña proporción de ellos corresponde a formas hereditarias, ya sea el síndrome de Lynch (2–5%), las distintas formas de poliposis colorrectal (1%) o el CCR asociado al gen MYH (1%). Además, en un 20–25% adicional de casos hay una agregación familiar de esta neoplasia (CCR familiar), sin que se haya identificado hasta la fecha un componente hereditario bien establecido2.
El mayor conocimiento de la historia natural y de los factores patogénicos implicados en el CCR ha permitido la instauración de programas preventivos dirigidos a evitar su aparición (prevención primaria), detectarlo precozmente (prevención secundaria) o minimizar su impacto en el pronóstico del paciente una vez este ya se ha presentado (prevención terciaria)3. La prevención secundaria se basa, fundamentalmente, en las estrategias de cribado o screening, y tiene como objetivo identificar sujetos asintomáticos con lesiones precancerosas o en una fase inicial de la progresión tumoral4. El presente artículo de revisión se centrará exclusivamente en el cribado en población de riesgo medio, definido como los individuos de edad ≥ 50 años sin factores de riesgo adicionales3.
Las técnicas de cribado del CCR deben cumplir las siguientes características: a) ser sensibles para la detección de adenomas y CCR; b) ser específicas para evitar los resultados falsos positivos; c) ser aceptadas por la población en cuanto a seguridad, confort y accesibilidad; d) tener en cuenta la historia natural de la neoplasia, y e) ser coste-efectivas. En la actualidad, las estrategias que cumplen estos requisitos y, por tanto, están recomendadas en el cribado de esta neoplasia, son las pruebas de detección de sangre oculta en heces (SOH) y las exploraciones endoscópicas, como la sigmoidoscopia flexible o la colonoscopia. Además, en los últimos años han ido apareciendo nuevas modalidades que podrían llegar a constituir alternativas viables en un futuro próximo, las cuales se fundamentan en la detección de biomarcadores presentes en diversos fluidos biológicos.
En el presente artículo se revisan las comunicaciones más relevantes presentadas en el Congreso Anual de la American Gastroenterological Association (AGA), celebrado en Orlando en mayo de 2013, en relación con el cribado del CCR, haciendo especial hincapié en los resultados a medio y largo plazo de las estrategias de detección de SOH y sigmoidoscopia flexible, así como en las primeras experiencias con el uso de nuevos biomarcadores.
Detección de sangre oculta en hecesExisten diversos métodos para la detección de SOH. De todos ellos, el más clásico es la prueba del guayaco (SOHg), la cual se basa en la actividad seudoperoxidasa de la hemoglobina. Esta prueba, realizada con periodicidad anual o bienal, se ha evaluado en 4 ensayos clínicos aleatorizados (ECA), los cuales muestran de forma constante una reducción de la mortalidad por CCR, estimada en el 16% (riesgo relativo [RR]: 0,84; intervalo de confianza [IC] del 95%, 0,78–0,90)5. Además, uno de los ensayos mencionados ha mostrado también una reducción del 20% en la incidencia de esta neoplasia cuando la detección de SOH se realiza anualmente (RR: 0,80; IC del 95%, 0,70–0,90) y del 17% cuando la periodicidad es bienal (RR: 0,83; IC del 95%, 0,73–0,94)6.
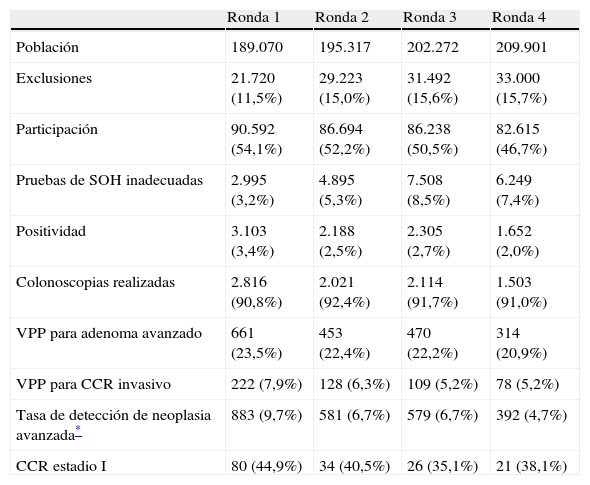
Uno de los aspectos más desconocidos en relación con el uso de las pruebas de detección de SOH es el comportamiento de la población en el transcurso de las distintas rondas. Este aspecto es crucial dada la naturaleza de esta estrategia, pues si no se consigue una correcta adherencia, los beneficios en términos de reducción de mortalidad y/o incidencia pueden ser inferiores a los esperables. En este sentido, en el congreso de la AGA se han presentado los resultados a medio plazo del programa poblacional del Alto Rin (Alsacia, Francia), los cuales proporcionan una información muy valiosa en cuanto a la adherencia tras 4 rondas de cribado mediante detección de SOHg7. Como puede observarse en la tabla 1, a lo largo de las rondas se observó una disminución en la participación, desde el 47,9% en primera ronda hasta el 38,5% en cuarta, sin que hubiera diferencias en cuanto al sexo pero sí en relación con la edad (la disminución fue más acusada en los más jóvenes). De forma global, el 56,7% de la población diana participó en, como mínimo, 1 ronda y el 19,6% completó las 4. El valor predictivo positivo (VPP) para neoplasia avanzada (CCR o adenoma avanzado) disminuyó del 31,4% en primera ronda al 26,1% en cuarta, así como la tasa de detección de neoplasia avanzada (del 9,7 al 4,7%, respectivamente). De manera similar, también se observó una disminución de la proporción de tumores diagnosticados en estadio I (del 44,9% en primera ronda al 38,1% en cuarta). En conclusión, estos resultados demuestran que la participación y el rendimiento diagnóstico disminuyen a lo largo de un programa de cribado, un hecho que no se había constatado en los estudios controlados previos. En este sentido, esta observación cuestiona la reproducibilidad de la eficacia de estos últimos en términos de disminución de mortalidad, y enfatiza la importancia de reforzar la participación y adherencia a los programas así como de disminuir las inequidades en función de las características de los distintos subgrupos de sujetos7.
Resultados del programa de cribado de cáncer colorrectal (CCR) del departamento del Alto Rin (Alsacia, Francia), consistente en la detección de sangre oculta en heces mediante el método del guayaco con periodicidad bienal7
| Ronda 1 | Ronda 2 | Ronda 3 | Ronda 4 | |
| Población | 189.070 | 195.317 | 202.272 | 209.901 |
| Exclusiones | 21.720 (11,5%) | 29.223 (15,0%) | 31.492 (15,6%) | 33.000 (15,7%) |
| Participación | 90.592 (54,1%) | 86.694 (52,2%) | 86.238 (50,5%) | 82.615 (46,7%) |
| Pruebas de SOH inadecuadas | 2.995 (3,2%) | 4.895 (5,3%) | 7.508 (8,5%) | 6.249 (7,4%) |
| Positividad | 3.103 (3,4%) | 2.188 (2,5%) | 2.305 (2,7%) | 1.652 (2,0%) |
| Colonoscopias realizadas | 2.816 (90,8%) | 2.021 (92,4%) | 2.114 (91,7%) | 1.503 (91,0%) |
| VPP para adenoma avanzado | 661 (23,5%) | 453 (22,4%) | 470 (22,2%) | 314 (20,9%) |
| VPP para CCR invasivo | 222 (7,9%) | 128 (6,3%) | 109 (5,2%) | 78 (5,2%) |
| Tasa de detección de neoplasia avanzada* | 883 (9,7%) | 581 (6,7%) | 579 (6,7%) | 392 (4,7%) |
| CCR estadio I | 80 (44,9%) | 34 (40,5%) | 26 (35,1%) | 21 (38,1%) |
SOH: sangre oculta en heces; VPP: valor predictivo positivo.
En los últimos años han aparecido métodos inmunológicos de detección de SOH basados en la determinación de la globina humana mediante anticuerpos específicos (SOHi). Este tipo de prueba presenta varias ventajas en relación con el método del guayaco: posee mayor sensibilidad, requiere solo una muestra de heces y no es necesario efectuar ninguna restricción dietética, lo que comporta una mayor aceptación por parte de la población3. Hasta la fecha, no se dispone de ECA que evalúen la eficacia de la prueba de SOHi en términos de incidencia o mortalidad, aunque sí en relación con resultados intermedios (tasa de detección de neoplasia colorrectal). Un estudio que compara la prueba de detección de SOHg (Hemoccult II®) con la de SOHi (OC-Sensor®) muestra que este último es significativamente más eficaz para la detección de CCR y adenomas avanzados, aunque la especificidad es menor8. De manera similar, la revisión sistemática de la US Preventive Services Task Force concluye que la prueba de SOHi es más sensible para la detección del CCR (61–69%) que la prueba de SOHg (25–38%), aunque menos específica (el 91–98 frente al 98–99%, respectivamente)9.
En la actualidad hay poca información en relación con la adherencia a lo largo de un programa de cribado mediante SOHi. Así, en el Congreso de la AGA se han presentado los resultados alcanzados en Países Bajos tras 3 rondas de cribado10–12. En el primero de estos estudios se evaluaron 10.050 sujetos de riesgo medio invitados a participar en la tercera ronda de cribado mediante SOHi (OC-Sensor®; punto de corte, 50 ng de hemoglobina/ml de tampón) con periodicidad bienal10. De ellos, 5.671 (56%) devolvieron la prueba de SOHi en tercera ronda, mientras que el 52 y el 56% lo hicieron en segunda y primera rondas, respectivamente. Globalmente, 377 (6,8%) de los participantes en tercera ronda dieron positivo a la prueba, mientras que este porcentaje fue del 7,4 y 8,1% en segunda y primera rondas, respectivamente (p<0,01). El VPP para neoplasia avanzada fue del 30% en tercera ronda, mientras que en segunda y primera rondas fue del 44 y 55%, respectivamente (p<0,01). Por último, la concentración media de hemoglobina descendió de 430 ng/ml en primera ronda a 370 ng/ml en segunda (p=0,16) y 348 ng/ml en tercera (p=0,08). Estos resultados sugieren que la participación a lo largo de 3 rondas de cribado se mantiene estable, pero que la tasa de positividad de la prueba de SOHi y su VPP para neoplasia avanzada disminuye significativamente10.
En el segundo estudio se evaluó si la realización de 2 pruebas de SOHi por ronda permitía aumentar el rendimiento diagnóstico del programa de cribado12. Esta evaluación se llevó a cabo en el contexto de un estudio de base poblacional en el que se seleccionó, de manera aleatoria, una muestra representativa de la población (n=3.197), a la cual se invitó a participar en 2 rondas de cribado mediante SOHi con periodicidad bienal. En cada ronda, todos los invitados recibieron 2 kits de SOHi (OC-Sensor®; punto de corte, 50 ng/ml). En este estudio, no hubo diferencias estadísticamente significativas en la participación en primera (61,3%) y segunda (61,2%) rondas, pero sí en la tasa de positividad (el 12,8% en primera y el 8,6% en segunda; p<0,001). Además, la tasa de positividad en segunda ronda de los que habían participado en la primera fue inferior a la de los que no lo habían hecho (el 7,6 frente al 14,5%, respectivamente; p<0,001). La tasa de detección de neoplasia avanzada fue del 4,1% en primera ronda y del 1,5% en segunda ronda (p<0,001), con un VPP de al menos una prueba positiva del 38 y el 18%, respectivamente (p<0,001). Por último, cuando los resultados obtenidos con 2 pruebas de SOHi por ronda se compararon con los de una serie histórica en la que se empleó una sola prueba por ronda13, se observó un incremento de la tasa de positividad en el conjunto de las 2 rondas (8,4 + 6,0% con una sola prueba, en comparación con 12,8 + 8,6% con 2 pruebas; p<0,001), así como de la tasa de detección de neoplasia avanzada (el 5,1 frente al 5,6%, respectivamente). En resumen, los resultados de este estudio indican que la realización de 2 pruebas de SOHi por ronda se asocia a una participación elevada y estable, similar a la que se obtiene con una sola prueba, pero incrementa la tasa de positividad. En el transcurso de las 2 rondas, la tasa de detección de neoplasia avanzada disminuye con el uso de 2 pruebas, pero continúa siendo superior a la obtenida con una sola, lo que sugiere la potencial ventaja de emplear 2 pruebas de SOHi tanto en primera como en segunda rondas12.
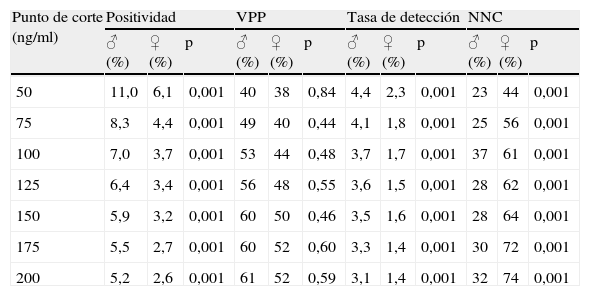
Por otro lado, en el momento actual, los programas de cribado abordan de manera idéntica a varones y mujeres, a pesar de que es bien conocida la mayor prevalencia de neoplasia avanzada en varones y una localización más proximal de esta en mujeres. Por este motivo es importante evaluar si la prueba de SOHi se comporta de manera similar en ambos sexos. Este objetivo se evaluó en un tercer estudio holandés, en el que se analizaron 7.501 individuos cribados mediante SOHi (OC-Sensor®; 50 ng/ml) en primera ronda y 6.208 en segunda11. En él, la participación fue del 63% en ambas rondas y siempre mayor en mujeres que en varones (primera ronda, el 65,0 frente al 60,1%; segunda ronda, el 65,2 frente al 61,1%, respectivamente; p<0,001)11. Como puede observarse en la tabla 2, las tasas de positividad y detección de neoplasia avanzada fueron superiores en varones que en mujeres para todos los puntos de corte evaluados y, de forma paralela, el número de sujetos a cribar necesarios para detectar una neoplasia avanzada fue menor en varones que en mujeres. Sin embargo, no hubo diferencias estadísticamente significativas en relación con el VPP para la detección de neoplasia avanzada. Por último, la localización de las lesiones detectadas fue similar en ambos sexos, con un 16% de los varones y un 18% de las mujeres con lesiones proximales al ángulo esplénico. En conclusión, los resultados de este estudio demuestran que, a pesar de que la tasa de positividad es superior en varones que en mujeres, el VPP de la prueba de SOHi es similar en ambos sexos, con independencia del punto de corte que se escoja11.
Resultados obtenidos en primera ronda de cribado con el uso de una prueba de detección de sangre oculta en heces mediante método inmunológico, a diferentes puntos de corte11
| Punto de corte (ng/ml) | Positividad | VPP | Tasa de detección | NNC | ||||||||
| ♂ (%) | ♀ (%) | p | ♂ (%) | ♀ (%) | p | ♂ (%) | ♀ (%) | p | ♂ (%) | ♀ (%) | p | |
| 50 | 11,0 | 6,1 | 0,001 | 40 | 38 | 0,84 | 4,4 | 2,3 | 0,001 | 23 | 44 | 0,001 |
| 75 | 8,3 | 4,4 | 0,001 | 49 | 40 | 0,44 | 4,1 | 1,8 | 0,001 | 25 | 56 | 0,001 |
| 100 | 7,0 | 3,7 | 0,001 | 53 | 44 | 0,48 | 3,7 | 1,7 | 0,001 | 37 | 61 | 0,001 |
| 125 | 6,4 | 3,4 | 0,001 | 56 | 48 | 0,55 | 3,6 | 1,5 | 0,001 | 28 | 62 | 0,001 |
| 150 | 5,9 | 3,2 | 0,001 | 60 | 50 | 0,46 | 3,5 | 1,6 | 0,001 | 28 | 64 | 0,001 |
| 175 | 5,5 | 2,7 | 0,001 | 60 | 52 | 0,60 | 3,3 | 1,4 | 0,001 | 30 | 72 | 0,001 |
| 200 | 5,2 | 2,6 | 0,001 | 61 | 52 | 0,59 | 3,1 | 1,4 | 0,001 | 32 | 74 | 0,001 |
NNC: número de individuos necesarios a cribar para detectar un paciente con neoplasia avanzada (incluye cáncer colorrectal y adenoma avanzado); VPP: valor predictivo positivo.
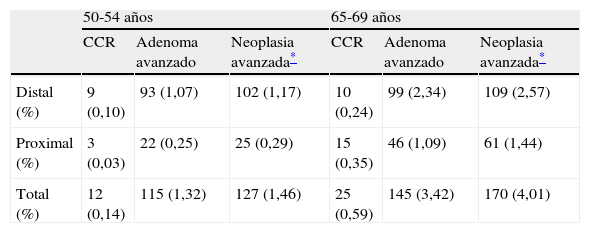
En relación con la localización de las lesiones detectadas en los programas de cribado se ha sugerido que tanto las pruebas de SOH como la propia colonoscopia son menos sensibles para la detección de lesiones proximales, las cuales se diagnostican con mayor frecuencia en individuos de edad más avanzada. Un estudio presentado en el Congreso de la AGA evaluó el efecto de la edad en la localización de las neoplasias detectadas en el programa de la región del Valle de Aosta (Italia)14. En él, entre los años 2006 y 2010 se invitó a 38.000 sujetos de riesgo medio a participar en un programa de SOHi (OC-Sensor®; punto de corte, 100ng/ml) y se evaluó la tasa de detección acumulada tras 3 rondas de cribado en los participantes en la primera de ellas, estratificados en función de la edad (50–54 frente a 65–69 años) y la localización de las lesiones. En el 75% de los 12.944 participantes en primera ronda se efectuaron 2 pruebas consecutivas y en el 50% las 3 (media, 2,2 pruebas por sujeto). En la cohorte más joven, el 5,3% presentó, como mínimo, una prueba positiva, mientras que en la cohorte de mayor edad, esta proporción fue del 12,6%. Como puede observarse en la tabla 3, tras la realización de 3 rondas de SOHi, la tasa acumulada de detección de neoplasia avanzada distal fue el doble en la cohorte de 65 a 69 años que en la de 50 a 54 años, mientras que la de localización más proximal fue el cuádruple, lo que confirma un desplazamiento relativo de las neoplasias avanzadas hacia tramos más proximales en relación con el envejecimiento de la población14.
Tasa de detección acumulada de cáncer colorrectal (CCR) y adenomas avanzados tras 3 rondas de cribado mediante prueba de detección de sangre oculta en heces inmunológica, en función de la edad y localización de las lesiones14
| 50-54 años | 65-69 años | |||||
| CCR | Adenoma avanzado | Neoplasia avanzada* | CCR | Adenoma avanzado | Neoplasia avanzada* | |
| Distal (%) | 9 (0,10) | 93 (1,07) | 102 (1,17) | 10 (0,24) | 99 (2,34) | 109 (2,57) |
| Proximal (%) | 3 (0,03) | 22 (0,25) | 25 (0,29) | 15 (0,35) | 46 (1,09) | 61 (1,44) |
| Total (%) | 12 (0,14) | 115 (1,32) | 127 (1,46) | 25 (0,59) | 145 (3,42) | 170 (4,01) |
Por último, otro de los aspectos evaluados en relación con el cribado mediante detección de SOHi han sido los resultados a medio-largo plazo de los programas de base poblacional, en especial por lo que respecta a la adherencia tras sucesivas rondas. En esta ocasión, no se trata de un programa organizado en un sistema público de salud, sino el desarrollado por una aseguradora (Kaiser Permanente) en California (Estados Unidos), y consistente en la determinación anual de SOHi durante un período de 5 años15. Para ello se evaluaron 2 cohortes que iniciaron el cribado en el año 2007 o 2008. Durante este período, el 36,3 y el 34,8% de los participantes de la primera y segunda cohorte, respectivamente, fueron cribados mediante colonoscopia (20%) o sigmoidoscopia (15–16%). De aquellos en los que se realizó una colonoscopia, el 43 y el 44% habían presentado previamente una prueba de SOHi positiva. Durante el seguimiento, la tasa anual de positividad fue del 4,7–3,7% y del 5,0–3,6% en ambas cohortes, respectivamente, y siempre superior en la primera ronda. Se diagnosticó un CCR en 315 (0,5%) y 328 (0,3%) sujetos de ambas cohortes, de los cuales el 73 y el 80%, respectivamente, fueron detectados por la prueba de SOHi. En la cohorte del año 2007, el 87,2% de los participantes completó 3 o más pruebas en 5 años, incluyendo un 45,1% que la realizó anualmente, mientras que en la cohorte de 2008, el 95,6% de los participantes efectuó 2 o más pruebas, y un 57,8% la realizó anualmente. Estos resultados indican que es factible realizar un programa de cribado de CCR de base poblacional mediante detección de SOHi en Estados Unidos y que la adherencia alcanzada tras 5 años es elevada15.
Sigmoidoscopia flexibleLa sigmoidoscopia flexible se realiza con un endoscopio que permite examinar la superficie mucosa del intestino grueso hasta 60cm del margen anal (recto, sigma y parte distal del colon descendente). Esta exploración se realiza previo lavado del colon con un enema o administración de laxantes, y sin necesidad de sedación.
Hay 3 ECA que evalúan la utilidad de la sigmoidoscopia como estrategia de cribado. Los 2 estudios europeos —UK Flexible Sigmoidoscopy Screening Trial (UKFSST)16 e Italian SCORE Trial17— están dirigidos a evaluar la eficacia de una sigmoidoscopia única en personas de 55 a 64 años con un total de 170.432 y 34.292 personas incluidas, mientras que el americano —PLCO Cancer Screening Trial— evalúa la eficacia de la sigmoidoscopia a intervalos de 3–5 años e incluye 154.000 personas de entre 55 y 74 años18.
En el año 2010 se publicaron los resultados de mortalidad del UKFSST tras 11 años de seguimiento16. En el análisis por intención de cribar, la incidencia de CCR fue significativamente menor en el grupo de sigmoidoscopia que en el grupo control, con una disminución de CCR en el colon izquierdo del 36%. En el análisis por protocolo, la incidencia fue un 33% menor de manera global y un 50% menor en relación con las lesiones del colon izquierdo. Además, la mortalidad por CCR se redujo en un 31% en el grupo de intervención en el análisis por intención de cribar, alcanzando el 43% en el grupo en el que se realizó la sigmoidoscopia16.
Los resultados del estudio italiano SCORE17 demuestran una reducción de la incidencia de CCR en el grupo de sigmoidoscopia, así como una reducción de la incidencia y mortalidad relacionada con el CCR en los que participaron en el cribado, de manera similar a lo que ocurre en el UKFSST16. No obstante, a diferencia de lo que ocurrió en el estudio inglés, no se observaron diferencias en la mortalidad por CCR en el análisis por intención de cribar, posiblemente debido a un insuficiente período de seguimiento17.
Finalmente, en el año 2012 se publicaron los resultados del PLCO Cancer Screening Trial19. En él, tras un seguimiento de 11,2 años, se observó una reducción en la incidencia de CCR del 21% (RR: 0,79; IC del 95%, 0,72–0,85; p<0,0001) y en la mortalidad por CCR del 26% (RR: 0,74; IC del 95%, 0,63–0,87; p=0,0003). Además, la reducción en la incidencia de CCR se observó tanto para las lesiones distales como para las proximales, mientras que la reducción de la mortalidad solo se constató en relación con las lesiones situadas en recto y colon distal19.
Por otro lado se ha sugerido que la combinación de la detección de SOH y la sigmoidoscopia podría incrementar la eficacia de ambas estrategias por separado, un hecho especialmente relevante por lo que respecta a la detección de lesiones localizadas en el colon proximal, las cuales son más difíciles de detectar en ambas aproximaciones. En este sentido, el programa de cribado inglés —NHS Bowel Cancer Screening Programme (BCSP)—, consistente en la detección de SOH bienal, incorporará próximamente la realización de una sigmoidoscopia a los 55 años, seguida de la detección de SOH desde los 60 hasta los 74 años. Sin embargo se desconoce si el hecho de haber realizado una sigmoidoscopia previamente puede influir en la participación y en los resultados de la ulterior prueba de SOH. Este aspecto se ha evaluado en 60.917 participantes en el UKFSST16 (40.697 en el grupo control y 20.220 en la rama de sigmoidoscopia) incluidos en Reino Unido, a los que se les invitó a realizar una prueba de SOHg en el contexto del BCSP con posterioridad a su inclusión en el estudio20. La edad media en el momento de la invitación a realizar la prueba de SOHg fue de 69 años y el tiempo medio transcurrido desde su exposición previa a la sigmoidoscopia fue de 11 años. En comparación con el grupo control, los sujetos procedentes de la rama de sigmoidoscopia presentaron una menor participación (el 71,8 frente al 70,3%; p<0,001) y una menor tasa de positividad (el 2,33 frente al 1,89%; p=0,003). Además, el VPP para CCR (el 12,18 frente al 10,84%; p=0,58) y adenoma avanzado (el 33,23 frente al 23,29%; p=0,004) fue también menor en los invitados previamente a realizar una sigmoidoscopia20.
La combinación de la prueba de detección de SOH y sigmoidoscopia también se ha evaluado en Italia21, en el contexto de un ensayo controlado y aleatorizado previo en el que se comparaban diferentes estrategias de cribado22. En este estudio, los participantes en los que la sigmoidoscopia había sido normal fueron invitados a realizar una prueba de SOHi cada 2 años (una única muestra y con un punto de corte de 100 ng/ml). Los resultados preliminares obtenidos tras 4 rondas de cribado demostraron una tasa de detección de CCR del 0,22% y de adenoma avanzado del 0,62% entre los 2.771 participantes que realizaron, como mínimo, una prueba de SOHi tras una sigmoidoscopia negativa21. La tasa de detección para adenoma avanzado fue similar entre los participantes, con independencia del número de pruebas negativas. Sin embargo, la tasa de detección de CCR descendió al 0,04% tras una prueba de SOHi negativa, y no se observó ningún otro caso tras 2 o más pruebas negativas. El VPP para CCR y adenoma avanzado disminuyó del 23% en primera ronda al 15% en segunda, y posteriormente permaneció estable. La proporción de lesiones detectadas localizadas en el colon proximal fue del 79% para CCR y del 57% para adenomas avanzados. Estos resultados sugieren que la prueba de SOHi permite detectar una proporción significativa de lesiones proximales en sujetos en los que la sigmoidoscopia fue negativa, y que el intervalo tras una prueba de SOHi negativa puede alargarse dada la importante reducción del riesgo de CCR que se obtiene21.
Uso de nuevos biomarcadoresComo se ha comentado anteriormente, una prueba de cribado debe ser no invasiva, económica, reproducible y capaz de detectar lesiones premalignas con un alto riesgo de degeneración, y CCR en fase inicial con una alta sensibilidad y especificidad. En la actualidad, ninguna de las estrategias disponibles cumple estas características. Las exploraciones endoscópicas son más efectivas, pero invasivas y caras, mientras que las pruebas de SOH logran una disminución modesta de la mortalidad por CCR. En este sentido se ha sugerido que la identificación de biomarcadores asociados al desarrollo de CCR y adenomas avanzados puede ser una aproximación útil para mejorar el rendimiento de las estrategias de cribado.
La alteración del patrón normal de metilación es un importante mecanismo epigenético ligado a la carcinogénesis colorrectal y ocurre de manera precoz23. A diferencia de otros biomarcadores, la metilación del ADN ha demostrado ser estable, reproducible y consistente entre sujetos, y se puede detectar en sangre, heces y otros fluidos biológicos24. En este sentido, además de su potencial utilidad para el cribado del CCR, se ha sugerido que las pruebas de ADN fecal podrían detectar otras neoplasias gastrointestinales. Este hecho ha sido abordado por 2 estudios, el primero de los cuales evaluó los patrones de metilación específicos de cada tipo de cáncer25. Para ello se analizaron mediante reduced representation bisulfite sequencing muestras de archivo procedentes de pacientes con lesiones benignas (n=18) y malignas de páncreas (n=18), así como mucosa colorrectal sana, apareadas por edad, sexo y hábito tabáquico. Los genes candidatos fueron posteriormente evaluados mediante PCR (reacción en cadena de la polimerasa) específica de metilación en muestras de 38 pacientes con neoplasia colorrectal (20 con cáncer y 18 con adenomas > 10mm), 19 con cáncer de esófago, 10 con cáncer de estómago, 38 con cáncer de páncreas y 45 controles. El análisis de regresión para clasificar las muestras permitió identificar los genes CLEC11A, C13ORF18, KCNN2, ABCB1, SLC38A3, CD1C, IKZF1, ADCY1, CHR12133, RSPO3 y TWIST1 como los más informativos. De los 45 pares de asociaciones posibles, 17 presentaron una precisión diagnóstica > 80% para distinguir la procedencia anatómica de las neoplasias y, entre ellas, la combinación CLEC11A y TWIST1 fue la que tuvo una mayor precisión diagnóstica (global, 91%: 50 de las 66 [89%] correspondientes a neoplasias del tracto superior, 33 de las 38 [87%] neoplasias colorrectales y 44 de las 45 [98%] de las muestras normales)25.
Otra aproximación en el uso de marcadores de ADN fecal para el diagnóstico de las neoplasias digestivas ha sido el realizado por Morikawa et al26, que analizaron un panel de 8 genes metilados en muestras de heces procedentes de pacientes con CCR (n=56), adenomas colorrectales (n=28) y otras neoplasias, que incluían cáncer de hígado, páncreas, vesícula biliar, estómago y duodeno (n=24). En este análisis se identificaron uno o más marcadores metilados en el 91,0, 92,8 y 70,8% de las muestras de pacientes con CCR, adenomas y otras neoplasias, respectivamente, mientras que ello ocurrió en solo el 27,4% de las procedentes de sujetos sin patología neoplásica. Estos resultados sugieren la potencial utilidad de las pruebas de ADN fecal no tan solo para el cribado del CCR, sino también para el de otras neoplasias digestivas26.
Otra de las estrategias que se han propuesto para el cribado del CCR mediante la detección de biomarcadores en heces es la determinación de los valores de M2-PK, una isoforma de una piruvato cinasa implicada en la glucólisis y sobreexpresada en el CCR. En un estudio caso-control presentado en el Congreso de la AGA se incluyeron 70 pacientes con CCR y 161 controles sanos con el fin de evaluar la eficacia de la determinación de la concentración de M2-PK en heces para el diagnóstico de CCR27. La sensibilidad, especificidad, VPP y valor predictivo negativo de la prueba para la detección de CCR fue del 78,6, 96,3, 90,2 y 91,2%, respectivamente. La sensibilidad de la prueba fue inferior en los tumores estadio I (50,0%) que en los más avanzados (II, 88,0%; III, 79,2%, y IV, 80,0%), así como en los localizados en el colon proximal (64,3%) en comparación con los distales (82,1%)27.
Los microARN (miARN) son moléculas de ARN no codificante de ~18–22 nucleótidos de longitud, que regulan negativamente la expresión génica mediante la inhibición de la traducción o la degradación del ARN mensajero de genes codificantes. En los últimos años se ha sugerido que podrían ser biomarcadores de CCR con utilidad en el diagnóstico, predicción de la respuesta al tratamiento o pronóstico. Así, se ha constatado que los miARN están presentes de forma estable en plasma y otros fluidos corporales y, recientemente, un estudio de nuestro grupo ha demostrado que el perfil de expresión de miARN en plasma de los pacientes con CCR o adenomas avanzados es distinto del de los sujetos control28. En este sentido, un estudio presentado en el congreso de este año ha evaluado la utilidad de la determinación de los valores de miR-21 y miR-92a en heces, en combinación con la prueba de SOHi, en 138 pacientes con CCR, 26 con adenomas avanzados y 126 sujetos sanos29. En él, la sensibilidad de la combinación de ambos miARN con la prueba de SOHi fue superior a la de esta última de manera aislada (el 78,4 frente al 66,7%, respectivamente; p=0,04) para el diagnóstico de CCR. Además, la sensibilidad para el diagnóstico de adenoma avanzado o CCR precoz (estadio 0 o I) también fue superior con la estrategia combinada (el 63,9 frente al 33,3%; p<0,001). Estos resultados apoyan la potencialidad de estos marcadores para el cribado del CCR29.
En resumen, las comunicaciones presentadas en la edición 2013 del Congreso de la AGA confirman la eficacia a medio y largo plazo de las estrategias de cribado mediante SOH, en especial las efectuadas con métodos inmunológicos y sigmodiscopia flexible, y sugieren la posible utilidad de nuevos biomarcadores en heces, como la determinación de metilación del ADN, M2-PK o miARN.
FinanciaciónMinisterio de Economía y Competitividad (SAF2010-19273), Agència de Gestió d’Ajuts Universitaris i de Recerca (2009 SGR 849) y Fundación Científica de la Asociación Española contra el Cáncer. CIBERehd (Centro de Investigación Biomédica en Red en Enfermedades Hepáticas y Digestivas) está financiado por el Instituto de Salud Carlos III.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.