Evaluar el resultado del cribado de hepatitis B y C en pacientes ingresados con COVID-19.
Pacientes y métodosEstudio transversal, prospectivo, realizado en dos hospitales españoles de tercer nivel. Se estudiaron marcadores de hepatitis B (HBsAg, anti-HBc) y C (anti-VHC, ARN VHC) a todos los pacientes hospitalizados con COVID-19 del 1 de marzo al 31 de diciembre de 2020.
ResultadosEn este periodo ingresaron 4662 pacientes con COVID-19: 56,3% fueron varones, la edad mediana fue 76 (0-104) años. Se realizó serología de hepatitis B a 2915 (62,5%) pacientes; 253 (8,75%) presentaban anti-HBc+y 11 (0,38%) HBsAg+. De los 11 pacientes, 4 desconocían el diagnóstico, 7 recibieron esteroides y uno recibió profilaxis. Hubo un caso de reactivación del VHB. Se determinaron anticuerpos anti-VHC a 2895 (62%) pacientes; 24 (0,83%) fueron positivos. De ellos, 13 pacientes estaban diagnosticados: 10 habían recibido tratamiento, uno se había curado espontáneamente y dos no habían sido tratados. De los 11 restantes, 10 tenían ARN VHC indetectable. En total, solo 3 (0,10%) pacientes tenían carga viral detectable. Sin embargo, ninguno recibió tratamiento (2> 90 años con comorbilidades, uno falleció por COVID-19).
ConclusionesEl cribado de hepatitis C en pacientes ingresados por COVID-19 en nuestro medio ha mostrado menor utilidad de la esperada. La baja prevalencia de infección activa tras los tratamientos antivirales y la alta edad mediana de nuestra población limitan la detección de potenciales candidatos a tratamiento. El cribado de hepatitis B debería dirigirse a prevenir la reactivación en pacientes que precisen tratamientos inmunosupresores.
To evaluate the results of a hepatitis B and C screening program in hospitalized COVID-19 patients.
MethodTransversal prospective study conducted in two Spanish hospitals. Patients admitted from March 1st to December 31st 2020 with a diagnosis of COVID-19 were tested for markers of hepatitis B (HBsAg, anti-HBc) and C (anti-HCV, HCV RNA) infection.
ResultsIn this period, 4662 patients with COVID-19 were admitted to our centers: 56.3% were male, median age was 76 (0–104) years. Data regarding HBV infection was available in 2915 (62.5%) patients; 253 (8.75%) were anti-HBc+ and 11 (0.38%) HBsAg+. From these, 4 patients did not have a previous diagnosis of hepatitis B, 7 received corticosteroids and one received prophylaxis. There was one HBV reactivation. Anti-HCV was available in 2895 (62%) patients; 24 (0.83%) were positive. From these, 13 patients had a previous hepatitis C diagnosis: 10 patients had been treated with SVR, one achieved spontaneous cure and 2 did not receive treatment. From the 11 previously unknown anti-VHC+patients, 10 had a negative HCV RNA. Overall, only 3 (0.10%) patients tested RNA HCV+. However, none received HCV treatment (2 older than 90 years with comorbidities, 1 died from COVID-19).
ConclusionScreening of hepatitis C infection in hospitalized COVID-19 patients seems less useful than expected. The low prevalence of active infection after antiviral treatments and the high age of our population limit the detection of potential candidates for treatment. HBV screening should be aimed to prevent reactivation under immunosuppressive treatments.
Las hepatitis víricas continúan siendo un problema de salud pública global por su alta prevalencia y morbimortalidad. Se calcula que en 2015 unos 257 millones de personas en todo el mundo tenían infección crónica por el virus de la hepatitis B (VHB) y unos 71 millones por el virus de la hepatitis C (VHC), causando en ese año 1,34 millones de muertes, la mayoría por hepatopatía crónica (720.000 muertes) y cáncer hepático primario (470.000 muertes). Por todo ello, la Organización Mundial de la Salud (OMS) ha establecido como uno de sus objetivos la eliminación de las hepatitis víricas para el año 2030, reduciendo las nuevas infecciones en un 90% y la mortalidad en un 65%1.
Tras la introducción de la vacuna de la hepatitis B en los años 90, España se considera un país de baja endemicidad, con una prevalencia de HBsAg entre 0,2-0,5% y de anticuerpos anti-HBc entre 4%-6%2.
En cuanto a la infección por virus C, la aparición de los nuevos antivirales de acción directa (AAD) en el año 2015 y la elaboración del Plan Estratégico Nacional para el abordaje de la hepatitis C en el Sistema Nacional de Salud ha permitido el tratamiento de más de 143.000 personas con hepatitis C en nuestro país3. Sin embargo, un estudio nacional de seroprevalencia llevado a cabo por el Ministerio de Sanidad en 2018 estimó una prevalencia de anticuerpos anti-VHC del 0,85% y de individuos con ARN del VHC detectable de un 0,22%, lo que permite calcular la existencia de unas 76.500 personas con hepatitis C no tratadas en nuestro país4. La Asociación Española para el Estudio del Hígado (AEEH), en un documento de posicionamiento del año 2019 recomienda distintas estrategias para la eliminación de la hepatitis C en España, que incluyen el cribado en los grupos de edad de mayor prevalencia y en los grupos de riesgo de adquisición de la hepatitis C, así como la identificación de pacientes previamente diagnosticados y no tratados o no curados con los tratamientos previos5. La unión de todos estos esfuerzos permite a España ser unos de los países con mayor probabilidad de lograr los objetivos de eliminación de la hepatitis C de la OMS6.
El advenimiento de la pandemia de COVID-19 en el año 2020 paralizó el cribado de la hepatitis B y C al evitar que los pacientes acudieran de forma presencial a las consultas y supuso varios retos para el diagnóstico y la asistencia de estas enfermedades. Por un lado, los pacientes con enfermedad hepática avanzada presentan un peor pronóstico tras la infección por SARS-CoV-27. Por otro lado, la reorganización de la asistencia sanitaria ha hecho que la mayoría de los programas de eliminación de la hepatitis C se hayan visto retrasados, lo que ha repercutido en una disminución de inicio de nuevos tratamientos3. En cuanto a la infección por el VHB, debido a que los pacientes hospitalizados con neumonía por COVID-19 reciben a menudo dosis altas de corticoides y otros fármacos inmunosupresores, determinar el estado de infección previo puede ser fundamental para prevenir la reactivación del VHB realizando profilaxis en estos pacientes.
Sin embargo, el alto número de ingresos hospitalarios debidos a la infección por
SARS-CoV-2 constituye una oportunidad para continuar el cribado de hepatitis B y C aprovechando el contacto de estos pacientes con el sistema sanitario, y así poder seguir avanzando en el objetivo de la OMS de eliminar las hepatitis virales para el año 2030.
El objetivo principal del presente estudio fue evaluar el resultado de una estrategia de cribado de la infección por VHC y VHB en pacientes hospitalizados con COVID-19. Como objetivos secundarios, se investigó el porcentaje de pacientes diagnosticados de hepatitis C mediante el cribado que pudo acceder a tratamiento con AAD y si la infección por SARS-Cov-2 y su tratamiento tuvo algún impacto sobre la evolución y el tratamiento de la infección por el VHB.
Pacientes y métodosSe realizó un estudio transversal, de inclusión prospectiva y multicéntrico en dos hospitales españoles de tercer nivel: Hospital Universitario de Burgos y Complejo Asistencial Universitario de León. Siguiendo las recomendaciones del Ministerio de Sanidad sobre el manejo de la COVID-19 en Atención Hospitalaria8, todos los pacientes ingresados en nuestros centros desde el 1 de marzo de 2020 hasta el 31 de diciembre de 2020 con infección por SARS-CoV-2 fueron cribados mediante el estudio de marcadores de infección por el VHB (HBsAg, anti-HBc) y VHC (anti-VHC y ARN VHC), recibiendo, por tanto, un cribado oportunista universal. El diagnóstico de la infección por VHC se hizo en un solo paso. Se estudió la prevalencia de anticuerpos anti-VHC y anti-HBc, la proporción de pacientes con infección activa y pasada y la de pacientes previamente diagnosticados y/o tratados de hepatitis B y C en nuestros centros. Se investigó también el porcentaje de pacientes diagnosticados de hepatitis C mediante el cribado que pudo acceder a tratamiento con AAD y si el tratamiento de la infección por SARS-Cov-2 influyó en el manejo de la infección por el VHB detectada en el cribado. Las decisiones operativas sobre la realización de serología, la instauración de tratamiento o profilaxis y la de consultar con la Unidad de Hepatología, correspondieron a cada equipo COVID, que funcionó de forma autónoma e independiente.
Se recogieron variables demográficas y epidemiológicas relativas a la hepatopatía (edad, sexo, diagnóstico previo de hepatitis B o C, tratamiento previo), variables analíticas (hemograma, coagulación, bioquímica básica y hepática, marcadores de inflamación sistémica como proteína C reactiva, IL-6 y ferritina y PCR de
SARS-CoV-2). La fibrosis hepática se cuantificó mediante test no invasivos (APRI, FIB-4) en los pacientes diagnosticados de hepatitis B y C.
El estudio fue aprobado por el Comité de Ética e Investigación Clínica de los dos centros: Hospital Universitario de Burgos y Complejo Asistencial Universitario de León. Los datos se analizaron mediante el programa estadístico SPSS 20.0. Las variables categóricas se expresaron mediante porcentajes, y las cuantitativas mediante la mediana y rango. Las comparaciones entre variables cuantitativas se realizaron mediante el test de la U de Mann-Whitney. Se consideró estadísticamente significativo el valor de p <0,05.
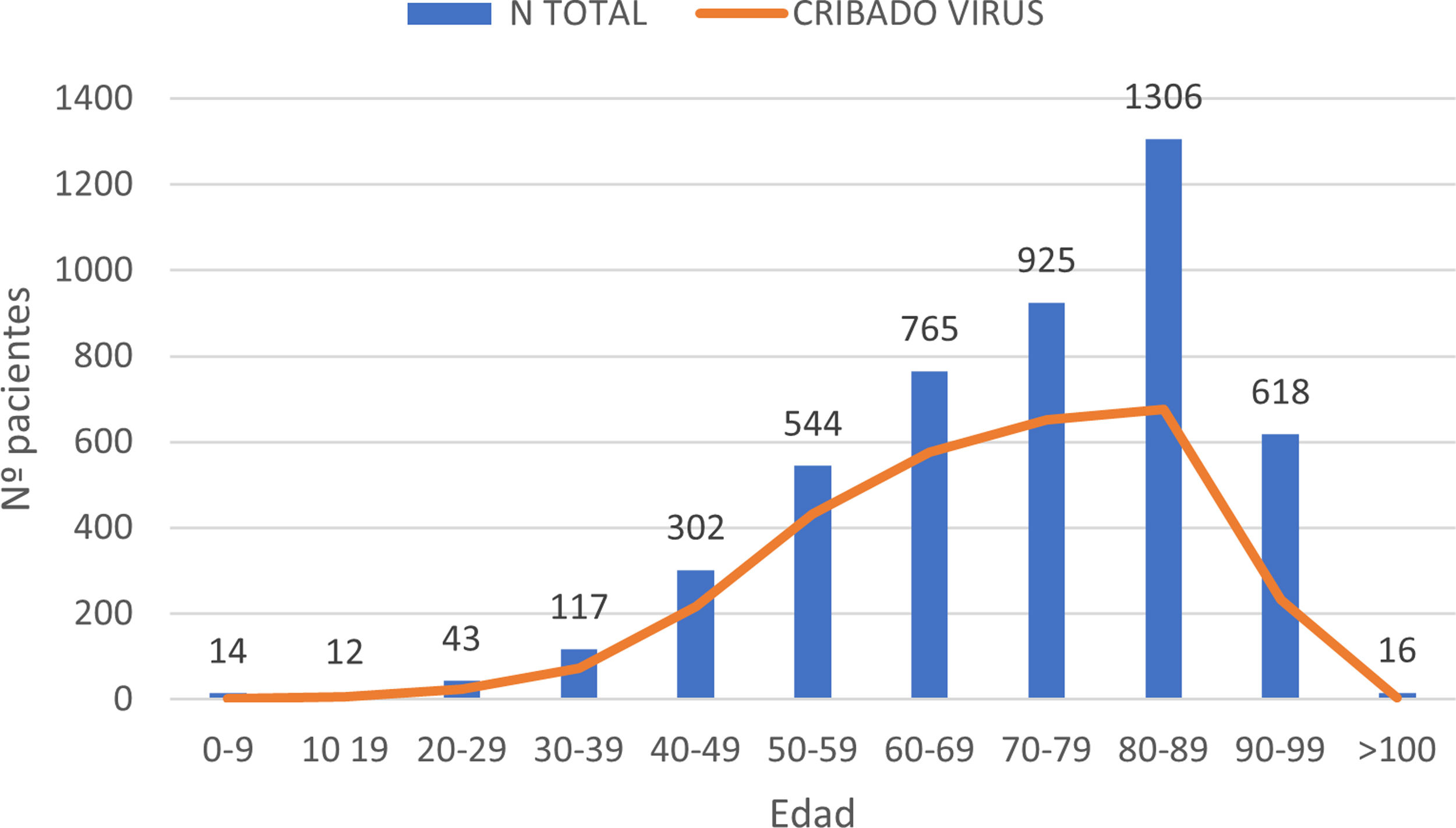
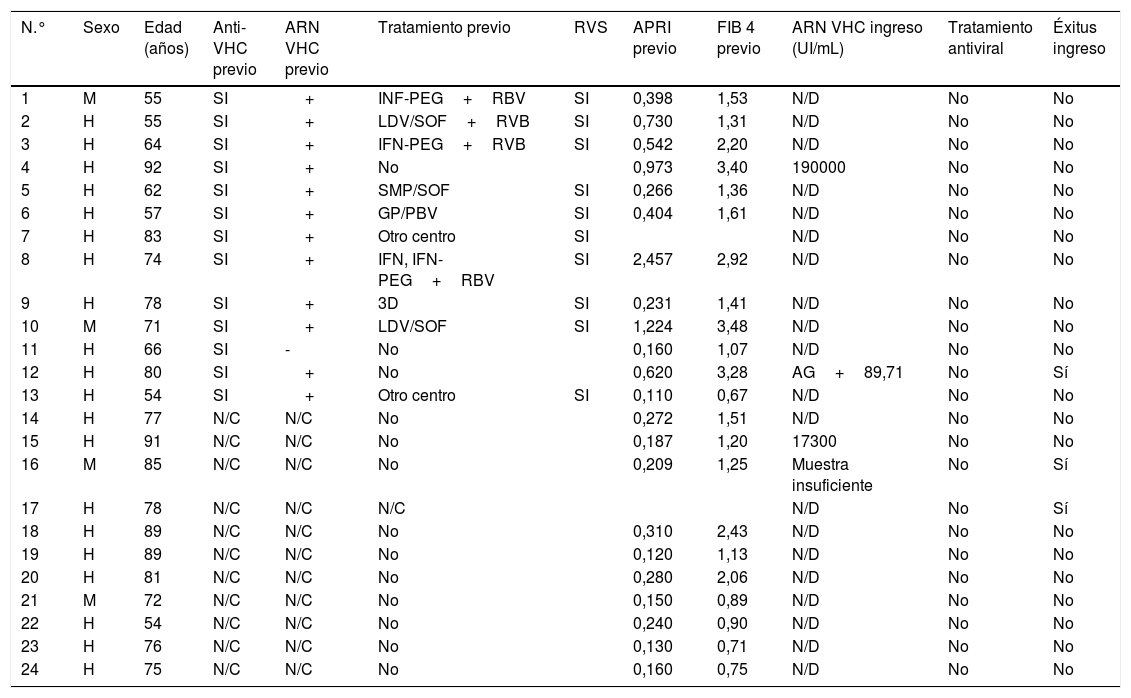
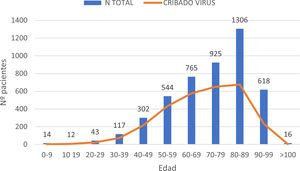
ResultadosEn el periodo de estudio, 4662 pacientes con COVID-19 fueron hospitalizados en nuestros centros. El 56,3% de los pacientes fueron varones. La edad mediana fue de 76 (0-104) años. La distribución de los pacientes ingresados por grupos de edad fue la siguiente: 0-9 años 0,3%, 10-19 años 0,3%, 20-29 años 0,9%, 30-39 años 2,5%, 40-49 años 6,5%, 50-59 años 11,7%, 60-69 años 16,4%, 70-79 años 19,8%, 80-89 años 28%, 90-99 años 13,3% y>100 años 0,3% (fig. 1). Se realizó serología de hepatitis B a 2915 (62,5%) pacientes y de hepatitis C a 2895 (62%) pacientes (fig. 2). La mediana de edad de los pacientes a los que se realizó cribado de hepatitis B y C fue significativamente inferior a la de los pacientes no cribados. En el caso de la hepatitis B los pacientes cribados tuvieron una edad mediana de 71,8 (0-102) años frente a 83,5 (0-104) años en los pacientes no cribados (p<0,05). Lo mismo sucedió en los pacientes a los que se realizó serología de VHC, con una mediana de edad de 72 (0-102) años frente a aquellos en los que no se realizó la serología, que presentaron una edad mediana de 83 (0-104) años (p<0,05).
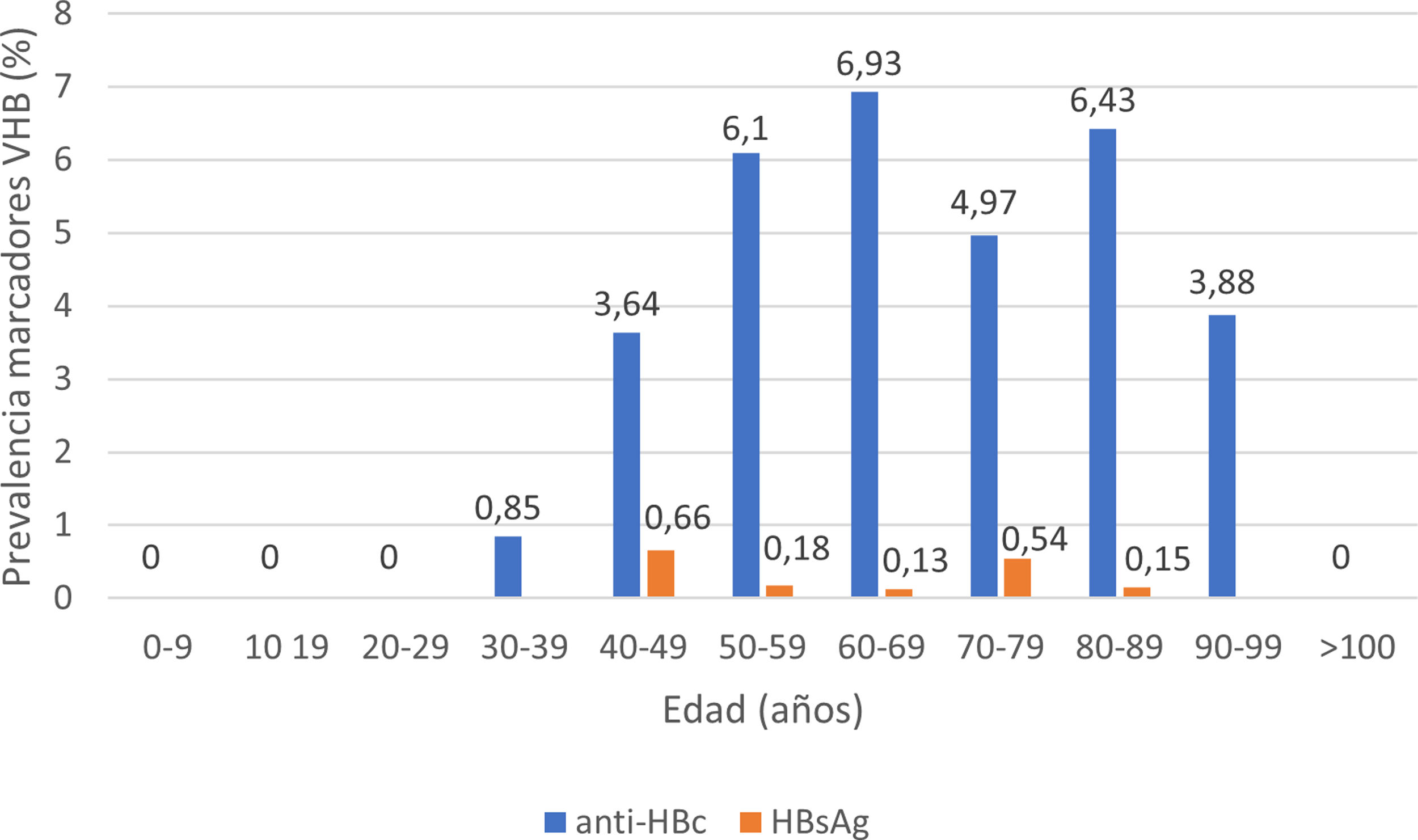
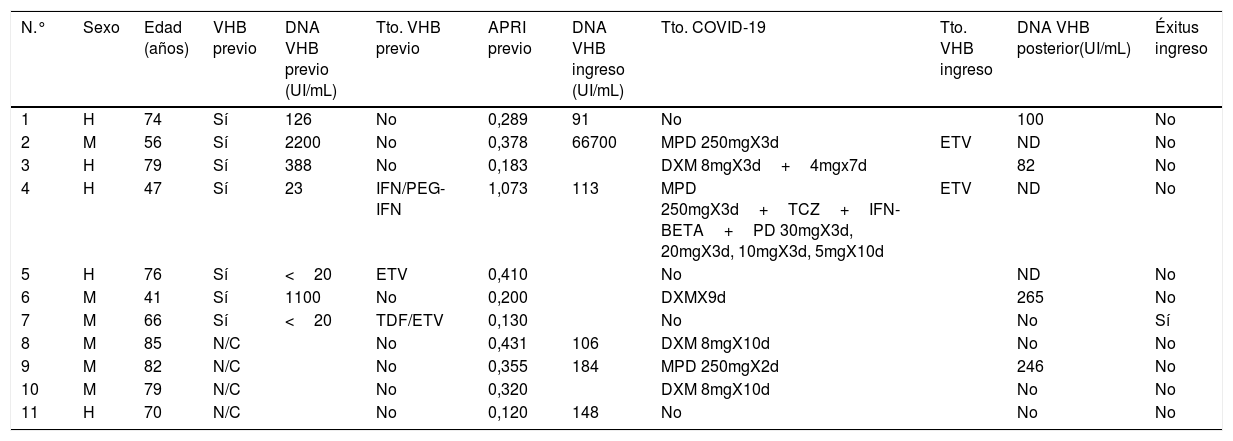
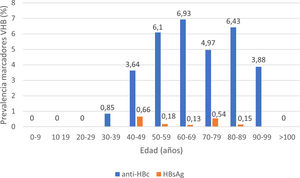
De los pacientes con datos sobre infección por VHB, 253 pacientes presentaron anticuerpos anti-HBc+y 11 pacientes HBsAg+, lo que indica una prevalencia de anti-HBc del 8,75% (IC95% 7,72-9,78) y de HBsAg del 0,38% (IC95% 0,15-0,60). La prevalencia de anti-HBc+y HBsAg+por grupos de edad se ilustra en la figura 3. De los 11 pacientes con infección activa por el VHB, solo 4 pacientes (el 36,4% de los pacientes con hepatitis B y el 0,14% del total de la cohorte) carecían de un diagnóstico previo de hepatitis B. La edad mediana de estos pacientes fue de 80 años, y ninguno de ellos mostró fibrosis significativa (todos tenían APRI <0,5). En la tabla 1 se muestran las características de los pacientes HBsAg+. Siete de los once pacientes HBsAg+(63,6%) recibieron dosis altas de corticoides durante el ingreso; de ellos solo uno recibió profilaxis con entecavir (14,2%) y otro (14,2%) inició tratamiento con entecavir posteriormente, debido a una reactivación leve (ADN VHB 69900 UI/ml).
Características de los pacientes HBsAg positivo
| N.° | Sexo | Edad (años) | VHB previo | DNA VHB previo (UI/mL) | Tto. VHB previo | APRI previo | DNA VHB ingreso (UI/mL) | Tto. COVID-19 | Tto. VHB ingreso | DNA VHB posterior(UI/mL) | Éxitus ingreso |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | 74 | Sí | 126 | No | 0,289 | 91 | No | 100 | No | |
| 2 | M | 56 | Sí | 2200 | No | 0,378 | 66700 | MPD 250mgX3d | ETV | ND | No |
| 3 | H | 79 | Sí | 388 | No | 0,183 | DXM 8mgX3d+4mgx7d | 82 | No | ||
| 4 | H | 47 | Sí | 23 | IFN/PEG-IFN | 1,073 | 113 | MPD 250mgX3d+TCZ+IFN-BETA+PD 30mgX3d, 20mgX3d, 10mgX3d, 5mgX10d | ETV | ND | No |
| 5 | H | 76 | Sí | <20 | ETV | 0,410 | No | ND | No | ||
| 6 | M | 41 | Sí | 1100 | No | 0,200 | DXMX9d | 265 | No | ||
| 7 | M | 66 | Sí | <20 | TDF/ETV | 0,130 | No | No | Sí | ||
| 8 | M | 85 | N/C | No | 0,431 | 106 | DXM 8mgX10d | No | No | ||
| 9 | M | 82 | N/C | No | 0,355 | 184 | MPD 250mgX2d | 246 | No | ||
| 10 | M | 79 | N/C | No | 0,320 | DXM 8mgX10d | No | No | |||
| 11 | H | 70 | N/C | No | 0,120 | 148 | No | No | No |
d: días; DXM: dexametasona; ETV: entecavir; H: hombre; IFN: interferón; IFN-PEG: interferón pegilado; M: mujer; MPD: metiprednisolona; N/C: no conocido; ND: no detectable; PD: prednisona; TCZ: tocilizumab; TDF: tenofovir; Tto.: tratamiento.
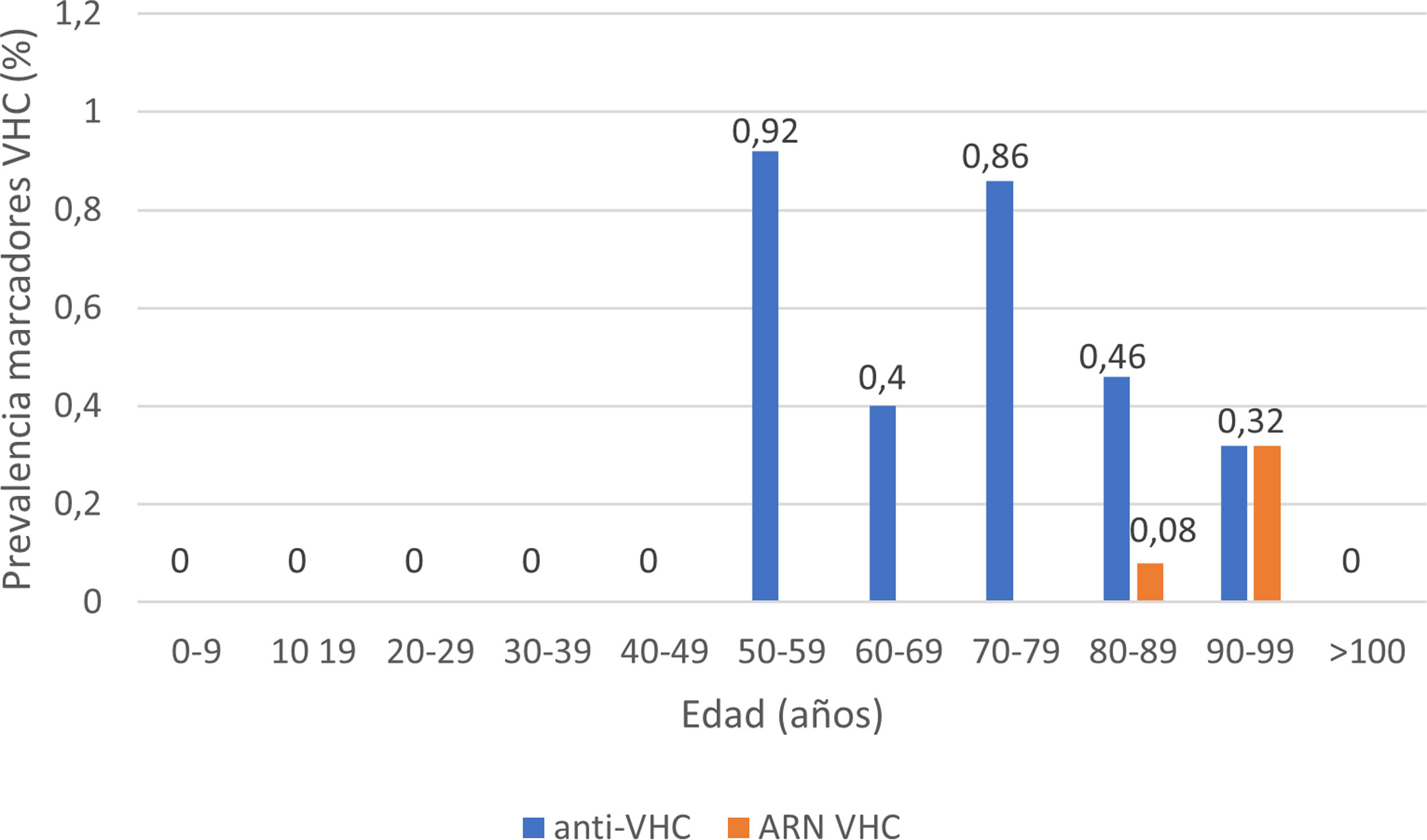
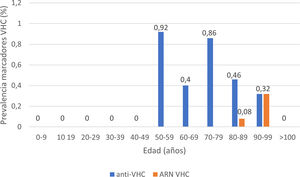
La serología de hepatitis C se realizó a 2895 (62%) pacientes; 24 presentaron anticuerpos anti-VHC+, con una prevalencia de 0,83% (IC95% 0,50-1,16). De ellos, 13 pacientes habían sido diagnosticados previamente de hepatitis C: 10 pacientes habían recibido tratamiento antiviral y presentaban RVS, un paciente había presentado curación espontánea y dos pacientes no habían recibido tratamiento debido a su avanzada edad en la época de los tratamientos basados en interferón. De los 11 pacientes con serología VHC+no conocida previamente (no referida por el paciente ni constatable en nuestro laboratorio), 10 presentaron ARN VHC no detectable. En total, solo 3 de los pacientes estudiados presentaron un ARN VHC+, por lo que la prevalencia de infección activa por el VHC fue de 0,10% (IC95% 0,04-0,30). La distribución de la prevalencia de anticuerpos anti-VHC+y de ARN VHC+por grupos de edad se muestra en la figura 4. De los tres pacientes con ARN VHC+, solo uno (33,3%) no había sido diagnosticado previamente de hepatitis C. Sin embargo, ninguno de los pacientes identificados en el cribado recibió tratamiento antiviral. Dos pacientes eran mayores de 90 años: el primero, con demencia y Charlson 8, falleció pocas semanas tras el alta; el otro, con arteriopatía periférica y Charlson 6, rechazó el tratamiento y el tercero falleció en el ingreso por COVID-19. Los datos de los pacientes anti-VHC+con o sin ARN VHC+se muestran en la tabla 2.
Características de los pacientes anti-VHC positivo
| N.° | Sexo | Edad (años) | Anti-VHC previo | ARN VHC previo | Tratamiento previo | RVS | APRI previo | FIB 4 previo | ARN VHC ingreso (UI/mL) | Tratamiento antiviral | Éxitus ingreso |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 55 | SI | + | INF-PEG+RBV | SI | 0,398 | 1,53 | N/D | No | No |
| 2 | H | 55 | SI | + | LDV/SOF+RVB | SI | 0,730 | 1,31 | N/D | No | No |
| 3 | H | 64 | SI | + | IFN-PEG+RVB | SI | 0,542 | 2,20 | N/D | No | No |
| 4 | H | 92 | SI | + | No | 0,973 | 3,40 | 190000 | No | No | |
| 5 | H | 62 | SI | + | SMP/SOF | SI | 0,266 | 1,36 | N/D | No | No |
| 6 | H | 57 | SI | + | GP/PBV | SI | 0,404 | 1,61 | N/D | No | No |
| 7 | H | 83 | SI | + | Otro centro | SI | N/D | No | No | ||
| 8 | H | 74 | SI | + | IFN, IFN-PEG+RBV | SI | 2,457 | 2,92 | N/D | No | No |
| 9 | H | 78 | SI | + | 3D | SI | 0,231 | 1,41 | N/D | No | No |
| 10 | M | 71 | SI | + | LDV/SOF | SI | 1,224 | 3,48 | N/D | No | No |
| 11 | H | 66 | SI | - | No | 0,160 | 1,07 | N/D | No | No | |
| 12 | H | 80 | SI | + | No | 0,620 | 3,28 | AG+89,71 | No | Sí | |
| 13 | H | 54 | SI | + | Otro centro | SI | 0,110 | 0,67 | N/D | No | No |
| 14 | H | 77 | N/C | N/C | No | 0,272 | 1,51 | N/D | No | No | |
| 15 | H | 91 | N/C | N/C | No | 0,187 | 1,20 | 17300 | No | No | |
| 16 | M | 85 | N/C | N/C | No | 0,209 | 1,25 | Muestra insuficiente | No | Sí | |
| 17 | H | 78 | N/C | N/C | N/C | N/D | No | Sí | |||
| 18 | H | 89 | N/C | N/C | No | 0,310 | 2,43 | N/D | No | No | |
| 19 | H | 89 | N/C | N/C | No | 0,120 | 1,13 | N/D | No | No | |
| 20 | H | 81 | N/C | N/C | No | 0,280 | 2,06 | N/D | No | No | |
| 21 | M | 72 | N/C | N/C | No | 0,150 | 0,89 | N/D | No | No | |
| 22 | H | 54 | N/C | N/C | No | 0,240 | 0,90 | N/D | No | No | |
| 23 | H | 76 | N/C | N/C | No | 0,130 | 0,71 | N/D | No | No | |
| 24 | H | 75 | N/C | N/C | No | 0,160 | 0,75 | N/D | No | No |
AG: antígeno; GP: glecaprevir; H: hombre; IFN: interferón; IFN-PEG: interferón pegilado; LDV: ledipasvir; M: mujer; N/C: no conocido; N/D: no detectable; PBV: pibrentasvir; RBV: ribavirina; RVS: respuesta viral sostenida; SMP: simeprevir; SOF: sofosbuvir; 3D: paritaprevir/ritonavir+ombitasvir+dasabuvir.
La AEEH, en su documento de posicionamiento para la eliminación del VHC de 2019, recomienda asociar distintos métodos de cribado, entre los que se incluye el cribado poblacional etario5, ya que distintos estudios recientes han demostrado que el cribado poblacional seguido de tratamiento del VHC es coste-efectivo en distintas franjas etarias y en la población general adulta9–11. Puesto que la encuesta nacional de seroprevalencia realizada por el Ministerio de Sanidad en 2017 y 2018 encontró que la prevalencia de infección por VHC es residual en personas menores de 40 años4, y que la máxima prevalencia de infección activa se concentra en el grupo de varones de entre 50-69 años, nuestra sociedad propuso el cribado poblacional en la franja de 40 a 70 años5, además de otras estrategias como el cribado basado en factores de riesgo de adquisición del VHC.
La pandemia COVID-19 supuso un enlentecimiento o incluso la parada de los programas de cribado del VHC a nivel mundial. Sin embargo, el alto número de ingresos hospitalarios derivados de la infección por SARS-CoV-2 nos planteó la posibilidad de realizar un cambio de estrategia, llevando a cabo un cribado oportunista de la infección por VHC en pacientes ingresados con COVID-19, ya que esta población podría presentar características favorables para la detección de casos de hepatitis C no conocidos. En primer lugar, la gran mayoría de los pacientes ingresados por complicaciones de la infección por SARS-CoV-2 son mayores de 50 años12,13. Por otra parte, la pandemia COVID-19 afecta por igual a personas con o sin factores de riesgo de infección por virus C y a todo tipo de colectivos12, incluyendo los vulnerables y los alejados del sistema sanitario (incluso se podría hipotetizar que más a estos últimos por las deficientes condiciones sanitarias), por lo que el ingreso por COVID-19 podría constituir una situación privilegiada de acercamiento del cribado a estos pacientes, que además iría inmediatamente ligado a la evaluación de su enfermedad y al tratamiento, al haber sido realizado durante la estancia en el propio centro hospitalario.
Aunque la patogenia de la infección por SARS-CoV-2 no se conoce aún con exactitud, en algunos pacientes se ha observado una respuesta inmune excesiva que ocasiona una inflamación pulmonar grave, por lo que en el tratamiento de esta condición se han utilizado fármacos inmunosupresores dirigidos a limitar el daño mediado por el sistema inmune14. Las alteraciones inmunes derivadas de la propia infección por el
SARS-CoV-2 así como el uso de fármacos inmunosupresores (corticoides, antagonistas de los receptores de IL-1 e IL-6 e inhibidores de la quinasa janus) suponen un riesgo de reactivación del VHB, lo cual ocasiona importante morbimortalidad15. El riesgo de reactivación del VHB depende tanto del estado de la infección (activa o pasada), como del tipo de fármacos inmunosupresores empleados, siendo máximo en pacientes con infección activa o pasada tratados con deplecionadores de linfocitos B como rituximab y en pacientes HBsAg+que reciben corticoides a altas dosis, antraciclinas o
anti-TNF-alfa16–18. Por lo tanto, con la excepción de los esteroides, el resto de fármacos inmunomoduladores utilizados en el tratamiento del COVID-19 grave, se consideran de bajo riesgo de reactivación, especialmente en los pacientes HBsAg negativo/anti-HBc positivo.
Por los motivos anteriormente señalados, y siguiendo el documento del Ministerio de Sanidad previamente citado8, se decidió incluir en el protocolo analítico realizado en el momento del ingreso hospitalario por infección COVID-19 la serología de los virus de la hepatitis B y C.
Nuestro estudio muestra algunos resultados que creemos que merece la pena destacar. En primer lugar, la prevalencia de infección por VHB es similar a la de otros estudios llevados a cabo en nuestro país2, pero la prevalencia de hepatitis C activa es menor que la previamente comunicada4,9,11. Esto podría explicarse por el importante envejecimiento de nuestra población de estudio, en la que los grupos de edad de teórica mayor prevalencia de infección por VHC (de 50 a 74 años), están infrarrepresentados con respecto a la población total de ingresados. Por otra parte, la baja prevalencia actual de infección activa por el VHC podría estar en relación con la alta tasa de tratamientos con AAD en España, especialmente en las personas con infección conocida por el VHC, como se desprende de los datos aportados por este estudio.
Destaca, sin embargo, el bajo porcentaje de pacientes previamente diagnosticados: solo el 54,2% de los pacientes con anticuerpos anti-VHC y el 63,6% de los pacientes HBsAg+tenían un diagnóstico previo de hepatitis viral o estaban en seguimiento en nuestros hospitales por este motivo. Sin embargo, el hecho de que en el grupo de pacientes con anticuerpos anti-VHC+no conocidos previamente en nuestros centros el porcentaje de pacientes virémicos fuera de 1/11 (9,1%) frente a 12/13 (92,3%) en los pacientes previamente diagnosticados, obliga a pensar que muchos de estos pacientes podrían haber sido estudiados e incluso tratados previamente en otros centros. Nuestros datos coinciden con los resultados de la encuesta nacional de seroprevalencia, en la que el 71% de los pacientes con infección activa actual por el VHC ya conocían el diagnóstico5, siendo en nuestro caso este porcentaje de un 66%.
Es interesante resaltar asimismo la elevada edad y en general la escasa afectación hepática de los pacientes con hepatitis B y C detectados en el programa de cribado. Esto, unido a las comorbilidades de los pacientes y a su propia decisión, condicionó que finalmente ninguno de ellos recibiera tratamiento antiviral tras el diagnóstico por el escaso beneficio que les hubiera supuesto la curación en el caso de la hepatitis C y por no cumplir los criterios para el tratamiento en el caso de la hepatitis B.
En cuanto a la infección por VHB, es de reseñar el escaso impacto en términos globales que tuvo el diagnóstico sobre el manejo real de los pacientes, ya que solo lo modificó en 2 casos de los 2915 cribados. La importancia relativa del diagnóstico aumenta de forma sustancial si nos centramos solo en los pacientes HBsAg+. De ellos, casi dos tercios recibieron tratamiento con corticoides a dosis altas durante el ingreso, y el diagnóstico de hepatitis B modificó el manejo en 2 de 7 pacientes. Llama la atención que solo en el 14,2% de los casos se indicó profilaxis de la reactivación del VHB. Esto explica que se produjese un caso de reactivación del VHB que, aunque leve, obligó a la paciente a recibir tratamiento posterior.
Las principales limitaciones de este estudio son: en primer lugar, la alta tasa de incumplimiento del protocolo de cribado dada la plena autonomía de los equipos COVID para la toma de decisiones y en segundo lugar, el envejecimiento de la población en nuestro medio, con una alta mediana de edad en los pacientes ingresados por complicaciones de la infección por COVID-19, lo cual ha podido infraestimar la verdadera prevalencia de infección en nuestra área. La fortaleza de nuestro estudio reside en el alto número de pacientes cribados, lo que proporciona una imagen bastante real de la situación actual en cuanto a la prevalencia de las hepatitis virales en nuestro medio y apoya las sugerencias de la guía de cribado de la infección por VHC del Ministerio de Sanidad de 2020, en la que no se recomienda el cribado en personas sin exposiciones de riesgo en base a la evidencia disponible19.
ConclusionesAunque el cribado oportunista de hepatitis C en los pacientes hospitalizados por COVID-19 puede constituir una buena oportunidad por la fácil unión del diagnóstico y tratamiento sin necesidad de implementar nuevos recursos, nuestros resultados sugieren una prevalencia de infección activa por VHC menor de la esperada en nuestro medio. La generalización de los tratamientos antivirales y la alta edad mediana de nuestra población limitan las posibilidades de detección de pacientes potencialmente tratables. El cribado de infección por VHB en este contexto debería dirigirse a prevenir la reactivación de la hepatitis B en pacientes que precisen tratamiento inmunosupresor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.