INTRODUCCION
Los adenomas son las neoplasias más frecuentes localizadas en el colon y el recto, con una prevalencia de hasta el 30-35% a partir de los 50 años1,2. En la actualidad está bien demostrado que la resección de estas lesiones y el seguimiento posterior mediante colonoscopia reducen el riesgo de desarrollar cáncer colorrectal (CCR)3-6. Es sabido que los pacientes con adenomas tienen una alta probabilidad de presentar adenomas metacrónicos y CCR. Por ello, todas las sociedades implicadas en la prevención de esta neoplasia recomiendan realizar un seguimiento de los pacientes que han presentado un adenoma colorrectal debido al elevado riesgo de desarrollar lesiones metacrónicas7-10. Esta circunstancia, junto con la aceptación de la colonoscopia como técnica de cribado en la población de riesgo intermedio (individuos mayores de 50 años, sin factores de riesgo personal o familiar) y elevado (con antecedentes familiares de CCR o neoplasias relaciona-das)10, ha incrementado la demanda de esta técnica endoscópica, lo que obliga a maximizar su efectividad con el fin de disminuir los costes, los riesgos y la sobreutilización de los recursos disponibles.
La periodicidad del control endoscópico tras la resección de adenomas viene determinada por el riesgo de desarrollar lesiones metacrónicas. Actualmente se sabe que determinadas situaciones incrementan este riesgo, como la presencia de 3 o más adenomas en la colonoscopia inicial, y la presencia de un adenoma avanzado (AA) o CCR11, por lo que a los pacientes con estas lesiones se les recomienda un intervalo entre colonoscopias más corto que en los que únicamente presentan 1-2 adenomas de bajo riesgo10.
Sin embargo, la información disponible respecto a la importancia relativa de los diferentes factores que definen al AA (tamaño $ 1 cm, componente velloso o presencia de displasia de alto grado [DAG]) es aún controvertida. El conocimiento de si alguna de estas características supone un riesgo adicional con respecto al resto sería de gran interés para lograr una mejor optimización de las estrategias de vigilancia. En este sentido, la DAG se ha definido como el marcador principal de transformación maligna del adenoma12, aunque se desconoce su valor predictivo en relación con el desarrollo de CCR o de AA en el subgrupo de pacientes con AA en la colonoscopia inicial.
El objetivo del presente estudio ha sido evaluar si la presencia de DAG se asocia con un mayor riesgo de desarrollar CCR o AA tras la polipectomía endoscópica en pacientes con AA. Si ello fuera así, el subgrupo de pacientes con DAG podrían ser tributarios de un seguimiento diferenciado del propuesto para el conjunto de pacientes con AA.
MATERIAL Y MÉTODOS
Se revisaron todos los pacientes atendidos en la Unidad de Endoscopia Digestiva del Hospital Clínic de Barcelona, durante el período comprendido entre enero de 1996 y diciembre de 1997. Se incluyeron todos los pacientes con AA (tamaño $ 1 cm, presencia de componente velloso o DAG) resecados completamente mediante polipectomía endoscópica. Se excluyó a los pacientes con historia personal de CCR o enfermedad inflamatoria intestinal, con historia familiar de poliposis adenomatosa familiar o CCR no asociado a poliposis, y los pacientes en que no se había llevado a cabo un adecuado control endoscópico tras la colonoscopia inicial.
A todos los pacientes se les efectuó un seguimiento en nuestro servicio mediante un protocolo de vigilancia común que contemplaba la realización de una nueva colonoscopia dentro de los primeros 3 años tras la colonoscopia inicial, y posteriormente cada 3-5 años, en función de los hallazgos de la exploración previa.
En la colonoscopia inicial se recogieron las siguientes variables: edad, sexo, indicación de la exploración, intubación cecal, y número total, tamaño y localización de los pólipos, adenomas, AA y AA con DAG detectados. La determinación del tamaño de las lesiones se efectuó mediante comparación con el tamaño de la pinza de biopsia abierta (6 mm) con el diámetro mayor del pólipo. Se consideraron proximales las lesiones localizadas en el ciego, ascendente y transverso, y distales las situadas en el colon descendente, el sigma y el recto.
En relación con las exploraciones realizadas durante el seguimiento, las variables recogidas fueron las siguientes: tiempo transcurrido desde la colonoscopia basal, e intubación cecal, así como el número total, el tamaño y localización de los pólipos, adenomas, AA y AA con DAG detectados, y presencia de CCR.
En los pacientes con más de una lesión, se consideró la más avanzada teniendo en cuenta la histología, el tamaño, el patrón glandular y el grado de displasia. Todos los adenomas fueron clasificados según la clasificación de la OMS13 en displasia de alto o bajo grado. Se definió como neoplasia colorrectal avanzada la presencia de un AA o CCR.
Análisis estadístico
Los pacientes fueron clasificados en 2 grupos en función de la presencia o no de DAG en la colonoscopia inicial. La comparación de las variables categóricas se realizaron mediante la prueba de la x2, mientras que para las variables continuas se utilizó la prueba de la U de Mann-Whitney. Para el cálculo de la probabilidad de desarrollar una neoplasia colorrectal avanzada durante el seguimiento se construyeron curvas por el método de Kaplan-Meier y se compararon mediante las pruebas de rangos logarítmico e índice de Breslow. Por último, se identificaron los parámetros basales asociados a la aparición de neoplasia colorrectal avanzada y metacrónica. Se consideró que una diferencia era estadísticamente significativa cuando alcanzaba un valor de p < 0,05. Todos los cálculos se efectuaron con el paquete estadístico SPSS 11.0.
RESULTADOS
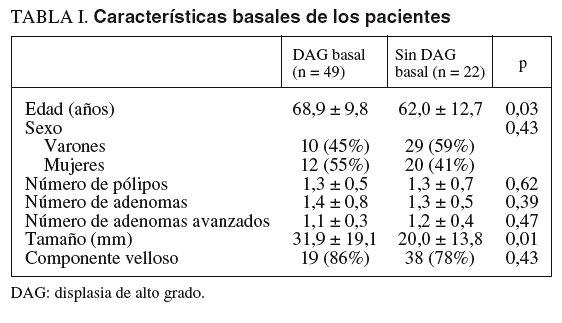
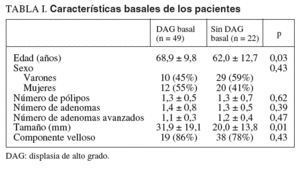
Durante el período de estudio, se registraron 189 pacientes en los que se diagnosticó la presencia de AA. De ellos, 71 cumplían los criterios de inclusión y se clasificaron en 2 grupos según la presencia (n = 49) o ausencia (n = 22) de DAG. La tabla I muestra las características basales de estos pacientes. No se encontraron diferencias significativas entre ambos grupos con relación al sexo, el número de pólipos, de adenomas, de AA, la presencia de componente velloso o la localización de las lesiones. Sin embargo, la edad (p = 0,03) y el tamaño de los AA (p = 0,01) fueron significativamente superiores en el grupo de pacientes con DAG.
No hubo diferencias en el tiempo de seguimiento de los pacientes con y sin DAG basal (56,5 ± 26,3 frente a 61,6 ± 27,8 meses, respectivamente; p = 0,41). De manera similar, el número de colonoscopias realizadas durante el seguimiento (3,1 ± 1,6 frente a 2,6 ± 1,5, respectivamente; p = 0,148), y el intervalo entre la colonoscopia basal y la primera exploración de control (20,2 ± 17,8 [rango, 3,2-92,2] frente a 26,6 ± 20,4 meses [rango, 1,4-101,5], respectivamente; p = 0,20) fue similar en ambos grupos.
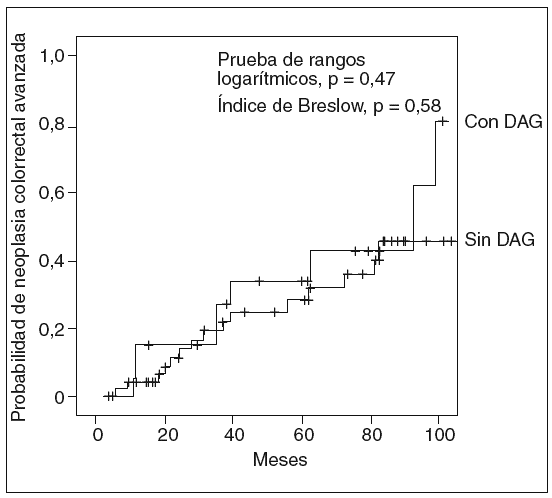
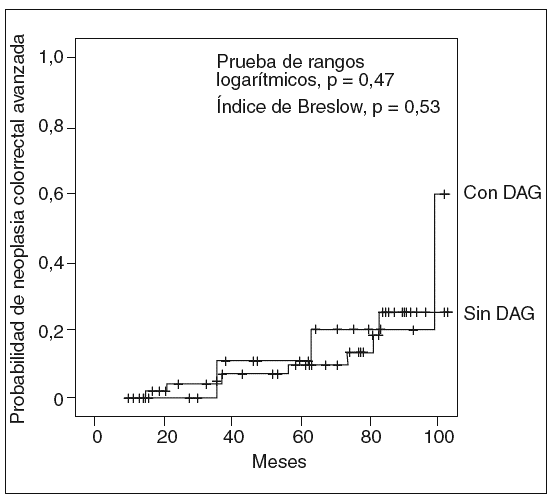
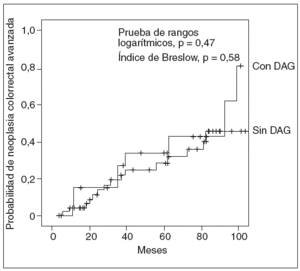
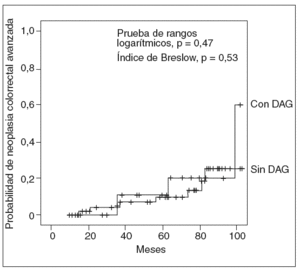
En la tabla II se comparan las lesiones metacrónicas detectadas en los pacientes con y sin DAG basal. Como se puede apreciar, no se detectaron diferencias en cuanto al número de pacientes que presentaron pólipos, adenomas, AA, AA con DAG, o CCR metacrónico, ni en relación con el número de estas lesiones, entre ambos grupos. La probabilidad de desarrollar una neoplasia colorrectal avanzada durante el seguimiento fue similar en ambos grupos (rango logarítmico, p = 0,47; índice de Breslow, p = 0,58) (fig. 1). Asimismo, tampoco se observaron diferencias en relación con la probabilidad de aparición de DAG (rango logarítmico, p = 0,47; índice de Breslow, p = 0,53) (fig. 2).
Fig. 1. Probabilidad de desarrollar una neoplasia colorrectal avanzada durante el seguimiento, en función de la presencia o ausencia de displasia de alto grado (DAG) en el adenoma avanzado detectado en la colonoscopia basal.
Fig. 2. Probabilidad de desarrollar una neoplasia colorrectal con displasia de alto grado (DAG) o cáncer colorrectal durante el seguimiento, en función de la presencia o ausencia de DAG en el adenoma avanzado detectado en la colonoscopia basal.
El desarrollo de neoplasia colorrectal avanzada durante el seguimiento no se asoció con ninguna de las características basales evaluadas (sexo [p = 0,33), edad [p = 0,08], tamaño [p = 0,82], localización proximal [p = 0,15], presencia de componente velloso [p = 0,50] o DAG [p = 0,47], número de pólipos [p = 0,76], de adenomas [p = 0,95] o de AA [p = 0,70] en la colonoscopia inicial).
DISCUSION
El valor predictivo de las características basales de los adenomas colorrectales, en relación con la aparición de lesiones metacrónicas tras su resección endoscópica, ha sido objeto de numerosos estudios. A partir de ellos, ha sido posible establecer que el número de adenomas, así como la presencia de AA, se asocian con un mayor riesgo de desarrollar una neoplasia colorrectal avanzada durante el seguimiento11. Sin embargo, es controvertido si la presencia de DAG comporta un incremento adicional de este riesgo en relación con los restantes AA, definidos exclusivamente en función del tamaño o a la presencia de componente velloso. Si ello fuera así, este subgrupo de pacientes sería tributario de una estrategia de vigilancia endoscópica más intensiva, diferenciada del resto de pacientes con AA. Según nuestros datos, el presente estudio supone la primera evaluación dirigida específicamente a establecer el valor predictivo de la presencia de DAG en pacientes con AA, en relación con el desarrollo de lesiones neoplásicas avanzadas durante el seguimiento. En este sentido, los resultados obtenidos sugieren que la presencia de DAG no supone un riesgo adicional en los pacientes con AA, por lo que no habría una base racional para modificar el intervalo de 3 años propuesto por la mayoría de guías de práctica clínica en esta situación clínica10.
Como se ha señalado anteriormente, todos los estudios publicados, que han tenido por objeto evaluar los factores predictivos de desarrollo de neoplasia colorrectal avanzada, metacrónica, se han realizado en el seno de una cohorte no seleccionada de pacientes con adenomas colorrectales, es decir, no restringida al grupo de pacientes con AA basal. De ellos, 5 estudios han evaluado la implicación de la presencia de DAG14-18. Así, Atkin et al14, en un estudio observacional que incluyó a 1.618 pacientes evaluados mediante rectosigmoidoscopia, observaron un incremento significativo de la incidencia de CCR en los pacientes con DAG respecto a los que presentaban adenomas sin DAG (odds ratio [OR] = 3,3; intervalo de confianza [IC] del 95%, 1,1-8,0; p = 0,01). En otro trabajo más reciente con un diseño similar, que incluyó más de 1.000 pacientes15, también se observó este incremento del riesgo (OR = 7,7; IC del 95%, 1,6-37,7; p = 0,01). Finalmente, los otros 3 estudios, 2 de ellos realizados en el seno de ensayos clínicos controlados16,17 y otro de cohortes18, han evaluado la DAG como posible predictor del desarrollo de neoplasia colorrectal avanzada durante el seguimiento, englobando en esta definición la aparición de CCR y AA. Mientras que ninguno de los 2 primeros identificó esta correlación (OR = 1,86; IC del 95%, 0,96-3,64, y OR = 2,50; IC del 95%, 0,45-13,73, respectivamente), en el estudio de cohortes ésta fue evidente (OR = 14,4; IC del 95%, 5,0-41,4; p < 0,001). Estas diferencias entre los distintos estudios pueden explicarse por su heterogeneidad con respecto al diseño, los criterios de inclusión, el tamaño muestral y el período de seguimiento.
Aunque en otros trabajos el tamaño de la lesión inicial superior a 1 cm14,18,19 y el patrón glandular velloso14,18,20 se han asociado con un incremento de neoplasia colorrectal avanzada y metacrónica, éste no ha sido el caso del presente estudio. Ello puede deberse a las características de la población evaluada, ya que al limitarse a los pacientes con AA, la mayoría de los pólipos eran mayores de 1 cm y presentaban un componente velloso. Por otro lado, algunos estudios han sugerido que la localización proximal de la lesión basal puede ser un factor de riesgo para el desarrollo de neoplasia avanzada durante el seguimiento. Esta circunstancia se ha evaluado en 2 estudios aleatorizados y controlados16,19 y en uno observacional15. Así, Bonithon-Kopp et al16 y Martínez et al19 hallaron una asociación entre la localización proximal del adenoma y la aparición de una neoplasia colorrectal avanzada y metacrónica (OR = 1,65; IC del 95%, 1,02-2,67, y OR = 2,63; IC del 95%, 1,31-5,3, respectivamente), mientras que no fue así en el de Bertario et al15 (OR = 0,7; IC del 95%, 0,1-7,6). A este respecto, conviene señalar que en el trabajo de Bonithon-Kopp et al16 también se encontró una asociación entre la localización proximal del adenoma y la presencia de adenomas múltiples en la colonoscopia de seguimiento, por lo que es posible que algunos de éstos no fueran lesiones incidentes sino adenomas no detectados en la colonoscopia inicial.
Es importante señalar que nuestro trabajo presenta algunas limitaciones. En primer lugar, las relacionadas con su diseño retrospectivo, si bien todas las variables han sido recogidas a partir del registro informatizado de nuestra Unidad, lo cual permite evitar o minimizar sesgos de selección. En segundo lugar, dado que el proceso de carcinogénesis colorrectal es lento, un período de seguimiento más prolongado podría aumentar la probabilidad de encontrar nuevas variables asociadas con el desarrollo de neoplasia avanzada metacrónica. Por último, dado el bajo número de pacientes incluidos, no podemos excluir que la ausencia de diferencias entre ambos grupos no se deba a una baja potencia estadística. No obstante, el exhaustivo análisis efectuado, teniendo en cuenta no tan sólo la aparición de CCR, sino también la de AA con o sin DAG durante el seguimiento, así como la evaluación cuantitativa del número de lesiones detectadas, va en contra de esta posibilidad.
En conclusión, los resultados del presente estudio sugieren que la presencia de DAG no supone un factor de riesgo adicional para el desarrollo de una neoplasia colorrectal avanzada, metacrónica, en los pacientes con AA. De confirmarse estos resultados, no habría una base racional para modificar el intervalo de seguimiento propuesto para el conjunto de estos pacientes, con independencia de que esta lesión haya sido categorizada como AA en función de su tamaño superior a 1 cm o la presencia de componente velloso o DAG.
AGRADECIMIENTOS
La realización del presente estudio ha sido posible gracias a las ayudas recibidas del Fondo de Investigación Sanitaria (PI 05/1285) y del Ministerio de Educación y Ciencia (SAF 04-07190). Francesc Balaguer disfruta de un contrato posformación sanitaria especializada del Instituto Carlos III y Victòria Gonzalo de un contrato de investigación del Hospital Clínic, Institut d'Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS).