La infección por el virus de la hepatitis B (VHB) continúa siendo un problema global de salud pública. La vacunación frente al VHB, introducida en España en la década de 1990, constituye el método más eficaz para reducir la incidencia de la enfermedad. No obstante, la migración procedente de países donde la prevalencia de la infección es alta contribuye a que en nuestro país la tasa esté aún entre el 0,5 y el 1%. El espectro de la enfermedad crónica ocasionada por el VHB es muy variable y abarca desde el portador inactivo a pacientes con hepatitis crónica, cirrosis y carcinoma hepatocelular. A pesar de que en los últimos años no se han producido grandes avances en el desarrollo clínico de nuevos fármacos para el tratamiento de la hepatitis B crónica, los cambios en la epidemiología, en el conocimiento de la historia natural, métodos diagnósticos e indicaciones de tratamiento aconsejan la actualización del documento de consenso de la Asociación Española para el Estudio del Hígado (AEEH) sobre el tratamiento de la infección por el VHB publicado en el año 2012. El documento de la AEEH revisa el tratamiento de la hepatitis B crónica y establece como mejor pauta la administración prolongada de un análogo de nucleós(t)ido con alta barrera genética a la resistencia (entecavir, tenofovir o tenofovir alafenamida). El interferón-pegilado constituye una alternativa en pacientes con enfermedad hepática poco avanzada, pero su aplicabilidad es limitada por su baja eficacia y efectos adversos frecuentes. En todos los pacientes se debe evaluar el riesgo de progresión a enfermedad hepática avanzada y de desarrollo de carcinoma hepatocelular. Determinados subgrupos de pacientes con infección crónica por VHB deben ser incluidos en programas de vigilancia para el diagnóstico precoz de carcinoma hepatocelular, que constituye en el momento actual la principal complicación de la enfermedad.
Hepatitis B virus (HBV) infection remains a global public health problem. HBV vaccination is the most effective tool to reduce the incidence of HBV disease. Despite there has not been new clinical developments for the treatment of chronic hepatitis B in the last few years, changing epidemiology and current insights on natural history, diagnostic tools and therapy indications make necessary an update of the former version of the consensus document of the Spanish Association for Study of the Liver on the treatment of hepatitis B infection published in 2012. The current document updates the management of chronic hepatitis B. The treatment of choice is the long-term administration of a nucleos(t)ide analogue with high barrier to resistance (entecavir, tenofovir or tenofovir alafenamide). Pegylated interferon may be an option in patients with non-advanced liver disease, but its applicability is limited due to the low efficacy and poor tolerability. All patients must be monitored for the risk of progression to advanced liver disease and development of hepatocellular carcinoma.
A pesar de que en los últimos años no se han producido grandes avances en el desarrollo clínico de nuevos fármacos para el tratamiento de la hepatitis B crónica, sí que han ocurrido cambios en la epidemiología, en el conocimiento de su historia natural, en los métodos diagnósticos y en las indicaciones de tratamiento, que aconsejan la actualización del documento de consenso de la Asociación Española para el Estudio del Hígado (AEEH) sobre el tratamiento de la infección por el virus de la hepatitis B (VHB) publicado en el año 20121. Para ello, la Junta Directiva de la AEEH ha encargado a un panel de expertos la revisión y actualización del documento, cuya versión final ha sido aprobada por dicha Junta.
Las recomendaciones de este documento se han basado en lo posible en la evidencia científica existente. Sin embargo, en los casos de información insuficiente o ausente, las recomendaciones se fundamentan en las opiniones y experiencia personal de los propios expertos. Las recomendaciones se han clasificado de acuerdo con un sistema de evaluación de la recomendación utilizado en diferentes guías y documentos de consenso2. La calidad de la evidencia científica se ha clasificado en 3 niveles: alto (A), moderado (B) o bajo (C). El sistema proporciona 2niveles de recomendación: sólida (1) o débil (2). Esto significa que a mayor nivel de evidencia más sólida es la recomendación, y viceversa.
Epidemiología a nivel mundial y en EspañaLa Organización Mundial de la Salud (OMS) estima en 257 millones el número de personas infectadas por el VHB en el mundo, lo que supone una prevalencia de alrededor del 3,5% de la población mundial. La prevalencia de la hepatitis B es más alta en la región del Pacífico occidental y en África, donde cerca del 6% de la población adulta está infectada. En las regiones del Mediterráneo oriental, Asia sudoriental y Europa, se estima que la prevalencia es del 3,3, 2,0 y 1,6%, respectivamente. El espectro de la enfermedad crónica es muy variable, y abarca desde el portador inactivo hasta pacientes con hepatitis crónica, cirrosis y carcinoma hepatocelular (CHC). De hecho, la OMS estima que en el año 2015 la hepatitis B causó 887.000 muertes, principalmente por cirrosis y CHC3.
España tradicionalmente se ha clasificado entre los países de endemicidad intermedia, definida por una prevalencia del antígeno de superficie del VHB (HBsAg) en la población general de entre el 2% y el 7%. Sin embargo, desde la introducción de la vacuna en el calendario de vacunaciones del Sistema Nacional de Salud en la década de 19904, con una cobertura vacunal por encima del 95%5, la incidencia de hepatitis B ha disminuido notablemente, pasando de 2 casos por 100.000 habitantes en 2002 a 1,27 casos en 2005. En 2008, sin embargo, hubo un repunte de un 25% en la incidencia hasta 2,27 casos por 100.000 habitantes en el contexto de un aumento del contagio por vía sexual y un aumento de la población migrante procedente de zonas de alta prevalencia6. A partir de 2008 se produjo un nuevo descenso de la incidencia que se mantiene hasta la actualidad, con tasas de contagio entre 1,27 y 1,65 casos por 100.000 habitantes. En la actualidad, España se sitúa entre los países de baja endemicidad, con prevalencia del HBsAg en torno al 0,5-0,8% de la población general7-9.
Otros factores, además de la vacunación, que contribuyen a disminuir la incidencia de la infección aguda son el control sistemático de las donaciones de sangre o el cribado serológico de las gestantes en el embarazo, así como otras actividades preventivas, de efectividad variable, dirigidas a evitar o limitar los comportamientos de alto riesgo, como el consumo de drogas por vía parenteral con material no desechable, las relaciones sexuales de riesgo sin preservativo, la exposición a tatuajes y piercing en condiciones no higiénicas o las actividades clínicas denominadas «procedimientos invasivos en condiciones no seguras».
En España, en 1995 se incluyó la hepatitis B entre las enfermedades de declaración obligatoria. La notificación se inició en 1997 con la declaración agregada semanal de casos de hepatitis aguda por las comunidades autónomas. En el año 2005 se añadió la declaración individualizada (variables demográficas, clínicas y de vacunación) remitida anualmente al Centro Nacional de Epidemiología. A partir de 2014 la declaración de casos se hace de forma individualizada con periodicidad semanal y se amplió la encuesta epidemiológica con variables de exposición y riesgo de infección. Además, cambió la definición de caso: desapareció el caso sospechoso y se notifica el caso probable y confirmado10. La tendencia de la tasa de notificación de casos en los últimos años es descendente, en gran parte debido al impacto de los programas de vacunación.
Recomendaciones:- •
Por tratarse de una enfermedad de declaración obligatoria, los casos de hepatitis B (probables o confirmados) deben remitirse al Centro Nacional de Epidemiología (A1).
- •
La mayoría de las personas infectadas por el VHB no va a presentar síntomas a lo largo de su evolución, por lo que se recomienda el cribado serológico en las poblaciones de riesgo (A1).
La hepatitis aguda B puede cursar con síntomas en la mitad de los casos y el 1% de las formas ictéricas puede evolucionar a hepatitis fulminante. Sin embargo, en los niños y jóvenes tiende a ser asintomática. La edad de adquisición de la infección es un factor que predice la evolución a la cronicidad: el 90% después de la infección perinatal, el 30% si se adquiere entre 1 y 5 años, e inferior al 5% en adultos inmunocompetentes.
La positividad del HBsAg durante más de 6 meses es el marcador característico de la infección crónica por el VHB. La hepatitis B crónica es un proceso dinámico, que resulta de la interacción entre la replicación del virus y la respuesta inmunológica del huésped11. Dado que es un virus no citopático y la lesión hepática se produce por la respuesta inmune del huésped, el incremento en el nivel de transaminasas, fundamentalmente ALT, es sugestivo de un proceso de inflamación hepática (hepatitis). Por el contrario, hay ocasiones en las que las cifras de transaminasas son normales y ello indica la presencia de infección sin inflamación y respuesta inmune escasa o ausente. Además, en los pacientes con hepatitis B crónica es importante la determinación del HBeAg y de su anticuerpo, anti-HBe, ya que las formas con HBeAg positivo o negativo tienen un comportamiento evolutivo diferente y su tratamiento puede ser distinto. También es imprescindible cuantificar la actividad replicativa del virus mediante la determinación de la concentración de ADN-VHB en el suero, para lo que se dispone de diversas técnicas, muy sensibles y precisas, basadas en procedimientos de biología molecular. Asimismo, es posible cuantificar el HBsAg en el suero, identificar el genotipo del virus y detectar la presencia de ciertas mutaciones en su genoma.
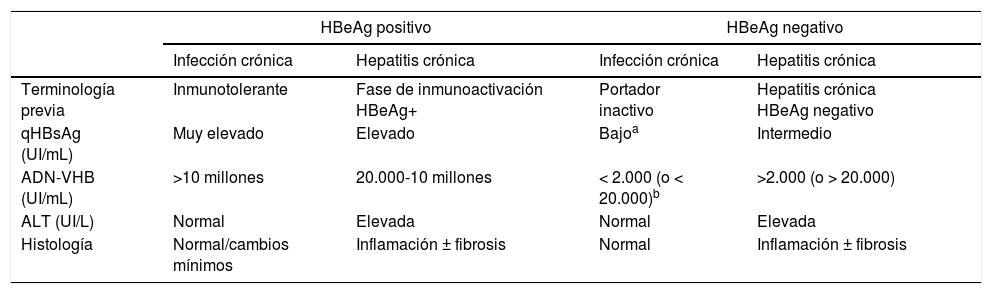
En su historia natural se pueden diferenciar 4 fases de infección activa, no necesariamente secuenciales (tabla 1), y una fase de curaciónfuncional:
- 1.
Fase de infección crónica HBeAg positivo (antes, de inmunotolerancia12). Se caracteriza por la presencia de HBeAg, niveles muy elevados de ADN-VHB, valores normales de ALT, actividad necroinflamatoria leve o hígado normal en la biopsia hepática y progresión lenta o nula de la fibrosis. Esta fase es típica de gente joven (<40 años) que ha adquirido el virus por transmisión vertical, cuando el sistema inmune está aún inmaduro. Esta fase puede durar 20 o 30 años, mientras que en los pacientes que adquieren la infección en la adolescencia o en la edad adulta es poco duradera. En esta fase la tasa de seroconversión espontánea, definida como la pérdida de HBeAg con desarrollo de anti-HBe, es muy baja. Estos pacientes son muy contagiosos, por presentar niveles muy elevados de carga viral.
- 2.
Fase de hepatitis crónica o actividad inmuneHBeAg positivo. Se caracteriza por la presencia de HBeAg, un descenso del nivel de ADN-VHB con respecto a los observados en la fase previa, unos valores de ALT elevados o fluctuantes y un aumento de la actividad histológica con progresión de la fibrosis. Esta fase aparece más rápidamente en personas infectadas en la edad adulta y su duración varía de semanas a años. La tasa anual de seroconversión espontánea del HBeAg (sin tratamiento antiviral) es del 1-20%. Los pacientes que permanecen durante años en esta fase, sobre todo si presentan brotes repetidos de necrosis, tienen riesgo de desarrollar cirrosis y CHC1,12.
- 3.
Fase de hepatitis crónica HBeAg negativo. En algunos pacientes con infección crónica por VHB la actividad inflamatoria persiste en ausencia de positividad del HBeAg. Este fenómeno se debe, en la mayoría de las ocasiones, a una infección por virus que presentan ciertas mutaciones del genoma que impiden que los hepatocitos infectados produzcan HBeAg. La hepatitis B crónica HBeAg negativo es muy frecuente en el área mediterránea y en Oriente, y constituye actualmente la forma más común de hepatitis B crónica en nuestro medio. En ocasiones se observan episodios de exacerbación, con aumento de los valores de ALT, precedidos por una elevación del nivel de ADN-VHB, que se siguen de periodos de remisión de duración variable. Estos episodios se asocian con progresión de la fibrosis. En los periodos de remisión, los niveles de ADN-VHB pueden ser bajos (inferiores a 2.000 UI/ml) y los valores de ALT normales, lo que simula una fase de portador inactivo o infección crónica con HBeAg negativo. Son necesarias, por tanto, las determinaciones frecuentes (cada 3-4 meses) de ALT y ADN-VHB durante al menos un año para categorizar bien a estos pacientes1,12.
- 4.
Fase de infección crónica HBeAg negativo (antes, portador inactivo). Se define por tener HBeAg negativo y anti-HBe positivo, valores de ALT persistentemente normales con niveles bajos de ADN-VHB (en general, inferiores a 2.000 UI/ml, aunque algunos pacientes presentan valores entre 2.000 y 20.000 UI/ml). La cuantificación de nivel de HBsAg (qHBsAg) puede ser útil para diferenciar esta fase de los pacientes en zona gris (ALT normal o <1,5 veces el límite superior de la normalidad con ADN-VHB oscilante >20.000 UI/ml). Los niveles de qHBsAg inferiores a 1.000 UI/ml son altamente sugestivos de infección crónica HBeAg negativo13,14. El pronóstico a largo plazo de los pacientes en esta fase, en general, es bueno15,16, si bien en ocasiones se producen reactivaciones de la infección con elevaciones del nivel de ADN-VHB y de ALT, por lo que es recomendable monitorizar estos parámetros al menos una vez al año. La pérdida de HBsAg con desarrollo de anti-HBs puede ocurrir de forma espontánea en el 1-3% de los casos anualmente, en general, tras varios años con niveles indetectables de ADN-VHB17.
- 5.
Fase de curación funcional tras la pérdida de HBsAg. Se define por HBsAg negativo con o sin anti-HBs, anti-HBc positivo y se caracteriza por valores normales de ALT y, por lo general, niveles indetectables de ADN-VHB en suero. No obstante, con frecuencia puede detectarse ADN covalente, circular y cerrado (ADNccc) en el hígado12. La pérdida de HBsAg en pacientes sin fibrosis avanzada se asocia con un riesgo mínimo de cirrosis, descompensación y CHC, y una mejoría en la supervivencia. Sin embargo, si la cirrosis se ha desarrollado antes de la pérdida de HBsAg, los pacientes siguen teniendo riesgo de desarrollar CHC. Es importante recordar que en esta fase y en contextos de inmunosupresión puede producirse la reactivación de la replicación del VHB18.
Resumen de las principales características de las fases de la infección crónica por el virus de la hepatitis B
| HBeAg positivo | HBeAg negativo | |||
|---|---|---|---|---|
| Infección crónica | Hepatitis crónica | Infección crónica | Hepatitis crónica | |
| Terminología previa | Inmunotolerante | Fase de inmunoactivación HBeAg+ | Portador inactivo | Hepatitis crónica HBeAg negativo |
| qHBsAg (UI/mL) | Muy elevado | Elevado | Bajoa | Intermedio |
| ADN-VHB (UI/mL) | >10 millones | 20.000-10 millones | < 2.000 (o < 20.000)b | >2.000 (o > 20.000) |
| ALT (UI/L) | Normal | Elevada | Normal | Elevada |
| Histología | Normal/cambios mínimos | Inflamación ± fibrosis | Normal | Inflamación ± fibrosis |
El riesgo de progresión a cirrosis y CHC es variable. La progresión a cirrosis es más frecuente en la hepatitis crónica HBeAg negativo (tasa anual de 8-10%) que en la hepatitis crónica HBeAg positivo (tasa anual de 2-5%). En pacientes con cirrosis compensada, la supervivencia a los 5 años es del 80-86% frente al 14-35% en pacientes con cirrosis descompensada19. Es importante recordar que, como en otras hepatitis crónicas, esta se asocia también al desarrollo de CHC.
Recomendación:- •
En la valoración inicial de un paciente con infección crónica por VHB es recomendable evaluar el estatus serológico y virológico (HBsAg o preferiblemente qHBsAg, HBeAg/anti-HBe y niveles de ADN-VHB), así como el grado de lesión hepática (ALT y métodos no invasivos de fibrosis) (A1).
La infección crónica por el VHB se diagnostica por la presencia en el suero del HBsAg durante un periodo superior a 6 meses. Se trata de un proceso dinámico asociado a cambios en la replicación del VHB y en la respuesta inmune del huésped; por ello, el espectro patológico es muy amplio e incluye desde pacientes sin lesión hepática o con lesiones hepáticas mínimas hasta pacientes con cirrosis hepática o CHC. Es necesario un diagnóstico preciso que permita conocer la fase de la historia natural en que se encuentra la enfermedad hepática para evaluar la capacidad de progresión, la necesidad de tratamiento y la pauta de seguimiento en los pacientes no tratados. En la mayoría de los pacientes, sobre todo los que tienen HBeAg negativo, es preciso un seguimiento durante 6-12 meses para conseguir una clasificación correcta.
El diagnóstico incluye la historia clínica, exploración física, parámetros bioquímicos, marcadores serológicos del VHB, determinación del ADN-VHB, ecografía abdominal, métodos no invasivos de evaluación de la fibrosis y biopsia hepática. Además, a todos los familiares de primer grado, las parejas sexuales y los convivientes de los pacientes con infección crónica por el VHB se les debe aconsejar la determinación de marcadores serológicos del VHB (HBsAg, anti-HBc y anti-HBs) y la vacunación si son negativos para todos los marcadores.
- •
Historia clínica. Se debe valorar la existencia de historia familiar de cirrosis o CHC, las manifestaciones extrahepáticas del VHB y las enfermedades asociadas del paciente, sobre todo las que forman parte del síndrome metabólico.
- •
Exploración física. Valorar los signos de las manifestaciones extrahepáticas del VHB y de la presencia de cirrosis hepática o hipertensión portal.
- •
Parámetros bioquímicos. La cifra de las transaminasas se relaciona con la actividad necroinflamatoria, pero los valores normales no descartan enfermedad hepática avanzada. Su determinación es útil en la decisión de tratamiento. El hemograma, la actividad de protrombina, la bilirrubina total y la albúmina sirven para evaluar la hipertensión portal y la gravedad de la afectación hepática.
- •
Marcadores del VHB. Incluyen:
- a)
HBeAg y anti-HBe. Son esenciales para identificar la fase de la infección crónica por VHB.
- b)
ADN-VHB. Su nivel indica la replicación del VHB. Se debe determinar con una técnica de alta sensibilidad y amplio rango dinámico, preferentemente de reacción en cadena polimerizada (PCR) en tiempo real. Es esencial para identificar la fase de la infección crónica por VHB, la decisión de tratamiento y el seguimiento de los pacientes.
- c)
Genotipo VHB. Aunque su análisis no es imprescindible, puede ser útil para seleccionar pacientes con alta probabilidad de respuesta al tratamiento con interferón (IFN) pegilado (PEG)1.
- d)
HBsAg cuantificado (qHBsAg). Su nivel refleja la cantidad y la actividad transcripcional del ADNccc localizado en el núcleo de los hepatocitos infectados por VHB, sobre todo en los pacientes con HBeAg positivo. Se determina mediante una técnica de enzimoinmunoanálisis y su nivel varía en función del genotipo del VHB, siendo más elevado en el genotipo A. En pacientes con HBeAg negativo no tratados, con ADN-VHB <2.000 UI/ml, valores de qHBsAg <1.000 UI/ml son indicativos de infección crónica (portador inactivo) con riesgo bajo de CHC, mientras que cifras de qHBsAg < 100 UI/ml se asocian con la pérdida espontánea del HBsAg. En pacientes tratados con IFN-PEG, los niveles de qHBsAg a las 12 y 24 semanas de tratamiento tienen un elevado valor predictor negativo de respuesta, por lo que son útiles como reglas de parada. Por otra parte, la monitorización del nivel de qHBsAg en pacientes tratados con análogos de nucleós(t)idos puede servir para estimar la duración necesaria del tratamiento para conseguir la pérdida del HBsAg y, sobre todo, para predecir la respuesta sostenida tras la suspensión del tratamiento. Aunque todavía no se ha establecido un valor de corte, un nivel <100 UI/ml parece predecir dicha respuesta sostenida. En los tratamientos futuros dirigidos a conseguir la curación funcional de la infección por VHB será esencial monitorizar el nivel de qHBsAg20.
- e)
Nuevos marcadoresdel VHB. El antígeno relacionado con el core del VHB (HBcrAg) se correlaciona con la actividad transcripcional del ADNccc, sobre todo en el paciente con HBeAg negativo. Se determina mediante una técnica de electroquimioluminiscencia. Aunque se necesitan más estudios, HBcrAg puede ser superior al qHBsAg para identificar pacientes con infección crónica HBeAg negativo (portador inactivo) con independencia del genotipo y para predecir la recidiva viral tras la suspensión del tratamiento con análogos21,22. El ARN-VHB circulante es el mejor indicador de la actividad transcripcional del ADNccc. No existen todavía ensayos estandarizados para su determinación. Puede predecir la recidiva viral tras la suspensión del tratamiento con análogos23.
- •
Enfermedades asociadas. Se debe descartar la presencia de enfermedad hepática de etiología autoinmune, metabólica, por alcohol o la enfermedad por depósito de grasa no alcohólica, así como las coinfecciones con los virus de la hepatitis D (VHD), C (VHC) y virus de la inmunodeficiencia humana (VIH). Se debe determinar el anticuerpo de clase IgG frente al virus de la hepatitis A (anti-VHA IgG) y si es negativo se debe recomendar la vacunación contra dicho virus.
- •
Ecografía abdominal. Es útil para identificar la presencia de signos de cirrosis hepática y de hipertensión portal, así como para el diagnóstico de CHC. No obstante, la ausencia de alteraciones ecográficas no excluye la enfermedad hepática avanzada1.
- •
Métodos no invasivos de evaluación de la fibrosis hepática.
- -
Elastometría hepática. En pacientes con infección crónica por VHB la medida de la rigidez hepática es útil para valorar la presencia de fibrosis significativa o de hepatopatía crónica avanzada o de cirrosis. En pacientes con infección crónica y HBeAg negativo (portador inactivo) el valor de la elastometría es similar al de los controles normales24. Un metaanálisis reciente concluyó que la precisión diagnóstica de la elastometría es superior para excluir que para confirmar la enfermedad hepática y que es mayor para el diagnóstico de cirrosis. Los valores de corte diagnósticos fueron muy variables en los diferentes estudios con medianas de 7,2kPa para fibrosis significativa (F2-F4) y de 12,4kPa para cirrosis (F4)25. El uso de 2valores de corte mejora el rendimiento diagnóstico, asumiendo la presencia de una zona gris entre ambos valores que requiere estudio posterior. Los valores de corte recomendados son ≤6,2kPa y >9,4kPa para fibrosis significativa; ≤9,4kPa y >13,1kPa para cirrosis26. Los valores de la elastometría aumentan en pacientes con marcada inflamación hepática, que se refleja en un nivel elevado de transaminasas y, por ello, no se recomienda la elastometría con nivel de ALT superior a 5 veces el valor normal. Se ha propuesto elevar los valores de corte diagnósticos en pacientes con ALT entre 1 y 5 veces el valor superior de la normalidad, si bien esta estrategia no mejora el rendimiento diagnóstico24.
- -
Biomarcadores. En los últimos años se han desarrollado varios biomarcadores como alternativa a la biopsia hepática para valorar la fibrosis hepática. APRI y FIB-4 no son adecuados para su uso en hepatitis B crónica por su precisión diagnóstica moderada y gran solapamiento27,28. En un estudio reciente, un nivel de corte de FIB-4 <0,70 descartó la presencia de cirrosis en el 97% de los casos con edad superior a 30 años29. Estudios asiáticos han señalado que RPR (cociente RDW/plaquetas; RDW= amplitud de distribución eritrocitaria) es superior a APRI y FIB-4 para predecir fibrosis significativa y cirrosis; y que GPR (cociente GGT/plaquetas) es superior al resto de los biomarcadores, incluido RPR, para predecir fibrosis avanzada (F3-F4), sobre todo en pacientes con HBeAg negativo con actividad necroinflamatoria relevante (A3-A4)30,31. Sin embargo, en otro metaanálisis reciente la precisión diagnóstica de GPR fue moderada y similar a la de FIB-428. Es necesario validar estos resultados en población caucásica antes de recomendar su uso.
- •
Biopsia hepática. No es imprescindible en la mayoría de los casos para establecer el diagnóstico ni para la decisión del tratamiento. Es útil en los casos con enfermedades asociadas para evaluar la importancia de cada una de ellas al considerar el tratamiento y en los casos en los que el valor de la elastometría se encuentre en la zona gris.
Recomendaciones:
- •
Es necesario un diagnóstico preciso que permita conocer la fase de la historia natural en que se encuentra la enfermedad hepática, basado en la determinación de HBeAg, anti-HBe, ADN-VHB y ALT (A1).
- •
La determinación de qHBsAg es útil para el diagnóstico de la infección crónica HBeAg negativo (B1).
- •
La elastometría hepática es el método no invasivo de elección para valorar la lesión hepática por su mayor precisión diagnóstica, sobre todo para descartar fibrosis avanzada (A1).
- •
Los biomarcadores parecen tener menor precisión diagnóstica, por lo que se necesitan más estudios para ampliar su uso (B1).
- •
La ecografía es útil para establecer el diagnóstico de cirrosis hepática y CHC (A1).
- •
La biopsia hepática está indicada en pacientes con enfermedades hepáticas asociadas y en los que el valor de la elastometría se encuentre en la zona gris (B1).
Con los fármacos de los que se dispone actualmente no es posible la erradicación de la infección por VHB, debido a la persistencia de ADNccc en el núcleo de los hepatocitos. Por ello, el objetivo final del tratamiento en pacientes con hepatitis B crónica es mejorar la supervivencia, evitar la progresión de la enfermedad e impedir el desarrollo de descompensación hepática, CHC y muerte o la necesidad de trasplante hepático. Dado que estos eventos ocurren generalmente a largo plazo, se han establecido unos objetivos intermedios que se utilizan como medida indirecta de la eficacia del tratamiento y que son los siguientes:
- •
Inhibición mantenida de la replicación viral.
- •
Negativización del HBeAg, con o sin seroconversión a anti-HBe, en pacientes con hepatitis B crónica y HBeAg positivo.
- •
Normalización de los valores de ALT.
- •
Pérdida del HBsAg, con o sin desarrollo de anti-HBs, lo que se entiende como curación funcional o resolución de la infección. Este sería el objetivo ideal y es el punto más próximo a la curación de la infección que se puede alcanzar en el momento actual, aunque desafortunadamente solo se consigue en una pequeña proporción de pacientes.
- •
Otros objetivos del tratamiento de la infección por el VHB son:
- ∘
Evitar la transmisión vertical del virus en mujeres embarazadas.
- ∘
Evitar la reactivación del virus en pacientes que reciben tratamiento inmunosupresor o que precisen tratamiento para la hepatitis C crónica.
- ∘
Reducir el riesgo de desarrollo de CHC en pacientes con antecedentes familiares del tumor en relación con el VHB.
- ∘
Evitar la progresión a insuficiencia hepática aguda en pacientes con hepatitis aguda B grave y evitar la necesidad de trasplante hepático en aquellos con insuficiencia hepática aguda.
- ∘
Reducir el riesgo de recidiva de la infección tras el trasplante hepático.
- ∘
Reducir el riesgo de recurrencia del tumor en pacientes con CHC.
- ∘
Controlar o revertir las manifestaciones sistémicas ocasionadas por el VHB.
La indicación de tratamiento es la misma para los individuos con hepatitis crónica HBeAg positivo y HBeAg negativo, y debe basarse en la evaluación de los siguientes parámetros:
- -
Valores de ALT.
- -
Niveles de ADN-VHB.
- -
Lesión hepática valorada por biopsia hepática o métodos no invasivos.
El tratamiento está indicado si se cumplen al menos 2de los 3criterios siguientes: valor de ALT elevado, nivel de ADN-VHB superior a 2.000 UI/ml y presencia de al menos actividad necroinflamatoria o fibrosis moderada (grado A ≥ 2 o estadio F ≥ 2 en la escala Metavir)1,32-34. Los valores de ALT se definen como elevados si son superiores al límite de normalidad del laboratorio, que usualmente es inferior para las mujeres que para los varones. La Asociación Americana para el Estudio de las Enfermedades Hepáticas, en sus recomendaciones, considera límites más bajos para el valor normal de ALT (35 U/L para los varones y 25 U/L para las mujeres); sin embargo, la evidencia científica más amplia está basada en los valores usuales de laboratorio34. En los pacientes con valor normal de ALT y nivel de ADN-VHB superior a 2.000 UI/ml, la gravedad de la lesión hepática determinará la indicación de tratamiento, mientras que en aquellos con ALT >2 veces el límite superior de la normalidad y ADN-VHB >20.000 UI/ml se puede iniciar el tratamiento independientemente de la lesión hepática. Como norma general, en todos los individuos con hepatitis B crónica, tanto HBeAg positivo como negativo, está indicado el tratamiento, mientras que en los casos de infección crónica sin lesión hepática la recomendación general es seguirlos periódicamente e individualizar el tratamiento en casos especiales.
En los casos de hepatitis crónica HBeAg positivo de diagnóstico reciente, el tratamiento debe retrasarse al menos 3 meses para dar una opción a la seroconversión espontánea del HBeAg. En los sujetos con infección crónica y HBeAg positivo (anteriormente fase de tolerancia inmune) menores de 30 años, sin otros datos de enfermedad hepática ni historia familiar de CHC y con marcadores no invasivos indicativos de ausencia de fibrosis avanzada, no está indicada la biopsia hepática ni el inicio del tratamiento. Estos individuos deben ser seguidos cada 3-6 meses y la realización de biopsia hepática o indicación de tratamiento se deben establecer cuando se eleven los valores de ALT o cuando superen los 30 años de edad. En los pacientes con infección crónica y HBeAg positivo, los antivirales orales son capaces de reducir la replicación viral, pero la posibilidad de eliminación del HBeAg y del HBsAg es prácticamente nula a pesar del tratamiento prolongado, por lo que es preferible observarlos y hacer controles periódicos. En los sujetos con HBeAg positivo que presentan manifestaciones extrahepáticas, como la poliarteritis nodosa o la glomerulonefritis membranosa, a menudo la cifra de ALT es normal, la concentración de ADN-VHB está elevada y no presentan lesión hepática. En estos casos, el tratamiento está indicado porque mejora las manifestaciones extrahepáticas.
En los pacientes con lesión hepática leve (A1F1 en la escala Metavir) el seguimiento es obligatorio y se puede considerar el tratamiento de forma individualizada. En los pacientes con cirrosis compensada se debe iniciar el tratamiento cuando la viremia es detectable, independientemente del nivel de ADN-VHB y de ALT.
Los pacientes con CHC deben ser tratados con análogos de nucleós(t)idos de la misma manera que los pacientes con cirrosis descompensada, ya que se ha demostrado que el tratamiento reduce el riesgo de recurrencia del CHC y mejora el pronóstico de la enfermedad hepática35,36. Por otra parte, en los pacientes con antecedente familiar de CHC debe considerarse el tratamiento, aunque no cumplan los criterios antes reseñados, con el objetivo de disminuir el riesgo de desarrollo de CHC12.
Los pacientes con HBsAg positivo coinfectados por el VHC que vayan a ser tratados con antivirales directos para la hepatitis C y sin indicación de tratamiento para la hepatitis B deben ser controlados estrechamente (ADN-VHB y ALT). Si se considera la profilaxis, recibirán un análogo de nucleós(t)ido durante el periodo de tratamiento de la hepatitis C y hasta 12 semanas después de su finalización12,37,38.
Recomendaciones:- 1.
En los individuos con hepatitis B crónica, el tratamiento está indicado si la cifra de ALT está elevada, el nivel de ADN-VHB es superior a 2.000 UI/ml y/o existe al menos actividad necroinflamatoria y/o fibrosis moderadas (A1).
- 2.
Los pacientes con cirrosis hepática compensada deben ser tratados si el ADN-VHB es detectable, aunque el valor de ALT sea normal (A1).
- 3.
Los pacientes con cirrosis descompensada deben ser tratados sin demora, independientemente del nivel de ADN-VHB y de los valores de ALT, con análogos de nucleós(t)idos potentes (A1).
- 4.
Los pacientes con historia familiar de CHC o manifestaciones extrahepáticas pueden recibir tratamiento aunque no cumplan todos los criterios (B2).
- 5.
Los pacientes con hepatitis B crónica que no reciben tratamiento deben ser seguidos cada 6 meses (A1).
Existen 2tipos de fármacos aprobados para el tratamiento hepatitis B crónica los análogos de nucleós(t)idos (lamivudina [LAM], adefovir dipivoxil [ADV], entecavir [ETV], telbivudina [TBV] y los 2profármacos de tenofovir: tenofovir disoproxil fumarato [TDF] y tenofovir alafenamida [TAF]) y los IFN convencionales α-2a y α-2b y la forma pegilada del α-2a (IFN-PEG α-2a). Entre los análogos, el uso de LAM, ADV y TBV no está recomendado actualmente debido a su baja barrera genética a la resistencia1, mientras que entre los IFN, la forma pegilada ha sustituido a la convencional por la mayor comodidad de administración (una dosis semanal en lugar de 3dosis por semana), mayor eficacia y mejor tolerancia1.
Tratamiento con análogos de nucleós(t)idosLos recomendados son ETV, TDF y TAF debido a su alta potencia antiviral y elevada barrera a la resistencia. Las principales ventajas del tratamiento con análogos son la administración oral, la elevada eficacia en la inhibición de la replicación del VHB, la seguridad a largo plazo y la posibilidad de ser usados en cualquier situación, incluyendo la cirrosis descompensada y el trasplante hepático o durante el embarazo en el caso del TDF. Por el contrario, el principal inconveniente de su uso es la necesidad de un tratamiento prolongado, cuya duración es inicialmente indefinida (tabla 2). La inhibición de la replicación viral que se obtiene con el tratamiento con análogos mejora significativamente el daño necroinflamatorio y la fibrosis hepática, pudiendo incluso conseguir la reversión de la cirrosis39,40. Como consecuencia de lo anterior, el tratamiento con análogos reduce el riesgo de complicaciones de la enfermedad hepática41,42 y aumenta la supervivencia, haciéndola similar a la de la población general43. Además, en aquellos pacientes en los que el tratamiento consigue negativizar el HBsAg se obtiene un beneficio clínico adicional al conseguido con la inhibición de la replicación viral44,45.
Ventajas e inconvenientes del tratamiento con análogos de nucleós(t)idos o interferón pegilado
| Análogos de nucleos(t)idos | Interferón pegilado | |
|---|---|---|
| Duración del tratamiento | Indefinida | Limitada (12 meses) |
| Vía de administración | Oral | Subcutánea |
| Actividad antiviral | Potente | Modesta |
| Desarrollo de resistencia | Extremadamente infrecuente | Nunca |
| Pérdida de HBeAg y HBsAg | Infrecuente | Modesta, genotipo-dependiente |
| Efectos adversos | Excepcionales | Frecuentes |
| Seguridad en el embarazo | TDF: clase B | Clase C |
| Contraindicaciones | Ninguna | Frecuentes |
La formulación aprobada en la hepatitis B crónica es IFN-PEG α-2a. Teóricamente, el IFN tiene la ventaja de su doble actividad, antiviral e inmunoestimulante, por lo que con su uso se persigue inducir un control inmunológico persistente de la infección, a través de un tratamiento con una duración limitada. Como consecuencia, las tasas de negativización del HBeAg y del HBsAg que se obtienen con IFN-PEG son superiores a las obtenidas con análogos. Sin embargo, sus inconvenientes son numerosos: administración subcutánea semanal, actividad antiviral modesta, efectos adversos muy frecuentes y un número elevado de contraindicaciones (tabla 2), que restringen notablemente su uso y que han hecho que durante los últimos años esta opción terapéutica haya perdido gran parte de su papel en el tratamiento de la hepatitis B crónica. No obstante, la respuesta sostenida tras la interrupción del tratamiento se acompaña de una mejoría histológica, un descenso en el riesgo de desarrollar complicaciones de la enfermedad hepática y un aumento de la supervivencia global1.
Teóricamente, la combinación de un análogo y IFN-PEG podría tener efectos sinérgicos, por lo que se han ensayado diversas estrategias de combinación, incluyendo tratamiento combinado inicial, adición de IFN-PEG tras un periodo de tratamiento con análogo y cambio de análogo a IFN-PEG. Aunque un estudio que comparó la combinación de novo de IFN-PEG más TDF con la monoterapia de ambos fármacos mostró una mayor tasa de negativización del HBsAg con el tratamiento combinado, este efecto beneficioso fue modesto y se limitó a pacientes infectados por el genotipo A46. Otro estudio reciente no mostró beneficio del tratamiento secuencial con un análogo seguido de IFN-PEG sobre la monoterapia47. Por tanto, no existen evidencias en el momento actual que sustenten esta estrategia frente a la monoterapia12,34.
Recomendaciones:- 1.
El tratamiento inicial de la hepatitis B crónica, tanto HBeAg positivo como negativo, se basa en la monoterapia con un análogo de nucleós(t)ido o con IFN-PEG (A1).
- 2.
La elección de una u otra estrategia dependerá del estadio de fibrosis hepática, de factores virológicos, del perfil de comorbilidades del paciente, así como de sus preferencias (B1).
La respuesta al tratamiento antiviral se clasifica en virológica, serológica, bioquímica e histológica. La respuesta puede ser evaluada en distintos momentos durante y tras el tratamiento. Las definiciones de respuesta virológica varían en función de la estrategia terapéutica utilizada.
Tipos de respuesta virológica- •
Tratamiento con análogos
- ∘
Respuesta virológica durante el tratamiento: negativización del ADN-VHB durante el tratamiento, determinado mediante una técnica sensible de PCR, con un límite de detección de 10 UI/ml.
- ∘
Respuesta virológica parcial durante el tratamiento: descenso del ADN-VHB mayor de 1 log10, pero aún detectable al cabo de 12 meses de tratamiento en pacientes con buen cumplimiento terapéutico.
- ∘
Rebote virológico durante el tratamiento: aumento del nivel de ADN-VHB superior a 1 log10 UI/ml con respecto al valor más bajo obtenido durante el tratamiento y que debe ser confirmado en una segunda determinación realizada con un mes de diferencia respecto a la primera. La causa más frecuente de rebote virológico cuando se utilizan ETV, TDF o TAF es el mal cumplimiento terapéutico. En pacientes con buen cumplimiento que presentan un rebote virológico debe investigarse la posibilidad de desarrollo de resistencias, aunque el riesgo es extremadamente bajo con los análogos recomendados en la actualidad. El rebote virológico suele ir seguido de un rebote bioquímico, definido como una elevación de ALT durante el tratamiento en un paciente que había alcanzado una respuesta bioquímica inicial.
- ∘
Respuesta virológica sostenida tras tratamiento: cifras de ADN-VHB inferiores a 2.000 UI/ml durante al menos 12 meses tras la interrupción del tratamiento.
- •
Tratamiento con interferón pegilado
- ∘
Respuesta virológica durante el tratamiento: ADN-VHB inferior a 2.000 UI/ml al 6.° mes de tratamiento y a su finalización.
- ∘
Respuesta virológica sostenida tras tratamiento: cifras de ADN-VHB inferiores a 2.000 UI/ml durante al menos 12 meses tras la finalización del tratamiento.
- •
Respuesta serológica en hepatitis crónica HBeAg positivo: negativización del HBeAg y desarrollo de anti-HBe. En pacientes tratados con IFN-PEG esta respuesta puede aparecer hasta 6 meses después de finalizado el tratamiento.
- •
Resolución de la infección o curación funcional: negativización del HBsAg, confirmado en una segunda determinación, con o sin desarrollo de anti-HBs.
Normalización del nivel de ALT, considerando normales los valores tradicionales (∼40 UI/L).
Respuesta histológicaClásicamente se ha definido por un descenso en la actividad necroinflamatoria (≥2 puntos en el índice de actividad histológica o en el sistema de Ishak), sin aumento de la fibrosis hepática comparado con los hallazgos histológicos pretratamiento. No obstante, en el momento actual las biopsias hepáticas antes y después del tratamiento no están justificada en la mayoría de los pacientes.
Recaída tras la interrupción del tratamiento con análogos- ∘
Recaída virológica. Aunque no está claramente definida, el criterio más aceptado es la presencia de niveles de ADN-VHB superiores a 2.000 UI/ml tras la interrupción del tratamiento.
- ∘
Recaída clínica. Se define por la combinación de recaída virológica y de ALT por encima de 2veces los valores normales. La recaída clínica se puede considerar mantenida cuando estos criterios persisten durante más de 3-6 meses y grave cuando el nivel de ALT es superior a 10 veces el normal en 2controles consecutivos, cuando un valor entre 5 y 10 veces el normal se mantiene durante un mes o más o cuando, siendo superior a la normalidad, se acompaña de aumento en la cifra de bilirrubina directa >1,5mg/dl o del INR ≥ 0,5 con respecto al valor basal.
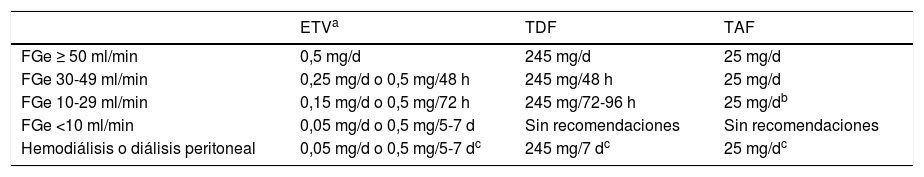
Los análogos recomendados son ETV, TDF y TAF. ETV es un ciclopentano que se administra por vía oral a la dosis de 0,5mg/día (1mg/día en caso de resistencia a LAM, aunque ETV no es el análogo de elección en esta circunstancia). TDF es un análogo de nucleótido que se administra por vía oral a la dosis de 245mg/día, mientras que TAF es también un análogo de nucleótido cuya dosis oral diaria es de 25mg. Este último fue aprobado para el tratamiento de la hepatitis B por la Agencia Europea del Medicamento en enero de 2017, por lo que la experiencia con su uso es más corta que con los otros 2análogos. En febrero de 2020, TAF no está financiado por el sistema sanitario público español para el tratamiento de la hepatitis B, aunque sí lo está en combinación con otros antivirales para el tratamiento de la infección por VIH. Por otra parte, se dispone de formulaciones genéricas de ETV y TDF. Debido a su eliminación renal, las dosis de ETV y TDF deben ser ajustadas cuando el filtrado glomerular estimado (FGe) es <50ml/min, mientras que no es necesario hacerlo cuando se usa TAF (tabla 3).
Ajuste de dosis de ETV, TDF y TAF en función del filtrado glomerular estimado (FGe)
| ETVa | TDF | TAF | |
|---|---|---|---|
| FGe ≥ 50 ml/min | 0,5 mg/d | 245 mg/d | 25 mg/d |
| FGe 30-49 ml/min | 0,25 mg/d o 0,5 mg/48 h | 245 mg/48 h | 25 mg/d |
| FGe 10-29 ml/min | 0,15 mg/d o 0,5 mg/72 h | 245 mg/72-96 h | 25 mg/db |
| FGe <10 ml/min | 0,05 mg/d o 0,5 mg/5-7 d | Sin recomendaciones | Sin recomendaciones |
| Hemodiálisis o diálisis peritoneal | 0,05 mg/d o 0,5 mg/5-7 dc | 245 mg/7 dc | 25 mg/dc |
FGe: filtrado glomerular estimado.
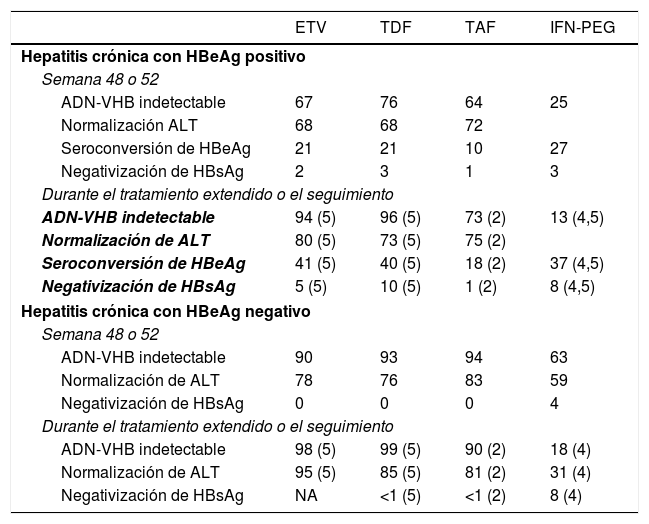
La eficacia, en términos de respuesta virológica, bioquímica, serológica y de resolución de la infección es similar con los 3análogos (tabla 4), aunque no existen estudios que comparen directamente ETV con TDF o TAF. Aunque algunos estudios asiáticos han observado un menor riesgo de desarrollo de CHC en pacientes tratados con TDF que en los tratados con ETV48,49, este efecto no se ha observado en otros estudios realizados también en Asia o en otra áreas del mundo50-52, de modo que en el momento actual no existen evidencias suficientes para sustentar una diferente evolución clínica en cuanto a probabilidades de desarrollo de CHC, necesidad de trasplante hepático o muerte entre pacientes tratados con ETV o con TDF50.
Tasas de respuesta virológica, bioquímica y serológica obtenidas con los fármacos actualmente recomendados
| ETV | TDF | TAF | IFN-PEG | |
|---|---|---|---|---|
| Hepatitis crónica con HBeAg positivo | ||||
| Semana 48 o 52 | ||||
| ADN-VHB indetectable | 67 | 76 | 64 | 25 |
| Normalización ALT | 68 | 68 | 72 | |
| Seroconversión de HBeAg | 21 | 21 | 10 | 27 |
| Negativización de HBsAg | 2 | 3 | 1 | 3 |
| Durante el tratamiento extendido o el seguimiento | ||||
| ADN-VHB indetectable | 94 (5) | 96 (5) | 73 (2) | 13 (4,5) |
| Normalización de ALT | 80 (5) | 73 (5) | 75 (2) | |
| Seroconversión de HBeAg | 41 (5) | 40 (5) | 18 (2) | 37 (4,5) |
| Negativización de HBsAg | 5 (5) | 10 (5) | 1 (2) | 8 (4,5) |
| Hepatitis crónica con HBeAg negativo | ||||
| Semana 48 o 52 | ||||
| ADN-VHB indetectable | 90 | 93 | 94 | 63 |
| Normalización de ALT | 78 | 76 | 83 | 59 |
| Negativización de HBsAg | 0 | 0 | 0 | 4 |
| Durante el tratamiento extendido o el seguimiento | ||||
| ADN-VHB indetectable | 98 (5) | 99 (5) | 90 (2) | 18 (4) |
| Normalización de ALT | 95 (5) | 85 (5) | 81 (2) | 31 (4) |
| Negativización de HBsAg | NA | <1 (5) | <1 (2) | 8 (4) |
Datos expresados en %. Entre paréntesis años de tratamiento o seguimiento.
En pacientes con hepatitis crónica HBeAg positivo, el tratamiento con ETV durante 5años alcanza una probabilidad acumulada de respuesta virológica del 95%, una probabilidad de seroconversión del HBeAg del 45% y de normalización de ALT del 80%. En torno a un 5% de los pacientes negativizan el HBsAg al cabo de 5años de tratamiento1. En pacientes con hepatitis crónica HBeAg negativo la probabilidad acumulada de respuesta virológica y bioquímica al cabo de 5 años es del 98 y del 95%, respectivamente53,54.
En pacientes con hepatitis crónica HBeAg positivo, el tratamiento con TDF durante 5años consigue respuesta virológica en el 96% de los casos, respuesta bioquímica en el 73%, seroconversión a anti-HBe en el 40% y pérdida de HBsAg en el 10%40. En pacientes con hepatitis crónica HBeAg negativo las tasas de respuesta virológica, bioquímica y de resolución de la infección son del 99, 85 y <1%, respectivamente1. Al cabo de 10 años de tratamiento con TDF, el 100% de los pacientes con HBeAg negativo y el 98% de aquellos con HBeAg positivo tienen respuesta virológica, mientras que las tasas de respuesta bioquímica son del 83% en el primer grupo y del 78% en el segundo55.
Los datos disponibles en el momento actual con TAF se limitan a 96 semanas de tratamiento. En hepatitis crónica HBeAg positivo, el tratamiento con TAF durante 2años consigue respuesta virológica en el 75%, seroconversión del HBeAg en el 10% y resolución de la infección en el 1% de los pacientes, sin diferencias con respecto a las obtenidas con TDF56. En pacientes con hepatitis crónica HBeAg negativo, la eficacia del TAF fue también similar a la de TDF, con respuesta virológica en el 90% y pérdida del HBsAg en el 1% al cabo de 2años de tratamiento56. Comparado con TDF, los grupos tratados con TAF, tanto con HBeAg positivo como negativo, tuvieron una mayor tasa de normalización de ALT al cabo de 96 semanas de tratamiento56, sin que exista una clara explicación para este efecto.
Riesgo de desarrollo de resistencia antiviralA los 5años de tratamiento, la probabilidad de desarrollo de resistencias genotípicas a ETV en pacientes naïve fue del 1,2%1. Por lo que respecta a TDF, no se habían observado resistencias al cabo de 8años de tratamiento en pacientes con HBeAg positivo o negativo57. Sin embargo, recientemente se ha descrito en 2pacientes la existencia de una cuádruple mutación en el gen que codifica la transcriptasa inversa del VHB que confiere resistencia a TDF, lo que indicaría que TDF posee una muy alta barrera a la resistencia, pero que es posible58. Aunque no hay datos a largo plazo, no se han observado resistencias a TAF tras 2años de tratamiento en el análisis que incluye pacientes con HBeAg positivo y negativo56.
SeguridadUna de las principales ventajas del tratamiento con análogos es su seguridad a largo plazo59,60. El tratamiento prolongado con ETV es muy seguro, incluso en pacientes con comorbilidades61. Aunque es un hecho infrecuente, la administración prolongada de TDF se ha asociado con deterioro de la función renal, disfunción tubular, incluyendo síndrome de Fanconi40,62 y con un descenso en la densidad mineral ósea63. Un metaanálisis no ha demostrado diferencias en la incidencia de disfunción renal entre pacientes tratados con ETV y TDF64, aunque este hecho ha sido atribuido a la corta duración del tratamiento en los estudios analizados. Por el contrario, los estudios que han comparado a más largo plazo el efecto de ETV y TDF han mostrado un mayor deterioro de la función renal con este último, aunque este efecto adverso se observa en un número muy escaso de pacientes65,66 y ocurre fundamentalmente en aquellos con disfunción renal basal, con edad avanzada o con comorbilidades67, así como en pacientes en los que no se ha ajustado la dosis de TDF a la función renal.
TAF es un profármaco que alcanza altos niveles de tenofovir en las células hepáticas con una dosis menor que TDF, lo que se traduce en unas menores concentraciones plasmáticas y una menor exposición al fármaco de riñones, huesos y otros órganos. Este mejor perfil teórico de seguridad de TAF con respecto a TDF se ha confirmado en los estudios de registro, de manera que el uso de TAF se asoció de forma significativa con un menor deterioro de la función renal y una menor pérdida de densidad ósea mineral al cabo de 96 semanas de tratamiento56.
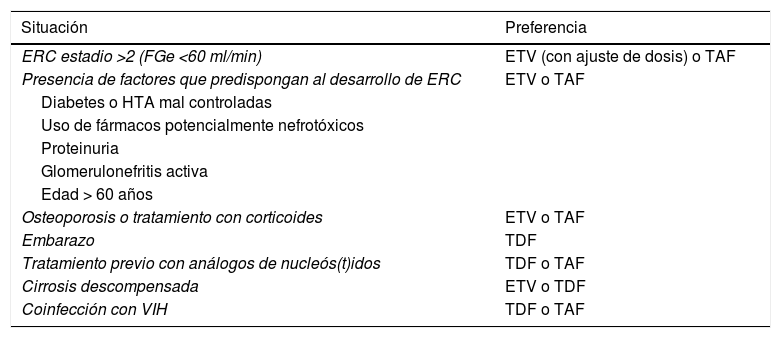
Por otra parte, se ha observado que la disfunción renal desarrollada durante el tratamiento con TDF mejora al cambiar a ETV68 o a TAF, aunque con este último la experiencia es más corta y basada fundamentalmente en pacientes coinfectados con VIH69. Estos aspectos relacionados con la seguridad deben condicionar en determinadas circunstancias la elección de uno u otro análogo (tabla 5).
Elección del análogo en situaciones especiales
| Situación | Preferencia |
|---|---|
| ERC estadio >2 (FGe <60 ml/min) | ETV (con ajuste de dosis) o TAF |
| Presencia de factores que predispongan al desarrollo de ERC | ETV o TAF |
| Diabetes o HTA mal controladas | |
| Uso de fármacos potencialmente nefrotóxicos | |
| Proteinuria | |
| Glomerulonefritis activa | |
| Edad > 60 años | |
| Osteoporosis o tratamiento con corticoides | ETV o TAF |
| Embarazo | TDF |
| Tratamiento previo con análogos de nucleós(t)idos | TDF o TAF |
| Cirrosis descompensada | ETV o TDF |
| Coinfección con VIH | TDF o TAF |
ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; HTA: hipertensión arterial.
La interrupción del tratamiento con análogos antes de que se haya producido la resolución de la infección conlleva riesgo de reactivación viral, por lo que la estrategia de mantenerlo hasta que se alcance este objetivo es la más segura69,70,71, especialmente en pacientes con cirrosis en los que una reactivación puede ocasionar consecuencias clínicas desfavorables. No obstante, sería deseable conseguir la resolución de la infección o al menos la respuesta virológica sostenida en la mayoría de los pacientes con un tratamiento limitado en el tiempo, por lo que la posibilidad de interrumpir de forma segura el tratamiento con análogos antes de que ocurra la negativización del HBsAg es uno de los aspectos más controvertidos en el manejo actual de la hepatitis B crónica.
En pacientes con HBeAg positivo sin cirrosis hepática el tratamiento puede interrumpirse una vez que se haya producido respuesta virológica y seroconversión del HBeAg confirmada en 2determinaciones con intervalo entre ellas de 3 a 6 meses y tras un tratamiento de consolidación de al menos 12 meses1. Cuando se cumplen estas condiciones para interrumpir el tratamiento, la mayoría de los pacientes mantienen la respuesta serológica, pero solo el 60% mantiene la respuesta virológica al cabo de un año de la interrupción72. Por ello, es necesario un seguimiento trimestral durante el primer año con el fin de identificar a aquellos pacientes que van a necesitar la reintroducción del tratamiento. Las indicaciones para reiniciar el tratamiento serían básicamente las mismas que en pacientes naïve.
En pacientes con HBeAg negativo, la mayor parte de la información acerca de la interrupción del tratamiento con análogos antes de que se produzca la negativización del HBsAg procede de países asiáticos, debido a que la Asociación Asia-Pacífico para el Estudio del Hígado estableció en el año 2012 que podía considerarse la interrupción en pacientes con respuesta virológica documentada en 3ocasiones separadas cada una de ellas por 6meses y tras un mínimo de 24 meses de tratamiento73. Los objetivos de esta recomendación eran fundamentalmente el ahorro económico y la reducción de los efectos adversos y de las resistencias antivirales que puede ocasionar el tratamiento a largo plazo. Las tasas de recaída virológica tras la interrupción del tratamiento en estas circunstancias están en torno al 55 y al 70% al cabo de 1 y 2 años, pero son inferiores cuando el tratamiento de consolidación, entendiendo como tal su mantenimiento tras la negativización del ADN-VHB, es superior a los 24 meses72. Alrededor de un 45% de los pacientes desarrollan una recaída clínica, que, en caso de ocurrir sobre una cirrosis, puede provocar descompensación de la enfermedad74. Las tasas de negativización del HBsAg observadas en los estudios asiáticos tras la interrupción del análogo han sido, en general, bajas, con incidencias anuales inferiores al 2%75, probablemente debido a que el tratamiento fue reintroducido de forma precoz tras la recaída virológica en la mayoría de los casos76. Un estudio retrospectivo que analizó la incidencia y los factores predictivos de negativización del HBsAg tras la interrupción del tratamiento en 691 pacientes observó que durante un seguimiento de 3,2 años, aquellos con recaída clínica que no volvieron a recibir tratamiento presentaron 7,3 veces más posibilidades de negativización del antígeno que los que sí lo recibieron75. Un estudio aleatorizado, llevado a cabo en Alemania, analizó las consecuencias de la interrupción o la continuación de TDF en 42 pacientes, la mayoría de origen caucásico, sin fibrosis avanzada, tratados un mínimo de 4años con TDF y con respuesta virológica mantenida durante al menos 3años y medio, utilizando unos criterios restrictivos para reiniciar el tratamiento tras la recaída clínica en aquellos en los que el tratamiento fue interrumpido77. En ese estudio se observó que las tasas de negativización del HBsAg fueron del 9,5%, 14% y 19% al cabo de uno, 2y 3años de la interrupción, mientras que ningún paciente que permaneció con tratamiento negativizó el HBsAg durante el seguimiento. A pesar de los criterios restrictivos para reiniciar el tratamiento, no se observaron efectos adversos inesperados y al cabo de 144 semanas de seguimiento el 38% de los pacientes había necesitado su reintroducción77. Estos resultados confirman los publicados hace años tras la interrupción de ADV78, son similares a los de otros estudios observacionales79,80 y plantean la estrategia de interrumpir el tratamiento con el objetivo de conseguir la resolución de la infección a través de la respuesta inmunológica ocasionada por la reactivación viral81. Esta estrategia ha sido considerada en la Guía Clínica de la Asociación Europea para el Estudio del Hígado12, que permite considerar la interrupción del análogo en pacientes seleccionados sin cirrosis, con respuesta virológica mantenida durante al menos 3años y que estén dispuestos a seguir un estricto control tras la interrupción. No obstante, sería deseable conocer mejor cuáles son los pacientes que se benefician de ella y cuáles los que pueden verse perjudicados, así como definir los criterios adecuados para reiniciar el tratamiento. Diversos estudios han demostrado que los niveles de qHBsAg alcanzados durante el tratamiento pueden ser útiles para definir la población más beneficiada de la interrupción75,80, aunque hasta ahora no se habían establecido puntos de corte que permitieran una correcta estratificación. Una revisión sistemática reciente que incluyó 11 estudios, todos ellos asiáticos, concluyó que un nivel de qHBsAg de 100 UI/ml en el momento de la interrupción es útil para predecir la evolución posterior82. Las tasas de recaída clínica oscilaron entre el 15 y el 29% en pacientes con qHBsAg <100 UI/ml y entre el 48 y el 64% en aquellos con nivel >100 UI/ml, mientras que las tasas de negativización del HBsAg oscilaron entre el 21 y el 59% en el primer grupo y entre el 3 y el 7% en el segundo82. Aunque es probable que en un futuro próximo se puedan redefinir mejor estas poblaciones con el uso de nuevos marcadores del VHB, como el HBcrAg83, en el momento actual no parece prudente recomendar la interrupción del tratamiento en pacientes con nivel de qHBsAg >100 UI/ml, salvo en el seno de estudios diseñados con el objetivo de aumentar el conocimiento sobre esta estrategia. En el caso de interrupción prematura del tratamiento, los pacientes deben ser controlados mensualmente durante los primeros 6meses con el fin de identificar a aquellos que precisan reiniciarlo. La decisión de reiniciarlo tras la recaída clínica es difícil, porque un tratamiento precoz puede disminuir las posibilidades de negativización del HBsAg, mientras que un retraso en su inicio puede ser perjudicial. En términos generales, el reinicio estaría indicado en caso de recaída clínica grave o mantenida, según las definiciones previas. El tratamiento en pacientes no cirróticos que desarrollan una recaída clínica bajo un seguimiento estrecho consigue una rápida remisión virológica y bioquímica72.
Recomendaciones:- •
Los análogos de nucleos(t)idos recomendados son ETV, TDF y TAF (A1).
- •
En pacientes con enfermedad renal crónica (FGe < 60ml/min) o con factores que predispongan a su desarrollo, incluyendo la edad mayor de 60 años, así como en aquellos con osteoporosis o riesgo de desarrollarla, ETV y TAF serían de elección. En pacientes con FGe < 50ml/min, TAF tiene la ventaja sobre ETV de que no precisa ajuste de dosis (B1).
- •
Inicialmente, la duración del tratamiento con un análogo de nucleós(t)idos es indefinida. La estrategia más segura de interrupción del tratamiento se basa en hacerlo una vez que se ha alcanzado la negativización del HBsAg, por lo que una vez logrado y confirmado este objetivo el tratamiento debe ser interrumpido (B1).
- •
En pacientes con hepatitis crónica HBeAg positivo el tratamiento puede ser interrumpido antes de la negativización del HBsAg en caso de respuesta virológica y seroconversión del HBeAg confirmada en 2determinaciones con intervalo entre ellas de 3 a 6 meses y tras un tratamiento de consolidación de al menos 12 meses (B2).
- •
En pacientes con hepatitis crónica HBeAg negativo se puede considerar la interrupción del tratamiento antes de la negativización del HBsAg en aquellos sin fibrosis avanzada o cirrosis al inicio del tratamiento, con respuesta virológica mantenida durante al menos 3 años y una vez alcanzado un nivel de HBsAg < 100 UI/ml, siempre que estén dispuestos a un seguimiento estricto tras la interrupción (C2).
- •
En cualquier caso, el tratamiento no debe interrumpirse antes de la resolución de la infección en pacientes con cirrosis hepática diagnosticada al inicio o durante él, en aquellos con manifestaciones sistémicas de la enfermedad, con tratamiento inmunosupresor o que no estén dispuestos a un seguimiento estrecho (B1).
- •
Los pacientes que desarrollan enfermedad renal durante el tratamiento con TDF deben ser cambiados a ETV, ajustando la dosis a la función renal, o a TAF, que no precisa ajuste de dosis. En caso de tratamiento previo con LAM o TBV, el cambio debe hacerse a TAF (B1).
El IFN-PEG α-2a a la dosis de 180μg por semana durante 48 semanas constituye la pauta recomendada, tanto en pacientes con HBeAg positivo como negativo. En aproximadamente el 25-30% de los pacientes con HBeAg positivo se consigue respuesta virológica sostenida y respuesta serológica1,32. Además, la mayoría de los pacientes que negativizan el HBeAg a los 6meses de finalizado el tratamiento mantienen esta respuesta serológica a medio-largo plazo1,32. La pérdida del HBsAg o curación funcional se obtiene en el 3% de los pacientes a los 6meses de finalizado el tratamiento, pero estas cifras se incrementan de forma progresiva, especialmente en pacientes en los que se ha logrado respuesta serológica, en los que alcanza un 30% a los 3años de seguimiento1,32. Los factores basales que predicen una respuesta favorable al tratamiento con IFN-PEG son fundamentalmente la presencia de un nivel elevado de ALT, nivel bajo de ADN-VHB e infección por genotipos A o B1,32.
En pacientes con hepatitis B crónica HBeAg negativo, el tratamiento con IFN-PEG durante 48 semanas consigue tasas de respuesta bioquímica y virológica sostenidas del 60 y del 63% a los 6meses de finalizarlo, pero, a diferencia de lo que ocurre en los pacientes con HBeAg positivo, estas se reducen con el paso del tiempo y son de alrededor del 31 y del 18%, respectivamente a los 4años de finalizado el tratamiento1. La pérdida del HBsAg tras tratamiento con IFN-PEG ocurre con menor frecuencia en pacientes con HBeAg negativo que con HBeAg positivo, pero aun así las tasas se incrementan progresivamente tras finalizar el tratamiento desde un 3% a los 6meses hasta el 9% a los 3años y un 12% a los 51. No existen factores basales que hayan mostrado utilidad para predecir la respuesta a IFN-PEG en pacientes con HBeAg negativo.
SeguridadEl tratamiento con IFN-PEG ocasiona efectos secundarios frecuentes, que en ocasiones pueden ser graves y que obligan a reducir la dosis en aproximadamente el 25% de los pacientes y a interrumpirlo de forma precoz en el 5%1. Está contraindicado en pacientes con enfermedades psiquiátricas graves, epilepsia mal controlada, enfermedad cardíaca grave, enfermedades autoinmunes o citopenias. También está contraindicado durante el embarazo y en pacientes con cirrosis descompensada o con hepatitis aguda grave. Debe utilizarse con precaución en pacientes con cirrosis compensada, en especial en aquellos con datos de hipertensión portal, debido al riesgo de descompensación que puede acarrear la necrosis hepatocelular inmunomediada.
Duración del tratamientoEn pacientes con hepatitis B crónica HBeAg negativo se ha investigado la prolongación del tratamiento con IFN-PEG a 96 semanas84, y se ha observado un incremento significativo en las tasas de respuesta con respecto al tratamiento estándar de 48 semanas. Sin embargo, el seguimiento tras la interrupción del tratamiento ha sido corto, por lo que en el momento actual la duración recomendada es de 48 semanas.
El tratamiento con IFN-PEG debe acortarse en caso de que durante su transcurso se pueda prever la ausencia de respuesta, con el objetivo de evitar efectos adversos y costes innecesarios. En pacientes con HBeAg positivo, un nivel de qHBsAg mayor de 20.000 UI/ml en la semana 12 de tratamiento (para pacientes infectados por genotipos B o C) y una ausencia de cualquier descenso con respecto al nivel basal (para genotipos A y D) predicen una muy baja probabilidad de respuesta serológica85 y pueden utilizarse como indicadores para la interrupción precoz del tratamiento. En pacientes con HBeAg negativo, la combinación de una ausencia de descenso en la semana 12 de tratamiento del nivel de qHBsAg junto con un descenso <2 log10 en las cifras de ADN-VHB, en ambos casos con respecto al valor basal, tiene una muy elevada capacidad para predecir ausencia de respuesta en pacientes infectados por genotipo D1 y puede también ser utilizada como regla de interrupción precoz del tratamiento.
Recomendaciones:- •
La duración recomendada del tratamiento con IFN-PEG es de 48 semanas (B1).
- •
En pacientes con HBeAg positivo infectados por genotipos A o D que, al cabo de 12 semanas de tratamiento presentan un nivel de qHBsAg >20.000 UI/ml y ausencia de descenso con respecto a los basales, el tratamiento puede ser interrumpido por falta de eficacia (B1).
- •
En pacientes con HBeAg negativo infectados por genotipo D que, al cabo de 12 semanas de tratamiento presentan ausencia de descenso del nivel de qHBsAg junto con un descenso <2 log10en el ADN-VHB, en ambos casos con respecto a los valores basales, el tratamiento puede ser interrumpido por falta de eficacia (B1).
Puede ocurrir con cualquiera de los análogos, especialmente en pacientes con alto nivel de ADN-VHB al inicio del tratamiento. En la mayoría de los casos la prolongación del tratamiento con el mismo análogo consigue la respuesta virológica1. No obstante, debe valorarse la cinética del ADN-VHB y, si a partir de la semana 48 de tratamiento el nivel sigue descendiendo, puede continuarse con el mismo fármaco, ya que el riesgo de desarrollo de resistencia es extremadamente bajo. Si, por el contrario, el nivel de ADN-VHB se mantiene estable, debe valorarse cambiar de análogo o hacer un tratamiento combinado con ETV + TDF o TAF, especialmente en pacientes con enfermedad hepática avanzada en los que el mantenimiento de la replicación viral puede tener consecuencias clínicas desfavorables86. Si se opta por el tratamiento combinado, una vez conseguida la respuesta virológica podría valorarse la vuelta a la monoterapia tras un periodo de consolidación87.
Rebote virológicoUtilizando ETV, TDF o TAF la causa más frecuente de rebote virológico es un cumplimiento deficiente del tratamiento. En pacientes naïve, el riesgo de desarrollo de resistencias con ETV es muy bajo1 y excepcional con TDF58. Sin embargo, en pacientes con resistencia previa a LAM, hasta un 51% desarrolla resistencia a ETV al cabo de 5 años de tratamiento1,32, por lo que no debe utilizarse en pacientes con resistencia a LAM o a TBV ni en aquellos en los que existan dudas sobre la historia previa de tratamiento con análogos de nucleós(t)idos. No se han descrito resistencias a TDF cuando se utiliza como rescate en pacientes con fracaso previo a otros análogos88 y tampoco se han descrito en pacientes naïve tratados con TAF56. Aunque no existen datos sobre el uso de TAF en pacientes con resistencia a otros análogos es asumible que su barrera genética a la resistencia sea similar a la de TDF. En pacientes que desarrollan resistencia a ETV se recomienda cambio a TDF o TAF, y es preferible este último cuando existan enfermedad renal u ósea o factores predisponentes para cualquiera de ellas. La monoterapia con TDF se ha mostrado eficaz como rescate en pacientes con resistencia a LAM, ADV o ETV o con resistencias múltiples88, así como en la simplificación del tratamiento tras haber conseguido respuesta virológica con tratamiento combinado en pacientes con resistencia a LAM89. En el hipotético caso de resistencia a TDF o TAF, la recomendación, aunque sin evidencia científica que la sustente, es cambiar a ETV o añadir ETV al TDF o al TAF en caso de antecedente de resistencia a LAM.
Recomendaciones:- •
En cualquier situación de ausencia de respuesta virológica al tratamiento con análogos debe investigarse el grado de cumplimiento terapéutico (B1).
- •
En pacientes con respuesta virológica parcial debe analizarse la cinética del ADN-VHB a partir de la semana 48 de tratamiento. Si el ADN-VHB sigue en descenso se debe continuar con el mismo análogo, mientras que en caso de no descenso debe valorarse el cambio a otro análogo o aplicar un tratamiento combinado con ETV + TDF o TAF (B2).
- •
En pacientes que desarrollan resistencia a ETV se recomienda cambio a TDF o TAF (A1).
- •
En el hipotético caso de resistencia a TDF o TAF, la recomendación es cambiar a ETV o añadir ETV a TDF o a TAF en caso de antecedente de resistencia a LAM (C2).
El seguimiento durante el tratamiento dependerá del fármaco utilizado. En los pacientes en tratamiento con ETV, TDF o TAF está indicado hacer una determinación analítica a los 3meses del inicio que incluya función renal (creatinina, FGe, niveles de fosfato sérico), ALT y ADN-VHB90-93. En los casos con HBeAg positivo, debe añadirse la determinación del HBeAg. Estos controles analíticos deberán repetirse cada 3 meses hasta que el ADN-VHB sea indetectable. Después, una vez que la viremia es indetectable, se recomiendan controles cada 6 meses que incluyan función renal, ALT y ADN-VHB. Si el fármaco utilizado es TDF, los controles semestrales deben incluir la determinación del nivel de fosfato sérico. En los sujetos en tratamiento con TAF no se requiere ajuste de dosis con relación al FGe si este es ≥15ml/min.
En los pacientes con HBeAg positivo, se recomienda determinar el HBeAg y el anti-HBe cada 6 meses. En caso de pérdida del HBeAg, deben confirmarse los resultados en una muestra consecutiva. En todos los casos, el HBsAg o, preferiblemente, el qHBsAg debe determinarse anualmente. En los casos de negativización del HBsAg, este debe confirmarse en una determinación posterior. La cuantificación del qHBsAg es útil sobre todo en los sujetos con HBeAg positivo, ya que la caída importante en el nivel de qHBsAg durante las 24 primeras semanas de tratamiento se asocia a la pérdida del HBeAg y a mayores posibilidades de eliminación del HBsAg.
Los pacientes con cirrosis hepática deben ser incluidos en un programa de vigilancia periódica para el diagnóstico precoz de CHC, mediante estudio ecográfico semestral.
Los pacientes que reciben IFN-PEG requieren una monitorización más estrecha durante las 48 semanas de tratamiento. El seguimiento de estos pacientes requiere, además de los controles ya citados, la determinación del nivel de hemoglobina, leucocitos y plaquetas basalmente, al mes del tratamiento y cada 3meses para ajustar las dosis de IFN, así como el análisis de la TSH cada 3-6 meses durante el tratamiento. En estos pacientes la cuantificación de los títulos de qHBsAg a las 12 semanas del tratamiento es útil para identificar a aquellos que no van a responder a él. En los pacientes con HBeAg positivo infectados por genotipo A o D, la ausencia de un descenso en el valor de qHBsAg a las 12 semanas de tratamiento con IFN-PEG predice falta de respuesta, mientras que en los pacientes con HBeAg negativo infectados por genotipo D se requiere la combinación de una caída de menos de 2 log10 UI/ml en el ADN-VHB junto con ausencia de descenso en el nivel de qHBsAg a la semana 12 para interrumpir el tratamiento por falta de respuesta85,94,95.
Recomendación:- •
Durante el tratamiento deben realizarse controles periódicos que incluyan valores de ALT, ADN-VHB y qHBsAg. En pacientes tratados con análogos de nucleós(t)idos debe controlarse periódicamente la función renal y el nivel de fosfato sérico, mientras que en los tratados con IFN-PEG los controles deben incluir hemograma y TSH (A1).
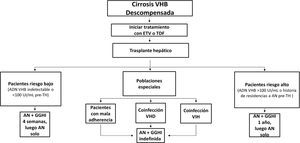
En los pacientes con cirrosis relacionada con la infección por el VHB, la incidencia acumulada de descompensación hepática a los 5 años está alrededor del 20%12. La supervivencia a los 5 años de los pacientes con cirrosis descompensada es del 15-35%96. Estos pacientes deben ser tratados sin demora con un análogo de nucleós(t)idos con alta barrera genética a la resistencia, con independencia del nivel de ADN-VHB12,34,97. Al mismo tiempo, deben ser remitidos para valoración de trasplante hepático si son candidatos potencialmente elegibles.
El objetivo del tratamiento antiviral en estos pacientes es doble: por un lado, mejorar la función hepática y evitar eventualmente el trasplante hepático; por otro, minimizar el riesgo de recurrencia de la infección por VHB postrasplante hepático, que está en relación con el nivel de viremia en el momento del trasplante. El tratamiento antiviral modifica la historia natural de la cirrosis descompensada, mejora la función hepática y aumenta la supervivencia a corto y largo plazo, sobre todo si se inicia precozmente98,99. La supervivencia libre de trasplante hepático es superior al 80% en los pacientes tratados con análogos64,100 y hasta un tercio de ellos pueden llegar a ser retirados de la lista de espera del trasplante98. Esta mejoría clínica puede tardar varios meses en observarse y, entretanto, los pacientes pueden fallecer por insuficiencia hepática o por sus consecuencias. La mayoría de los fallecimientos se producen en los primeros 6 meses después de iniciar el tratamiento, con independencia del grado de supresión de la replicación viral alcanzado99. Los pacientes con valores de MELD o Child-Pugh altos son los que tienen un riesgo aumentado de mortalidad, de ahí la importancia de que sean remitidos prontamente para evaluación de trasplante hepático, sin esperar a que la viremia sea indetectable.
El IFN-PEG está contraindicado en este grupo de pacientes. ETV o TDF son los análogos de primera línea en los pacientes con cirrosis descompensada; en la elección del análogo se debe tener en cuenta la historia de resistencia previa a los antivirales y la existencia de factores de riesgo de enfermedad renal u ósea. En los pacientes con resistencia previa a LAM, TDF es el fármaco de elección. En pacientes en tratamiento con TDF y con enfermedad renal u ósea subyacente o en riesgo de desarrollarlas, debe considerarse la posibilidad de cambiar a ETV o a TAF34, dependiendo de la existencia de resistencia previa a LAM. La dosis de ETV en la cirrosis descompensada es de 1mg al día (en comparación con 0,5mg/día en la cirrosis compensada) porque esa fue la dosis utilizada en el estudio de registro para esta población101. Sin embargo, la dosis de 0,5mg al día ha demostrado una eficacia similar102.
Los pacientes con cirrosis descompensada, sobre todo aquellos con enfermedad hepática muy avanzada, son un grupo en el que la seguridad de los análogos es muy relevante. Estos pacientes deben ser objeto de una monitorización estrecha para detectar de forma precoz la aparición de complicaciones que pueden ser graves, como la acidosis láctica, un efecto secundario afortunadamente raro de cualquier análogo, cuyo riesgo es quizá mayor en los pacientes con cirrosis descompensada, sobre todo en aquellos con MELD ≥ 201. Asimismo, en estos pacientes la insuficiencia renal es frecuente, lo que obliga al ajuste de la dosis del análogo y a la monitorización frecuente de la función renal. No existen todavía datos sobre la seguridad y eficacia de TAF en pacientes con enfermedad hepática descompensada97. Estos pacientes pueden tener un riesgo mayor de experimentar reacciones adversas hepáticas o renales graves, por lo que se recomienda una monitorización estrecha de las pruebas bioquímicas hepáticas y de la función renal si se va a utilizar TAF.
Recomendaciones:- •
Los pacientes con cirrosis descompensada deben ser tratados sin demora con un análogo con alta barrera genética a la resistencia con independencia del nivel de ADN-VHB (A1). En la elección del análogo se debe tener en cuenta la historia de resistencias previas a otros análogos y los factores de riesgo de enfermedad renal u ósea.
- •
Los pacientes con cirrosis descompensada en tratamiento con análogos deben ser monitorizados estrechamente para descartar efectos adversos relacionados con el tratamiento como insuficiencia renal o acidosis láctica (A1).
- •
Los pacientes con cirrosis descompensada deben ser remitidos para evaluación de trasplante hepático, si son candidatos potenciales, sin esperar a que el ADN-VHB sea indetectable (A1).
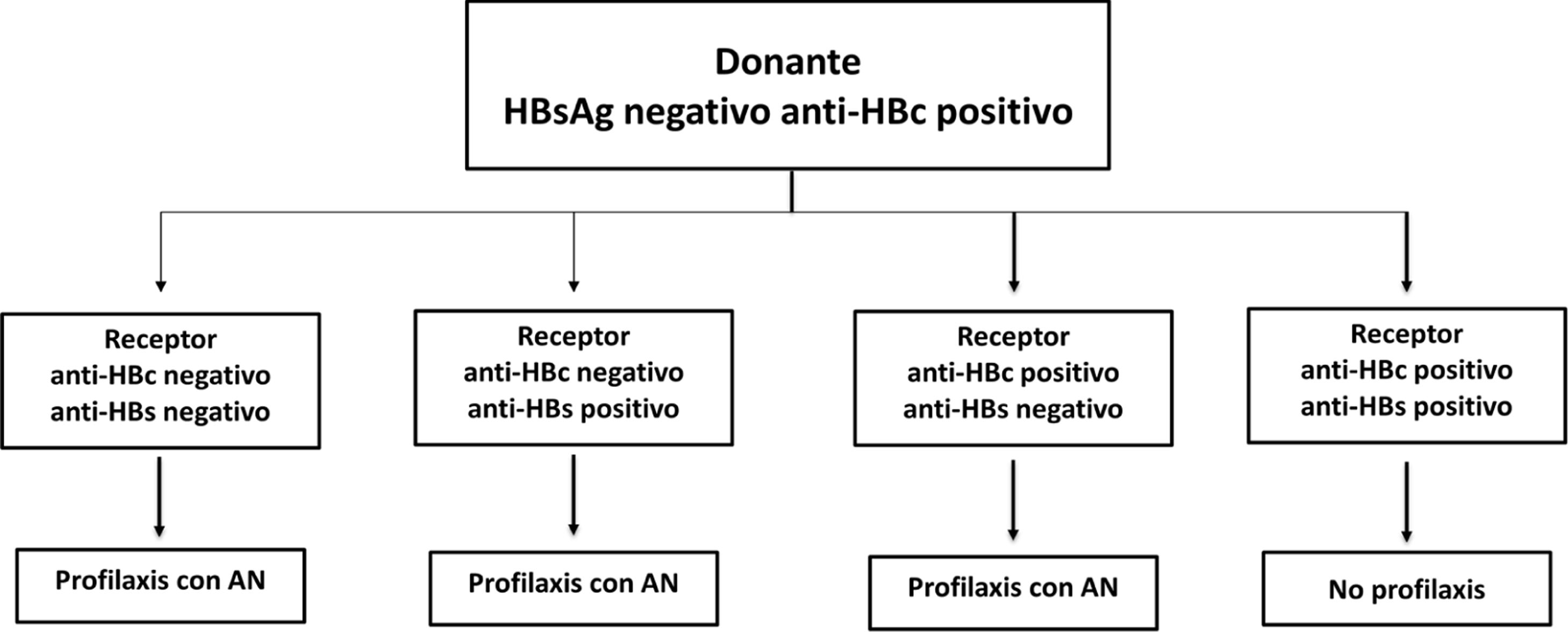
En el pasado, la hepatitis B llegó a ser considerada una contraindicación al trasplante hepático pues, en ausencia de estrategias de profilaxis y de tratamiento eficaces, la mayoría de los pacientes se trasplantaban virémicos y la reinfección del injerto no solo era universal, sino que se acompañaba en muchos casos de una hepatitis de evolución rápidamente progresiva y fatal103. La aparición en primer lugar de la gammaglobulina hiperinmune (GGHI) antihepatitis B y después de los análogos posibilitó el desarrollo de estrategias de profilaxis y de tratamiento eficaces que han revolucionado la práctica del trasplante hepático en los pacientes con hepatopatía relacionada con el VHB de forma que, hoy en día, los resultados del trasplante hepático son equiparables a los obtenidos en otras etiologías104,105.
Tratamiento en lista de esperaEn los pacientes en lista de espera de trasplante hepático el objetivo del tratamiento con análogos con alta barrera genética a la resistencia (ETV o TDF/TAF) es conseguir que el ADN-VHB sea indetectable lo antes posible y que se mantenga así hasta el trasplante, lo que reduce el riesgo de recurrencia de la hepatitis B postrasplante103.
Aunque es deseable que la viremia sea indetectable en el momento del trasplante hepático, la existencia de ADN-VHB detectable no debe demorar la inclusión del paciente en lista de espera ni supone una contraindicación para él106,107. Esto es de especial relevancia en los pacientes con fallo hepático agudo sobre crónico relacionado con el VHB que con frecuencia tienen niveles relativamente altos de viremia108.
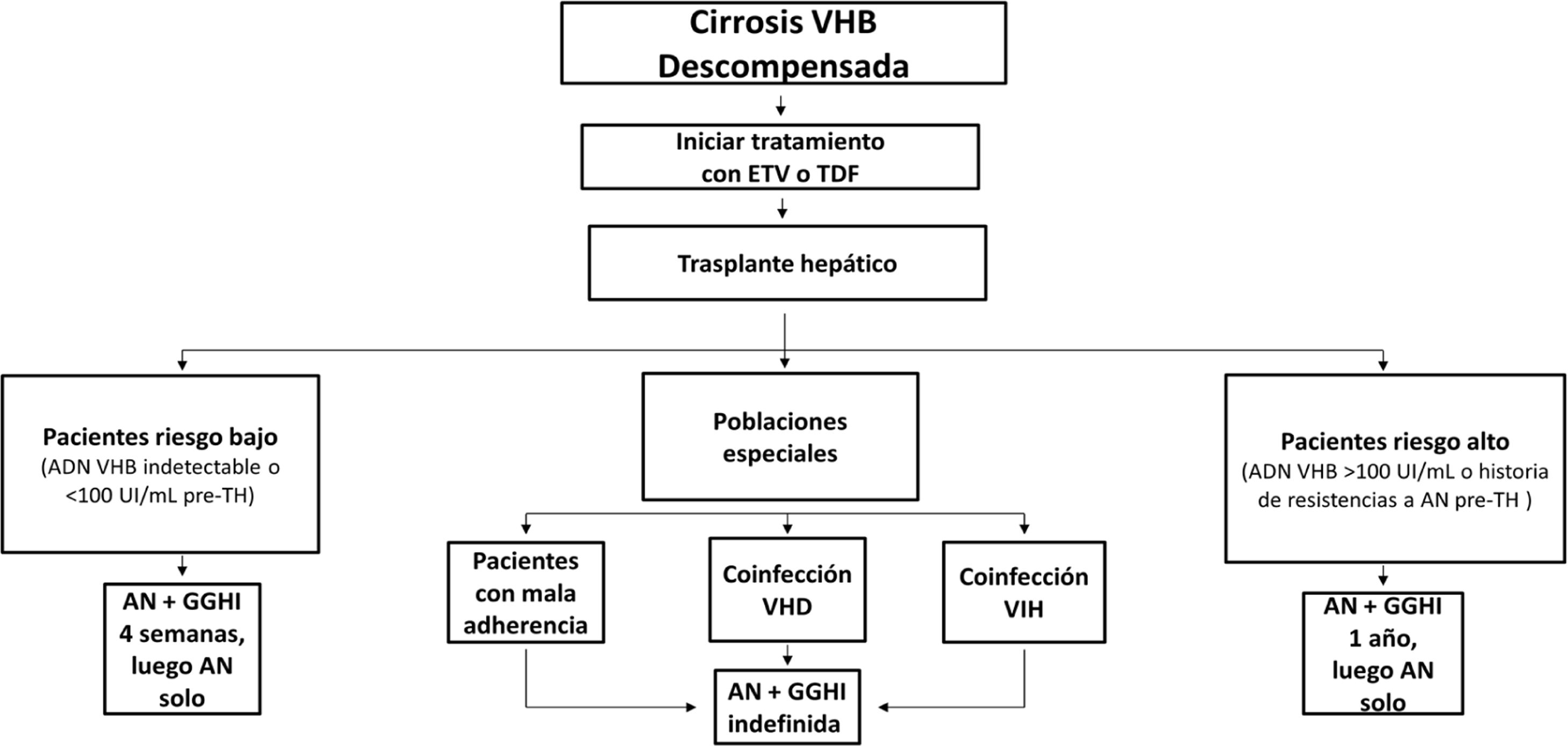
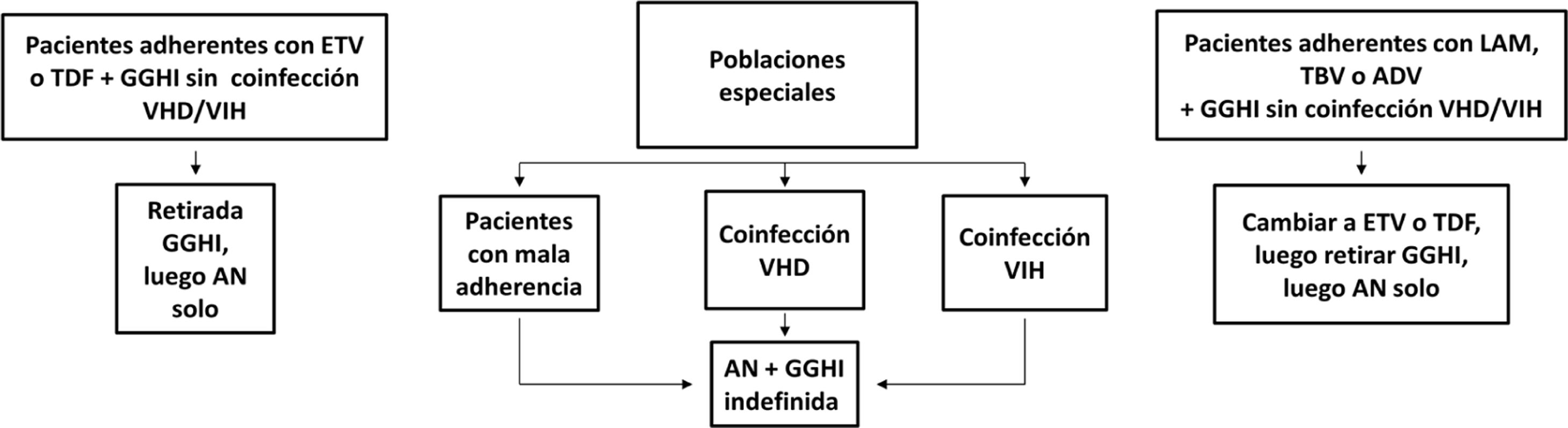
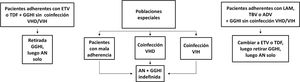
Profilaxis de la recidiva de la hepatitis B después del trasplante hepáticoPacientes de novoLa combinación de un análogo y GGHI antihepatitis B se ha convertido en la profilaxis estándar, capaz de reducir la tasa de recurrencia de la infección por VHB tras el trasplante hepático a <5%96,109. Los análogos utilizados deben ser potentes y con alta barrera genética a la resistencia (ETV o TDF/TAF)110,111 y se deben continuar indefinidamente tras el trasplante hepático. En general, se mantiene el iniciado antes del trasplante, salvo que circunstancias clínicas recomienden su sustitución por otro (véase sección «tratamiento de los pacientes con cirrosis descompensada»).
Existe más controversia sobre la necesidad y duración de la utilización de GGHI112. Aunque la mayoría de los centros todavía utilizan GGHI durante el periodo postrasplante hepático inicial, la dosis y duración de esta son muy variables y los beneficios de la utilización de GGHI a largo plazo siguen siendo inciertos. Las dosis de GGHI pueden administrarse a demanda o en tiempos establecidos; esta última es la opción preferible en pacientes malos cumplidores. En la profilaxis de mantenimiento, la vía de administración puede ser indistintamente intravenosa, intramuscular o subcutánea, dependiendo de la dosis y del protocolo de cada hospital112,113.
Los inconvenientes de la GGHI, como el elevado precio, su administración parenteral o los efectos secundarios, han generado una búsqueda constante de estrategias para optimizar su utilización, como el empleo de dosis bajas, la retirada tras un periodo variable de tiempo postrasplante hepático o incluso su ausencia de los protocolos de profilaxis. Según los datos disponibles en la actualidad, la pauta de utilización de GGHI podría individualizarse según el riesgo de recurrencia de la hepatitis B postrasplante hepático (fig. 1).
El principal factor de riesgo de recurrencia de la infección por VHB postrasplante hepático es la presencia de viremia >100 UI/ml en el momento del trasplante. El antecedente de resistencia a análogos es también un factor de riesgo de recurrencia de la infección por VHB tras el trasplante114. En los pacientes de riesgo alto, la estrategia de profilaxis recomendada es la combinación de ETV o TDF/TAF de forma indefinida y la administración de GGHI a largo plazo. La duración óptima de la GGHI no está bien establecida, pero se recomienda que sea al menos de un año tras la negativización del ADN-VHB postrasplante hepático. Se recomienda mantener los siguientes títulos de anti-HBs predosis: >500 UI/ml hasta el 3.er mes, >100-250 UI/ml hasta el 6.° mes y >50-100 UI/ml a partir del 6.° mes.
Pacientes de riesgo bajoLos pacientes considerados de bajo riesgo son aquellos con viremia indetectable o baja (<100 UI/ml) en el momento del trasplante hepático. En estos pacientes, la pauta de profilaxis recomendada es la combinación de ETV o TDF/TAF de forma indefinida y la administración de GGHI a corto plazo. La duración óptima de la GGHI tampoco está bien establecida. Aunque se han indicado resultados excelentes con periodos de GGHI tan cortos como 5-7 días115,116, un periodo de un mes parece a la vez suficiente y razonable en pacientes con tratamiento antiviral óptimo117. En los pacientes con viremia indetectable pretrasplante hepático, la utilización de una pauta de profilaxis sin GGHI, basada únicamente en la administración de ETV o TDF/TAF, puede ser una alternativa válida, sobre todo en centros en los que el coste de la profilaxis constituya una consideración importante107,118.
Poblaciones especialesLos pacientes con coinfección por VHD o por VIH o con cumplimiento cuestionable al tratamiento con análogos no son realmente grupos de riesgo alto per se, pero presentan unas características especiales que los hacen candidatos a la administración indefinida de GGHI. La coinfección por VHD no se asocia con un riesgo aumentado de recurrencia de la hepatitis B, pero la recurrencia de la hepatitis D es en sí misma de riesgo ante la ausencia de fármacos para tratarla con eficacia. En un análisis reciente, se valoró la retirada de la GGHI a tiempos variables tras el trasplante hepático en 81 pacientes trasplantados por hepatitis D en diferentes estudios con solo un caso de recidiva del VHD119. A pesar de estos datos, en la actualidad no se recomienda la monoprofilaxis con análogos fuera del contexto de ensayos clínicos. Los pacientes coinfectados con el VIH que están recibiendo análogos tienen con frecuencia viremias intermitentes de bajo grado postrasplante120, lo que aboga a favor de la utilización de GGHI para minimizar el riesgo de fracaso de la profilaxis. Los pacientes con cumplimiento cuestionable de los análogos son candidatos a profilaxis combinada e indefinida con análogo + GGHI117.
El CHC pretrasplante hepático no es per se un factor de riesgo de recidiva de la hepatitis B postrasplante que, sin embargo, es más frecuentes en tumores más avanzados (extra-Milán) que en los CHC que están dentro de los criterios de Milán121. La recidiva del CHC, en cambio, se asocia claramente con la recurrencia de la hepatitis B postrasplante hepático, pero en estos casos la profilaxis combinada es poco eficaz para evitarla114,122. Por tanto, la elección de la profilaxis en los pacientes con CHC debe basarse en su riesgo virológico, como en los pacientes sin CHC.
Profilaxis a largo plazoRetirada de GGHI a largo plazo en pacientes establesLa retirada de la GGHI a largo plazo tras un periodo variable postrasplante hepático de profilaxis en combinación con un análogo es una de las estrategias utilizadas para reducir los costes e inconvenientes de la GGHI en pacientes estables114. En lo que se refiere a los pacientes tratados con análogos con alta barrera a la resistencia, la información que se puede obtener de los diferentes estudios se puede resumir así: el tiempo transcurrido desde el trasplante hepático es al menos 6 meses, la tasa de recidiva (positividad del HBsAg) ha oscilado entre el 0 y el 8,7%123-125, muy pocos pacientes con recidiva tras la retirada de la GGHI presentaron ADN-VHB detectable con o sin elevación de las enzimas hepáticas y, por último, esta situación típicamente ocurrió en pacientes con mal cumplimiento de los análogos117.
Con base en lo anterior, antes de retirar la GGHI en pacientes estables (con HBsAg y ADN-VHB negativos) se deben tener en cuenta los siguientes factores: cumplimiento, presencia de coinfección VHD o VIH y tipo de análogo mientras el paciente estaba con la profilaxis en combinación (baja o alta barrera a la resistencia) (fig. 2). Si el paciente estaba recibiendo un análogo con baja barrera a la resistencia, se recomienda el cambio a ETV o TDF/TAF antes de la retirada de la GGHI. Se recomienda también mantener la profilaxis combinada de forma indefinida en los pacientes con coinfección por VHD o VIH y en aquellos con problemas de cumplimiento.
Algoritmo de profilaxis a largo plazo de la recurrencia de la hepatitis B en pacientes estables.
ADV: adefovir; AN: análogos de nucleós(t)idos; ETV: entecavir; GGHI: gammaglobulina hiperinmune antihepatitis B; LAM: lamivudina; TBV: telvibufina; TDF: tenofovir; VHD: virus de la hepatitis D; VIH: virus de la inmunodeficiencia humana.
La inmunización activa con vacuna frente al VHB después del trasplante hepático supone una alternativa teórica atractiva a la administración indefinida de la profilaxis, en general, y de la GGHI, en particular. Sin embargo, los estudios que han evaluado la eficacia de la vacunación postrasplante hepático han sido muy heterogéneos respecto a las características y número de pacientes incluidos, tipo de donante (cadavérico vs. vivo), tipo de vacuna, uso de adyuvantes, protocolos de vacunación y definición de respuesta. En los pacientes trasplantados por hepatopatía crónica los resultados son en general insatisfactorios, con tasas de respuesta globales inferiores al 30-40%126; tasas que son mucho más altas (75-100%) en los trasplantados por insuficiencia hepática aguda126. En la actualidad no se recomienda esta estrategia en la práctica clínica con el objetivo de suspender la profilaxis antiviral y solo debería plantearse en el contexto de ensayos clínicos, si bien puede contemplarse en los trasplantados por fallo hepático agudo.
Retirada total de la profilaxisEl concepto de que la profilaxis de la recurrencia de la hepatitis B debe mantenerse por tiempo indefinido tras el trasplante hepático se basa en hallazgos indirectos, fundamentalmente en la detección frecuente de ADN-VHB en suero (en general, a títulos bajos y transitoria), células mononucleares de sangre periférica o hígado en pacientes sin evidencia clínica ni serológica de recurrencia de la hepatitis B postrasplante127,128. Este concepto ha sido cuestionado en un estudio prospectivo en el que se analizó la eficacia y seguridad de la retirada total de la profilaxis de forma programada en 30 pacientes muy seleccionados, con bajo riesgo teórico de recidiva de la hepatitis B postrasplante hepático ya que en todos el ADN-VHB sérico era indetectable en el momento del trasplante. La tasa de recidiva de la hepatitis B (positividad del HBsAg con o sin viremia detectable) fue del 20% (6/30) y solo 3 pacientes requirieron la restitución de la profilaxis129,130. En otro estudio reciente, se analizó de forma retrospectiva la retirada total de la profilaxis (GGHI + análogo) en un grupo de 10 pacientes con abandono voluntario de la profilaxis por problemas de cumplimiento, con resultados también positivos131. A pesar de los resultados anteriores, en el momento actual no se puede recomendar la retirada total de la profilaxis en la práctica y esta solo se debería abordar en el contexto de ensayos clínicos.
Recomendaciones:- •
Todos los pacientes en lista de espera de trasplante hepático por hepatopatía relacionada con el VHB deben ser tratados con un análogo con alta barrera genética a la resistencia (A1).
- •
La profilaxis de la recurrencia de la hepatitis B postrasplante hepático debe basarse en la administración de ETV o TDF/TAF de forma indefinida (A1).
- •
Respecto a la GGHI, se recomienda un enfoque individualizado de su utilización basado en el riesgo de recurrencia de la infección por VHB postrasplante hepático (A1).
La prevalencia de donantes con anti-HBc positivo varía según el área geográfica: 2-3% en los EE. UU., alrededor del 10% en Europa y más del 50% en Asia132. En España, la prevalencia es alrededor del 10%133 y aumenta con la edad del donante: alcanza el 30% en los donantes de más de 60 años134. La utilización de estos injertos se asocia con un riesgo de transmisión de hepatitis B incluso en ausencia de viremia detectable en el donante debido a la presencia de infección oculta en una proporción significativa135,136. En ausencia de profilaxis, el riesgo de transmisión de la hepatitis B depende sobre todo del estado anti-HBc/anti-HBs del receptor en el momento del trasplante hepático137-139. El riesgo más alto se observa en los receptores naïve (con anti-HBc negativo y anti-HBs negativo) con una prevalencia de hepatitis B de novo de entre el 47,8 y el 65,5%. Los receptores con anti-HBc positivo aislado tienen un riesgo que oscila entre el 13 y el 17,9%. Sorprendentemente, los pacientes anti-HBs positivo por vacunación (con anti-HBs positivo aislado) no están protegidos, con un riesgo de infección por VHB de novo que oscila entre el 9,7 y el 23,3%. Sin embargo, debe señalarse que detalles tan relevantes en apariencia como el nivel de anti-HBs en el momento del trasplante hepático, su evolución postrasplante hepático o la presencia de mutantes pre-S en relación con la vacuna no están generalmente disponibles en los estudios y quizás podrían ayudar a entender mejor el desarrollo de hepatitis B de novo en estos pacientes140. Por último, los receptores que son positivos para anti-HBc y anti-HBs son los que tienen el riesgo más bajo (1,4-5,5%).
Globalmente, la profilaxis reduce de forma significativa el riesgo de hepatitis B de novo en todos los grupos de pacientes, excepto en aquellos que son positivos para anti-HBc y anti-HBs, debido a la baja incidencia de hepatitis B de novo sin profilaxis en este grupo137. En la figura 3 se muestra un algoritmo de utilización de los injertos hepáticos procedentes de donantes con HBsAg negativo y anti-HBc positivo. Los análogos son los fármacos de elección en la profilaxis y deben administrarse de forma indefinida. Hasta el momento actual, LAM ha sido el fármaco considerado de elección en la profilaxis por su relación coste-eficacia. Con la reducción del coste de ETV y TDF y el riesgo de resistencia a LAM con el paso del tiempo141,142, estos fármacos constituyen una alternativa mejor que LAM143. Estudios recientes han analizado la inmunización activa pre- y postrasplante hepático como una estrategia para prevenir la infección por VHB de novo y eliminar la necesidad de la administración de un análogo144,145. Desafortunadamente, el pequeño tamaño de las series y la heterogeneidad de los regímenes han llevado a resultados contradictorios. Esta estrategia requiere una monitorización frecuente del nivel de anti-HBs y podría ser más eficaz en el trasplante hepático de donante vivo, en el que la vacuna podría ser administrada a los receptores no inmunizados antes del trasplante hepático145.
Recomendaciones:
- •
Los injertos hepáticos de donantes HBsAg negativo anti-HBc positivo deberían ser utilizados preferentemente en los pacientes trasplantados por hepatitis B, pues estos ya van a recibir una profilaxis eficaz contra la recurrencia de la hepatitis B, en segundo lugar, en los receptores que son positivos para anti-HBc o para anti-HBs y, en último lugar, en los receptores naïve (B1).
- •
La necesidad de administrar profilaxis depende del perfil serológico anti-HBc/anti-HBs del receptor en el momento del trasplante hepático y se basa en la administración de un análogo de forma indefinida (A1).
- •
Aunque LAM ha demostrado ser muy eficaz, ETV o TDF son opciones preferibles por su alta barrera genética a la resistencia (B1).
La infección crónica por VHB es la causa más frecuente de CHC a nivel mundial146. La mayor parte del conocimiento sobre el riesgo de CHC en la infección por VHB se basa en estudios realizados en el sudeste asiático y África subsahariana, donde la infección por VHB es endémica y se adquiere en la época perinatal. No obstante, se estima que la incidencia de CHC en pacientes con hepatitis B es del 0,4-0,6% anual147. En general, el CHC suele presentarse en pacientes con cirrosis hepática asociada a la infección por virus B y por tanto en fases avanzadas de la enfermedad (70-90%), pero es importante mencionar el potencial carcinogénico del virus (cuyo genoma es capaz de integrarse en el ADN humano), en especial de alguna de las proteínas que codifica (proteína X). En los pacientes no cirróticos el riesgo es menor, pero no despreciable, sobre todo en varones, con edad superior a 40 años, con antecedentes familiares de CHC o si la infección es de larga duración (transmisión vertical), así como en pacientes procedentes de áreas de alta endemicidad (africanos o asiáticos), coinfectados por otros virus (VHC/VIH) y genotipo C1,12,19,146,148,149.
Al igual que en otras infecciones víricas, la supresión viral por parte de los análogos de nucleós(t)idos logra modificar el riesgo de CHC entre los pacientes con hepatitis B. El tratamiento con análogos se ha asociado a una reducción del riesgo de CHC, aunque este no desaparece por completo41,150-153. Un estudio en pacientes caucásicos demostró que el riesgo de CHC en pacientes con cirrosis o mayores de 50 años persiste tras 5años de tratamiento antiviral154.
Indicaciones de cribadoLa Asociación Americana para el Estudio de las Enfermedades Hepáticas recomienda el cribado basado en los umbrales de tasa de incidencia de CHC ≥0.2% por año entre aquellos sin cirrosis y entre 0.2% y 1.5% por año entre pacientes con cirrosis subyacente155,156. La presencia de antecedentes familiares de CHC, edad y raza se consideran criterios adicionales para la estratificación del riesgo de CHC en pacientes con hepatitis B. Se recomienda la vigilancia de CHC para todos los pacientes con cirrosis y, en ausencia de cirrosis, en caso de historia familiar de CHC u origen africano o asiático con edad mayor de 40 años en varones o de 50 años en mujeres.
Los controles semestrales mediante ecografía abdominal permiten detectar precozmente la presencia de tumor y deben efectuarse rigurosamente en todos los pacientes en riesgo. En los últimos años se han desarrollado, además, sistemas de puntuación o scores para predecir el riesgo de CHC en pacientes con hepatitis B. Aunque estos sistemas de puntuación pueden alcanzar valores predictivos negativos altos (superiores al 95%) para el desarrollo de CHC durante un periodo de 3 a 10 años en pacientes no tratados, pueden no predecir adecuadamente el riego de CHC en pacientes en tratamiento antiviral. Además, la mayor parte fueron validados en población asiática (genotipos B/C) que difiere de la población del área mediterránea (raza caucásica y genotipos A/D)12. PAGE-B es un score recientemente desarrollado y validado en pacientes caucásicos en tratamiento con análogos de nucleós(t)idos que presenta una buena capacidad predictiva de desarrollo de CHC durante los primeros 5años de tratamiento con ETV o TDF. Este score se puede aplicar fácilmente en la práctica clínica porque se basa en parámetros ampliamente disponibles (plaquetas, edad, sexo)157 (tabla 6). La probabilidad acumulada de desarrollar CHC a los 5años en pacientes con riesgo bajo, moderado o alto fue de 0%, 3% y 17%, respectivamente.
Modelo PAGE-B para predicción del riesgo de CHC a los 5 años en pacientes caucásicos en tratamiento con ETV o TDF
| Variable | Valor en puntos |
|---|---|
| Edad en años | |
| 16-29 | 0 |
| 30-39 | 2 |
| 40-49 | 4 |
| 50-59 | 6 |
| 60-69 | 8 |
| ≥70 | 10 |
| Género | |
| Femenino | 0 |
| Masculino | 6 |
| Plaquetas/mm3 | |
| ≥ 200.000 | 0 |
| 100.000-199.999 | 6 |
| <100.000 | 9 |
| Riesgo | ≤ 9: bajo |
| 10-17: moderado | |
| ≥ 18: alto | |
Fuente: Tomada de Ahn et al.153.
Todos los pacientes con CHC deben recibir tratamiento antiviral con análogos de nucleós(t)idos, independientemente de los valores de carga viral, porque se ha demostrado que el tratamiento reduce el riesgo de recurrencia de CHC y mejora el pronóstico de la enfermedad hepática35. En un metaanálisis que incluyó 8.060 casos, la ratio de riesgo de recurrencia al año y 3años fue claramente menor en pacientes en tratamiento antiviral (RR 0,41; IC 95%: 0,28-0,61 al año; RR: 0,63; IC 95%: 0,43-0,94 a 3años)36.
Recomendaciones:- •
Los pacientes con cirrosis por VHB deben realizar cribado semestral de CHC mediante ecografía (A1).
- •
En pacientes sin cirrosis pero con antecedente familiar de CHC o procedentes de países africanos o asiáticos y de edad superior a 40 (varones) o 50 años (mujeres), especialmente en caso de transmisión vertical o infección por genotipo C, se recomienda cribado semestral de CHC mediante ecografía (B1).
- •
En pacientes tratados con ETV o TDF se recomienda el cálculo de la puntuación PAGE-B al inicio del tratamiento. Aquellos con riesgo alto (puntuación ≥18 puntos) deben ser incluidos en un programa de cribado semestral de CHC, mientras que el cribado se puede considerar en aquellos con riesgo moderado (10-17 puntos) (B2).
La coinfección por VHB y VIH es un problema de salud frecuente y entre los aproximadamente 37 millones de personas infectadas por VIH en el mundo se estima que el 5-20% presentan coinfección por el VHB. La infección por VIH ejerce un impacto significativo sobre la historia natural de la hepatitis B crónica. Los pacientes coinfectados presentan cifras más elevadas de ADN-VHB y en ellos es más frecuente la presencia del HBeAg y un aumento del riesgo de morbimortalidad por enfermedad hepática crónica y CHC en comparación con los pacientes negativos para VIH y los positivos para VIH sin hepatitis B158-160. En los pacientes con VIH positivo sin evidencia serológica de infección por VHB se debe indicar la vacunación frente al VHB, monitorizar la respuesta de anticuerpos y reevaluarla anualmente en aquellos inmunocomprometidos para valorar la administración de dosis de recuerdo161.
Las indicaciones de tratamiento de la hepatitis B en los pacientes coinfectados son las mismas que en los pacientes sin infección por VIH. Las guías de tratamiento antirretroviral recomiendan iniciar el tratamiento en todos los pacientes con infección por VIH-1 con y sin sintomatología y con independencia de la cifra de linfocitos CD4+. Por lo tanto, se debe indicar el tratamiento para las 2infecciones de forma simultánea utilizando una combinación de inhibidores de la transcriptasa inversa del VIH activos frente al VHB (TDF o TAF con LAM o emtricitabina)12,162-164. Estas combinaciones proporcionan muy buenas tasas de eficacia antiviral sin aparición de resistencias165. El TAF reduce la incidencia de efectos adversos del TDF sobre la función tubular renal y la densidad ósea sin afectar a la supresión de la replicación viral de ambos virus y el cambio de TDF a TAF no altera el control virológico de las 2infecciones. Recientemente se ha comunicado que hasta en un 10% de los pacientes con coinfección VHB/VIH con buen cumplimiento del tratamiento se detecta viremia B residual no asociada a la aparición de mutantes resistentes164, pero no se conocen bien los mecanismos ni el significado clínico de la persistencia de niveles de ADN-VHB. Los datos con IFN-PEG son limitados en los pacientes coinfectados y con HBeAg positivo, pero estudios recientes no han demostrado un aumento de la pérdida o seroconversión del HBeAg después de la adición de IFN-PEG al tratamiento con LAM o emtricitabina y TDF166.
Pacientes con coinfección del virus de la hepatitis B y CLos virus de la hepatitis B y C comparten varios mecanismos de transmisión y la coinfección por el virus C se ha descrito en el 7-15% de los pacientes con hepatitis B crónica167. La infección crónica por ambos virus acelera la progresión de la enfermedad hepática e incrementa el riesgo de desarrollo de CHC168. Habitualmente, la infección por VHC inhibe la replicación del VHB, pero la presencia de este último virus no compromete la eficacia del tratamiento, ni en el pasado con IFN-PEG y ribavirina, ni en la actualidad con los antivirales directos, y las tasas de respuesta viral sostenida son similares (por encima del 95%) en pacientes con coinfección VHB/VHC y en pacientes monoinfectados por VHC168. Tampoco existen evidencias de que la eficacia antiviral de los análogos de nucleós(t)idos para la hepatitis B se vea afectada por la coinfección por VHC. Sin embargo, existe riesgo de reactivación de la replicación del VHB durante o después del tratamiento con antivirales directos. En consecuencia, se debe monitorizar el nivel de ADN-VHB en todos los pacientes con HBsAg positivo en tratamiento para la hepatitis C y prescribir el tratamiento con ETV o TDF/TAF en aquellos con indicación de iniciarlo169. Si no existe indicación clara de tratamiento de la hepatitis B, se puede considerar la profilaxis con cualquiera de los análogos durante el tratamiento de la hepatitis C y mantenerla hasta 12 semanas después de finalizarlo. El riesgo de reactivación es prácticamente inexistente en pacientes con HBsAg negativo y anti-HBc positivo, pero se debe controlar el HBsAg o el ADN-VHB en caso de elevación de las transaminasas.
Pacientes con coinfección de los virus de las hepatitis B y DEl VHD infecta únicamente a los pacientes con HBsAg positivo y ello obliga a realizar el cribado de infección por VHD en todos los pacientes con hepatitis B. Aunque la incidencia del VHD ha disminuido mucho en los últimos años, en algunas áreas geográficas, como la cuenca mediterránea o los países del este de Europa, entre el 5 y el 10% de los pacientes con HBsAg positivo presentan coinfección por VHD170. La hepatitis D se caracteriza por una mayor gravedad de la enfermedad hepática y una incidencia de cirrosis más elevada que las observadas en pacientes con hepatitis B crónica.
El IFN es el único medicamento recomendado para el tratamiento de la hepatitis D crónica. En algunas series históricas la utilización de dosis elevadas de IFN-α estándar (9-10 MU 3veces por semana) consiguió tasas de respuesta en torno a un 15%, con mejoría histológica en el caso de los pacientes respondedores171,172. Más recientemente, el tratamiento con IFN-PEG durante un año obtuvo respuesta (ARN-VHD indetectable a las 24 semanas de la finalización del tratamiento) en el 28% de los pacientes173. Otros estudios han arrojado cifras de respuesta virológica a la semana 24 postratamiento en el 25-37% de los pacientes, pero se han descrito recaídas tardías, un año después de la finalización del tratamiento. Ni la prolongación del tratamiento con IFN-PEG ni la adición de análogos de nucleós(t)ido mejoran la tasa de respuesta173,174. En ausencia de cirrosis, estos últimos fármacos se deben administrar solo si existe replicación significativa del VHB (cifras de ADN-VHB repetidamente superiores a 2.000 UI/ml). El beneficio terapéutico y el riesgo de desarrollar eventos clínicos se relacionan estrechamente con la negativización del ARN-VHD175,176.
El desarrollo de nuevos fármacos es una necesidad para la hepatitis D crónica. En la actualidad se encuentran en diferentes fases de desarrollo clínico inhibidores de la prenilación (lonafarnib) e inhibidores de la entrada (Myrcludex B)172.
Pacientes con enfermedad renal crónicaLos pacientes con enfermedad renal crónica en programa de hemodiálisis constituyen un grupo de riesgo de infección por el VHB. Aunque la respuesta a la vacuna de la hepatitis B es inferior a la de la población general, la prevalencia de infección crónica por VHB en este colectivo se ha reducido drásticamente en los últimos años, pero todavía puede ser causa de morbilidad, por lo que el cribado es obligatorio12. La vacuna está indicada en todos los pacientes seronegativos, y como la tasa de inmunización es inferior a la de la población general, está indicada la administración de dosis de refuerzo177. Los pacientes en hemodiálisis pueden tratarse con ETV o TAF siguiendo los mismos criterios que en los pacientes inmunocompetentes sin enfermedad renal crónica y ajustando la dosis en el caso de ETV (tabla 3). Como ya se ha mencionado, se deben utilizar fármacos con elevada barrera genética para evitar resistencias y con el mejor perfil de seguridad renal178. En este sentido, ETV sería el de elección en pacientes naïve, reservándose el TAF para los que tienen resistencia a LAM. El tratamiento antiviral con análogos de nucleós(t)idos se ha utilizado también en pacientes con glomerulonefritis asociada con el VHB con remisión clínica y mejoría de la proteinuria en 2/3 partes de ellos179. Los pacientes con trasplante renal infectados por VHB deben, asimismo, recibir tratamiento o profilaxis con análogos de modo similar (ETV en pacientes naïve y TAF en naïve o pretratados, aunque no se dispone de datos de eficacia y seguridad en este subgrupo). Se deben evitar tanto LAM (por el riesgo de resistencias) como IFN (por el peligro de favorecer el rechazo del riñón trasplantado)180.
Hepatitis agudaLa mayoría (95%) de las hepatitis agudas B en adultos inmunocompetentes se resuelven espontáneamente, por lo que no existe indicación de tratamiento. Sin embargo, en los casos de hepatitis aguda de curso grave (coagulopatía, signos de fallo hepático agudo) se debe indicar tratamiento antiviral. ETV y TDF (y es probable que también TAF, aunque no se dispone de datos con este fármaco en pacientes con hepatitis aguda grave) constituyen las mejores alternativas por su potencia y elevada barrera genética, en especial, si se considera la opción del trasplante hepático181,182. El tratamiento con IFN no se recomienda en los pacientes con hepatitis aguda grave.
EmbarazoEl abordaje clínico de la hepatitis B durante el embarazo presenta diversos problemas, entre ellos el tratamiento de la enfermedad en la gestante y la prevención de la transmisión de la infección al recién nacido, cuyo riesgo de desarrollar una hepatitis crónica alcanza el 90%. El IFN (estándar y pegilado) está contraindicado en el embarazo y tampoco los análogos de nucleós(t)idos tienen el registro para su uso, de ahí que se deba evaluar con cuidado la indicación de tratamiento183, pero así como LAM, ETV y ADV carecen de datos consistentes de seguridad en humanos, TBV y TDF no han mostrado evidencias de toxicidad para el feto12. De los 2, TDF representa la mejor opción por su elevada barrera genética y la ausencia de riesgo de desarrollo de resistencias. No se dispone de datos de seguridad de TAF en pacientes gestantes y no se puede recomendar su uso.
La decisión de tratamiento debe contemplar la gravedad de la enfermedad y el riesgo de la transmisión perinatal1,183. Si una paciente con indicación de tratamiento desea quedarse embarazada en un corto espacio de tiempo, en la mayoría de los casos se puede esperar hasta después del parto para iniciar el tratamiento antiviral con análogos de nucleós(t)idos. Por otro lado, si la paciente tiene factores predictores de respuesta al IFN-PEG, puede indicarse este tratamiento, cuya duración limitada a 48 semanas posibilitaría después el embarazo. Ante un embarazo en una paciente en tratamiento con análogos, no se debe interrumpir la medicación, pero el antiviral de elección en esta circunstancia es TDF y se tiene que cambiar a este medicamento si la paciente estuviera recibiendo ETV o LAM12,34.
En todos los recién nacidos de madre con HBsAg positivo está indicada la inmunoprofilaxis combinada con vacuna y gammaglobulina específica. Esta estrategia reduce muy significativamente (en más del 90%) el riesgo de transmisión. Sin embargo, en pacientes con cifras de viremia elevadas (>200.000 UI/ml), se debe indicar el uso previo de un antiviral (de nuevo TDF es el fármaco de elección) a partir de la semana 24-28 de gestación1,12,34. La duración del tratamiento antiviral como profilaxis de la transmisión vertical no se ha establecido y se aboga por suspenderlo inmediatamente después del parto o mantenerlo hasta 3meses después. La lactancia materna no está contraindicada en mujeres con hepatitis B y tampoco en las que reciben tratamiento con TDF.
NiñosDespués de casi 3décadas de vacunación universal a todos los recién nacidos en nuestro país, la incidencia de infección por VHB en niños se ha reducido de forma drástica. La mayoría de los que desarrollan una hepatitis crónica se encuentran en la fase de infección crónica HBeAg positivo, con elevados niveles de viremia y mínima o nula actividad necroinflamatoria hepática (fase de tolerancia inmune), y presentan enfermedad leve, por lo que no requieren tratamiento184. La tasa de seroconversión espontánea del HBeAg es muy elevada en niños y por ese motivo se requiere un seguimiento cuidadoso de los que muestran signos de actividad de la enfermedad antes de iniciar el tratamiento e indicarlo solo en los niños o adolescentes con enfermedad hepática activa o potencialmente grave (necroinflamación y fibrosis moderada/avanzada). En el pasado se han utilizado IFN estándar, LAM y ADV con resultados de eficacia, perfil de seguridad y riesgo de resistencias similares a los observados en pacientes adultos184,185. Tanto ETV como TDF son igual de eficaces en población pediátrica y, lo mismo que en la población adulta, constituyen los fármacos de elección si está indicado el tratamiento.
Recomendaciones:- •
Lasindicaciones de tratamiento de la hepatitis B en los pacientes con VIH positivo son las mismas que en los pacientes monoinfectados. En todos los pacientes coinfectados se debe indicar tratamiento con combinaciones basadas en TDF/TAF con LAM/emtricitabina, independientemente de la cifra de linfocitos CD4+ (A1).
- •
Los pacientes en hemodiálisis deben tratarse con análogos de nucleós(t)idos de alta barrera genética (ETV/TAF), ajustando la dosis en el caso de ETV. En pacientes sin resistencia a LAM, ETV constituye la primera elección y se reserva TAF para los pretratados con LAM (B1).
- •
El IFN-PEG durante 48 semanas es el tratamiento recomendado para la hepatitis D crónica compensada, que consigue la respuesta virológica en aproximadamente el 25% de los pacientes. Los antivirales orales para el VHB no son eficaces para el VHD, pero deben utilizarse si existe replicación activa del VHB (ADN-VHB > 2.000 UI/ml en pacientes sin cirrosis o cualquier nivel en pacientes con cirrosis) (A1).
- •
En los pacientes con coinfección de virus de la hepatitis B y C la tasa de respuesta al tratamiento con antivirales directos es similar a la de los pacientes monoinfectados por VHC. Sin embargo, existe riesgo de reactivación del VHB durante o después del tratamiento con antivirales directos. Se debe controlar estrechamente el nivel de ADN-VHB en los pacientes con HBsAg positivo en tratamiento para la hepatitis C, iniciar el tratamiento con análogos de nucléos(t)idos (ETV o TDF/TAF) en aquellos con indicación de hacerlo y considerar la profilaxis en los restantes durante el tratamiento de la hepatitis C y hasta 12 semanas después.
- •
En las mujeres embarazadas la decisión del tratamiento debe contemplar la gravedad de la enfermedad y el riesgo de la transmisión perinatal. Además de la inmunoprofilaxis activa y pasiva con vacuna y gammaglobulina específica en todos los recién nacidos, en las pacientes con niveles de viremia elevados (>200.000 UI/ml) se recomienda el tratamiento con TDF a partir de la semana 24-28 de gestación. En las mujeres que ya están en tratamiento con análogos no se debe suspender la medicación, pero hay que hacer el cambio a TDF si recibían otro antiviral (A1).
- •
La incidencia de infección por VHB en niños se ha reducido significativamente en los últimos años (A1). En los pocos casos en los que está indicado el tratamiento, ETV y TDF son los fármacos de elección, al igual que en la población adulta (B1).
Las personas con infección crónica (con HBsAg positivo) o con contacto previo con el VHB (con HBsAg negativo y anti-HBc positivo) que reciben tratamientos inmunosupresores o fármacos biológicos están expuestas a una reactivación de la infección cuya gravedad puede ir desde una elevación asintomática y transitoria de las transaminasas hasta una hepatitis fulminante. Cuando el VHB infecta a una persona susceptible, el virus penetra en los hepatocitos, su ADN se integra en el ADN hepatocitario y se transforma en ADNccc. El ADNccc es bastante estable en las células infectadas y puede persistir durante décadas en un estado latente que sirve como reservorio para la reactivación del VHB, incluso en pacientes con una aparente resolución de la infección por el VHB (con HBsAg negativo y anti-HBc positivo)186.
La reactivación del VHB se define como un aumento en la replicación viral (generalmente >1 log de ADN-VHB) en personas con carga viral detectable o como la positividad del ADN-VHB en personas con carga viral indetectable o infección resuelta187,188. En pacientes con HBsAg positivo, la reactivación se caracteriza por un aumento rápido en el nivel de ADN-VHB, seguido de un aumento de transaminasas. En pacientes con HBsAg negativo, este proceso suele ir precedido por una positivización del HBsAg189,190. El mecanismo al que se atribuye la reactivación está relacionado, primero, con un aumento de la replicación del VHB y de la expresión de sus antígenos en los hepatocitos durante la inmunosupresión, seguido de una destrucción de hepatocitos infectados mediada por linfocitos T durante la recuperación inmune.
Se han descrito factores relacionados con el huésped, con el virus y con el tipo de tratamiento que se asocian con un riesgo mayor de reactivación del VHB187,188. La presencia de HBsAg o de ADN-VHB detectable incrementa considerablemente el riesgo de reactivación. Parece que en los pacientes con HBsAg negativo y anti-HBc positivo la positividad del anti-HBs es un factor protector frente a una eventual reactivación; no obstante, la información es limitada y este factor actualmente no modifica la indicación de tratamiento profiláctico191. La enfermedad subyacente también puede tener un impacto sobre el riesgo de reactivación (por ejemplo, linfoma). En general, a mayor potencia del tratamiento citotóxico o inmunosupresor, mayor es el riesgo de reactivación viral. El nivel de inmunosupresión necesario para producir reactivación en pacientes con HBsAg positivo es menor que en aquellos con HBsAg negativo y antiHBc positivo; sin embargo, la prevalencia de personas con infección resuelta por VHB es mucho mayor, por lo que esta situación es clínicamente relevante. Las terapias que deplecionan los linfocitos B, como el rituximab, aumentan de forma significativa el riesgo de reactivación tanto en pacientes con HBsAg positivo como en pacientes con HBsAg negativo y anti-HBc positivo. Por otro lado, en caso de pacientes trasplantados de médula ósea, la reactivación del VHB es casi universal en pacientes con HBsAg positivo y de aproximadamente el 50% en aquellos con infección resuelta18,192.
El primer paso para prevenir la reactivación por VHB es identificar a los pacientes en riesgo. Se debe evaluar el estado serológico del VHB en todos los candidatos a tratamiento inmunosupresor o quimioterapia mediante la determinación de HBsAg y anti-HBc. En caso de serologías negativas, podría evaluarse el estado vacunal (anti-HBs) y completar la pauta si fuera necesario. No obstante, con frecuencia, en estos pacientes no es posible demorar el tratamiento inmunosupresor tras la administración de la vacuna. En caso de HBsAg positivo, los pacientes deben ser remitidos al especialista para la evaluación y diagnóstico de la fase de infección por VHB en la que se encuentran y, en consecuencia, determinar si cumplen criterios para iniciar tratamiento antiviral. En caso de HBsAg negativo y anti-HBc positivo se debe completar el estudio con la determinación de ADN-VHB y, si este es detectable, los pacientes deben manejarse como el grupo de HBsAg positivo y remitirse al especialista.
Tomando en consideración los 2principales factores (el tipo de infección por VHB y el tipo de tratamiento inmunosupresor) se puede estratificar el riesgo de reactivación en bajo (<1%), moderado (1-10%) y alto (>10%)18,190,191 (tabla 7). Los pacientes HBsAg positivo que no tengan indicación de tratamiento deberán recibir profilaxis antiviral si están incluidos en los grupos de riesgo alto o moderado. El mismo criterio para el inicio de la profilaxis deberá aplicarse a los pacientes con HBsAg negativo, antiHBc positivo y ADN-VHB positivo, mientras que en los ADN-VHB negativo la profilaxis estaría indicada si pertenecen al grupo de alto riesgo. Los pacientes con este perfil incluidos en los grupos de riesgo moderado o bajo-moderado deben ser controlados de forma estrecha (evaluar al menos cada 3meses el nivel de transaminasas, ADN-VHB y HBsAg durante y hasta 6 meses después de finalizado el tratamiento inmunosupresor); en caso de que este control periódico no sea posible por cualquier razón, deberá considerarse la profilaxis antiviral.
Riesgo de reactivación VHB según el tratamiento inmunosupresor y el estado serológico del VHB
| Tipo de tratamiento inmunosupresor | HBsAg positivo | HBsAg negativo y anti-HBc positivo |
|---|---|---|
| Tratamientos deplecionantes de linfocitos B (p. ej., rituximab, natalizumab, alemtuzumab) | Alto | Alto |
| Inmosupresión asociada al trasplante de médula ósea | Alto | Alto |
| Inhibidores potentes TNFα (p. ej., infliximab, adalimumab, certolizumab, golimumab) | Moderado-alto | Bajo-moderado |
| Derivados antraciclínicos (p. ej., doxorrubicina) | Alto | Bajo-moderado |
| Tratamiento local del CHC (TACE) | Alto | Bajo-moderado |
| Quimioterapia sistémica o inhibidores de citocina o integrina (p. ej., abatacept, ustekinumab, natalizumab, vedolizumab) | Moderado | Bajo-moderado |
| Inhibidores ciclofilina (p. ej., ciclosporina) | Moderado | Bajo-moderado |
| Inhibidores tirosina-cinasa (p. ej., imatinib) | Moderado | Bajo-moderado |
| Inhibidores del proteosoma (p. ej., bortezomib) | Moderado | Bajo-moderado |
| Inhibidores de la histona deacetilasa (p. ej., romidepsina) | Moderado | Bajo-moderado |
| Inhibidores menos potentes TNF-α (p. ej., etanercept) | Moderado | Bajo |
| Prednisona (o equivalente) ≥10 mg/d ≥ 4 semanas | Alto | Moderado |
| Prednisona (o equivalente) <10 mg/d ≥ 4 semanas | Moderado | Bajo |
| Prednisona (o equivalente) < 1 semana | Bajo | Bajo |
| Antimetabolitos (p. ej., AZA/6-MP, metotrexato) | Bajo | Bajo |
| Inyecciones intraarticulares de corticoides | Bajo | Bajo |
AZA: azatioprina; CHC: carcinoma hepatocelular; MP: mercaptopurina; TACE: quimioembolización transarterial; TNF: factor de necrosis tumoral.
Diversos estudios han demostrado que el tratamiento antiviral con análogos de nucleós(t)idos disminuye muy significativamente el riesgo de reactivación del VHB193. Por otra parte, el tratamiento antiviral preventivo es más eficaz que el tratamiento de la reactivación una vez producida194. La LAM es un fármaco de eficacia demostrada en esta situación y, por su comprobada seguridad y bajo coste, ha sido el fármaco de elección. No obstante, debido al riesgo de aparición de resistencias en pacientes con HBsAg positivo o en los que se prevé que la duración del tratamiento antiviral vaya a ser larga, puede ser preferible utilizar análogos más potentes y con elevada barrera genética como ETV o TDF, que actualmente son alternativas de coste asequible12,195. Aunque no existe experiencia con el uso de TAF en este contexto, estaría indicada su prescripción en casos de enfermedad renal u ósea con antecedente de resistencia a LAM.
La pauta antiviral debe iniciarse preferiblemente al menos 2semanas antes del tratamiento inmunosupresor o la quimioterapia, sobre todo en los pacientes con ADN-VHB detectable, mantenerla durante el tratamiento y seguirla un mínimo de 12 meses (18 meses para los regímenes basados en rituximab u otros anticuerpos anti-CD20) después del cese del tratamiento inmunosupresor e interrumpirlo solo si la enfermedad subyacente está en remisión12. El tratamiento antiviral deberá mantenerse en aquellos pacientes con HBsAg positivo con situación basal de hepatitis B crónica e indicación de tratamiento. Se aconseja monitorizar las pruebas de función hepática y el ADN-VHB cada 3-6 meses durante el tratamiento profiláctico y durante al menos 12 meses después de su cese, ya que algunas reactivaciones del VHB aparecen después de la interrupción de la profilaxis.
Recomendaciones:- •
Es necesario un cribado serológico del VHB a todos los pacientes que vayan a recibir quimioterapia o tratamientos inmunosupresores o biológicos (A1).
- •
En pacientes con HBsAg positivo con riesgo de reactivación moderado o alto y en aquellos con HBsAg negativo y anti-HBc positivo con riesgo alto se recomienda la profilaxis antiviral. En pacientes con HBsAg negativo y anti-HBc positivo con riesgo moderado o bajo-moderado se recomienda la monitorización durante el tratamiento y hasta 6 meses después de finalizado el tratamiento inmunosupresor (B1).
- •
Los fármacos recomendados en la profilaxis antiviral son ETV, TDF o TAF (A2).
- •
La profilaxis antiviral debe iniciarse preferiblemente 2 semanas antes del tratamiento inmunosupresor, sobre todo en casos de ADN-VHB detectable, y debe prolongarse 12 meses (18 meses para los regímenes basados en rituximab u otros anticuerpos anti-CD20) tras su finalización (B1).
Todos los autores han actuado como asesores y ponentes de Gilead Sciences y Bristol Meyers Squibb.