La enfermedad hepática grasa no alcohólica (EHGNA) es la causa más frecuente de hepatopatía crónica en nuestro medio y se prevé un incremento de su incidencia en los próximos años asociada al incremento de la obesidad y el síndrome metabólico. Esta guía de práctica clínica propone recomendaciones sobre el diagnóstico y en especial marcadores no invasivos, así como en el manejo y seguimiento de esta enfermedad. La intervención dietética basada en la dieta mediterránea y el cambio del estilo de vida constituyen el pilar del tratamiento de la EHGNA, pero aún falta por elucidar si la composición de la dieta puede influir en la mejoría de la enfermedad más allá de la pérdida de peso. El tratamiento con fármacos debe restringirse a los pacientes con esteatohepatitis y fibrosis significativa que no consiguen resolución de la esteatohepatitis después de una intervención con dieta y ejercicio físico durante un año. Nuevos fármacos aún en fases iniciales de desarrollo han demostrado ser superiores a placebo. Por último, el impacto de la EHGNA en la indicación de trasplante hepático, la viabilidad del injerto y la recidiva de EHGNA de novo tras el trasplante, así como el incrementado riesgo cardiovascular determinan todo el proceso peritrasplante hepático. Esta guía de práctica clínica se ha elaborado tras la I Reunión de Consenso sobre EHGNA con un panel de experto nacionales e internaciones en Sevilla y tienen como objetivo proponer recomendaciones basadas en la evidencia científica disponible para el manejo de estos pacientes.
Non-alcoholic fatty liver disease (NAFLD) is the main cause of liver diseases in Spain and the incidence is raising due to the outbreak of type 2 diabetes and obesity. This CPG suggests recommendation about diagnosis, mainly non-invasive biomarkers, and clinical management of this entity. Life-style modifications to achieve weight loss is the main target in the management of NAFLD. Low caloric Mediterranean diet and 200 minutes/week of aerobic exercise are encouraged. In non-responders patients with morbid obesity, bariatric surgery or metabolic endoscopy could be indicated. Pharmacological therapy is indicated in patients with NASH and fibrosis and non-responders to weight loss measures. NAFLD could influence liver transplantation, as a growing indication, the impact of steatosis in the graft viability, de novo NAFLD rate after OLT and a raised cardiovascular risk that modify the management of this entity. The current CPG was the result of the First Spanish NAFLD meeting in Seville.
La enfermedad hepática grasa no alcohólica (EHGNA) se ha convertido en la causa más frecuente de enfermedad hepática crónica en niños y adultos, asociada con la epidemia mundial de obesidad y síndrome metabólico (SMet)1-3, y es una causa creciente de enfermedad hepática avanzada en Europa4,5. En los próximos años, la EHGNA y la enfermedad hepática alcohólica se convertirán en las causas más prevalentes de hepatopatía crónica en nuestro medio. La incidencia de nuevos casos de hepatopatía por hepatitis C y hepatitisB disminuirán drásticamente dada la eficacia de los nuevos agentes antivirales de acción directa6,7 y la vacunación universal de la hepatitisB. Los factores asociados con el riesgo incrementado de progresión de la enfermedad hepática incluyen: consumo de alcohol y factores genéticos y ambientales, como edad, sexo, hábitos dietéticos y estado nutricional8-10. La intervención dietética y el cambio del estilo de vida constituyen el pilar del tratamiento de la EHGNA11. La incorporación de medidas encaminadas a mantener estos cambios del estilo de vida a lo largo del tiempo constituye un gran reto12.
Estas guías de práctica clínica se han elaborado tras la IReunión de Consenso sobre EHGNA celebrada en mayo de 2016 en Sevilla, bajo el auspicio de la Asociación Española para el Estudio del Hígado (AEEH) y con la colaboración de un panel de expertos nacionales e internacionales. Tienen como objetivo proponer recomendaciones sobre el manejo de la enfermedad por EHGNA y responder preguntas clave para la práctica clínica de gastroenterología, hepatología, medicina interna y atención primaria.
La evidencia y las recomendaciones de esta guía se han establecido de acuerdo a los niveles: A (alto), B (moderado), C (bajo) y grados: fuerte (1), débil (2).
Las recomendaciones iniciales tras la Reunión de Consenso sobre el grado de evidencia científica fueron evaluadas posteriormente por un jurado de expertos para asegurar la mayor objetividad posible de las mismas.
Enfermedad hepática grasa no alcohólicaPrevalencia e incidencia¿Cuál es la prevalencia de EHGNA en la población general?Los datos respecto a la prevalencia de EHGNA varían en función de la población estudiada (edad, sexo, raza, comorbilidades), de las diferencias geográficas y de los métodos diagnósticos utilizados. La mayoría de datos sobre la prevalencia de EHGNA proceden de estudios que han usado técnicas no invasivas, especialmente ecografía o resonancia magnética (RM)2,3.
La prevalencia de EHGNA en estudios que lo han evaluado únicamente mediante ecografía varía entre el 17 y el 46%. En España, la prevalencia estimada mediante estudios poblacionales es del 25,8%, y el grado de fibrosis significativa, estimada mediante la combinación secuencial de elastografía de transición y biopsia hepática, es del 2,8% en la población general13,14. Los resultados de un metaanálisis muy reciente que ha analizado un total de 86 estudios de 22 países con una muestra de más de 8 millones de individuos muestran una prevalencia global de EHGNA del 25%15,16.
Recomendaciones- •
La prevalencia global de EHGNA es elevada. Se estima del 25% en Europa en población adulta, y actualmente representa la enfermedad hepática crónica más frecuente en los países occidentales (A1).
La prevalencia de EHGNA aumenta en paralelo a la prevalencia de SMet y sus componentes, en especial la obesidad y la diabetes mellitus (DM)17,18.
Todos los estudios poblacionales y diferentes metaanálisis coinciden en demostrar que la prevalencia de EHGNA y esteatohepatitis no alcohólica (EHNA) es significativamente superior en pacientes con SMet o con la presencia de algunos de sus componentes, especialmente obesidad y DM, aunque también con hipertensión arterial (HTA). La prevalencia de EHGNA y EHNA en pacientes obesos sometidos a cirugía bariátrica se ha estimado hasta en el 91 y el 37%, respectivamente. Entre los pacientes con DM, la prevalencia de EHGNA se estima en un 40-70%, y la prevalencia de EHNA, alrededor del 22%19. Dado que la prevalencia de DM tipo 2 (DM2) en la población española es del 13,8%20, las tasas estimadas de EHNA en esta población serían del 5,5-9,7%.
RecomendacionesLa prevalencia de EHGNA y EHNA es significativamente superior en los pacientes con SMet y particularmente en aquellos con obesidad y/o DM2, en comparación con la población general (A1).
¿Está aumentando la prevalencia EHGNA en las últimas décadas?La información sobre la incidencia de EHGNA es limitada. Teniendo en cuenta que la prevalencia de obesidad ha aumentado de 2 a 3 veces en las últimas 3décadas en nuestro país21, es asumible que la incidencia de EHGNA haya aumentado de forma proporcional. Los resultados de un estudio reciente indican que en Estados Unidos los pacientes incluidos en lista de espera con EHNA aumentaron en un 170% entre 2004 y 2013, lo que sugiere indirectamente un aumento marcado en su incidencia3,19. En este contexto, en 2013 la EHNA se estableció como la segunda causa más frecuente de inclusión de los pacientes en lista de espera de trasplante hepático (TH)16-22.
RecomendacionesLa prevalencia de EHGNA está aumentando de forma global en las últimas décadas en paralelo al aumento progresivo de la obesidad y la diabetes en la población general, aunque los datos específicos respecto a la incidencia en nuestra área todavía son limitados (B1).
¿Existe evidencia para realizar cribado de EHGNA en la población general?Ante la elevada prevalencia de EHGNA y su potencial progresión a EHNA y CH, parece razonable plantear estrategias de cribado1. Estudios recientes han investigado la utilidad de programas de cribado para la detección de fibrosis hepática significativa en población general y en población con factores de riesgo.
En resumen, estos estudios muestran una prevalencia de fibrosis hepática significativa del 6% en población general y del 18% en población con factores de riesgo, siendo la EHGNA la causa más frecuente de fibrosis en estos casos14,23. Aunque estos datos sugieren que se debería realizar el cribado en población con factores de riesgo, son necesarios estudios de coste-efectividad sobre estos programas de cribado para confirmar cuál es la mejor estrategia a seguir24.
Recomendaciones- •
Se debe realizar cribado de EHGNA en población de riesgo: los pacientes con obesidad, DM o SMet, mediante estudio de las enzimas hepáticas y ecografía (B1).
- •
Sin embargo, teniendo en cuenta la amplia población sobre la que incidiría el cribado, no disponemos de datos para confirmar si esta estrategia es sostenible y coste-efectiva (A2).
El EHGNA incluye un amplio espectro de lesiones que van desde la esteatosis hepática simple, que suele tener un curso estable, a la EHNA y la fibrosis25. La EHNA y la fibrosis presenta riesgo de progresión a cirrosis y carcinoma hepatocelular (CHC)26. En el 20% de los casos la fibrosis evoluciona con rapidez, en su mayoría en pacientes con EHNA24. La mortalidad por hepatopatía de los pacientes con EHNA se sitúa hasta el 18% frente al 3% sin EHNA a los 18,5años de seguimiento27. A los 10-15años del diagnóstico, entre el 5 y el 10% de los pacientes con EHNA sufrirán CH descompensada en el seguimiento, y entre el 1 y el 2%, un CHC28.
Recomendaciones- •
La historia natural de EHGNA sin EHNA es similar a la población general, mientras que la EHNA puede evolucionar a fibrosis avanzada, CH y CHC con una mortalidad estimada de 10-12% a los 10-15años del diagnóstico (A2).
- •
La comorbilidad de los pacientes con EHNA condiciona su supervivencia. El denominador común es la resistencia a la insulina (RI) y el síndrome metabólico (SMet). La principal causa de muerte en pacientes con EHNA es la enfermedad coronaria, seguida de las neoplasias extrahepáticas y la asociada a cirrosis (A2).
Estudios poblacionales y análisis retrospectivos confirman que la EHNA es una causa muy frecuente de cirrosis criptogénica y puede llegar a ser la indicación del 5-10% de los TH29. El perfil de los pacientes son mujeres entre 50-60años, con antecedentes de obesidad o DM2 con transaminasas discretamente elevadas. La presentación clínica en la mitad de los casos es una complicación de la hipertensión portal (HTP). La prevalencia de CHC se sitúa en torno al 7% y parece ser mayor que la descrita en la cirrosis relacionada con hemocromatosis o en colangitis biliar primaria pero menor que la encontrada en cirrosis virales o en cirrosis etílica.
Recomendaciones- •
La EHNA es una causa frecuente de cirrosis criptogénica, y su presentación clínica es típica como complicación de la HTP en hasta el 50% de los casos (A2).
El EHGNA en niños es un problema creciente que alcanza en algunos países desarrollados dimensiones epidémicas. Es la causa más común de enfermedad hepática en la infancia, con una prevalencia del 7,6-9,6% que aumenta hasta el 29,8-34,7% en casos de sobrepeso y obesidad30. Se conoce peor la historia natural del EHGNA en niños que en adultos, aunque cubre el mismo espectro de lesiones (EHGNA, EHNA, CH y CHC)31. En 66 niños con EHGNA seguidos durante 20años la supervivencia libre de trasplante fue significativamente menor a la esperada, falleciendo dos y precisando trasplante otros dos por CH descompensada. Al diagnóstico, el 29% de los niños tenía un SMet completo, y el 83% de ellos tenía al menos un parámetro de SMet: obesidad, HTA, dislipemia y/o hiperglucemia32.
Recomendaciones- •
La EHGNA en niños tiene el mismo espectro clínico que en adultos (A1).
- •
La EHNA y su progresión a cirrosis y cáncer de hígado está bien establecida y se considera el SMet como factor de progresión (A1).
En población pediátrica y adolescente, la EHGNA/EHNA se desarrolla en paralelo al incremento de la RI producido en el periodo prepuberal y puberal, por lo que es muy infrecuente su presentación en niños menores de 10años33,34. La obesidad central y la presencia de SMet aumentan el riesgo de esteatosis y EHNA en niños con sobrepeso y obesidad35,36. No hay una herramienta de cribado establecida en población pediátrica. A pesar de las limitaciones que tienen la determinación de transaminasas (infradiagnostican la esteatosis) y las técnicas radiológicas (solo definen grado de esteatosis, pero no de actividad inflamatoria ni de fibrosis), por su disponibilidad, coste e inocuidad la determinación de transaminasas y ecografía abdominal son herramientas útiles para cribado de EHGNA37.
RecomendacionesEl cribado se debe hacer en niños por encima de los 10 años que presenten:
- a)
Obesidad (índice de masa corporal [IMC] percentil≥95).
- b)
Sobrepeso (IMC percentil≥85) con factores de riesgo asociado (obesidad central, SMet, DM, RI o asociación familiar) (B1).
- •
Las herramientas de diagnóstico recomendadas en práctica clínica son la actividad de transaminasas y la ecografía abdominal (B1).
El patrón estándar para el diagnóstico y para determinar el pronóstico es la biopsia hepática. La EHNA pediátrica (denominada non alcoholic steatohepatitis [NASH] tipo 2) tiene caracteres diferenciales del adulto (NASH tipo 1) con un predominio de afectación portal (inflamación y fibrosis) y ausencia de balonización, aunque en una mayoría de niños afectados se solapan ambos tipos, por lo que son necesarios modelos de gravedad histológica específicos en niños38,39. La biopsia hepática es una técnica invasiva y costosa. Los métodos no invasivos para determinar EHNA y fibrosis utilizados en población adulta no están suficientemente validados en población pediátrica, aunque la determinación de citoqueratina-18 (CK-18) ofrece potencial para ser utilizado como marcador subrogado de EHNA en niños40.
Recomendaciones- •
La biopsia hepática solo se recomienda en caso de sospecha de enfermedad avanzada en población pediátrica, como último paso en el diagnóstico diferencial, o en el contexto de proyectos de investigación o ensayos clínicos (B1).
- •
Los métodos no invasivos para valorar el pronóstico no están suficientemente validados en edad pediátrica como para ser utilizados en la práctica clínica (B2).
Las medidas higiénico-dietéticas (dieta hipocalórica y ejercicio planificado) deben ser la base del tratamiento a pesar de la escasa evidencia disponible31,41. El efecto de estas medidas, sin embargo, es poco duradero por la escasa adherencia. La cirugía bariátrica ha demostrado mejoría histológica en adultos, pero la evidencia disponible al respecto en población pediátrica es muy escasa. La cirugía bariátrica se recomienda en pacientes con obesidad mórbida que presenten un IMC≥40 asociado a comorbilidades graves, entre las que se incluye la EHNA42. Las medidas farmacológicas estudiadas en adultos, como insulino-sensibilizantes (metformina), antioxidantes (vitaminaE), ácidos grasos poliinsaturados, ácido obeticólico y probióticos, o no han obtenido resultados o no han sido explorados en población pediátrica.
Recomendaciones- •
El tratamiento de EHGNA/EHNA en edad pediátrica debe basarse en recomendaciones dietéticas y de ejercicio físico; las medidas farmacológicas no están recomendadas por la escasez de evidencia disponible (B1).
- •
En niños y adolescentes obesos con enfermedad grasa hepática la cirugía bariátrica se debe realizar con la finalidad de tratar la obesidad mórbida (B1).
No, la acumulación de grasa en forma de triglicéridos no es un evento que desencadene per se la muerte celular en los hepatocitos ni la progresión de la enfermedad hepática43. Existen estudios experimentales in vitro y en modelos animales en los que la acumulación de triglicéridos por sobreexpresión de diacilglicerolaciltransferasa tipo 2 (DGAT2), o la administración de ácidos grasos monoinsaturados como el ácido oleico, incrementan la presencia de triglicéridos en hígado de los animales, pero no aumentan la RI o la lesión hepática44.
Recomendaciones- •
La acumulación de grasa en forma de triglicéridos no es un evento que desencadene la muerte celular en los hepatocitos ni la progresión de la enfermedad hepática (A2).
Sí, los estudios realizados en células humanas primarias hepáticas, en líneas tumorales establecidas hepáticas y en modelos experimentales apuntan que la presencia de ácidos grasos libres saturados, como los ácidos caprílico (8:0) y palmítico (16:0), generan estrés del retículo y lesión hepatocelular45,46.
La administración de ácidos grasos monoinsaturados como el ácido oleico (18:1), aunque incrementa el contenido de triglicéridos, reduce el estrés celular y la muerte hepatocelular.
Recomendaciones- •
La presencia de ácidos grasos libres saturados (p.ej., caprílico y palmítico) genera estrés del retículo y lesión hepatocelular. La administración de ácidos grasos monoinsaturados como el ácido oleico reduce el estrés celular y la muerte hepatocelular (A1).
Sí, la RI definida como una respuesta biológica alterada de sus tejidos efectores (hígado, músculo y tejido adiposo), y que se refleja por unos niveles plasmáticos superiores a 20μU/ml de insulina, se relaciona con eventos cardiovasculares y progresión del EHGNA. Numerosos estudios experimentales demuestran que la RI se asocia con el estrés del retículo y estrés oxidativo que inducen fosforilación en serina y treonina del receptor de la insulina, lo que reduce la efectividad de la cascada de señales de la insulina, como se ha demostrado en pacientes con obesidad mórbida y EHGNA47.
Recomendaciones- •
La RI (niveles plasmáticos superiores a 20μU/ml de insulina) se ha relacionado con eventos cardiovasculares y progresión de la enfermedad hepática por depósito de grasa (B2).
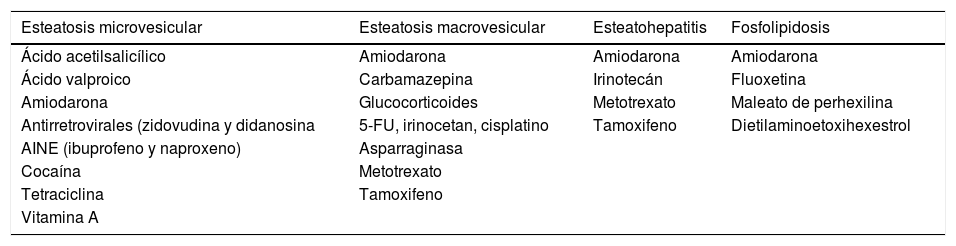
Se estima que solo el 2% de las enfermedades hepáticas por depósito de grasa son secundarias a medicamentos, los cuales se han clasificado en fármacos que pueden producir esteatosis y fosfolipidosis de forma directa (amiodarona, tamoxifeno, maleato de perhexilina y dietilaminoetoxihexestrol), fármacos que pueden inducir cambios metabólicos y precipitar o agravar la enfermedad grasa hepática (tamoxifeno, raloxifeno, corticoides, ácido valproico, carbamazepina, metotrexato, irinotecán, oxaliplatino, TARGA) y fármacos que pueden producir esporádicamente esteatohepatitis (carbamazepina)48,49.
El patrón histológico de la enfermedad es variable. La esteatosis macrovesicular puede producirse por amiodarona, citostáticos, tamoxifeno, corticoides o metotrexato.
La esteatosis microvesicular está en relación con la inhibición de la beta-oxidación de los ácidos grasos y se ha relacionado con ácido valproico, tetraciclina, ácido acetilsalicílico, ibuprofeno, zidovudina, corticoides y vitaminaA. Se ha asociado el desarrollo de EHNA con amiodarona, irinotecán, tamoxifeno y metotrexato44. Por último, la fosfolipidosis puede ser secundaria a amiodarona, fluoxetina, maleato de perhexilina y dietilaminoetoxihexestrol50 (tabla 1). Por otra parte, en el diagnóstico diferencial de la EHGNA se deben descartar otras causas de hepatopatía, así como otras causas de esteatosis hepática como la enfermedad de Wilson y otras causas de esteatosis hepática secundaria cuyo diagnóstico diferencial con la EHGNA «idiopática» es complejo, como es el caso del déficit de lipasa ácida microsomal51.
Listado de fármacos esteatogénicos
| Esteatosis microvesicular | Esteatosis macrovesicular | Esteatohepatitis | Fosfolipidosis |
|---|---|---|---|
| Ácido acetilsalicílico | Amiodarona | Amiodarona | Amiodarona |
| Ácido valproico | Carbamazepina | Irinotecán | Fluoxetina |
| Amiodarona | Glucocorticoides | Metotrexato | Maleato de perhexilina |
| Antirretrovirales (zidovudina y didanosina | 5-FU, irinocetan, cisplatino | Tamoxifeno | Dietilaminoetoxihexestrol |
| AINE (ibuprofeno y naproxeno) | Asparraginasa | ||
| Cocaína | Metotrexato | ||
| Tetraciclina | Tamoxifeno | ||
| Vitamina A |
- •
La enfermedad grasa hepática secundaria a fármacos es una entidad poco frecuente que puede producirse por acción tóxica directa cuyo mecanismo patogénico principal es la disfunción de la beta-oxidación mitocondrial de ácidos grasos, o de forma indirecta (C2).
- •
Los patrones histológicos de la enfermedad por depósito de grasa secundaria a fármacos son esteatosis macrovesicular, esteatosis microvesicular, esteatohepatitis y fosfolipidosis (A2).
Sí, la administración de agentes que incrementan la capacidad beneficiosa del estrés del retículo mediada por la denominada Unfolded Protein Response [UPR], como los ácidos 4-fenilbutírico y ursodeoxicólico conjugado con taurina, reducen la lesión inducida por los ácidos grasos saturados52. La administración de α-tocoferol no ha demostrado un efecto concluyente en los pacientes con EHNA. Sin embargo, estudios recientes apuntan que la administración de una dieta enriquecida con γ-tocoferol en combinación o no con α-tocoferol reduce la respuesta inflamatoria y biomarcadores de estrés oxidativo en los pacientes con SMet, lo que repercute en mejoría del paciente desde el punto de vista cardiovascular53.
Recomendaciones- •
La administración de agentes que incrementan la capacidad beneficiosa del estrés del retículo, como los ácidos 4-fenilbutírico y ursodeoxicólico conjugado con taurina, reducen la lesión inducida por los ácidos grasos saturados (B2).
La dieta rica en grasa, independientemente de que exista obesidad, modifica la microbiota intestinal54, siendo la alteración más consistente el aumento de phylum Firmicutes y una disminución del de Bacteriodetes. Esta disbiosis intestinal contribuye a la enfermedad hepática por depósito de grasa por mecanismos metabólicos e inflamatorios. Los primeros incluyen cambios en el balance energético de la dieta y disminución de la síntesis de colina y producción de metabolitos tóxicos. La inflamación hepática es, en gran parte, debida al incremento en la sangre portal de endotoxina y otros productos bacterianos al aumentar la permeabilidad por inflamación intestinal secundaria a la propia disbiosis55,56.
Recomendaciones- •
La disbiosis intestinal secundaria a una dieta rica en grasa contribuye a la enfermedad hepática metabólica grasa al producir cambios en el balance energético de la dieta, disminuir la síntesis de colina y promover la endotoxemia secundaria al aumento de la permeabilidad intestinal (B1).
Los datos son heterogéneos y provienen de estudios retrospectivos, que se diseñaron con otro objetivo y por tanto están condicionados por factores de confusión. Los datos publicados tanto en el trabajo de Zoller y Tilg57 como en las guías de EASL-EASD-EASO58 son un ejemplo de la heterogeneidad que existe en la población y en las herramientas utilizadas para establecer el diagnóstico de CHC (tomografía computarizada [TC], alfa-feto-proteína, ecografía o revisión de historias clínicas)58,59. Los datos de prevalencia de CHC en pacientes con EHNA provienen de cohortes retrospectivas y de una población muy seleccionada en la cual no se considera el estadio de fibrosis60-63. A pesar de estas limitaciones, en los últimos años se ha observado que aproximadamente la mitad de los casos de CHC surgen en estadios precirróticos de la EHNA. Además, los CHC sobre EHNA se presentan frecuentemente como tumores de gran tamaño y peor evolución que los asociados a hepatopatías de otras etiologías; en un análisis retrospectivo del registro de la base de datos del Medicare, el 61% de los pacientes con CHC asociado a EHGNA fallecieron al año, en comparación con el 50% de los que se asociaban a hepatitis virales, lo que puede deberse a que presentaban más edad, mayor comorbilidad y que no entraron en programas de vigilancia del CHC64,65. Esto plantea un área de investigación de gran interés para los próximos años. Un problema adicional es la dificultad del examen ecográfico en el contexto de obesidad, lo que puede complicar la vigilancia y el seguimiento de estos pacientes.
Dada la inmensa población de riesgo que supondría el cribado de esta población, se deberían identificar factores de riesgo para recomendar la prioridad de cribado en estos pacientes. La obesidad infantil (entre 7 y 13años) se ha identificado como un factor de riesgo en una cohorte danesa retrospectiva de 285.884 individuos66.
También se ha identificado como factor de riesgo la obesidad en edades jóvenes (20-40años) (OR=2,6)67. En un estudio prospectivo para explorar el riesgo de tumores malignos en la obesidad, se observó que el IMC>35kg/m2 se asoció a un RR=4,25)68.
También se ha observado un mayor riesgo de CHC en hígados explantados de obesos con cirrosis criptogénica (OR=11,1).
Igualmente, la DM se asocia de forma independiente a mayor riesgo en estudios tanto retrospectivos como prospectivos69-71.
La metformina se asoció a una reducción del riesgo de CHC en un metaanálisis reciente72.
Recomendaciones- •
Los pacientes con cirrosis por EHNA presentan un riesgo anual de desarrollar CHC estimado mayor del 1,5% (A1).
- •
En los pacientes con EHNA y ausencia de cirrosis se pueden desarrollar CHC y se desconoce cuál es la mejor estrategia de cribado. Sin embargo, se recomienda realizar cribado en los pacientes no cirróticos con fibrosis y obesidad (IMC>35kg/m2) o DM (B2).
- •
Se recomienda optimizar el control glucémico en los pacientes con DM2; la utilización sola, o en asociación con otros ADO, de metformina es una opción adecuada (B2).
El objetivo del cribado de CHC es el diagnóstico precoz que permita disminuir la mortalidad. La detección de nódulos únicos menores de 3cm, idealmente ≤2cm, permite la aplicación de tratamientos radicales. El cribado está indicado en pacientes candidatos a TH con un riesgo de desarrollar CHC>1,5% anual73. La herramienta recomendada para el cribado de CHC es la ecografía hepatobiliar cada 6meses. Los niveles de alfa-feto-proteína y/o el uso de la TC o la RM en lugar de ecografía no están recomendados74.
Recomendaciones- •
La TC o la RM se asocian a mayor riesgo de irradiación o alto coste, por lo que no se recomiendan como pruebas de cribado de hepatocarcinoma (B2).
- •
Los pacientes con EHNA y obesidad mórbida o complicaciones cardiovasculares graves podrían no ser candidatos a tratamientos específicos radicales (cirugía, tratamiento percutáneo o TH). Por tal motivo, se debería considerar la gravedad de la comorbilidad asociada a la EHNA para decidir si el paciente es candidato a cribado de CHC (C1).
Los criterios diagnósticos de CHC son: 1)criterios diagnósticos no invasivos (lesión hepática hipercaptante en fase arterial y lavado de la lesión en fase venosa) en pacientes cirróticos, independientemente de la etiología, y 2)criterios invasivos, por medio de una biopsia hepática, en pacientes cirróticos que no cumplen los criterios típicos no invasivos de CHC o en pacientes no cirróticos73,74. La esteatosis hepática focal puede interpretarse como nódulos hepáticos y requieren diagnóstico diferencial frente a CHC. No existen datos en la literatura para modificar estos criterios o algoritmo diagnóstico en pacientes con EHNA.
Recomendaciones- •
No se deben modificar los criterios diagnósticos de CHC en pacientes con EHNA (A1).
En pacientes no cirróticos, la primera opción terapéutica es la cirugía. En pacientes cirróticos, las opciones terapéuticas dependerán del estadio BCLC del CHC. En los pacientes con EHNA no existen recomendaciones especiales, pero se debe realizar una valoración exhaustiva del riesgo cardiovascular en el caso de ofrecer tratamientos quirúrgicos o sorafenib, ya que las comorbilidades asociadas a la patología de base hacen que estos pacientes sean más vulnerables a presentar contraindicaciones para este tipo de tratamientos. Así mismo, en pacientes candidatos a realizar quimioembolización, la valoración del árbol vascular es esencial, con el fin de evitar potenciales efectos secundarios relacionados con la técnica74,75.
Recomendaciones- •
No se deberían modificar las opciones terapéuticas en esta población, pero se deben considerar las comorbilidades en el momento de decidir la indicación de tratamiento (A2).
El riesgo de desarrollar cáncer diferente a CHC en pacientes con EHNA podría estar condicionado por factores relacionados con la enfermedad de base (EHNA) o a factores no relacionados, como pueden ser factores ambientales, familiares o por efectos adversos de la medicación que recibe el paciente74. Por tal motivo, el análisis de riesgo es complejo y la información publicada en relación a riesgo aumentado de cáncer extrahepático en la EHNA es controvertida.
Recomendaciones- •
El riesgo de desarrollar cáncer diferente a CHC en pacientes con EHNA no se halla bien definido (C2).
Existe un único estudio prospectivo que evalúa el riesgo de hepatotoxicidad idiosincrásica en pacientes con EHNA (n=74) y hepatitisC (n=174), en el que 6 pacientes del primer grupo desarrollaron hepatotoxicidad (incidencia 2,4% y OR de 3,95)76. Nguyen et al.77 apreciaron que el desarrollo de toxicidad hepática era más frecuente en pacientes con EHNA con un OR de 7,43. Aunque este estudio indica un mayor riesgo de toxicidad en EHNA, el escaso número de eventos y la ausencia de un grupo control limitan sus conclusiones. Sin embargo, otros fármacos, como las estatinas, no han mostrado un mayor riesgo de hepatotoxicidad en pacientes con hipertransaminasemia78.
Recomendaciones- •
La presencia de EHNA puede aumentar el riesgo de hepatotoxicidad (B2).
- •
La presencia de enfermedad hepática no aumenta el riesgo de hepatotoxicidad por estatinas (B1).
La biopsia es el único medio de evaluar la enfermedad hepática en el paciente con esteatohepatitis, ya que las pruebas de función hepática no ofrecen una correcta valoración de la balonización y/o necrosis hepatocelular ni del estadio de fibrosis79-82. En los pacientes con enfermedad hepática crónica de otras etiologías se deben evaluar factores de riesgo metabólicos como la RI y la presencia de esteatosis por ecografía. Si están presentes, se debería realizar una biopsia hepática para confirmar la existencia de una EHGNA concomitante33.
Los objetivos que debe marcarse el patólogo al informar el estudio histológico son:
- •
Sugerir y orientar sobre la etiología de la enfermedad hepática crónica.
- •
Confirmar el diagnóstico clínico y descartar otras posibles hepatopatías crónicas.
- •
Determinar el estudio evolutivo.
- •
Evaluar el grado de actividad inflamatoria en el momento diagnóstico.
- •
Determinar el pronóstico.
- •
Evaluar la progresión de la enfermedad.
- •
La biopsia hepática debe realizarse exclusivamente a pacientes seleccionados mediante técnicas no invasivas (analíticas y pruebas de imagen) (A1).
- •
La biopsia hepática no es un método de cribado para la EHGNA (A1).
El diagnóstico histológico de esteatohepatitis debe ser realizado preferiblemente por patólogos expertos en patología hepática o por patólogos generales con un entrenamiento básico en hepatología83. La principal característica histológica de la enfermedad hepática por depósito de grasa es el acúmulo de grasa en los hepatocitos, lo que se denomina esteatosis. La presencia de más de un 5% de hepatocitos esteatósicos es el criterio indispensable para el diagnóstico histológico de esteatosis hepática. Los criterios mínimos para el diagnóstico histológico de esteatohepatitis incluyen la presencia de esteatosis, daño hepatocelular (en forma de degeneración balonizante, apoptosis o necrosis) e infiltración inflamatoria lobulillar84,85. La presencia de fibrosis leve es frecuente en la esteatohepatitis, pero no es un requisito necesario para el diagnóstico histológico.
Recomendaciones- •
El diagnóstico de esteatohepatitis se debe realizar tras la evaluación histológica de una biopsia hepática por patólogos expertos en patología hepática o por patólogos generales con un entrenamiento básico en hepatología y atendiendo a los criterios histológicos establecidos y validados internacionalmente (A1).
El grado de actividad histológica de la EHNA se obtiene combinando la puntuación de esteatosis, inflamación lobulillar y balonización hepatocitaria según Kleiner et al.86.
La esteatosis se puntúa como 0 cuando es menor del 5% del tejido hepático; 1 si ≥5-33%; 2 si ≥34-66% y 3 si >66%. El grado de inflamación lobulillar se puntúa como 0 si no hay focos inflamatorios; 1 si hay <2 focos; 2 si hay de 2 a 4 focos, y 3 si hay >4 focos. La balonización hepatocitaria se estimará como 0 (no balonización), 1 (escasas células balonizadas) o 2 (prominente balonización).
El estadio de fibrosis se puntúa con un 0 si no hay fibrosis; 1 si hay fibrosis perisinusoidal o portal/periportal; 2 si hay fibrosis perisinusoidal y portal/periportal; 3 si hay puentes de fibrosis, y 4 si hay cirrosis87.
Recomendaciones- •
Emplear un protocolo de diagnóstico internacionalmente aceptado, como el «NAFLD activity score» de Kleiner o el «Steatosis, Activity and Fibrosis score» (SAF), evita la variabilidad interobservador y permite una mejor clasificación histológica (A1).
La lectura histológica protocolizada de biopsias hepáticas de pacientes con sospecha clínica de EHGNA es imprescindible para la optimización del diagnóstico y ayuda a disminuir las variaciones interobservador88. Es además un método adecuado para el estudio de series de pacientes y para la evaluación del efecto de las terapias en los ensayos clínicos que exigen biopsias periódicas. No obstante, el uso de un protocolo de lectura histológica como el SAF score (índice esteatosis, inflamación y fibrosis) o el algoritmo FLIP (fatty liver inhibition of progression)89 tiene el riesgo de disminuir la capacidad para integrar globalmente los datos microscópicos en una interpretación diagnóstica. Su finalidad es complementar, no sustituir, al diagnóstico histopatológico.
Recomendaciones- •
Para la lectura histológica de biopsias hepáticas de pacientes con sospecha clínica de EHNA se recomienda utilizar sistemáticamente el nuevo sistema de clasificación y estadificación denominado SAF score, desarrollado conjuntamente con el algoritmo diagnóstico FLIP (B1).
Existen diversos paneles de biomarcadores validados y capaces de determinar la presencia de esteatosis con alta especificidad, aunque sin capacidad para determinar su gravedad. Entre ellos destacan el Hepatic Steatosis Index90 y el Fatty Liver Index (FLI)91, validados independientemente33 (tabla 2). Estos paneles de biomarcadores pueden ser útiles en el cribado de EHGNA en población general y en pacientes en riesgo, como los diabéticos tipo2 u obesos92.
Métodos no invasivos de diagnóstico de EHGNA
| Variables | Fórmula | |
|---|---|---|
| Hepatic Steatosis Index (HSI) | AST ALT IMC Sexo DM2 | 8 × (ALT/AST ratio) + IMC (+2, si mujer; +2, si DM) |
| Fatty Liver Index (FLI) | Triglicéridos IMC GGT Cintura (cm) | FLI = (e 0,953*loge(triglicéridos)+0,139*IMC+0,718*loge(GGT)+0,053*circunferencia de cintura−15,745) / (1 + e0,953*loge(triglicéridos)+0,139*IMC+0,718*loge(GGT)+0,053*circunferencia de cintura−15,745) × 100 |
- •
Los paneles de biomarcadores son útiles en el cribado de EHGNA en poblaciones de riesgo como los diabéticos tipo2, aunque su empleo debe ser individualizado y no se puede recomendar su uso generalizado como herramientas de cribado en la actualidad (A2).
Hasta la fecha ningún marcador bioquímico ha conseguido desplazar a la biopsia hepática como patrón oro para el diagnóstico de esteatohepatitis. El análisis histológico sigue siendo preciso en la confirmación diagnóstica y la valoración de la gravedad tanto de la enfermedad inducida por alcohol como en la EHNA. No obstante, los marcadores bioquímicos de muerte celular, como los fragmentos M65 de la CK-1893, han mostrado resultados modestos en cuanto a precisión diagnóstica de esteatohepatitis. Los métodos basados en análisis lipidómico94 o proteómico, aunque prometedores, requieren todavía estudios de validación externa que los avalen como herramientas diagnósticas estandarizadas.
Recomendaciones- •
La evaluación histológica de la biopsia hepática sigue siendo necesaria para la confirmación diagnóstica y la valoración de la gravedad de la esteatohepatitis (A1).
El NAFLD fibrosis score y el FIB-4 son test validados en el EHGNA y su uso puede evitar la realización de una biopsia hepática95. Además, aportan valor pronóstico, ya que son capaces de predecir mortalidad global, mortalidad cardiovascular y mortalidad de causa hepática.
Los paneles serológicos de fibrosis tienen en general un alto valor predictivo negativo para el diagnóstico de fibrosis avanzada y son útiles para la exclusión de enfermedad avanzada, teniendo una menor utilidad en estadios iniciales de fibrosis96-98.
Recomendaciones- •
Los paneles serológicos de fibrosis basados en biomarcadores son útiles en la exclusión de fibrosis avanzada, pudiendo en ocasiones evitar la realización de una biopsia hepática (B2).
- •
Estos paneles a su vez aportan información sobre el pronóstico de la enfermedad hepática, pues son capaces de predecir mortalidad de origen hepático y, en el caso de la etiología no alcohólica, también de origen cardiovascular (B1).
La ecografía es una técnica sencilla y barata, pero con baja sensibilidad para detectar esteatosis leve. La TC es similar a la ecografía, pero más costosa.
El controlled attenuation parameter (CAP) es un método no invasivo para valorar la esteatosis hepática basado en la medición del componente viscoelástico del hígado. Tiene la ventaja de ir asociado a la elastografía de transición y permitir la valoración simultánea con la fibrosis. Un CAP>248db/m es significativo de esteatosis hepática99.
Tanto la espectroscopia por RM (1H-RME) como las técnicas de imagen de RM con distintos métodos que analizan la proton density fat fraction poseen una elevada sensibilidad y capacidad diagnóstica100,101.
Recomendaciones- •
La ecografía abdominal es una buena técnica de imagen para la evaluación inicial de pacientes con sospecha de esteatosis hepática (A1).
- •
El CAP se puede usar de forma simultánea con la elastografía de transición para la evaluación de la esteatosis (detección y cuantificación), especialmente en poblaciones con alta prevalencia (obesos, diabéticos). (B1).
- •
Las técnicas de RM (imagen y espectroscopia) tiene una elevada capacidad diagnóstica y permiten cuantificar la grasa intrahepática de manera precisa. Son muy útiles para estudios clínicos y ensayos terapéuticos (A1).
La presencia de inflamación asociada a la esteatosis identifica a los pacientes con EHGNA con un riesgo más elevado de fibrosis y progresión de la enfermedad. La presencia de fibrosis es un signo indirecto de existencia de inflamación.
Existen algunas técnicas de imagen, como la ecografía con contrastes especiales, la RM de imagen con la técnica DeMILI102 y la tomografía de emisión de positrones (PET), que en estudios preliminares sugieren una posible utilidad futura en detectar inflamación en pacientes con EHNA103.
Con las técnicas de imagen habituales (ecografía, TC, RM, elastografía) no se puede distinguir una esteatosis simple de una esteatohepatitis104.
Recomendaciones- •
No existe ninguna técnica de imagen que permita identificar y monitorizar los pacientes con EHGNA o EHNA que presentan inflamación o esteatohepatitis (C2).
Las técnicas de imagen convencionales (ecografía, TC, RM) no son capaces de cuantificar el estadio de fibrosis. La elastografía proporciona una estimación del estadio de fibrosis. De forma general, la elastografía tiene alta precisión diagnóstica para estadios avanzados de fibrosis (F3-F4) y para descartar fibrosis (valor predictivo negativo)105,106. En pacientes con obesidad significativa la incorporación de la sonda XL mejorará la fiabilidad diagnóstica106. Por tanto, la elastografía es una herramienta útil para monitorizar la progresión de la fibrosis hepática en la práctica clínica105.
La frecuencia de las determinaciones no está definida, pero parece aconsejable realizar determinaciones periódicas de la rigidez hepática, que podrían recomendarse con periodicidad anual a los pacientes en fases más avanzadas (≥F3) y cada 3años en los pacientes en fases más iniciales.
Recomendaciones- •
La elastografía de transición es útil para identificar pacientes con fibrosis por EHGNA, así como para monitorizar su progresión (B1), repitiendo las determinaciones a intervalos de 1 a 3años, según el grado de fibrosis basal (C2).
- •
En poblaciones con obesidad significativa es importante disponer de una elastografía de transición con las dos sondas incorporadas (M y XL) para mejorar el rendimiento diagnóstico y la fiabilidad de los resultados (B2).
La presencia de CH con HTP o de enfermedad hepática crónica avanzada compensada en los pacientes con EHGNA tiene importantes implicaciones pronósticas y de recomendaciones de cribado. Las pruebas de imagen (ecografía, TC y RM) pueden sugerir la presencia de CH al detectar un hígado de superficie nodular, esplenomegalia y circulación colateral107. La detección de circulación colateral es un signo de HTP clínicamente significativo108.
En pacientes con enfermedad hepática crónica avanzada que presentan plaquetas >150.000 y una rigidez hepática <20kPa, la endoscopia diagnóstica puede evitarse por el bajo riesgo de tener varices grandes. Este criterio está más validado para la enfermedad hepática avanzada de etiología vírica, pero es también aplicable a pacientes con EHGNA107.
Recomendaciones- •
La presencia de CH con HTP en los pacientes con EHGNA se puede sospechar por las técnicas de imagen (ecografía, TC, RM) (B2).
- •
Se puede evitar la endoscopia de cribado de varices a los pacientes con enfermedad hepática crónica avanzada por EHGNA que presentan plaquetas >150.000 y rigidez hepática <20kPa (B1).
En los últimos años se ha tratado de buscar la implicación genética en ambas enfermedades, con el objeto de mejorar la estratificación de los pacientes y contribuir a la llamada medicina personalizada109. Hasta la fecha, se han acumulado evidencias que indican que determinados polimorfismos de un único nucleótido (SNPs) localizados en los genes PNPLA3 y TM6SF2 son los que ejercen mayor influencia110. Hay numerosos estudios que confirman que ser portador de la variante de riesgo del PNPLA3111 y del TM6SF2112 confiere susceptibilidad al desarrollo de la patología, incrementando el riesgo de progresión. Adicionalmente, han surgido varios ensayos clínicos que indican que la variante de riesgo de PNPLA3 puede estar asociada a la respuesta al tratamiento farmacológico, así como a intervenciones en el estilo de vida113.
Recomendaciones- •
Considerando que los portadores de la variante de riesgo de SNPs localizados en los genes PNPLA3 y TM6SF2 presentan una probabilidad incrementada de desarrollar estadios más agresivos de la enfermedad, sería interesante realizar el cribado en poblaciones de riesgo, como una herramienta más de apoyo al clínico a la hora de la toma de decisiones (B2).
Los marcadores genéticos se heredan de manera muy estable y no se ven influidos por otros factores externos. Presentan capacidad predictiva, aunque al tratarse de una patología multifactorial su influencia es limitada. Su determinación se considera coste-efectiva, ya que la técnica aplicada es sencilla y su importe es reducido. Se han descrito numerosos algoritmos que incluyen variables clínicas, epidemiológicas y bioquímicas que ofrecen una moderada seguridad diagnóstica para la predicción de EHGNA y fibrosis en estos pacientes114-116.
No obstante, la inclusión de información genética podría incrementar dicha capacidad diagnóstica de manera significativa, aunque serían necesarios futuros estudios de validación en poblaciones de riesgo.
En varios estudios se ha demostrado que determinados SNPs pueden modular la respuesta de los pacientes con EHGNA a la intervención dietética117-119.
Recomendaciones- •
La determinación del perfil genético del paciente es una estrategia novedosa que debe ser considerada a la hora de realizar la evaluación integral del paciente (B2).
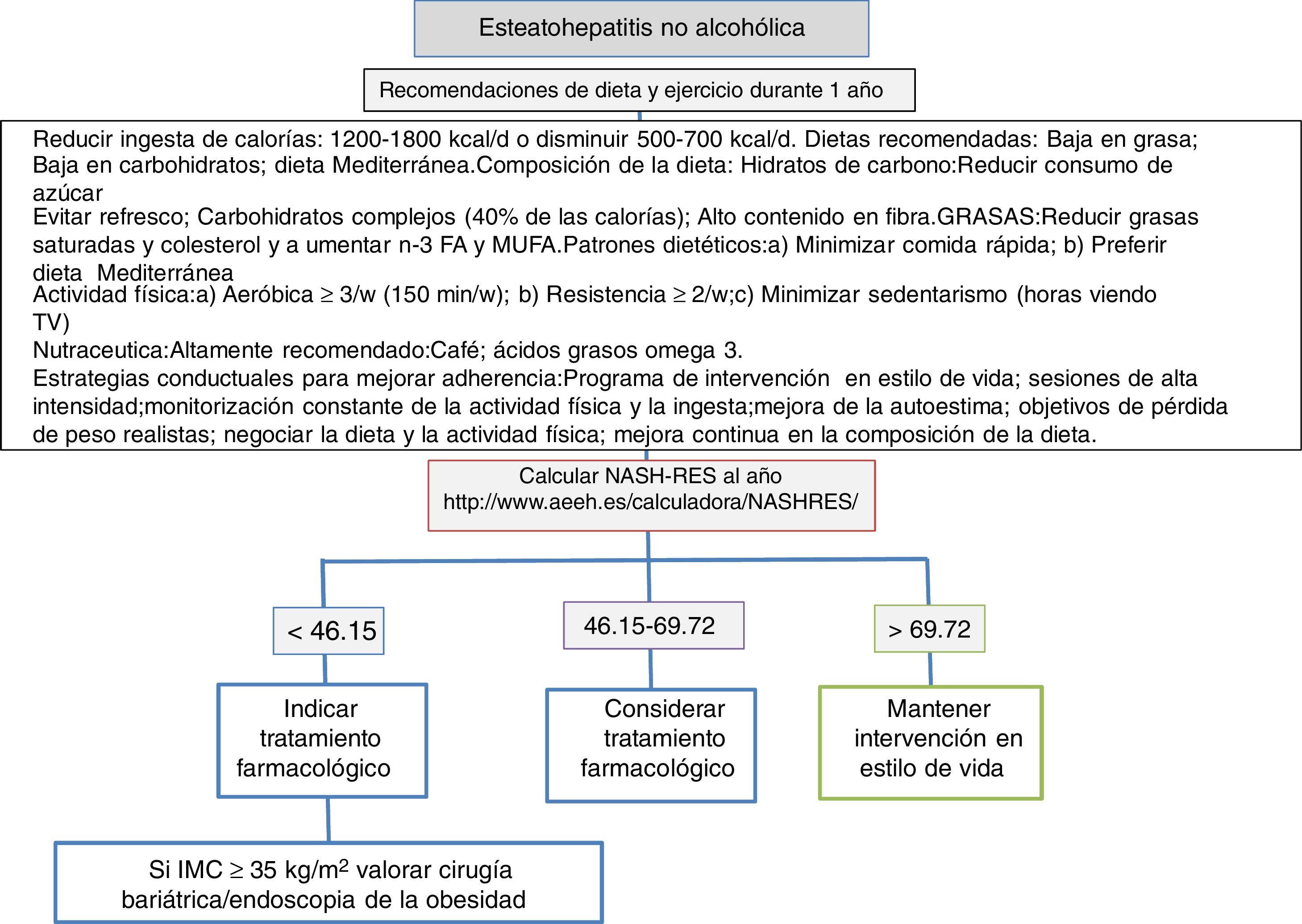
Se recomienda una dieta baja en calorías. En general, el aporte de energía de la dieta es el factor más importante que influye en la cantidad de grasa en el hígado, independientemente de si esta viene de una elevada ingesta de grasas o de hidratos de carbono120. Con respecto a la composición cualitativa de la dieta, las proporciones recomendadas son 50-60% de hidratos de carbono y 20-25% de lípidos. La dieta mediterránea respeta estas proporciones y puede ser la dieta recomendada para el control del EHGNA. Sin embargo, no está asociada a una pérdida de peso significativa, ya que esta depende de la carga calórica de la dieta. En pacientes insulinodependientes hay que tener especial cuidado, ya que se ha demostrado una asociación significativa entre un índice glicémico de la dieta ≥58 y el desarrollo de esteatosis hepática121 (fig. 1).
- •
Se debe recomendar reducir la ingesta calórica a todos los pacientes con EHGNA y sobrepeso/obesidad (A1).
- •
La elección de la dieta debe ser personalizada y basada en las comorbilidades y las preferencias del paciente (B2).
La dieta mediterránea es considerada en la actualidad como un patrón de alimentación saludable para muchas enfermedades, incluyendo el SMet, enfermedad cardiovascular y enfermedades neoplásicas. Este patrón dietético mejora la sensibilidad a la insulina y ha demostrado que consigue una reducción significativa de la esteatosis de hasta el 39%, comparado con un 7% con una dieta baja en grasas y alta en hidratos de carbono122. Este beneficio se postula que es debido al contenido en aceite de oliva (como ácido graso monoinsaturado) independiente del contenido calórico de la dieta, además del aumento de omega-3, fruta, vegetales, fibra y reducción de grasas saturadas, hidratos de carbono simples, bebidas azucaradas y alimentos procesados ricos en fructosa, grasas trans y alcohol123. Se ha reportado además el beneficio del aceite de oliva para otras enfermedades, como la DM2124.
Recomendaciones- •
La dieta mediterránea es la dieta recomendada (B1).
- •
El consumo de aceite de oliva puede estar indicado para los pacientes con EHGNA cuando se utiliza como parte de una dieta mediterránea (B2) así como para la prevención primaria de la EHGNA (C2).
- •
Es aconsejable la abolición de todas las bebidas y alimentos industriales que contengan fructosa (B2).
Se sospecha que muchos de los efectos antioxidantes y citoprotectores del café son independientes de la cafeína y son debidos a otros componentes, como los compuestos clorogénicos. En un metaanálisis reciente se demostró que, aunque el consumo de cafeína total no está asociado ni con la prevalencia ni con el grado de fibrosis hepática de pacientes con EHGNA, el consumo habitual de café con cafeína puede reducir de forma significativa la fibrosis hepática en pacientes con EHGNA. Teniendo en cuenta los potenciales beneficios del café, podemos recomendar su consumo regular en pacientes con EHGNA, puntualizando que se recomienda el consumo de café con cafeína, pero no el de cafeína aislada. La dosis recomendada no está establecida125.
Recomendaciones- •
Se recomienda el consumo habitual de café con cafeína en pacientes con EHGNA. El consumo del mismo ha sido asociado con la mejora histológica del daño hepático también por otras etiologías (A2).
Varios ensayos clínicos y un metaanálisis han demostrado que los suplementos de ácidos grasos omega-3, a partir de un mínimo de 0,83g/día de omega-3, reducen la grasa total en el hígado, aunque esto no se ha demostrado con biopsias hepáticas pareadas126. Los mecanismos que podrían explicar su beneficio en la EHGNA parecen radicar en su participación en la regulación de la expresión génica de sensibilizadores a la insulina y en la reducción de la inflamación, así como en sus efectos inhibidores sobre el factor nuclear kappaB.
Recomendaciones- •
Las dietas ricas en ácidos grasos omega-3 parecen mejorar la esteatosis hepática. No hay datos sobre la dosis óptima para recomendar el empleo de suplementos omega-3. Sin embargo, se considera recomendable la ingesta de alimentos ricos en omega-3 (B1).
En los estudios epidemiológicos, el consumo moderado de alcohol (en especial de vino tinto) se asocia con menor prevalencia de hígado graso no alcohólico, EHNA y fibrosis, e incluso se postula un efecto protector sobre la DM, el SMet y la RI127. La abstinencia total es obligatoria en la cirrosis por EHNA para reducir el riesgo de CHC, ya que se ha postulado que el alcohol es un factor predisponente128. Además, se ha demostrado que el consumo de una pequeña cantidad de alcohol es un factor de riesgo significativo para la aparición de alteración del metabolismo de la glucosa en pacientes con enfermedad por EHGNA y obesidad, si bien el riesgo de aparición varía en función de la cantidad de alcohol consumido129. Ocasionalmente se puede recomendar un consumo moderado (<21 unidades de bebida estándar [UBE] por semana en hombres y <14UBE por semana en mujeres), en especial de vino tinto130.
Recomendaciones- •
Hay datos contradictorios y no hay estudios concluyentes. A la espera de dichos estudios, en pacientes con EHNA es recomendable la abstinencia absoluta de bebidas alcohólicas (B1).
- •
Ocasionalmente, en pacientes con EHGNA sin EHNA o fibrosis se puede permitir un consumo moderado (<21UBE semana en hombres y <14UBE semana en mujeres), en especial de vino tinto (B1).
La pérdida de peso de al menos un 7% a través de los cambios en el estilo de vida131 o la cirugía bariátrica132 durante un año, dependiendo del IMC y las comorbilidades, producen efectos beneficiosos sobre el EHGNA y sus comorbilidades. La dieta mediterránea hipocalórica y el incremento en la actividad física, con la finalidad de bajar peso, deben ser recomendados a todos los pacientes con EHGNA, ya que la pérdida de peso se ha relacionado con la mejoría histológica del tejido y la evolución de la enfermedad133. La cirugía bariátrica debe ser considerada en pacientes con un IMC>40kg/m2 o >35kg/m2 e importantes comorbilidades y que hayan realizado intentos fallidos de cambios en el estilo de vida; la EHNA en sí misma no es una indicación de cirugía bariátrica.
Recomendaciones- •
La pérdida de peso a través de cambios en el estilo de vida o cirugía bariátrica cuando esta esté indicada deben ser recomendados como primera opción terapéutica en pacientes con EHNA (A1).
La intensidad de la pérdida de peso está relacionada de manera directa y proporcionada con la mejoría de las lesiones histológicas en pacientes con EHGNA, independientemente del tipo de intervención que se realice, bien sean cambios en el estilo de vida o cirugía bariátrica. La pérdida de peso igual o superior al 10% induce altas tasas de mejoría (>80%) no solo de las comorbilidades sino de todas las lesiones histológicas de la EHGNA. Por tanto, debemos recomendar pérdidas de peso superiores al 10% para lograr el máximo beneficio. Las pérdidas de peso entre el 7 y el 10% en pacientes con pocos factores de riesgo también mejoran las alteraciones metabólicas y reducen de manera significativa la esteatosis, la inflamación y la balonización133.
Recomendaciones- •
Las intervenciones en el estilo de vida o la cirugía bariátrica están orientadas a inducir pérdida de peso superior al 10%. Sin embargo, tasas entre el 7 y el 10% también producen beneficios a nivel hepático y sobre los factores de riesgo cardiometabólicos (A1).
La pérdida de peso independientemente del tipo de dieta o actividad física es el factor más importante relacionado con la mejoría de las características histológicas de pacientes con EHGNA. Sin embargo, son necesarios nuevos estudios para poder confirmar estas observaciones. Los estudios muestran que la actividad física (150-200min a la semana) produce una mejoría significativa de las alteraciones metabólicas y la esteatosis hepática determinada por histología o métodos no invasivos134. El descenso de las transaminasas se evidencia con una pérdida de peso ≥5%131,135. Tampoco hay estudios que confirmen el beneficio del tipo de ejercicio, la intensidad y la duración134-136.
Recomendaciones- •
La pérdida de peso debe ser recomendada a todos los pacientes con EHGNA (A1).
- •
Se recomienda caminar o correr durante 150-200min a la semana para obtener el máximo beneficio (B2).
La cirugía bariátrica provee efectos positivos y sostenibles en lo que a pérdida de peso se refiere137. La eficacia y la seguridad de la misma dependen fundamentalmente del tipo de técnica empleada y de la experiencia del centro138. La gastrectomía vertical y la derivación gástrica proporcionan tasas de pérdida de peso superiores a la colocación de banda gástrica; sin embargo, también tienen mayores tasas de complicaciones y mortalidad137.
La gravedad de la enfermedad hepática debe ser considerada en todo paciente que vaya a ser tratado con cirugía bariátrica, ya que la CH se asocia a un riesgo mayor de complicaciones y mortalidad. Las técnicas de gastrectomía tubular y derivación gastrointestinal son las recomendadas para tratar cirrosis Child-Pugh claseA, compensada, sin HTP, aunque existen pocos estudios que hayan evaluado la seguridad de las diferentes técnicas en pacientes con CH y se requiere más investigación en este ámbito139. La efectividad y la seguridad a largo plazo de las diferentes técnicas quirúrgicas en pacientes con EHGNA deben ser exploradas en futuros estudios.
Recomendaciones- •
La cirugía bariátrica es un proceder seguro y eficaz para tratar pacientes con obesidad mórbida y EHGNA (A1).
- •
En presencia de CH, la gravedad valorada por el estadio de Child-Pugh y/o MELD score deben condicionar la decisión del tratamiento. Los pacientes con cirrosis descompensada no deberían someterse a cirugía bariátrica (B1).
Los pacientes con EHNA y fibrosis avanzada presentan un aumento de la mortalidad total en comparación con la población general; de hecho, la presencia y la gravedad de la fibrosis es el factor determinante asociado a una mayor mortalidad por cualquier causa, incluyendo enfermedad cardiovascular (ECV)140. El aumento de mortalidad se debe fundamentalmente a causas cardiovasculares. Un reciente metaanálisis muestra una fuerte asociación entre EHNA diagnosticada por imagen o biopsia y diversos marcadores de ateroesclerosis subclínica141; además, diversos estudios muestran su asociación con el aumento de prevalencia de alteraciones de la estructura y función cardiaca y la presencia de arritmias142. Los pacientes con EHNA presentan un aumento de 2 veces el riesgo de padecer ECV en relación con la población general143,144.
Recomendaciones- •
Se debe evaluar el riesgo cardiovascular en todos los enfermos con EHGNA siguiendo las guías europeas (A1).
Las principales causas del aumento de la morbimortalidad cardiovascular en los pacientes con EHNA son la enfermedad coronaria, la disfunción e hipertrofia miocárdicas, la esclerosis valvular aórtica y las arritmias cardiacas142,145. Los pacientes con EHNA presentan:
- a)
Un aumento de la RI global y hepática que determina una dislipemia aterogénica145.
- b)
Cambios precoces en el metabolismo energético del miocardio que inducen cambios estructurales y funcionales del músculo cardiaco (disfunción e hipertrofia del ventrículo izquierdo en niños146 y en adultos147), que pueden estar asociados al aumento del riesgo de insuficiencia cardiaca congestiva que presentan este grupo de enfermos140.
- c)
Un riesgo cinco veces mayor de desarrollar fibrilación auricular de forma independiente a la presencia de síndrome metabólico y de otros factores de riesgo, como se ha demostrado en niños obesos146 y en pacientes con DM2148.
- •
A todos los pacientes con EHNA se les debe hacer un estudio de los factores de riesgo cardiovascular que incluya: 1)perfil lipoproteico (colesterol total, triglicéridos, cHDL, cLDL, apoB); 2) glucosa, insulina e índice HOMA; 3) determinación de presión arterial sistólica y diastólica, y 4) y electrocardiograma (A1).
En el manejo del alto riesgo cardiovascular de estos enfermos son esenciales tres herramientas terapéuticas:
- a)
Modificación de la dieta y otros estilos de vida.
- b)
Tratamiento de la hiperlipemia aterogénica. El manejo y el tratamiento de la hiperlipemia en los pacientes con EHGNA están recomendados y pueden mejorar las pruebas de función hepática149. Deben realizarse según los criterios y recomendaciones establecidos para la población general en las guías europeas. Las estatinas parecen ser seguras y presentar una baja toxicidad hepática. Una reducción de 2-3mmol/l de cLDL disminuye un 40% la incidencia de episodios cardiovasculares150,151.
- c)
Tratamiento de la HTA siguiendo las recomendaciones establecidas para la población general151. En la elección del tipo de fármacos antihipertensivos debemos considerar que los antagonistas de los receptores de la angiotensinaii (ARAII) son antiinflamatorios y antifibróticos hepáticos, aunque existen pocos estudios que demuestren estas acciones en pacientes con EHNA.
- •
El manejo y el tratamiento de la hiperlipemia en los pacientes con EHNA deben realizarse según los criterios y recomendaciones establecidos para la población general en las guías europeas (B1).
- •
El tratamiento de la HTA se debe realizar siguiendo las recomendaciones de la población general (A1).
Además del control de los factores de riesgo cardiovascular antes mencionados, el tratamiento debe focalizarse en tratar la presencia de las lesiones inflamatorias («NASH resolution»), degeneración balonizante y fibrosis152, que son los factores histológicos asociados a la progresión de la enfermedad, tanto hepática como neoplásica o cardiovascular. En cambio, la presencia de esteatosis simple no se asoció con la progresión de la enfermedad, así como tampoco el NAS score, que combina esteatosis, inflamación y degeneración balonizante ni el SAF score anatomopatológico del tejido153. Por tanto, la esteatosis es más un factor de confusión que un objetivo terapéutico. La fibrosis es con diferencia el factor pronóstico más relevante en esta enfermedad y su regresión sería el principal objetivo a conseguir154.
Recomendaciones- •
Los objetivos terapéuticos deben consistir en la resolución de la esteatohepatitis y la regresión de la fibrosis (B1).
La pérdida de peso se acompaña de una mejoría de todos los parámetros histológicos131. El impacto de la pérdida de peso depende del grado de enfermedad basal, de la presencia de DM2 y de la edad155. La normalización de transaminasas y la cuantía de pérdida de peso, junto a las variables anteriores y la puntuación NAS score de Kleiner86, permiten calcular la posibilidad de conseguir la resolución de la EHNA a través de un modelo predictivo no invasivo156. Además, en pacientes tratados con liraglutida, un agonista GLP-1 que promueve la pérdida de peso, la fórmula «NASH resolution»156 predijo la ausencia de resolución de la EHNA con una especificidad del 94%, siendo muy útil para definir reglas de parada de la intervención157. En varios estudios se reivindica la necesidad de investigar biomarcadores que ayuden a monitorizar la progresión de la enfermedad158.
Recomendaciones- •
En pacientes con EHNA sometidos a dieta y ejercicio físico o tratamiento con liraglutida se deben utilizar métodos no invasivos para confirmar la ausencia de respuesta y necesidad de tratamiento farmacológico (B1).
El tratamiento farmacológico debe conseguir los objetivos de resolución de la esteatohepatitis y la regresión de la fibrosis con un excelente perfil de seguridad. Por ello, el tratamiento farmacológico está indicado en pacientes con esteatohepatitis y fibrosis, o en aquellos casos sometidos a dieta y ejercicio físico sin respuesta terapéutica en un año158. El tratamiento farmacológico no está indicado en pacientes con esteatosis simple.
Recomendaciones- •
El tratamiento con fármacos debe restringirse a los pacientes con esteatohepatitis y fibrosis significativa (B1).
- •
Se debe indicar tratamiento farmacológico en pacientes que no consiguen resolución de la esteatohepatitis después de una intervención con dieta y ejercicio físico durante un año (B1).
Tanto la vitamina E (800 UI/día) como la pioglitazona han mostrado eficacia respecto a la mejora de las características histológicas en pacientes diagnosticados de EHNA, sin CH ni DM2, sin efecto significativo sobre la fibrosis, pero sí sobre la inflamación portal y la esteatosis159. No obstante, ambos fármacos se han asociado a efectos adversos a largo plazo, incluyendo incremento de mortalidad y desarrollo de tumores como el cáncer de próstata y del riesgo de ictus hemorrágico en el caso de la vitaminaE y aumento de peso, alteraciones del metabolismo óseo e insuficiencia cardiaca en el caso de la pioglitazona. La vitaminaE solo se recomienda en periodos cortos de tiempo y en pacientes con enfermedad evolucionada, pero no en cirróticos ni en diabéticos. La elección de uno u otro debe considerar tanto la eficacia como los efectos adversos de cada uno160.
Recomendaciones- •
La vitamina E (800 UI/día) mejora la histología hepática en pacientes con EHNA (B1) pero no está indicada en pacientes con diabetes, sin diagnóstico histológico, ni en pacientes con CH (C1).
- •
La pioglitazona puede usarse en el tratamiento de pacientes no diabéticos con esteatohepatitis demostrada por biopsia por periodos cortos de tiempo (off-label) (B2).
En tres estudios faseii publicados se demuestra que tanto el ácido obeticólico (25mg/día)161 como el elafibranor (120mg/día)162 y la liraglutida (1,8mg/día)163 son agentes capaces de mejorar las lesiones histológicas de la EHGNA con un perfil de seguridad aceptable. Se han comunicado síntomas gastrointestinales leves-moderados con el uso de liraglutida, leve elevación de creatinina en pacientes tratados con elafibranor y aparición de prurito en pacientes que recibían ácido obeticólico. En pacientes con DM2 y EHNA los agonistas de GLP-1, además de su mencionada capacidad de mejorar las lesiones histológicas hepáticas, dada su acción incretina, sensibilizadora de la insulina, y su capacidad de inducir pérdida de peso, podrían ser una adecuada opción terapéutica en estos pacientes; no obstante, son necesarios estudios en faseiii que establezcan la seguridad y la eficacia en pacientes con enfermedad hepática más evolucionada163.
Recomendaciones- •
La identificación de dianas moleculares en la patogénesis de la EHGNA ha permitido el desarrollo de nuevos fármacos que en faseii han demostrado ser superiores al placebo, pero se ha de culminar el desarrollo de estos fármacos (ensayos clínicos en faseiii) para alcanzar recomendaciones basadas en la evidencia (A1).
El aumento significativo en la prevalencia de la enfermedad hepática por depósito de grasa es una consecuencia directa de la epidemia de obesidad en el mundo junto al incremento concomitante de diabetes y SMet. Dos estudios recientes realizados en Estados Unidos demuestran que la CH por EHGNA con o sin CHC asociado se ha convertido en la indicación de TH que más ha aumentado desde 2002 (tanto de TH aislado como de trasplante hepático y renal combinado)164, siendo en la actualidad la segunda indicación en los nuevos registros de TH165,166 y la primera indicación de trasplante hepatorrenal combinado. No existen datos similares publicados en España.
Recomendaciones- •
La EHNA debe ser considerada como causa principal o concomitante de cirrosis en el paciente candidato a TH (A1).
En los pacientes con CH por EHNA coexisten comorbilidades con impacto pronóstico. Además, se caracterizan por ser individuos de más edad, frecuentemente mujeres y con antecedentes de enfermedad cardiovascular, con mayor prevalencia de enfermedad renal crónica asociada. En los pocos estudios disponibles se ha objetivado que si bien la tasa de contraindicación para recibir un TH es similar a la descrita en otras indicaciones, en cambio la causa de la contraindicación difiere. En los pacientes con EHNA predomina la contraindicación por comorbilidades cardiovasculares, mientras que en la CH por virusC predominan las causas sociopsicológicas167,168.
Recomendaciones- •
Debido a la alta asociación de EHNA con DM, obesidad, HTA, ECV y morbilidad peritrasplante, se recomienda un estudio minucioso del riesgo cardiovascular en los pacientes con EHNA candidatos a TH (A1).
- •
La acumulación de factores de riesgo cardiovascular debe ser cuidadosamente evaluada por un equipo multidisciplinar, y debe ser motivo de no inclusión de un paciente en lista de espera si el riesgo se considera elevado (B1).
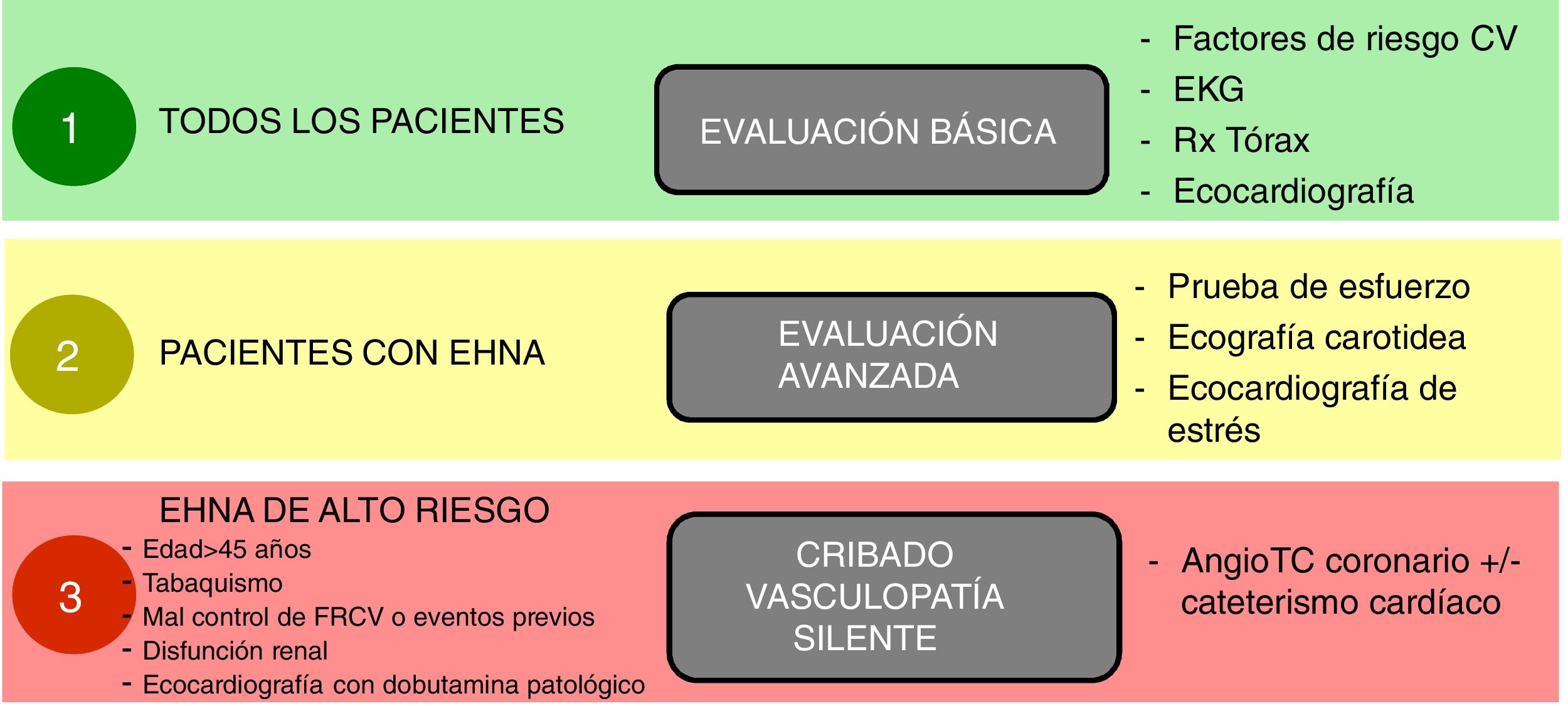
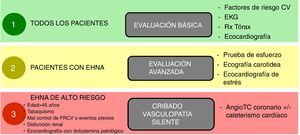
Sí, en pacientes con EHNA suele existir un perfil metabólico de riesgo cardiovascular elevado, lo cual hace más probable que presenten vasculopatía silente164,165,168. El estrés físico inherente al trasplante, incluyendo la cirugía propiamente dicha y las complicaciones que puedan ocurrir en el postoperatorio, pueden transformar la vasculopatía silente en ECV graves que finalmente aumenten la mortalidad. Por ello, es fundamental que la evaluación pretrasplante incluya una evaluación cardiológica profunda tanto estructural como funcional en condiciones de reposo y de estrés, incluyendo ecocardiograma de estrés (físico o farmacológico) y TC-coronariografía o incluso cateterismo en pacientes de alto riesgo para poner de manifiesto y corregir, si es posible, cualquier vasculopatía significativa169 (fig. 2). Además, la presencia y la severidad de la EHGNA se asocian con enfermedad renal crónica independientemente de la presencia de diabetes170.
Esquema propuesto de evaluación cardiológica pretrasplante en función del riesgo cardiovascular.
Notas: Los factores de riesgo cardiovascular deben controlarse adecuadamente antes del trasplante.
La presencia de vasculopatía clínicamente significativa debe ser tratada y estabilizada antes del trasplante.
Adaptado de Malhi et al.169.
- •
La evaluación pretrasplante debe incluir una evaluación cardiovascular profunda para detectar vasculopatía silente, y se debe estudiar la presencia de enfermedad renal crónica asociada (B1).
Los pacientes con obesidad mórbida presentan más complicaciones infecciosas y postquirúrgicas tras el TH. Algunos autores han publicado series cortas donde demuestran que la realización de gastrectomía tubular en el mismo acto del TH ayuda a estos pacientes a bajar su IMC en el postrasplante precoz171. Sin embargo, no hay que olvidar que la cirugía bariátrica añade un extra de morbimortalidad al TH, a la vez que podría favorecer estados carenciales en el postrasplante inmediato, que a su vez impedirían la correcta recuperación del paciente. Por todo ello, aunque la cirugía bariátrica podría favorecer la mejoría del perfil metabólico en pacientes trasplantados por cirrosis asociada a EHNA, el momento óptimo para su realización no está definido, por lo que la indicación de TH y el tipo de cirugía bariátrica combinada en pacientes con IMC>35 y DM debería individualizarse171.
Recomendaciones- •
Debido a la comorbilidad asociada a la obesidad mórbida en el postrasplante, se debe considerar la realización de cirugía bariátrica en estos pacientes. No existe consenso en el mejor momento para su realización y, por tanto, debe individualizarse (C2).
- •
La indicación de TH y del tipo de cirugía bariátrica en individuos obesos con un IMC>35 y DM debería individualizarse (A1).
Las diversas series publicadas, incluidas revisiones sistemáticas y metaanálisis, demuestran que la supervivencia postrasplante de los pacientes trasplantados por cirrosis por EHNA es similar a la de otras indicaciones172. En un metaanálisis reciente que incluía 717 pacientes trasplantados por EHNA frente a 3.520 trasplantados por otras indicaciones, la supervivencia al primer año (OR: 0,77; IC95%: 0,59-1,00; p=0,05), al tercer año (OR: 0,97; IC95%: 0,67-1,40; p=0,86) y al quinto año (OR: 1,09; IC95%: 0,77-1,56; p=0,63) no difirió entre grupos. Sin embargo, las causas de mortalidad fueron diferentes, siendo la mortalidad de origen cardiovascular (OR: 1,65; IC95%: 1,01-2,70; p=0,05) y sepsis (OR: 1,71; IC95%: 1,17-2,50; p=0,006) superior en los pacientes trasplantados por EHNA168.
Recomendaciones- •
La supervivencia post-TH es similar en pacientes con EHGNA y por otras indicaciones, pero es más frecuente la mortalidad de causa CV y por sepsis (B1).
Los estudios publicados hasta la fecha demuestran que es frecuente detectar enfermedad grasa en el hígado trasplantado por CH secundaria a EHNA en los 12 primeros meses, y suele ser leve173; sin embargo, aún no hay datos que muestren que la recurrencia de EHNA conduzca a fibrosis significativa o CH, al menos a corto-medio plazo174. Globalmente se estima que un 8% progresa a fibrosis significativa en los primeros 5años, mientras que esta cifra baja al 5% si se considera la presencia de CH. Tanto la esteatosis hepática como la esteatohepatitis recurrente, así como las detectadas de novo tras el trasplante, pueden presentarse con elevación de transaminasas y/o hallazgos ecográficos similares. Por ello, para confirmar el diagnóstico y/o establecer el diagnóstico diferencial con otras causas de elevación de transaminasas es necesaria la realización de una biopsia hepática174,175.
Recomendaciones- •
Puede ser necesario realizar una biopsia hepática para confirmar el diagnóstico de esteatosis/EHNA recurrente o de novo postrasplante o para excluir otras causas de alteración de la bioquímica hepática (A1).
No existen ensayos clínicos llevados a cabo específicamente en pacientes trasplantados por cirrosis asociada a EHNA. La evidencia disponible debe ser extrapolada de ensayos clínicos realizados sobre TH por cualquier etiología e indicación. Parece razonable pensar que los protocolos de inmunosupresión relacionados con menor impacto negativo en el perfil metabólico sean los más adecuados para pacientes con EHNA. En este sentido, las estrategias de minimización de inhibidores de calcineurina deben ser de primera elección, así como los protocolos libres de esteroides176. Por otro lado, el uso de everolimus está muy relacionado con el desarrollo y/o el agravamiento de la hipertrigliceridemia, por lo que debe ser evitado en pacientes con EHNA, salvo que el beneficio a obtener sea significativamente más importante que este efecto secundario177.
Recomendaciones- •
Los protocolos de inmunosupresión libres de esteroides y con minimización del inhibidor de calcineurina (apoyándose en terapias de inducción y/o micofenolato) podrían ser beneficiosos en pacientes con EHNA sometidos a TH (B1).
- •
La utilización de inhibidores de mTOR no es de primera elección en pacientes con EHNA debido a su efecto negativo sobre el perfil lipídico. No obstante, podrán administrarse cuando el beneficio clínico esperado sea significativo (B2).
Los factores de riesgo de SMet tras el TH son los mismos que los descritos en pacientes no trasplantados, por lo que las medidas de control deben ser similares: evitar la ganancia ponderal, control de la HTA, de la DM y de la dislipemia. Desafortunadamente, diversas series han destacado que el control de estas complicaciones metabólicas es inadecuado en un porcentaje relevante de pacientes debido a los efectos secundarios metabólicos (HTA, DM, dislipemia, aumento de peso, insuficiencia renal) del tratamiento inmunosupresor178. Desde el punto de vista quirúrgico, las series sobre cirugía de la obesidad tras el trasplante demuestran que se trata de una cirugía compleja con un número elevado de complicaciones179.
Recomendaciones- •
No se pueden dar recomendaciones específicas relacionadas con la prevención y/o el tratamiento de la esteatosis/EHNA post-TH, salvo las generales de evitar la ganancia ponderal y realizar un control adecuado de las comorbilidades metabólicas (B1).
- •
Se recomienda una monitorización estrecha de la función renal para diagnosticar y tratar precozmente la enfermedad crónica renal (A1).
- •
Se recomienda utilizar una inmunosupresión individualizada con el objetivo de evitar complicaciones metabólicas y proteger la función renal (B1).
La EHGNA incluye un amplio espectro de enfermedades que van desde la esteatosis hepática simple a la EHNA con fibrosis2,15. La EHNA puede evolucionar a fibrosis avanzada, cirrosis y CHC, con una mortalidad del 10-12% a los 10-15años del diagnóstico25. Las comorbilidades de los pacientes con EHGNA condicionan su supervivencia, teniendo como denominador común la RI y el SMet43-47, de forma que la principal causa de muerte de estos pacientes es la enfermedad coronaria142-148, seguida de las neoplasias extrahepáticas y la asociada a CH. La EHGNA es la causa más común de fibrosis y cirrosis en pacientes con elevación inexplicada de transaminasas4,5. La EHGNA en los niños es un problema creciente que en algunos países desarrollados está alcanzando dimensiones epidémicas, siendo la causa más común de enfermedad hepática en la infancia32. Aunque la historia natural del EHGNA en niños es menos conocida que en adultos, cubre el mismo espectro de manifestaciones en su historia natural32-39. El diagnóstico de certeza sigue siendo la biopsia hepática79,84,85, y emplear un protocolo de diagnóstico internacionalmente aceptado, como el score de Kleiner86, o la más reciente clasificación histopatológica SAF89, disminuye la variabilidad interobservador88 y permite una mejor clasificación histológica con fines terapéuticos y pronósticos. No se recomienda la realización de biopsia hepática para el cribado. Los biomarcadores94, los índices no invasivos95 o el CAP99 son de utilidad, así como los métodos basados en la elastografía para detectar fibrosis y esteatosis105,106. Determinados marcadores genéticos, como los SNPs localizados en los genes PNPLA3 y TM6SF2, presentan una probabilidad incrementada de desarrollar estadios más agresivos de la enfermedad111,112. Son necesarios estudios que validen métodos de diagnóstico no invasivo, como los biomarcadores radiológicos basados en la RM81,102. El cambio en estilo de vida basado en la dieta mediterránea y el ejercicio físico son el pilar del tratamiento de estos pacientes y deben estar orientados a inducir pérdidas de peso superiores al 10%131. Sin embargo, tasas entre el 7 y el 10% deben también producir beneficios a nivel hepático y sobre factores de riesgo cardiometabólicos131,133. Por otra parte, se deben evaluar y tratar todos los factores de riesgo cardiovascular asociados, como la dislipemia aterogénica, la HTA o la DM142-151.
El tratamiento farmacológico debe conseguir los objetivos de resolución de la esteatohepatitis y regresión de la fibrosis, y debe ser empleada en aquellos casos sometidos a dieta y ejercicio físico sin respuesta terapéutica en un año156-158. El tratamiento farmacológico no está indicado en pacientes con esteatosis simple. El desarrollo de nuevos fármacos, algunos en ensayos clínicos en faseiii161-163, deberán en un futuro definir las recomendaciones basadas en la evidencia. Debido a la alta asociación del EHGNA con DM, obesidad, HTA, enfermedad cardiovascular y morbilidad peritrasplante, se recomienda un minucioso análisis del riesgo cardiovascular en los pacientes con EHNA candidatos a TH164,169. La utilización de inhibidores de mTOR no es de primera elección en pacientes con EHNA debido a su efecto negativo sobre el perfil lipídico165. En conclusión, son necesarios nuevos estudios epidemiológicos que evalúen la prevalencia real actual en nuestro medio de la EHGNA, desarrollo de métodos de diagnóstico no invasivos fiables y reproducibles, así como completar los ensayos clínicos en marcha con fármacos (como elafibranor, ácido obeticólico o semaglutida) que actúan sobre diferentes dianas terapéuticas implicadas en la patogenia de la EHGNA. Los pacientes con EHNA y fibrosis se podrían beneficiar de estos fármacos con el objeto de cambiar la historia natural y mejorar el pronóstico de la EHGNA.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.