Tofacitinib es una molécula pequeña sintética, de administración oral, que actúa inhibiendo a las cinasas Janus implicadas en la patogénesis de diversas enfermedades inflamatorias, y constituye una nueva opción terapéutica para la colitis ulcerosa. La eficacia y la seguridad de tofacitinib en pacientes con colitis ulcerosa activa de moderada a grave han quedado demostradas en ensayos clínicos y este fármaco ha sido recientemente aprobado por la Agencia Europea de Medicamentos para el tratamiento de dicha enfermedad. En el presente artículo se revisan las características más destacadas de tofacitinib, sus principales diferencias con los tratamientos biológicos, los estudios que demuestran su eficacia en pacientes con colitis ulcerosa y su optimización en diferentes situaciones clínicas.
Tofacitinib is an oral synthetic small-molecule inhibitor of Janus kinases, which are involved in the pathogenesis of various inflammatory diseases, representing a new therapeutic option for ulcerative colitis. The efficacy and safety of tofacitinib have been demonstrated in clinical trials in patients with moderate to severe ulcerative colitis, and it has recently been approved by the European Medicines Agency to treat this disease. This article reviews the most relevant characteristics of tofacitinib, its main differences from biological agents, the studies which demonstrate its efficacy in patients with ulcerative colitis, and its optimal use in different clinical situations.
La colitis ulcerosa (CU) es una enfermedad inflamatoria intestinal (EII) crónica e idiopática que afecta a la mucosa del colon y que cursa con alternancia de fases de actividad y remisión. Su patogénesis es multifactorial, e incluye factores como predisposición genética, defectos en la barrera mucosa, trastornos en la regulación de respuestas inmunitarias, la microbiota intestinal y factores ambientales1. Su incidencia está en aumento y tiene mayor prevalencia en países desarrollados2,3.
El objetivo del tratamiento a corto plazo de la CU activa es controlar los síntomas y signos de la enfermedad (tratamiento de inducción). Una vez que esto se ha logrado, el objetivo del tratamiento a largo plazo es impedir que se produzcan nuevos brotes de la enfermedad (tratamiento de mantenimiento). El propósito común en ambas fases de tratamiento es actuar sobre el proceso de la enfermedad, reduciendo la inflamación de la mucosa del colon1. Las terapias para el tratamiento de la CU (aminosalicilatos, corticoides, azatioprina/mercaptopurina, ciclosporina y medicamentos biológicos) no son efectivas en todos los pacientes, por lo que persisten necesidades médicas no cubiertas en el tratamiento de inducción y mantenimiento4. En la actualidad, los aminosalicilatos son la primera línea de tratamiento para la inducción y mantenimiento de la remisión en la CU de leve a moderada; los corticosteroides están indicados cuando los pacientes no responden a los aminosalicilatos y en pacientes con actividad moderada y grave; y los inmunosupresores y los medicamentos biológicos se emplean en la CU de moderada a grave que no responde al tratamiento con corticoides o que es corticodependiente. Con esta disponibilidad de tratamientos farmacológicos, la necesidad de tratamiento quirúrgico se ha reducido en las últimas décadas, aunque la tasa de colectomía continúa siendo relativamente elevada (3-17% a los 10 años del diagnóstico)5,6.
La incorporación de los medicamentos biológicos (infliximab, adalimumab, golimumab, vedolizumab) en la práctica clínica ha supuesto en los últimos años una mejora en el tratamiento de la CU de moderada a grave7,8. Estos fármacos son anticuerpos monoclonales que actúan sobre citocinas o integrinas, es decir, sobre moléculas extracelulares o de la membrana celular. Recientemente, han aparecido nuevos principios activos para diversas enfermedades, clasificados como moléculas pequeñas (small-molecules). Algunas —filgotinib, upadacitinib, peficitinib, TD1473, Pf-06651600, Pf-06700841, ozanimod, etrasimod— se encuentran en distintas fases de desarrollo para la indicación de enfermedad de Crohn y/o CU9. Son moléculas de pequeño tamaño que actúan sobre la transducción de señales en el interior de la célula o modulan el tráfico de células inmunes. Entre estos fármacos está tofacitinib, un inhibidor de las cinasas Janus o JAK (de Janus kinases, en inglés)10. Fue aprobado en 2012 por la Food and Drug Administration y en 2017 por la European Medicines Agency y la Agencia Española del Medicamento y Productos Sanitarios para el tratamiento de la artritis reumatoide activa de moderada a grave11. En 2018, tofacitinib (Xeljanz®) en combinación con metotrexato ha obtenido la autorización de la European Medicines Agency para el tratamiento de la artritis psoriásica activa en pacientes adultos que han tenido una respuesta inadecuada o que han sido intolerantes a un tratamiento previo con un fármaco antirreumático modificador de la enfermedad y para el tratamiento de la CU en pacientes adultos con enfermedad activa de moderada a grave que han tenido una respuesta insuficiente, o una pérdida de respuesta, o que presentan intolerancia al tratamiento convencional o a un medicamento biológico11. El objetivo de este artículo es revisar el conocimiento actual sobre la eficacia de tofacitinib en el tratamiento de la CU, así como sus principales diferencias con los tratamientos biológicos y las estrategias de optimización en diferentes situaciones clínicas.
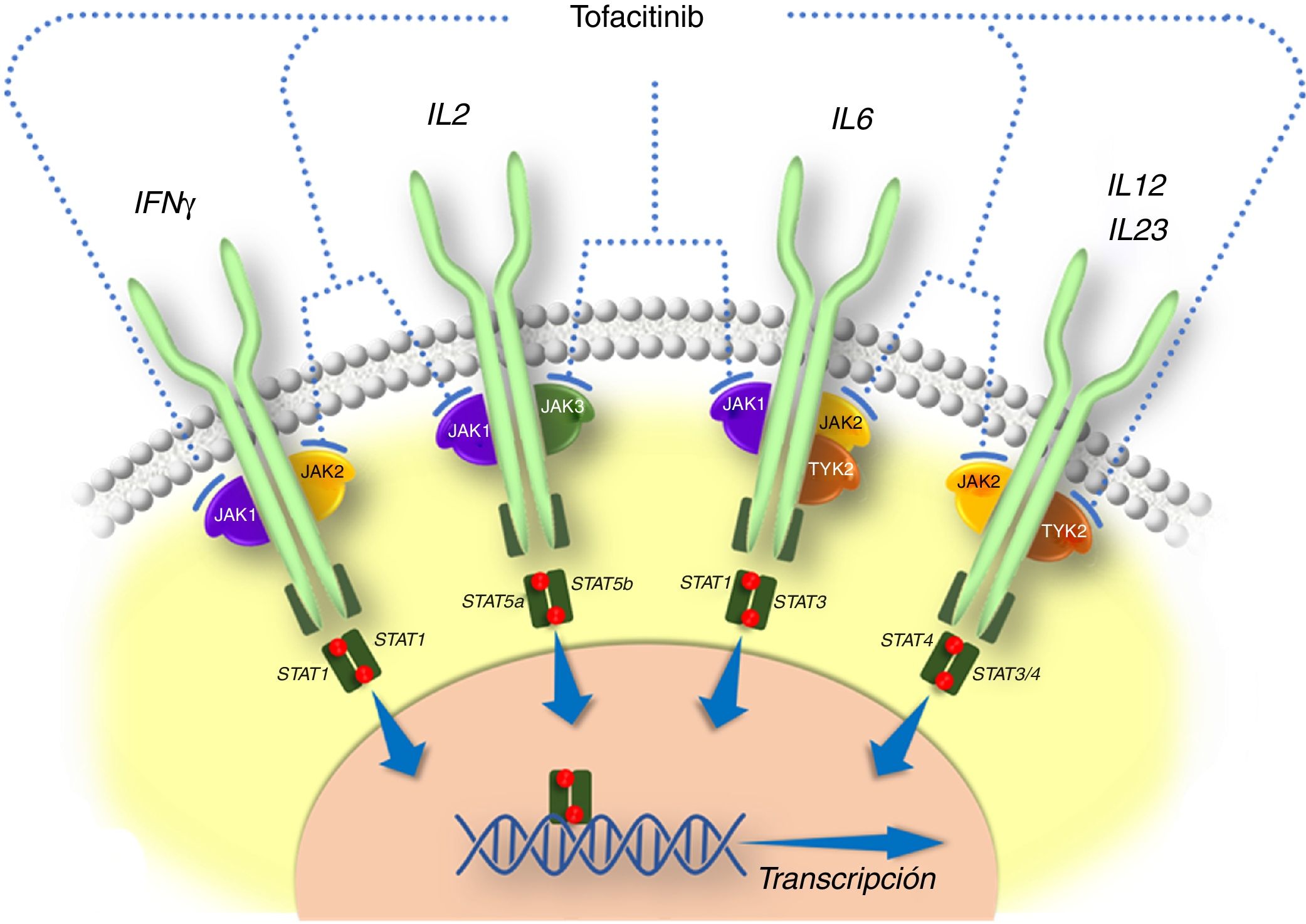
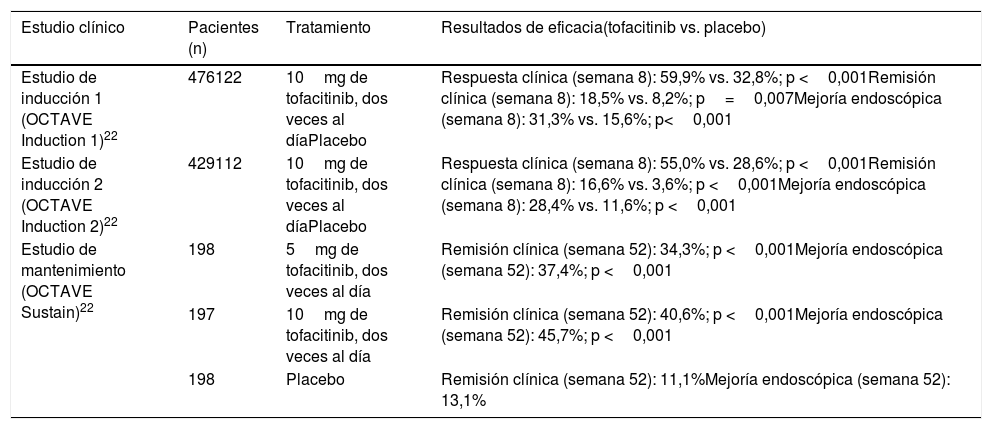
Generalidades sobre tofacitinibEn la patogenia de la EII y otras enfermedades inflamatorias están implicadas diversas citocinas que actúan activando las JAK. Las JAK son una familia de enzimas intracelulares de tipo tirosina-cinasas que fosforilan residuos hidroxilo de tirosina en sus proteínas diana, modificando su actividad. Incluyen las enzimas JAK1, JAK2, JAK3 y tirosin cinasa 2 (TYK2). Las cinasas JAK1, JAK2 y TYK2 son ubicuas, mientras que JAK3 se encuentra predominantemente en células hematopoyéticas. Las JAK son activadas por muchas citocinas, como las interleucinas y los interferones, y por hormonas como la eritropoyetina, la trombopoyetina y la hormona de crecimiento10. La unión de una citocina a su receptor induce la activación de las JAK asociadas a dicho receptor, y esto produce finalmente la fosforilación de los transductores de señales llamados signal transducers and activators of transcription (STAT), es decir, la activación de STAT. Los dímeros de STAT fosforilados son traslocados al núcleo, donde participan en la regulación de la expresión de cientos de proteínas que participan en la respuesta inmunológica y contribuyen a la inflamación10.
Tofacitinib es un fármaco sintético de pequeño tamaño que inhibe sobre todo las JAK3 y JAK1 y, en menor medida, las JAK2 y TYK212. Se une de forma selectiva y reversible al sitio de unión del ATP (adenosina trifosfato) en la cinasa. Esta acción bloquea la transducción de señales de los receptores de varias interleucinas (IL-2, IL-4, IL-6, IL-7, IL-15 e IL-21) e interferones de tipo I y II, modulando la respuesta inflamatoria e inmunitaria12,13. Por lo tanto, su mecanismo de acción en la CU consiste en la inhibición de varias citocinas que están relacionadas con la patogenia de la enfermedad14,15 (fig. 1).
Los avances en el conocimiento de la cascada de la inflamación, así como el papel de las citocinas y las moléculas de adhesión en la patogénesis de la EII, han conducido al desarrollo de fármacos biológicos que son efectivos en la CU. Actualmente están aprobados tres antagonistas del factor de necrosis tumoral (anti-TNF: infliximab, adalimumab y golimumab) y uno dirigido a la integrina α4β7 (vedolizumab). Estos agentes biológicos son anticuerpos monoclonales y para su producción se necesitan células vivas, no se sintetizan por procedimientos químicos. Además, como son proteínas, pueden inducir inmunogenicidad. Las diferencias más relevantes entre los fármacos biológicos y las denominadas moléculas pequeñas se resumen en la tabla 1.
Características diferenciales de los fármacos biológicos y las moléculas pequeñas
| Fármacos biológicos | Moléculas pequeñas | |
|---|---|---|
| Composición | Proteína | Sintética |
| Estructura | Secuencia conocida, estructura tridimensional variable y glicosilación | Estructura bien definida |
| Peso molecular | > 1 kDa | <700 Da |
| Estabilidad | Sensible a proteasa y calor | Estable (habitualmente) |
| Administración | Parenteral | Oral |
| Vida media in vivo | Larga (habitualmente) | Corta (habitualmente) |
| Diana | Extracelular | Intracelular |
| Mecanismo de acción | Bloqueo o disminución de niveles (habitualmente) | Inhibición enzimática (habitualmente) |
| Especificidad | Alta | Baja/variable |
| Coste de fabricación | Alta | Baja/variable |
| Degradación | Catabolismo | Metabolismo |
Fuente: Danese et al.4.
Aunque la eficacia de los fármacos anti-TNF es incuestionable, hasta un 30% de los pacientes no responden inicialmente al tratamiento (fallo primario)16 y hasta en el 50% puede haber pérdida de respuesta con el tiempo (fallo secundario)17. Además, las concentraciones séricas de anti-TNF antes de una nueva administración parecen determinar, al menos en parte, los resultados clínicos en la CU, habiéndose demostrado que cuando las concentraciones séricas de infliximab son bajas o indetectables existe un riesgo aumentado de colectomía18. Por ello, se ha sugerido que la monitorización de las concentraciones plasmáticas del agente biológico y de los anticuerpos antifármaco podría ser útil para la optimización de las dosis19–21. En contraposición, en los estudios llevados a cabo con tofacitinib en pacientes con CU no se ha observado una pérdida de eficacia debida a un descenso de la concentración plasmática media de tofacitinib22. Tofacitinib actúa rápidamente y los datos farmacocinéticos no sugieren que haya una reducción de las concentraciones séricas al prolongar la duración del tratamiento22,23, observándose su eficacia clínica de 2 a 8 semanas tras el inicio del tratamiento22,24. Por otra parte, con los tratamientos biológicos, el efecto terapéutico se relaciona con los niveles alcanzados, existiendo una gran variabilidad interindividual en la farmacocinética, por lo que se ha sugerido la conveniencia de monitorizar dichos niveles para optimizar el tratamiento24.
Finalmente, vedolizumab, un anticuerpo monoclonal humanizado que se une específicamente a la integrina α4β7, presenta los mismos principios de farmacocinética que los anti-TNF25. También se han detectado anticuerpos frente a este fármaco, aunque en menor frecuencia que en el caso de los anti-TNF21.
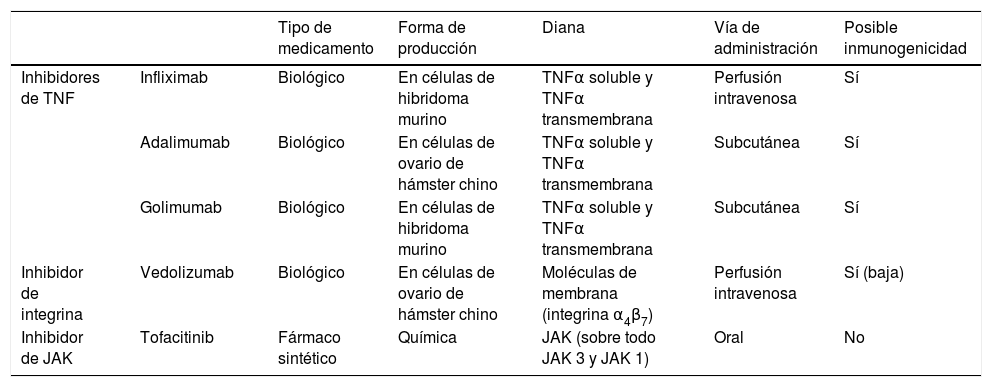
En la tabla 2 se resumen las principales diferencias entre los fármacos biológicos y los inhibidores de JAK que han demostrado eficacia en el tratamiento de la CU, en relación con su forma de producción, diana terapéutica, vía de administración y potencial inmunogenicidad.
Principales diferencias entre los fármacos biológicos y los inhibidores de cinasas Janus (JAK) que han demostrado eficacia en el tratamiento de la colitis ulcerosa
| Tipo de medicamento | Forma de producción | Diana | Vía de administración | Posible inmunogenicidad | ||
|---|---|---|---|---|---|---|
| Inhibidores de TNF | Infliximab | Biológico | En células de hibridoma murino | TNFα soluble y TNFα transmembrana | Perfusión intravenosa | Sí |
| Adalimumab | Biológico | En células de ovario de hámster chino | TNFα soluble y TNFα transmembrana | Subcutánea | Sí | |
| Golimumab | Biológico | En células de hibridoma murino | TNFα soluble y TNFα transmembrana | Subcutánea | Sí | |
| Inhibidor de integrina | Vedolizumab | Biológico | En células de ovario de hámster chino | Moléculas de membrana (integrina α4β7) | Perfusión intravenosa | Sí (baja) |
| Inhibidor de JAK | Tofacitinib | Fármaco sintético | Química | JAK (sobre todo JAK 3 y JAK 1) | Oral | No |
El desarrollo de los inhibidores de JAK, como tofacitinib, supone un nuevo abordaje en el tratamiento de las enfermedades inflamatorias inmunomediadas. Tienen una acción farmacológica rápida en formulación oral, lo que los hace especialmente atractivos. Por otra parte, los inhibidores de la vía de señalización JAK/STAT son capaces de bloquear múltiples citocinas al mismo tiempo. Sin embargo, tanto los biológicos anti-TNF como los antiintegrina están dirigidos a inhibir un único componente de la respuesta inflamatoria. La inhibición de una única citocina puede no ser suficiente para resolver completamente la respuesta inflamatoria intestinal, ya que está regulada por múltiples citocinas. Por otro lado, la inhibición simultánea de varias vías proinflamatorias permitiría, al menos teóricamente, abolir de forma más amplia la respuesta inflamatoria intestinal, si bien la inhibición de los distintos componentes de la cascada inflamatoria no suele ser completa9.
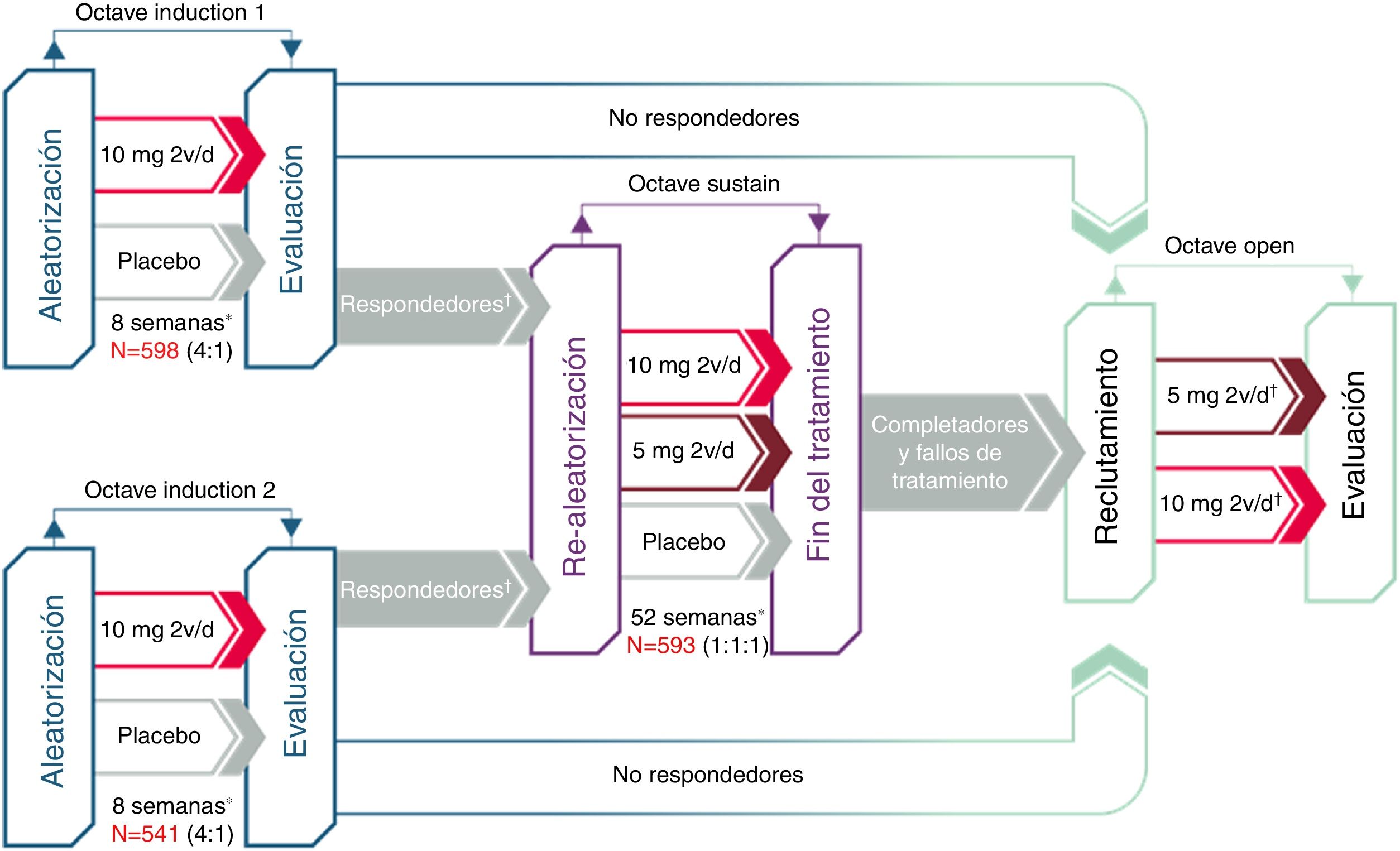
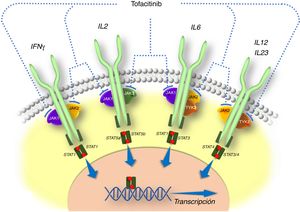
Desarrollo clínico de tofacitinib en la colitis ulcerosaLa eficacia de tofacitinib ha sido evaluada en un ensayo clínico de fase 2 y en tres de fase 3, en pacientes con CU de moderada a grave (fig. 2). Se revisan a continuación los aspectos más destacados de dichos estudios.
Desarrollo clínico de tofacitinib en colitis ulcerosa.
*Evaluación final de la eficacia completa en la semana 8/52. Tratamiento continuo hasta la semana 9/53.
†«Respondedores» se refiere a los pacientes que alcanzaron respuesta clínica durante el estudio OCTAVE Induction 1 o 2.
‡Los pacientes en remisión a la semana 52 de OCTAVE Sustain fueron asignados a tofacitinib 5mg/12h; los pacientes que completaron 8 semanas de tratamiento en OCTAVE Induction 1 o 2 y fueron clasificados como no respondedores, y los pacientes que completaron OCTAVE Sustain pero no cumplieron los requisitos de remisión o quienes abandonaron tempranamente el estudio por fallo del tratamiento fueron asignados a tofacitinib 10mg/12h.
Inicialmente se llevó a cabo un ensayo clínico de fase 2. Se trata de un estudio multicéntrico, doble ciego, controlado con placebo, con varias dosis de tofacitinib26. Se incluyeron 194 pacientes, que fueron aleatorizados (2:2:2:3:3) a recibir 0,5, 3, 10 o 15mg de tofacitinib o placebo, dos veces al día, durante 8 semanas. El criterio de valoración principal fue la respuesta clínica en la semana 8 evaluada mediante el índice de Mayo, que incluye el número de deposiciones, la presencia de sangre en heces, la valoración global del estado del paciente por parte del médico y las lesiones endoscópicas. Los criterios de valoración secundarios de eficacia fueron, entre otros, la remisión clínica, la respuesta endoscópica y la remisión endoscópica a las 8 semanas. Además, se midió la calidad de vida relacionada con la salud con el cuestionario para la enfermedad inflamatoria intestinal (Inflammatory Bowel Disease Questionnaire [IBDQ]).
Posteriormente se realizaron los estudios de inducción OCTAVE (Induction 1 y 2), dos ensayos clínicos de fase 3, aleatorizados, doble ciego y controlados con placebo de idéntico diseño22. Se incluyeron 598 y 541 pacientes, respectivamente, con CU activa de moderada a grave a pesar del tratamiento previo convencional o con anti-TNF. Los pacientes recibieron tratamiento de inducción con 10mg de tofacitinib dos veces al día o placebo durante 8 semanas. El criterio de valoración principal fue la remisión clínica en la semana 8.
En el estudio de mantenimiento (OCTAVE Sustain)22 se incluyeron 593 pacientes que habían tenido respuesta clínica al tratamiento de inducción y que fueron aleatorizados a recibir terapia de mantenimiento con tofacitinib (5mg o 10mg dos veces al día) o placebo durante 52 semanas. El criterio de valoración principal fue la remisión clínica en la semana 52.
Finalmente, está en curso un estudio de extensión abierto (OCTAVE Open). Se trata de un estudio de extensión de fase 3, multicéntrico, abierto y no controlado. El objetivo principal es evaluar la seguridad de tofacitinib a largo plazo, en dosis de 5mg y 10mg dos veces al día, en pacientes con CU activa de moderada a grave que habían completado los estudios de inducción (OCTAVE Induction 1 y 2) sin alcanzar la respuesta clínica o que habían completado o interrumpido el tratamiento en el estudio de mantenimiento (OCTAVE Sustain). Los objetivos secundarios son evaluar la eficacia y la calidad de vida a largo plazo27.
En los estudios OCTAVE Induction y Sustain, la remisión clínica se definió como una puntuación total del índice de Mayo ≤ 2, sin ningún subíndice con una puntuación> 1 y una puntuación en el subíndice de sangrado rectal de 0; es de destacar que esta definición de remisión es más estricta que la empleada en estudios previos con fármacos biológicos22.
Durante los estudios de inducción se permitió el uso concomitante de aminosalicilatos orales y corticoides orales. Sin embargo, no se permitió el uso de anti-TNF, azatioprina/mercaptopurina o metotrexato. Por otra parte, en el ensayo de mantenimiento se permitió el uso concomitante de corticoides orales, aunque se requirió la reducción gradual de la dosis hasta su suspensión.
Eficacia clínica de tofacitinib en la colitis ulcerosaEn primer lugar, al analizar la eficacia clínica de tofacitinib es importante tener en cuenta que los pacientes incluidos en los ensayos clínicos de inducción (OCTAVE Induction 1 y 2) sufrían una CU relativamente grave: la media de duración de la enfermedad fue de 8,1 años, el 51% de los pacientes tenían colitis extensa o pancolitis, la puntuación media del índice de Mayo fue de 9,0, el 52% de los casos había fracasado previamente al tratamiento anti-TNF y el 46% recibía corticoides al inicio del estudio con tofacitinib28.
Los ensayos clínicos de fase 3 confirmaron la superioridad de tofacitinib sobre placebo en el tratamiento de inducción y en el de mantenimiento de la remisión clínica en pacientes con CU de moderada a grave, como se resume en la tabla 3.
Resultados de eficacia en los ensayos clínicos con tofacitinib en pacientes con colitis ulcerosa
| Estudio clínico | Pacientes (n) | Tratamiento | Resultados de eficacia(tofacitinib vs. placebo) |
|---|---|---|---|
| Estudio de inducción 1 (OCTAVE Induction 1)22 | 476122 | 10mg de tofacitinib, dos veces al díaPlacebo | Respuesta clínica (semana 8): 59,9% vs. 32,8%; p <0,001Remisión clínica (semana 8): 18,5% vs. 8,2%; p=0,007Mejoría endoscópica (semana 8): 31,3% vs. 15,6%; p<0,001 |
| Estudio de inducción 2 (OCTAVE Induction 2)22 | 429112 | 10mg de tofacitinib, dos veces al díaPlacebo | Respuesta clínica (semana 8): 55,0% vs. 28,6%; p <0,001Remisión clínica (semana 8): 16,6% vs. 3,6%; p <0,001Mejoría endoscópica (semana 8): 28,4% vs. 11,6%; p <0,001 |
| Estudio de mantenimiento (OCTAVE Sustain)22 | 198 | 5mg de tofacitinib, dos veces al día | Remisión clínica (semana 52): 34,3%; p <0,001Mejoría endoscópica (semana 52): 37,4%; p <0,001 |
| 197 | 10mg de tofacitinib, dos veces al día | Remisión clínica (semana 52): 40,6%; p <0,001Mejoría endoscópica (semana 52): 45,7%; p <0,001 | |
| 198 | Placebo | Remisión clínica (semana 52): 11,1%Mejoría endoscópica (semana 52): 13,1% |
Remisión clínica: puntuación total de Mayo≤ 2, sin ninguna subpuntuación> 1 y subpuntuación de sangrado rectal de 0. Mejoría endoscópica: puntuación subescala endoscopia de Mayo 0 o 1. Respuesta clínica: reducción desde el valor basal en la puntuación Mayo ≥ 3 puntos y ≥ 30% acompañada por una reducción de la subpuntuación de sangrado rectal de al menos 1 punto o una puntuación absoluta de sangrado rectal de 0 o 1.
En el estudio de inducción 1 (OCTAVE Induction 1) se evidenció la remisión clínica a las 8 semanas en el 18,5% de los pacientes tratados con tofacitinib frente al 8,2% en el grupo placebo (p=0,007). En el estudio de inducción 2 (OCTAVE Induction 2) la remisión a las 8 semanas se demostró en el 16,6% de los pacientes con tofacitinib frente al 3,6% en el grupo placebo (p<0,001)22.
En un análisis post-hoc de los estudios de inducción 1 y 2, tofacitinib mostró un inicio de acción rápido, con una mejora significativa de los síntomas de la CU a los 3 días de su administración23. También se observó una mejora en la puntuación del índice de Mayo parcial (sin el componente de endoscopia) (p <0,001) y en la valoración global del paciente por parte del médico (Physician Global Assessment) (p <0,01) a las dos semanas del inicio del tratamiento (primera evaluación del estudio), con un descenso máximo de la PCR hacia la cuarta semana de tratamiento (primer momento evaluado tras el inicio del tratamiento)22. Este efecto beneficioso se observó tanto en pacientes que no habían recibido previamente tratamiento anti-TNF como en aquellos en los que este tratamiento había fracasado23. Por ello, y a diferencia de lo que ocurre con otros fármacos de acción más lenta (como vedolizumab), no se ha planteado la introducción de tratamiento concomitante con esteroides en aquellos pacientes que no los reciban al inicio del tratamiento.
Eficacia de tofacitinib en el mantenimiento de la remisión de la colitis ulcerosaEn el estudio de mantenimiento (OCTAVE Sustain) se demostró la remisión clínica a las 52 semanas en el 34,3% de los pacientes tratados con 5mg de tofacitinib dos veces al día y en el 40,6% de los que recibieron 10mg de tofacitinib dos veces al día, frente al 11,1% del grupo placebo (p <0,001, tanto para 5mg como para 10mg)22.
Uno de los criterios de valoración secundarios del estudio de mantenimiento (OCTAVE Sustain) fue la remisión sostenida a las 52 semanas sin tratamiento concomitante con corticoides. En los pacientes que estaban en remisión clínica al entrar en el estudio, la remisión se mantuvo sin usar corticoides en un mayor porcentaje de pacientes tratados con tofacitinib: en el 35,4% de los tratados con 5mg dos veces al día de tofacitinib, en el 47,3% de los tratados con 10mg dos veces al día de tofacitinib y en el 5,1% de los pacientes que recibieron placebo (p <0,001)22.
Además, el porcentaje de remisión sin corticoides entre los pacientes que recibían estos fármacos al inicio del estudio fue del 27,7% en los tratados con 5mg de tofacitinib, 27,6% en los tratados con 10mg de tofacitinib y 10,9% en los que recibieron placebo (p <0,05)11.
El mantenimiento a largo plazo se evaluó en el mes 12 del estudio OCTAVE Open. El 73,8% de los pacientes que alcanzaron la remisión al final del estudio OCTAVE Sustain (a las 52 semanas) tomando tofacitinib 5 o 10mg dos veces al día siguieron en remisión mientras recibían tofacitinib 5 mg dos veces al día29.
Eficacia de tofacitinib sobre las lesiones endoscópicasLa «mejoría endoscópica» fue un criterio de valoración secundario en los estudios de inducción (OCTAVE Induction 1 y 2). Se definió como una puntuación de 0 o 1 en el subíndice endoscópico de Mayo. En la tabla 3 se resumen los resultados más relevantes de la eficacia de tofacitinib en cuanto a las lesiones endoscópicas. Es de destacar que se confirmó la mejoría de las lesiones de la mucosa en el 46% de los pacientes al año de tratamiento22, una cifra considerablemente alta en comparación con otros fármacos como los biológicos.
Eficacia de tofacitinib en función del tratamiento previoLa eficacia de tofacitinib también se analizó en subpoblaciones preestablecidas de pacientes: con o sin tratamiento previo con anti-TNF y tratados o no con corticoides al inicio del estudio22. En los estudios clínicos de inducción con tofacitinib, el 52% de los pacientes habían fracasado previamente a un anti-TNF; de ellos, el 56% había tenido fallo primario, el 39% fallo secundario y el 33% había fracasado a dos o más anti-TNF30.
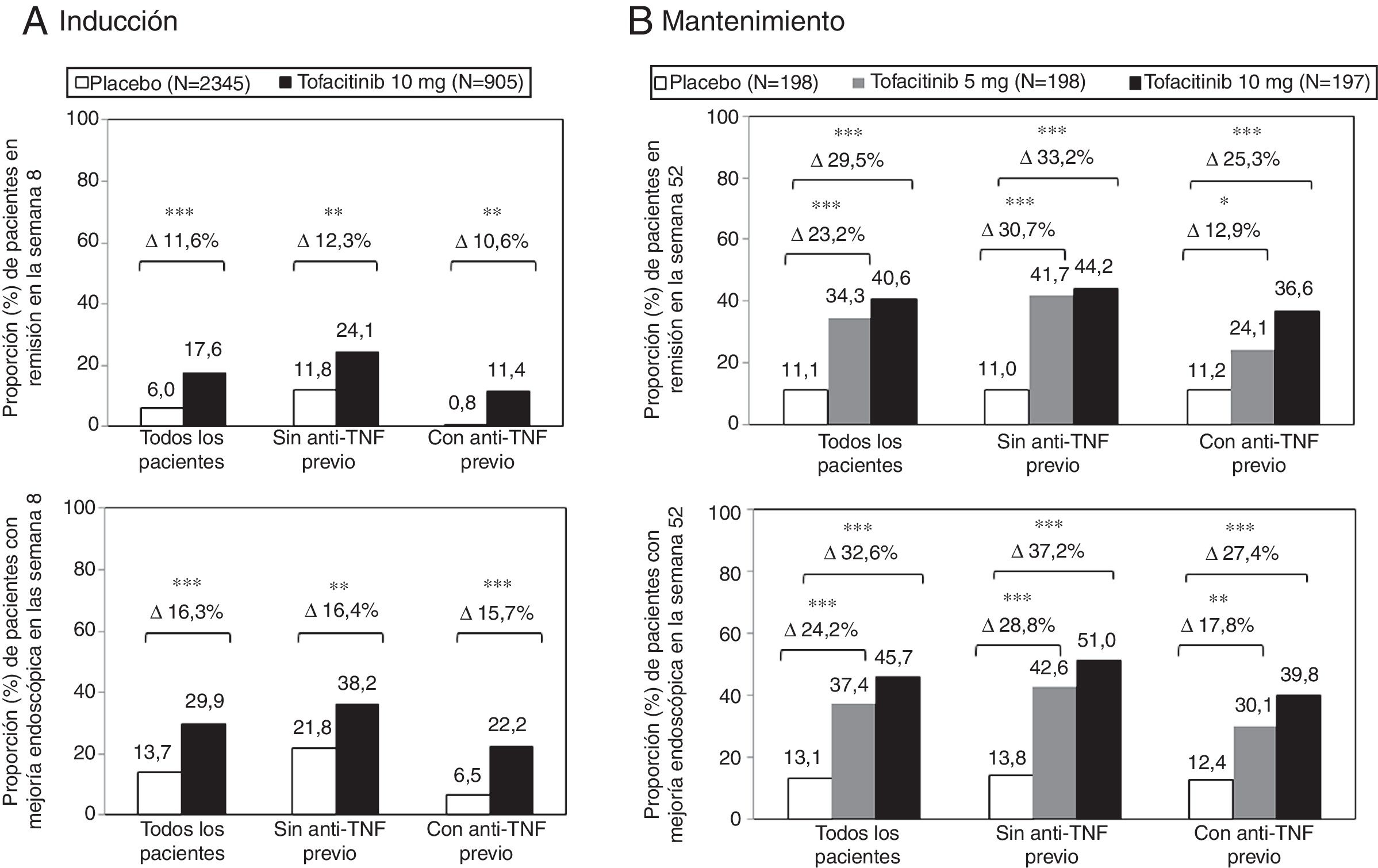
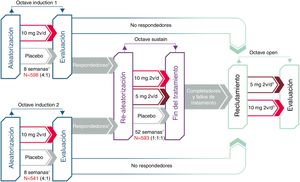
El beneficio terapéutico de tofacitinib en la inducción de la remisión en comparación con placebo fue similar en los pacientes con y sin fracaso al tratamiento previo con anti-TNF (fig. 3A). En ambos subgrupos de pacientes, una mayor proporción de pacientes tratados con tofacitinib 10mg dos veces al día alcanzó la remisión clínica y la mejoría endoscópica en la semana 8, en comparación con el grupo placebo11.
Proporción de pacientes con y sin tratamiento anti-TNF previo que alcanzaron la remisión clínica y la mejoría endoscópica en la semana 8 de los estudios OCTAVE Induction 1 y 2 combinados A) y mantuvieron la remisión clínica y la mejoría endoscópica en la semana 52 del estudio de mantenimiento OCTAVE Sustain B).
Remisión clínica: puntuación total de Mayo ≤ 2, sin ninguna subpuntuación> 1 y subpuntuación de sangrado rectal de 0. Mejoría endoscópica: puntuación subescala endoscopia de Mayo 0 o 1. *p <0,05; **p <0,01; ***p <0,0001 vs. placebo.
Durante el tratamiento de mantenimiento, los efectos del tratamiento con tofacitinib 5 y 10mg dos veces al día fueron evidentes en pacientes con y sin fracaso previo a anti-TNF. La diferencia del tratamiento respecto al placebo fue similar entre tofacitinib 5 mg dos veces al día y tofacitinib 10 mg dos veces al día en el subgrupo de pacientes sin fracaso previo del inhibidor de TNF. Sí hubo diferencias numéricas entre tofacitinib 5mg y 10mg dos veces al día en los pacientes que habían tenido fracaso terapéutico con anti-TNF antes del tratamiento con tofacitinib (fig. 3B). Por ello, en algunos pacientes, como en aquellos que hubieran fracasado previamente a un anti-TNF, se podría considerar la continuación de la dosis de 10mg dos veces al día como tratamiento de mantenimiento11,30.
Efecto de tofacitinib en la calidad de vidaEn los estudios clínicos de tofacitinib en pacientes con CU se han observado mejores resultados en la calidad de vida relacionada con la salud (CVRS, valorada mediante el cuestionario IBDQ) en aquellos tratados con el fármaco que en los que recibieron placebo31–33.
En el estudio clínico de fase 2, los pacientes mostraron preferencia por el fármaco del estudio en comparación con otras opciones de tratamiento. Además, el tratamiento con tofacitinib se asoció con una mejora de la CVRS estadísticamente significativa y dependiente de la dosis. En los pacientes en los que se logró la remisión endoscópica se obtuvo una mayor puntuación en el cuestionario IBDQ31. En un análisis multivariante, que evaluaba los factores asociados que más contribuían a la satisfacción con el tratamiento, la «función intestinal» (síntomas intestinales y frecuencia de las deposiciones) fue el más importante para la satisfacción del paciente tratado con tofacitinib32.
En los estudios de inducción, el tratamiento con 10mg de tofacitinib dos veces al día mejoró significativamente la CVRS a las cuatro semanas. En los pacientes que mostraron respuesta clínica en la fase de inducción, la mejora conseguida en la CVRS (con respecto a placebo) durante esa fase se mantuvo de manera significativa durante las 52 semanas del tratamiento de mantenimiento, en las pautas de 5mg y 10mg de tofacitinib dos veces al día33.
Finalmente, en una revisión sistemática y metaanálisis también se observó que tofacitinib es efectivo en la inducción de la remisión a corto plazo, mejorando la calidad de vida de los pacientes34.
Estrategias de optimización del tratamiento con tofacitinibExtensión del periodo de inducción durante 8 semanas adicionales (16 semanas en total)Los pacientes que no alcanzaron la respuesta clínica en los ensayos de inducción a las 8 semanas, recibieron tratamiento con 10mg de tofacitinib, dos veces al día, durante 8 semanas adicionales. Se observó que, de estos pacientes, un 53% adicional alcanzó la respuesta clínica y un 14% alcanzó la remisión al término de este periodo22.
Por ello, en aquellos pacientes en los que no se consiga una respuesta adecuada después de 8 semanas con 10mg de tofacitinib dos veces al día, y su estado clínico lo permita, se podría prolongar el tratamiento de inducción durante 8 semanas más, es decir, 16 semanas en total. Si después de 16 semanas de tratamiento con tofacitinib no hay indicios de beneficio terapéutico, se debe interrumpir el tratamiento11.
Aumento de la dosis de tofacitinibEn otro subanálisis del estudio de extensión abierto (OCTAVE Open) se incluyeron los datos de aquellos pacientes que, tras alcanzar la respuesta clínica a las 8 semanas con 10 mg de tofacitinib dos veces al día, recibieron 5mg dos veces al día en el estudio de mantenimiento (OCTAVE Sustain) y perdieron la respuesta clínica alcanzada. En estos pacientes se aumentó la dosis a 10mg dos veces al día (n=58) y recuperaron la respuesta y la remisión clínica en el 59% y 34% de los casos, respectivamente, a las 8 semanas del incremento de dosis, alcanzando unos porcentajes del 69% y 52%, respectivamente, a los 12 meses35. Por tanto, los pacientes en tratamiento de mantenimiento con 5mg de tofacitinib, dos veces al día, y con pérdida de respuesta, se pueden beneficiar del aumento de la dosis a 10mg dos veces al día35.
Retratamiento con tofacitinibPor último, los pacientes que presentaron una pérdida de respuesta tras interrumpir el tratamiento activo o al recibir placebo durante el estudio de mantenimiento (OCTAVE Sustain), volvieron a reiniciar tofacitinib a dosis de 10mg dos veces al día. Se observó respuesta clínica en el 75% de los pacientes, mejoría endoscópica en el 55%, y el 40% alcanzó la remisión clínica a las 8 semanas de retratamiento36. Por tanto, si ocurre una pérdida de respuesta tras la suspensión del tratamiento con tofacitinib, se puede considerar una nueva inducción con este fármaco con la dosis de 10 mg dos veces al día11.
Eficacia de tofacitinib y de los fármacos biológicos en metaanálisisLa eficacia y la seguridad de tofacitinib y de los medicamentos biológicos en el tratamiento de la CU han sido compendiadas en diversos metaanálisis tradicionales y metaanálisis en red34,37. No se han llevado a cabo comparaciones directas entre tofacitinib y fármacos biológicos. Los análisis indirectos no han demostrado diferencias significativas entre las dos modalidades de tratamiento, aunque un reciente metaanálisis en red ha indicado que tofacitinib puede ser el fármaco más efectivo en el mantenimiento de la remisión y la mejoría endoscópica38. En otro metaanálisis se ha concluido que tofacitinib es superior a los biológicos en pacientes con fracaso previo al tratamiento con anti-TNF39.
Ventajas de tofacitinib en el tratamiento de la colitis ulcerosaEl objetivo del tratamiento de la CU es lograr la remisión, ya que la persistencia de actividad clínica, aunque sea leve, reduce la calidad de vida40. Las tasas de remisión alcanzadas con los medicamentos biológicos actuales (anti-TNF y vedolizumab) o con los nuevos fármacos en sus últimas fases de desarrollo, se encuentran entre el 20% y el 35%, con tasas de respuesta de alrededor del 60-70%. Es decir, que ninguno de estos tratamientos consigue la remisión clínica de la mayoría de los pacientes40. Se necesitan, por tanto, nuevas estrategias de tratamiento con diferentes mecanismos de acción41.
Una ventaja evidente de las moléculas pequeñas frente a los medicamentos biológicos es su administración por vía oral (frente a la parenteral, ya sea intravenosa o subcutánea). En particular, y en comparación con los fármacos intravenosos, el uso de tofacitinib permitiría reducir los costes asociados a la administración por dicha vía (programación de visitas para la infusión, personal especializado, consumibles, condiciones especiales de almacenamiento, etc.)42.
A diferencia de los medicamentos biológicos, en los que puede ser necesario optimizar la dosis basándose en las concentraciones plasmáticas del principio activo, con tofacitinib esto no es necesario, al disponer este de una farmacocinética lineal en la cual la relación entre la dosis administrada y las concentraciones séricas obtenidas es lineal, y por tanto predecible40,43. Además, la vida media de las moléculas pequeñas es considerablemente más corta, lo que resulta en un aclaramiento rápido de fármaco en situaciones que lo pudieran requerir, como una infección grave o un embarazo44.
Una ventaja relevante de tofacitinib es que no produce inmunogenicidad, a diferencia de lo que ocurre con los fármacos biológicos, y muy especialmente los fármacos anti-TNF. Por ello, es previsible que la pérdida de respuesta como consecuencia del desarrollo de inmunogenicidad sea nula45,46.
Por último, los costes de producción de tofacitinib son inferiores a los de los medicamentos biológicos. Estos últimos se producen por ingeniería genética, con posibles cambios en el proceso de producción que pueden implicar cambios en la eficacia y la inmunogenicidad. Por el contrario, las moléculas pequeñas son de síntesis química42, lo que implica que no existe variabilidad en su composición.
La consideración de los aspectos de seguridad de tofacitinib no forma parte de los objetivos de la presente revisión. A modo de síntesis, el perfil de seguridad de tofacitinib es similar al de los inmunosupresores y biológicos utilizados para el tratamiento de la CU, a excepción de la incidencia de herpes zóster, con una incidencia ligeramente superior22,47. No obstante, muchos de los casos fueron clasificados como leves o moderados, afectando a un único dermatoma, y se resolvieron en la mayoría de las ocasiones sin retirar la medicación22,47.
ConclusiónLa eficacia de tofacitinib ha sido demostrada en pacientes con CU de moderada a grave, tanto en el tratamiento de inducción como en el de mantenimiento. Su vía de administración es oral, se usa en monoterapia, tiene un efecto rápido sobre la enfermedad y no provoca inmunogenicidad. Por todo ello, tofacitinib constituye un atractivo tratamiento en los pacientes con CU que experimentan fracaso o intolerancia al tratamiento convencional o a un medicamento biológico.
Conflicto de interesesEl Dr. Gisbert ha colaborado como orador, consultor y miembro asesor, o ha recibido fondos de investigación de: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Roche, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
El Dr. Panés ha colaborado como orador, consultor y miembro asesor, o ha recibido fondos de investigación de: Pfizer, Abbvie, Arena, Biogen, Boehringer-Ingelheim, Celgene, Genentech, Gilead, GoodGut, GSK, Janssen, MSD, Nestlé, Novartis, Oppilan, Progenity, Roche, Shire, Sigmoid Pharma, Takeda, Theravance, TiGenix y Topivert.
Los autores desean agradecer a Mónica Valderrama, Ana Cábez y Susana Gómez de Pfizer la revisión de este manuscrito, y a la Dra. Ana Moreno Cerro y a Anabel Herrero, PhD, la asistencia prestada en la redacción en nombre de Springer Healthcare y financiada por Pfizer España.