El Blastocystis hominis (B. hominis) es un protozoo comúnmente encontrado en el tracto gastrointestinal. Existen dudas sobre su significado clínico. El metronidazol (MTZ) es el tratamiento aconsejado de primera línea.
Material y métodosSe realizó una revisión retrospectiva entre 2011 y 2012. Se seleccionaron de forma aleatoria 151 de 383 muestras positivas para B. hominis. Los criterios de inclusión fueron: clínica sugestiva, indicación de tratamiento y realización de control microbiológico. Se realizó una revisión sistemática de los estudios que evalúan el efecto de MTZ sobre la infestación por B. hominis.
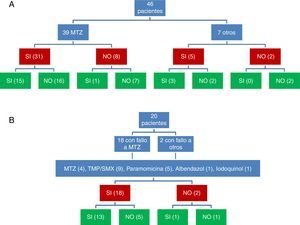
ResultadosCuarenta y seis pacientes cumplían criterios de inclusión (el 64% eran mujeres; edad, 44,2±2 años). Se utilizó MTZ en 39 pacientes, de los cuales 31 obtuvieron respuesta clínica (79,5%) pero solo 15 respuesta microbiológica (48,4%). No se apreció una relación dosis-efecto. Veinte pacientes sin respuesta microbiológica inicial recibieron una segunda tanda de tratamiento (MTZ, cotrimoxazol, paramomicina, otros), con una respuesta microbiológica del 70%. De forma global, se consiguió la curación de B. hominis en un 72% (IC95%: 57-83%). De 54 tratamientos asociados a respuesta clínica, se produjo respuesta microbiológica en 31 (57%); mientras que de los 12 que se siguieron de ausencia de respuesta clínica solo se observó la curación microbiológica en 2 (17%) (p=0,022). La tasa de erradicación en la revisión sistemática osciló entre 0 y 100%.
ConclusionesParece existir relación entre la respuesta clínica y microbiológica al tratamiento de B. hominis. En nuestro entorno geográfico la respuesta microbiológica al tratamiento con MTZ es insuficiente. La revisión sistemática muestra que la respuesta a MTZ es muy variable.
Blastocystis hominis (B. hominis) is a protozoan commonly found in the gastrointestinal tract. There are doubts about its clinical significance. Metronidazole (MTZ) is the recommended first-line treatment.
Materials and methodsA retrospective review was carried out between 2011 and 2012. A total of 151 samples were randomly selected from 383 samples positive for B. hominis. Inclusion criteria were: suggestive symptoms, treatment indication and microbiological follow-up. A systematic review was performed of all studies that evaluated the effect of MTZ on B. hominis infection.
ResultsForty-six patients met the inclusion criteria (64% women; age, 44.2±2 years). MTZ was used in 39 patients, 31 of whom obtained a clinical response (79.5%) but only 15 a microbiological response (48.4%). No dose-effect relationship was observed. Twenty patients with no initial microbiological response received a second round of treatment (MTZ, cotrimoxazole, paramomycin, others), with a microbiological response in 70%. Overall, B. hominis was cured in 72% (95% CI: 57%-83%). Of 54 treatments associated with a clinical response, a microbiological response occurred in 31 (57%), while in the remaining 12 with no clinical response, microbiological cure was observed in only 2 (17%) (P=.022). The eradication rate in the systematic review varied between 0% and 100%.
ConclusionsThere seems to be a relationship between the clinical and microbiological response to B. hominis treatment. The microbiological response to MTZ treatment is insufficient in our geographical setting. The systematic review shows that the response to MTZ is very variable.
El Blastocystis hominis (B. hominis) es un protozoo unicelular comúnmente encontrado en el tracto gastrointestinal. La parasitosis por B. hominis presenta una prevalencia a nivel mundial por encima del 50%, aunque varía según el área geográfica siendo más frecuente en países en vía de desarrollo1. El B. hominis es de los parásitos más comunes identificados en muestras de heces, junto a la Giardia lamblia (G. lamblia) y la Dientamoeba fragilis. El mecanismo de transmisión es fecal-oral. Existe en forma granular, vacuolar, quística y ameboide, esta última es la que se relaciona con el desarrollo de síntomas2.
A pesar de numerosos estudios, el papel patogénico de B. hominis sigue siendo controvertido3,4. No existen conceptos claros sobre la relevancia clínica, patogenicidad y necesidad de tratamiento. Se ha sugerido que esta infección se asocia frecuentemente a síntomas gastrointestinales tales como distensión y dolor abdominal, náuseas, vómitos y diarrea. Datos recientes indican que se relaciona también con alteraciones dermatológicas como eritema y urticaria, aunque esta forma de presentación sería menos frecuente1. En cuanto al mecanismo de acción patogénico, se ha descrito que el B. hominis expresa proteasas de la cisteína, las cuales desempeñan un papel fundamental en la invasión de las células huésped, la respuesta inmune y en la regulación del ciclo celular. En estudios in vivo se ha visto que estas proteasas pueden inhibir la producción de la inmunoglobulina A en la mucosa intestinal, contribuyendo a la supervivencia del parásito5.
El B. hominis presenta una amplia diversidad genética, existiendo alrededor de 17 subtipos identificados a través del análisis de secuencia de ARN ribosómico. El subtipo más frecuente en humanos es el 3. En España sobre todo se encuentra el subtipo 46. La heterogeneidad de las cepas podría explicar las diferencias en la patogenicidad. Sin embargo, se necesitan más estudios para aclarar si existe una relación entre el subtipo y la patogenicidad o si pueden contribuir otros factores.
Aunque existen dudas sobre su significado clínico y hasta qué punto se puede considerar al B. hominis como colonizador intestinal, hay estudios que identifican este parásito como único agente causal en infecciones gastrointestinales y dermatológicas en pacientes sintomáticos7. Por tanto, existe indicación de erradicación si la sintomatología es persistente, después de descartar otros diagnósticos. Se ha reportado la remisión espontánea en un 22% de los casos de una cohorte de individuos con B. hominis en muestras de heces8, mientras que otro estudio realizado en Taiwán muestra una remisión espontánea de un 91,2% al año de seguimiento9.
Para la erradicación del B. hominis se han utilizado distintos fármacos incluyendo el metronidazol (MTZ), la nitazoxanida, el trimetropim-sulfametoxazol (TMP/SMX), la paramomicina, el iodoquinol, el ketoconazol y el secnidazol, así como probióticos10. Se considera que el MTZ es el tratamiento de primera línea, sin embargo, la tasa de erradicación es muy variable y en ciertas áreas geográficas claramente insuficiente11. Se desconoce el mecanismo por el cual el MTZ erradica el B. hominis, pero está descrito que induce la muerte celular por apoptosis del parásito12. Las dosis de MTZ utilizadas en la literatura varían entre 250 y 750mg/8h durante 10 días13. Se ha sugerido que la variabilidad en la respuesta al MTZ puede ser secundaria a propiedades farmacocinéticas, la inactivación del fármaco por parte de la flora bacteriana o el rol de los distintos subtipos de B. hominis en la patogenicidad y susceptibilidad antimicrobiana14.
Los objetivos del presente estudio fueron: 1. Valorar la respuesta clínica y microbiológica al MTZ en nuestro entorno geográfico, y 2. Realizar una revisión sistemática de los estudios publicados donde se utiliza el MTZ para la infección por B. hominis, determinando así mismo la tasa de eficacia.
Material y métodosEstudio de casosSe evaluó el registro de estudio de parásitos en muestras de heces del servicio de Microbiología de CATLAB (Viladecavalls, Barcelona), que corresponden al área de salud del Hospital Universitari Mutua Terrassa (Terrassa, Barcelona). El área de salud del hospital corresponde a un medio rural y urbano y abarca 215.214 habitantes según el censo del año 2015. Durante 2011 y 2012 se solicitaron 9.844 estudios de parásitos en heces, de los cuales el 3,8% de las muestras (383 muestras) fueron positivas para B. hominis y el 11,7% (1.160 muestras) para G. lamblia. Del grupo de B. hominis se seleccionó de forma aleatoria una muestra de 151 pacientes adultos, 100 pertenecían a los Centros de Asistencia Primaria del área y 51 al propio hospital, en el cual se efectúan visitas de especialista de digestivo, tanto procedentes de la asistencia primaria como de consultas externas del Hospital. Se revisó la historia clínica compartida electrónica y el sistema integrado de receta electrónica de los pacientes (SIRE; Conselleria de Salut, Generalitat de Catalunya), de forma retrospectiva. Se seleccionaron todos los pacientes sintomáticos en los cuales se indicó tratamiento para erradicar B. hominis y en los que se había realizado un control microbiológico para comprobar la erradicación del parásito. Se excluyeron los casos con información insuficiente o no fiable.
Se registró la forma de presentación clínica, el tratamiento utilizado (fármaco, duración y dosis), la respuesta clínica y la respuesta microbiológica. Se consideró respuesta clínica la desaparición de los síntomas y respuesta microbiológica, un estudio de parásitos en heces negativo, ambas evaluadas al menos un mes después de completar el tratamiento. Como se trata de un estudio retrospectivo con datos anonimizados no fue necesario obtener el consentimiento del paciente.
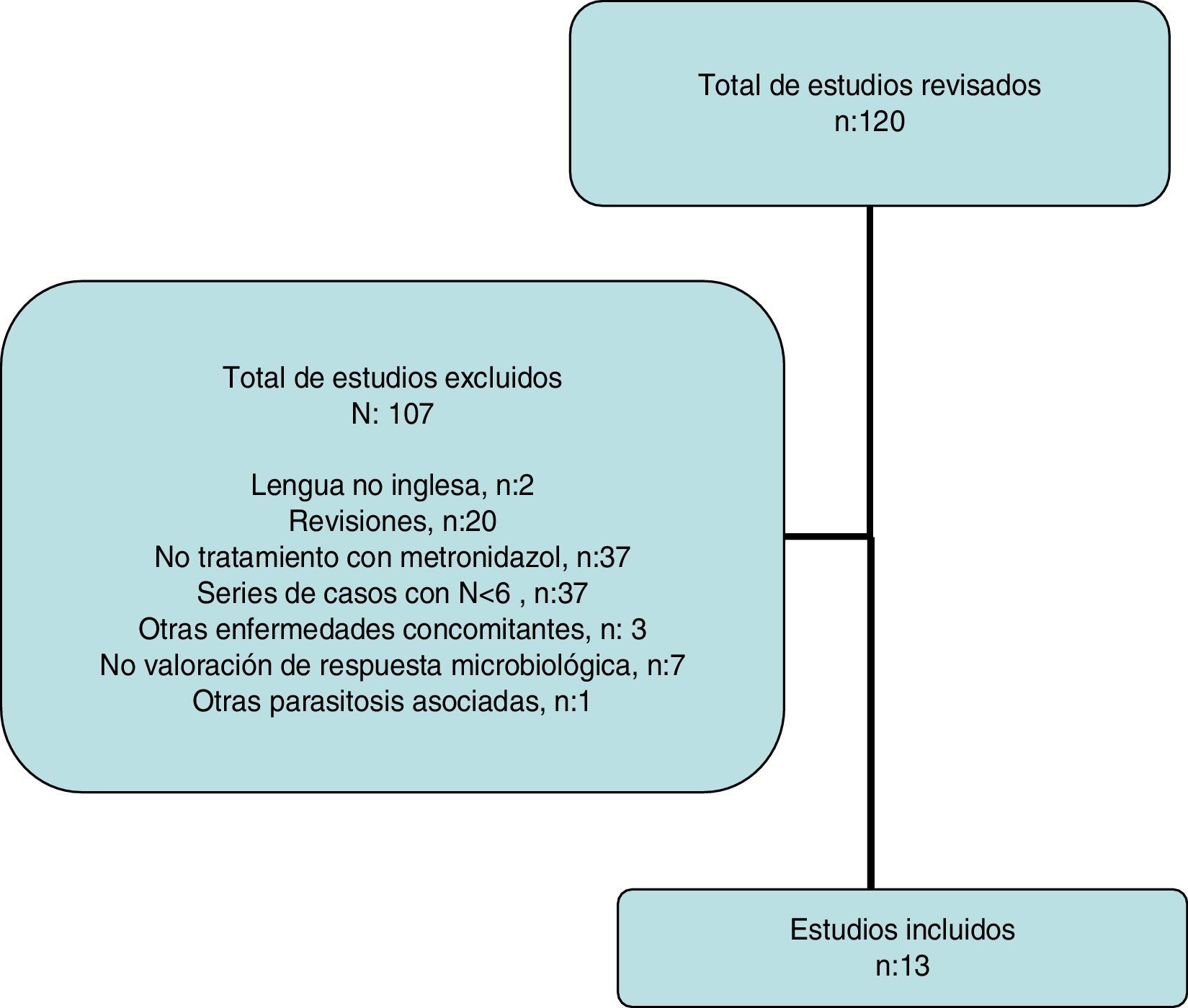
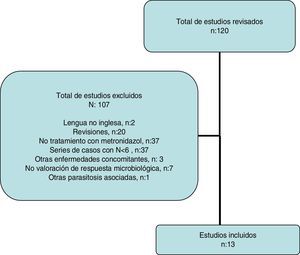
Revisión sistemáticaSe realizó una búsqueda bibliográfica sistemática para identificar aquellos estudios que evalúan el efecto del tratamiento con MTZ sobre la infestación por B. hominis en niños y adultos. Se efectuó la búsqueda electrónica en PubMed y Scopus hasta mayo de 2016 utilizando el siguiente algoritmo: (Blastocystis and treatment and human) OR (Blastocystis and metronidazole and human). Se revisaron los resúmenes presentados en los congresos de la «American Gastroenterological Association» (AGA) en los últimos 10 años. Además, se revisó la lista de citas bibliográficas de cada artículo seleccionado para identificar otros artículos. El proceso de búsqueda, selección de manuscritos y la extracción de datos fue realizado independientemente por L.B y F.F-B, y las discrepancias se resolvieron por consenso. Se excluyeron las revisiones científicas, las series de casos con una N menor de 6, presencia de enfermedades concomitantes (enfermedad inflamatoria intestinal, estados de inmunosupresión, neoplasias, infección por VIH, otras parasitosis asociadas) y los estudios en donde no se valoró la respuesta microbiológica.
Se registró el tamaño muestral, dosis de MTZ, respuesta microbiológica a MTZ, año de publicación y país de realización del estudio.
Análisis microbiológicoSe recogieron de forma rutinaria 3 muestras fecales de días diferentes por paciente. Todas las muestras fecales fueron remitidas al laboratorio de Microbiología fijadas con solución de acetato de sodio, ácido acético y formalina al 10% (SAF). Se detectó el B. hominis mediante microscopia óptica, previa concentración de la muestra con el sistema COPRO-PACK fijador SAF (Biomedics, S.L., Alemania).
Análisis estadísticoLos resultados se expresan como media±EEM y como proporciones con su intervalo de confianza del 95% (IC95%) cuando se consideró apropiado. Se utilizó el test de Chi cuadrado para analizar diferencias entre variables cualitativas. Se consideró significativo un valor de p<0,05.
ResultadosEstudio de casosDe los 151 pacientes seleccionados, solo 46 cumplían los criterios de inclusión (64% mujeres; edad media 44,2±2 [20-78 años]). El 90% de los casos tuvieron clínica de diarrea acuosa sin sangre y/o dolor abdominal y en el 71,7% la diarrea fue el síntoma predominante. El 10% restante presentaba clínica de dispepsia y/o hinchazón abdominal. Ningún paciente presentó fiebre ni pérdida de peso.
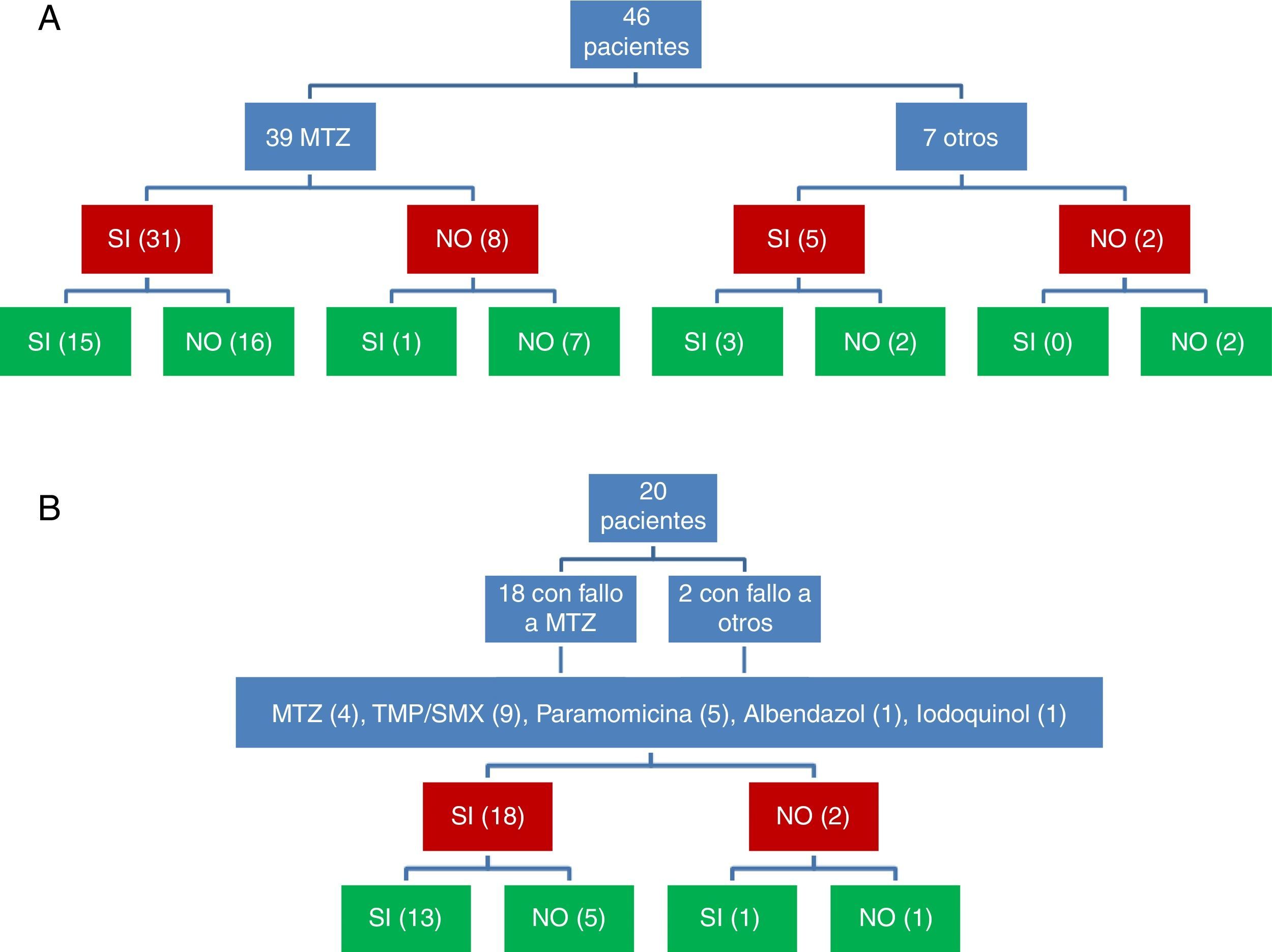
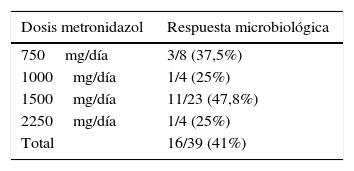
La respuesta clínica y microbiológica al tratamiento inicial (39 pacientes tratados con MTZ) se describe en la figura 1. En 36 pacientes (78,3%) se obtuvo respuesta clínica (31 pacientes tratados con MTZ; 79,5%). En 18 de estos 36 pacientes (50%) se obtuvo respuesta microbiológica (15 tratados con MTZ; 48,4%) (tabla 1). No se apreció una relación dosis-efecto entre la dosis de MTZ utilizada y la tasa de respuesta microbiológica (tabla 2). Veinte pacientes con ausencia de respuesta microbiológica tras el tratamiento inicial recibieron una segunda tanda de tratamiento (18 habían fallado a MTZ y 2 a otros antibióticos) (tabla 3), 18 (90%) de los mismos presentaron respuesta clínica. Se consiguió la respuesta microbiológica en 14 de 20 pacientes (70%), en el 66,7% con TMP/SMX (dosis: 800/160mg/12h) y en el 100% con paramomicina (dosis: 500mg/8h).
Valorando conjuntamente la respuesta clínica y microbiológica a las 2 tandas de antibiótico se consiguió la respuesta clínica y microbiológica tras 31 de 66 tratamientos (fig. 1). De 54 tratamientos asociados a respuesta clínica, se produjo respuesta microbiológica en 31 (57,4%); mientras que de los 12 que se siguieron de ausencia de respuesta clínica solo se observó la curación microbiológica en 2 (16,7%) (p=0,022).
De forma global, se consiguió la curación de B. hominis en 33 de los 46 pacientes en los que se valoró la respuesta clínica y microbiológica (71,7%; IC95%: 57,4-82,7%). En 3 de 29 (10,3%) pacientes con respuesta clínica y curación microbiológica se apreciaron recidivas de la infestación en el seguimiento diagnosticadas después de la reaparición de síntomas. En los 26 pacientes restantes no se apreció recidiva clínica después una media de seguimiento de 6,5±0,8 meses.
Revisión sistemáticaLa estrategia de búsqueda proporcionó 116 publicaciones (fig. 2); se excluyeron 103 después de examinar el título y el resumen porque no cumplían los criterios de inclusión.
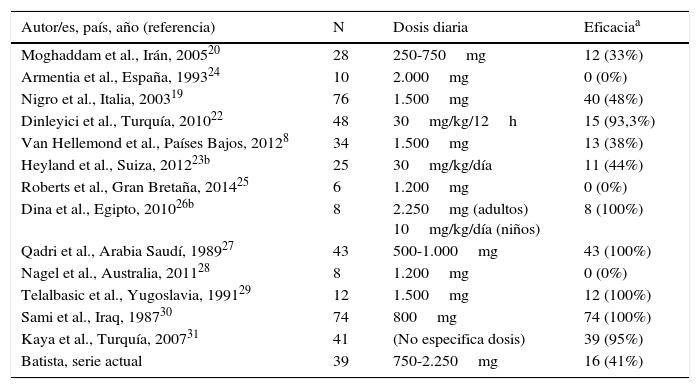
Finalmente se incluyeron 13 estudios, que se describen en la tabla 4, junto con los datos del presente estudio. Globalmente, se obtuvieron datos de 452 pacientes con infestación por B. hominis tratados con MTZ. Las dosis del fármaco fueron muy variables sin apreciarse un efecto dosis-respuesta. La tasa de erradicación fue también muy variable oscilando entre el 0 y 100% (tasa global: 62,6-50% si solo se tienen en cuenta los estudios europeos). La heterogeneidad de los resultados obtenidos han impedido realizar un metaanálisis de los estudios seleccionados.
Tasas de eficacia en la erradicación del B. hominis utilizando metronidazol descritas en la literatura
| Autor/es, país, año (referencia) | N | Dosis diaria | Eficaciaa |
|---|---|---|---|
| Moghaddam et al., Irán, 200520 | 28 | 250-750mg | 12 (33%) |
| Armentia et al., España, 199324 | 10 | 2.000mg | 0 (0%) |
| Nigro et al., Italia, 200319 | 76 | 1.500mg | 40 (48%) |
| Dinleyici et al., Turquía, 201022 | 48 | 30mg/kg/12h | 15 (93,3%) |
| Van Hellemond et al., Países Bajos, 20128 | 34 | 1.500mg | 13 (38%) |
| Heyland et al., Suiza, 201223b | 25 | 30mg/kg/día | 11 (44%) |
| Roberts et al., Gran Bretaña, 201425 | 6 | 1.200mg | 0 (0%) |
| Dina et al., Egipto, 201026b | 8 | 2.250mg (adultos) 10mg/kg/día (niños) | 8 (100%) |
| Qadri et al., Arabia Saudí, 198927 | 43 | 500-1.000mg | 43 (100%) |
| Nagel et al., Australia, 201128 | 8 | 1.200mg | 0 (0%) |
| Telalbasic et al., Yugoslavia, 199129 | 12 | 1.500mg | 12 (100%) |
| Sami et al., Iraq, 198730 | 74 | 800mg | 74 (100%) |
| Kaya et al., Turquía, 200731 | 41 | (No especifica dosis) | 39 (95%) |
| Batista, serie actual | 39 | 750-2.250mg | 16 (41%) |
En el presente estudio la determinación de parásitos en heces se solicitó en pacientes con clínica digestiva, sin signos de alarma. Se detectó la presencia de B. hominis en un 4% de las muestras estudiadas, siendo este porcentaje inferior a la frecuencia de infestación por G. lamblia. En un estudio realizado en Madrid se registró una prevalencia de infección por B. hominis del 6,9%15. Otro estudio en A Coruña muestra una prevalencia del 4,5% en una población pediátrica16. Por lo tanto, la prevalencia detectada en nuestro medio es similar a la previamente descrita en España. Se obtuvo una respuesta clínica y microbiológica al tratamiento en un 72% de los pacientes. El hecho de que la respuesta clínica fue significativamente más elevada en los pacientes con erradicación del parásito apoya la hipótesis de que B. hominis puede ser el causante de estos síntomas. Sin embargo, son necesarios ensayos clínicos controlados para confirmar esta afirmación.
Existe controversia en cuanto al tratamiento de primera línea para la erradicación del B. hominis. Este parásito está presente exclusivamente en la luz del colon sin interactuar con la mucosa, por lo tanto el fármaco ideal debe alcanzar altas concentraciones en la luz del colon, tener un tiempo de tránsito corto en el intestino delgado y resistencia a la inactivación por la flora intestinal17. Actualmente, como ya se ha mencionado, se considera al MTZ como el fármaco de primera línea.
Sin embargo, la efectividad descrita varía desde un 0% a un 100% (tabla 4); una de las principales causas de esta variabilidad puede ser la presencia de diferencias en el grado de resistencia al fármaco. De hecho se ha sugerido que la efectividad de MTZ depende del subtipo de B. hominis18. Por tanto, las diferencias geográficas respecto a las variabilidad en la sensibilidad de B. hominis a los antibióticos obliga a disponer de estudios de eficacia a nivel local.
En un estudio controlado con placebo realizado en Italia en 76 pacientes con infección por B. hominis, se demostró la resolución clínica un mes después del tratamiento en un 88% de los pacientes tratados con MTZ vs. un 14% en el grupo placebo. La respuesta microbiológica a MTZ fue del 80%, mientras que la respuesta al placebo fue del 3%. Se realizó un seguimiento a los 6 meses donde el 75% de los pacientes tratados con MTZ estaban asintomáticos; sin embargo, la respuesta microbiológica solo se mantuvo en el 48%19. Según nuestros resultados la mayoría de los pacientes (79,5%) alcanzaron la respuesta clínica con MTZ. Sin embargo, la respuesta microbiológica fue tan solo de un 38,5%, dato claramente inferior al proporcionado en el mencionado estudio italiano19. De todas maneras, es llamativa la diferencia entre la respuesta microbiológica inicial y la mantenida en el mencionado estudio italiano, lo que indica que quizás el estudio microbiológico inicial se realizó de forma demasiado temprana. Por otro lado, las diferencias entre la tasa de respuesta clínica y la microbiológica pueden ser debidas a varias posibilidades: puede producirse una disminución del número de parásitos con la consiguiente mejoría clínica pero sin conseguir erradicar la parasitosis definitivamente, o también el MTZ podría actuar indirectamente a través de la inhibición de otros microorganismos patógenos no identificados responsables de la clínica del paciente. Asimismo, no puede descartarse un efecto placebo inicial. De todas maneras, queda claro que valorar únicamente la respuesta clínica inicial al tratamiento es insuficiente para considerar la curación del paciente.
Al realizar el análisis concomitante de la respuesta clínica y microbiológica, se observó que la curación microbiológica fue significativamente más alta cuando se alcanzó la respuesta clínica. Esta observación apoya el papel causal del parásito en la patogénesis de los síntomas de los pacientes.
La descripción de fallos terapéuticos con MTZ ha motivado la búsqueda de fármacos alternativos. No existe consenso sobre qué tratamiento ofrecer a los pacientes con fracaso terapéutico con MTZ. Se han propuesto otros fármacos como tratamiento de primera línea que incluyen TMP/SMX y la paramomicina con tasas de erradicación entre 70-95%. En nuestro estudio, un segundo tratamiento con MTZ fue ineficaz (respuesta microbiológica: 25%). En cambio la respuesta microbiológica a TMP/SMX o paramomicina fue buena (67 y 100%, respectivamente), aunque el número de pacientes tratados fue escaso.
Los datos de la literatura respecto al efecto de TMP/SMX son controvertidos. En un estudio turco en una cohorte de 53 pacientes sintomáticos que recibieron tratamiento con este fármaco (niños, dosis de 6mg/kg TMP y 30mg/kg SMX; adultos, 320mg TMP, 1.600mg SMX por 7 días), se alcanzó una tasa de curación del parásito del 93,3% en adultos y del 94,7% en niños, con una respuesta clínica de un 73%21. Sin embargo, autores suizos indican que TMP/SMX solo produce una reducción del número de B. hominis y no una erradicación permanente23; dicho estudio demuestra también que el TMP/SMX parece no ser superior al placebo en el tratamiento de pacientes pediátricos con dolor abdominal recurrente e infección por B. hominis, consiguiendo una erradicación del 35% de los pacientes con TMP/SMX y del 44% de los casos con MTZ. Un 29% del grupo placebo tuvo aclaramiento espontáneo. En un estudio controlado con MTZ realizado en Irán, la respuesta a TMP/SMX (1 tab 3 veces/día durante 10 días) fue del 22%, mientras que la respuesta a MTZ fue del 33%20. Como ya se ha mencionado, diferencias en el subtipo de B. hominis y en su patogenicidad o grado de resistencia a los antibióticos podrían explicar las variaciones en la respuesta a TMP/SMX en diferentes áreas geográficas del mundo. En este sentido parece importante disponer de datos propios obtenidos en el entorno geográfico.
Otro fármaco de segunda línea es la paramomicina. Este antimicrobiano de amplio espectro presenta actividad bactericida. Se ha descrito que este fármaco es eficaz en casos de infección por B. hominis y urticaria crónica24. Hasta el momento, los estudios realizados en series pequeñas de pacientes describen tasas de curación por encima del 75%. La serie más larga corresponde a un estudio holandés con una población de 52 pacientes y una tasa de erradicación del 77% (dosis 500mg/8h durante 7-10 días). En este mismo estudio la respuesta a MTZ fue del 38%8. Aunque en nuestro estudio paramomicina se utilizó tan solo en 5 pacientes, todos tuvieron curación microbiológica, resultados que parecen prometedores.
En conclusión, parece existir una relación entre la respuesta clínica y microbiológica al tratamiento de B. hominis, lo que muestra el papel causal del parásito. En nuestro entorno geográfico la respuesta microbiológica al tratamiento con MTZ es claramente insuficiente. La revisión sistemática muestra que la respuesta a MTZ es muy variable oscilando entre 0 y 100%. Son necesarios estudios controlados para evaluar la eficacia de otros fármacos como el TMP/SMX o la paramomicina como tratamientos de primera línea. Estos estudios ayudarán a confirmar el papel patogénico de esta infestación.
Conflicto de interesesLos autores no presentan conflicto de intereses.
Este estudio se presentó en el congreso de la Asociación Española de Gastroenterología celebrado en Madrid en 2014, y fue publicado como un resumen en Gastroenterología y Hepatología 2014.