La esofagitis eosinofílica (EoE) es una enfermedad causada por una respuesta inmune frente a antígenos alimentarios en contacto con la mucosa esofágica. Su diagnóstico se define por la combinación de síntomas de disfunción esofágica e inflamación de la mucosa esofágica, predominantemente eosinofílica. Su curso crónico y la frecuente progresión hacia fibrosis subepitelial y estenosis esofágicas indican la necesidad de tratamiento. La información proporcionada por ensayos clínicos y revisiones sistemáticas recientes ha permitido desarrollar una nueva guía clínica, avalada por varias sociedades científicas europeas. Esta revisión recoge los aspectos más relevantes de la nueva guía, actualiza el concepto de EoE, informa de su epidemiología y factores de riesgo, condiciones asociadas y su historia natural en niños y adultos. Se proporcionan los criterios diagnósticos, se analizan las pruebas para diagnóstico y monitorización de la EoE, y las opciones terapéuticas en base a la mejor evidencia científica y la opinión consensuada de expertos.
Eosinophilic oesophagitis (EoE) is a disease caused by an immune response to food antigens in contact with the oesophageal mucosa. Its diagnosis is defined by the combination of oesophageal dysfunction symptoms and inflammation of the oesophageal mucosa predominantly by eosinophils. Its chronic course and frequent progression to subepithelial fibrosis and oesophageal strictures indicate the need for treatment. The information provided by recent clinical trials and systematic reviews has led to the development of new clinical guidelines, endorsed by several European scientific societies. This review includes the most relevant aspects of the new guidelines, updates the EoE concept and reports its epidemiology and risk factors, associated conditions and its natural history in children and adults. Diagnostic criteria are provided, and tests for EoE diagnosis and monitoring and therapeutic options are analysed based on the best scientific evidence and consensus opinion of experts.
La esofagitis eosinofílica (EoE) es una enfermedad inflamatoria del esófago de carácter crónico. Clínicamente se caracteriza por síntomas de disfunción esofágica, e histológicamente por inflamación esofágica en la que predominan los eosinófilos. Desde la caracterización inicial de la EoE como un síndrome clínico patológico propio distinto de la gastroenteritis eosinofílica, llevada a cabo a principios de los años 1990 por dos grupos independientes de investigadores1,2, su prevalencia ha aumentado dramáticamente, hasta afectar al menos a un habitante por cada 2.000 en Europa y Norteamérica3. Como resultado, la EoE representa en la actualidad la segunda causa de esofagitis crónica tras la enfermedad por reflujo gastroesofágico (ERGE) y la principal causa de disfagia e impactación de alimentos en niños y adultos jóvenes. Pese a no asociarse con mortalidad o riesgo de malignización, su carácter crónico y su comportamiento progresivo impactan negativamente sobre la calidad de vida de los pacientes4.
A lo largo de las dos décadas de historia de la enfermedad, el volumen de evidencia científica disponible sobre los distintos aspectos epidemiológicos, fisiopatológicos, clínicos y terapéuticos de la EoE ha crecido de manera exponencial, y ha sido resumido en cuatro documentos de consenso y guías de práctica clínica desarrollados por grupos de expertos5-8. Sin embargo, los grandes avances alcanzados en los últimos años, incluidos varios ensayos clínicos aleatorizados (ECA) y controlados y metaanálisis con revisiones sistemáticas, ausentes en las guías previas, condicionan que estas estén actualmente obsoletas. Además, la calidad global de todas las guías previas (evaluada mediante la herramienta AGREEII) es limitada, pues ninguna empleó métodos específicos para establecer la calidad de las pruebas o el peso de las afirmaciones y recomendaciones que proporcionaban9.
Una nueva guía clínica desarrollada por un grupo internacional de expertos utilizando el sistema GRADE para clasificar la evidencia y la fuerza de las recomendaciones acaba de ser publicada bajo el auspicio de la United European Gastroenterology10. Las recomendaciones se basaron en las mejores pruebas disponibles, y cuando tales pruebas no estaban disponibles o se consideró que eran incoherentes, se recurrió al consenso entre los autores expertos y la mejor práctica clínica. Tras someterse a dos rondas de votaciones, las recomendaciones fueron consensuadas en una reunión final presencial. La nueva guía10, cuyas principales recomendaciones se expondrán en esta revisión, pretende proporcionar a los clínicos que atienden a niños y adultos con EoE (incluyendo gastroenterólogos, alergólogos, pediatras, otorrinolaringólogos, patólogos, dietistas, médicos de familia y de servicios de urgencias) un marco estructurado para el diagnóstico y tratamiento de la enfermedad.
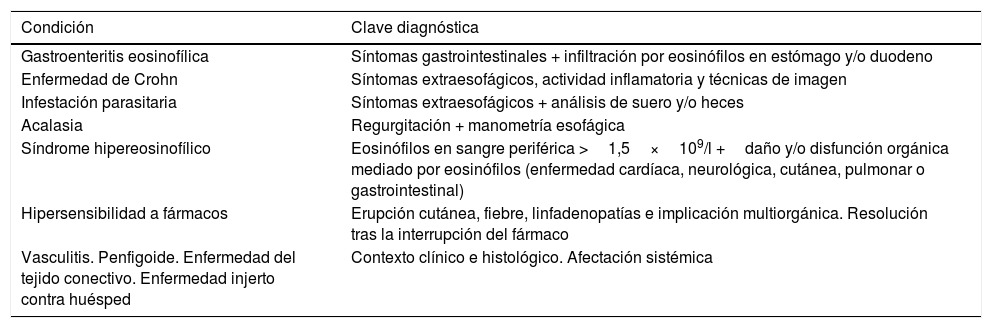
Definición de la esofagitis eosinofílica: evolución y concepto actualDe acuerdo con la definición más reciente, la EoE representa una enfermedad esofágica crónica, mediada por el sistema inmune, que se caracteriza clínicamente por síntomas relacionados con una disfunción del esófago e histológicamente por una inflamación predominantemente eosinofílica. Las manifestaciones clínicas y los hallazgos histológicos no deben interpretarse aisladamente, y deben excluirse otras causas locales y sistémicas de eosinofilia esofágica (tabla 1).
Causas locales y sistémicas de eosinofilia esofágica a excluir antes de diagnosticar una esofagitis eosinofílica
| Condición | Clave diagnóstica |
|---|---|
| Gastroenteritis eosinofílica | Síntomas gastrointestinales + infiltración por eosinófilos en estómago y/o duodeno |
| Enfermedad de Crohn | Síntomas extraesofágicos, actividad inflamatoria y técnicas de imagen |
| Infestación parasitaria | Síntomas extraesofágicos + análisis de suero y/o heces |
| Acalasia | Regurgitación + manometría esofágica |
| Síndrome hipereosinofílico | Eosinófilos en sangre periférica >1,5×109/l +daño y/o disfunción orgánica mediado por eosinófilos (enfermedad cardíaca, neurológica, cutánea, pulmonar o gastrointestinal) |
| Hipersensibilidad a fármacos | Erupción cutánea, fiebre, linfadenopatías e implicación multiorgánica. Resolución tras la interrupción del fármaco |
| Vasculitis. Penfigoide. Enfermedad del tejido conectivo. Enfermedad injerto contra huésped | Contexto clínico e histológico. Afectación sistémica |
Las primeras guías para la EoE, publicadas en 2007, consideraban como criterios diagnósticos la presencia de síntomas de disfunción esofágica, la infiltración eosinofílica del esófago (definida por biopsias epiteliales con >15 eosinófilos por campo de gran aumento), junto con la ausencia de respuesta a inhibidores de la bomba de protones (IBP) o, alternativamente, la exposición normal del esófago al ácido determinada mediante pH-metría5. Se establecía de este modo un criterio diagnóstico dicotómico que asumía que la ERGE y la EoE eran trastornos mutuamente excluyentes, siendo la ERGE la única enfermedad esofágica capaz de responder al tratamiento con IBP. Sin embargo, esta asunción era contraintuitiva, en tanto que la probabilidad a priori de la coexistencia de ambas enfermedades era alta, al afectar de manera común más frecuentemente a varones jóvenes11. En 2011, la primera serie prospectiva que evaluaba sistemáticamente el tratamiento con IBP en pacientes con eosinofilia esofágica y síntomas sugestivos de EoE mostró que hasta el 50% respondió a los IBP12. Además, los hallazgos clínicos, endoscópicos e histológicos fueron indistinguibles entre los respondedores y no respondedores a IBP, existiendo por tanto un amplio solapamiento entre la ERGE (determinada mediante monitorización del pH esofágico) y la EoE. Tras este estudio, las posteriores guías excluyeron la monitorización del pH esofágico como un criterio para el diagnóstico de EoE6, pero seguían considerando la respuesta a IBP como motivo suficiente para descartar una EoE. La definición de un nuevo fenotipo potencial de la enfermedad en 2011, denominado «eosinofilia esofágica respondedora a IBP», para clasificar a los pacientes con una aparente EoE que alcanzaban la remisión completa tras el tratamiento con IBP, desplazó a la ERGE como el principal diagnóstico diferencial de la EoE. Desde 2011, numerosos estudios han dejado claro que los pacientes respondedores a IBP comparten no solo características clínicas, endoscópicas e histológicas, sino también moleculares11. Ninguna otra enfermedad inflamatoria digestiva, excepto la «eosinofilia esofágica respondedora a IBP», se define por su respuesta a un tipo de medicamento, sino por sus características genotípicas y fenotípicas. Por lo tanto, la principal novedad de esta guía clínica actualizada es la retractación del anterior término, pasando a considerar el tratamiento con IBP no como un criterio diagnóstico para la EoE, sino más bien como un agente terapéutico13. Por tanto, la remisión clínica e histológica tras el tratamiento con IBP actualmente forma parte del espectro de la EoE y no se debe considerar como una entidad separada, si bien se requieren datos adicionales en niños. Igualmente, la ERGE no constituye un diagnóstico diferencial de la EoE, y ambas entidades pueden coexistir, independientemente o interactuando.
Epidemiología y factores de riesgo de la esofagitis eosinofílicaDiversos estudios han proporcionado información sobre la frecuencia de la EoE a partir de registros de casos, series de endoscopias y archivos de biopsias esofágicas, y más recientemente mediante estudios de base poblacional. Los resultados de estos últimos han sido recientemente resumidos en un metaanálisis3. La prevalencia de la EoE ha aumentado rápidamente en varios países de Europa y Norteamérica, con una incidencia global variable entre 1 a 20 nuevos casos por 100.000 habitantes y año, y prevalencia de entre 13 y 49 casos por 100.000 habitantes, siendo estas cifras significativamente mayores en los estudios publicados después de 2008.
En el caso particular de España, los resultados de un estudio de base poblacional que analizaba el periodo de estudio 2005 a 2011 estimaron una incidencia anual media para adultos de 6,4 casos por 100.000 habitantes, y una prevalencia de 44,6 casos por 100.000 habitantes14. Estas cifras han sido recientemente actualizadas para el periodo 2007-2016 y muestran un marcado aumento, hasta una incidencia media de 13,7 casos/100.000 habitantes/año y una prevalencia de 81,7 pacientes/100.000 habitantes15. La EoE representa un 7% de los diagnósticos entre los sujetos adultos remitidos a exploración endoscópica por síntomas esofágicos16. Sin embargo, esta frecuencia aumenta hasta el 23 y el 50% si se considera únicamente a los pacientes con disfagia o impactación alimentaria, respectivamente17,18. Estos datos deben ser corroborados en series pediátricas, dado que la enfermedad en niños parece aún claramente infradiagnosticada19,20.
La EoE puede presentarse a cualquier edad. En los niños la mayoría de los estudios coinciden en mostrar picos de incidencia que crecen con la edad21; entre los adultos, la mayor frecuencia de casos se ha descrito entre los 30 y los 50años22. Prácticamente todos los estudios han mostrado que la frecuencia de EoE es mayor en varones que en mujeres, tanto en niños como en adultos, con un odds ratio (OR) de 2,01 (IC95%: 1,63-2,48) en un metaanálisis de estudios poblacionales3. Aunque se ha descrito la asociación familiar, estudios en gemelos y de casos familiares han mostrado que la concurrencia de EoE dentro de una familia se asocia de manera mucho más intensa a componentes ambientales que a causas genéticas23. Así mismo, se ha descrito una asociación entre un polimorfismo de un único nucleótido (SNP) en el gen de la linfopoyetina estromal tímica (TSLP) y otro SNP en su receptor. Este último se encuentra codificado en la región pseudoautosómica de los cromosomas sexuales.
Junto con el sexo masculino, la atopia ha sido considerada otro importante factor de riesgo para padecer EoE: ciertamente, estos pacientes presentan rinitis, asma bronquial y eccema con una frecuencia significativamente superior a la de la población general24. La alergia alimentaria mediada por IgE también ha sido relacionada con la EoE, e incluso el tratamiento de la anafilaxia inducida por alimentos mediante inmunoterapia oral podría constituir un factor de riego para el desarrollo de EoE de novo25. Sin embargo, hasta la fecha no ha podido demostrarse que la atopia por sí misma predisponga a padecer EoE. De hecho, la EoE como forma particular de alergia alimentaria parece ser independiente de la acción de la IgE26 y, por el contrario, asociada a IgG427. En todo caso, y al margen de la atopia, la EoE ha sido relacionada con otros trastornos. Entre ellos, el más antiguo fue la asociación con la enfermedad celiaca, resultado de un evidente sesgo de publicación, y actualmente descartado por varios estudios sólidos28-30. Otras asociaciones descritas incluyen los síndromes hipereosinofílicos, la enfermedad inflamatoria intestinal, la atresia esofágica y algunos trastornos del tejido conectivo, como los síndromes de Marfan o de Ehlers-Danlos31, sin que haya sido posible demostrar una asociación causal o temporal entre ninguno de ellos y la propia EoE.
Diagnóstico de la esofagitis eosinofílicaLas manifestaciones clínicas más frecuentes de la EoE en niños mayores y adultos son la disfagia con alimentos sólidos y la impactación alimentaria y el dolor torácico no asociado con la deglución32,33. En los niños más pequeños los síntomas más comunes se solapan en gran medida con los propios del reflujo gastroesofágico, e incluyen vómitos, dolor abdominal, rechazo de alimentos y fallo de medro21. Estos síntomas deben orientar la sospecha diagnóstica y la realización de endoscopia siempre acompañada de toma de biopsias, ya que los hallazgos endoscópicos por sí solos no permiten establecer de manera fiable un diagnóstico de EoE34. Debido a que los cambios inflamatorios en la EoE son parcheados y pueden no estar presentes en todas las biopsias35,36, deberían obtenerse al menos 6 biopsias de dos localizaciones distintas en el esófago, típicamente en la mitad proximal y distal del órgano. La sensibilidad del diagnóstico aumenta con el número de biopsias y alcanza el 100% con al menos estas 6 biopsias, que deberían dirigirse a las áreas con anomalías endoscópicas, principalmente exudados blanquecinos y surcos longitudinales, ya que estas muestran la máxima infiltración por eosinófilos36-38. Las biopsias deben tomarse independientemente de que el esófago muestre un aspecto endoscópico normal, ya que esto se ha descrito en el 10 y el 32% de pacientes adultos y pediátricos, respectivamente39,40. En el momento del diagnóstico inicial deberían también obtenerse biopsias de la mucosa gástrica y duodenal con el fin de excluir una gastroenteritis eosinofílica, especialmente en niños o en caso de presentarse otros síntomas gastrointestinales concomitantes. Estas biopsias no son precisas en las posteriores valoraciones de un paciente41.
Desde la descripción inicial de la EoE el umbral histológico de densidad eosinofílica necesario para el diagnóstico de esta enfermedad ha variado42, fijándose a partir de 2011 en 15 eosinófilos por campo de gran aumento (CGA). Además de que este criterio proporciona uniformidad para todos los pacientes, permite distinguir de manera precisa entre las dos enfermedades asociadas con infiltración por eosinófilos en la mucosa del esófago, EoE y ERGE, pues la ERGE se asocia a un bajo recuento de eosinófilos, generalmente por debajo de 5 por CGA. Es importante resaltar aquí de nuevo que ERGE y EoE no son trastornos mutuamente excluyentes y pueden coexistir en un mismo paciente. El punto de corte de 15 eosinófilos por CGA ha mostrado recientemente una sensibilidad del 100% y una especificidad del 96% en el diagnóstico de la EoE43. Sin embargo, este umbral resulta algo arbitrario, pues el tamaño de un CGA varía entre fabricantes de microscopios42 y debe ser evaluado siempre dentro del contexto clínico, especialmente en aquellos casos con recuentos compatibles con EoE obtenidos de muestras de pacientes asintomáticos. Informar de la densidad de eosinófilos por milímetro cuadrado y la comunicación con el patólogo ante hallazgos cuestionables resultan útiles en la práctica clínica, así como evaluar otros marcadores histológicos adicionales que caracterizan a la EoE, como la presencia de microabscesos eosinofílicos, espacios intercelulares dilatados, despegamientos en la superficie epitelial por efecto de los eosinófilos, elongación de las papilas conjuntivas, y la presencia de fibrosis en la lámina propia. Las tinciones con hematoxilina y eosina resultan suficientes para la valoración histológica de la EoE en la rutina clínica. La utilidad de un nuevo sistema de gradación histopatológica específico para la EoE (EoEHSS) precisa ser aún evaluada44.
Una vez establecido el diagnóstico inicial de EoE, la monitorización de la actividad de la enfermedad, que incluye tanto la presencia o ausencia de síntomas como de inflamación eosinofílica en la mucosa del esófago en respuesta a las intervenciones terapéuticas, es una necesidad compartida con otras enfermedades crónicas. La capacidad de los síntomas (o de su ausencia) para predecir la actividad inflamatoria en la EoE se ha desvelado repetidamente muy limitada. El desarrollo del índice de actividad de la EoE (EEsAI) específico para esta enfermedad45, que cuantifica las dificultades potenciales previstas por los pacientes ante alimentos con diferentes consistencias, así como las modificaciones de la dieta o del comportamiento para solventarlas, posee una capacidad predictiva muy modesta sobre la actividad inflamatoria de la enfermedad, como ha quedado plasmado en un reciente estudio multicéntrico y prospectivo46.
Los hallazgos endoscópicos asociados a la EoE han sido sistematizados en la clasificación EREFS (acrónimo en inglés de exudados, anillos, edema, surcos y estenosis), que fue validada en pacientes adultos con un buen grado de acuerdo entre observadores47. La capacidad de esta clasificación para diagnosticar y monitorizar la actividad de la EoE, sin embargo, ha resultado hasta ahora igualmente muy limitada48,49. Por lo tanto, y pese a que esta práctica está muy extendida50, los clínicos no deberían hacer suposiciones sobre la actividad biológica de la EoE exclusivamente basadas en los síntomas o los hallazgos endoscópicos, debiendo apoyar sus decisiones necesariamente también en los resultados de las biopsias.
Historia natural de la esofagitis eosinofílicaLos primeros datos sobre la evolución de la enfermedad en ausencia de tratamiento fueron proporcionados por una serie suiza de 30 pacientes adultos con un seguimiento medio de 7,2años, que documentó la persistencia a lo largo del tiempo de la disfagia y de la infiltración eosinofílica esofágica51. Respecto a la enfermedad en la infancia, dos series de 89 y 330 niños con un seguimiento de hasta 8años21,52 confirmaron su carácter crónico y las frecuentes recaídas al suspender el tratamiento. Los adultos diagnosticados de EoE durante la infancia continúan presentando síntomas y necesitando tratamiento. La duración de la enfermedad no tratada constituye el principal factor de riesgo para la remodelación fibrosa esofágica y la formación de estenosis53, cuya prevalencia aumenta del 47 al 88% cuando el retraso diagnóstico (y la ausencia de tratamiento aparejado) pasa de 2 a más de 20años54, y se dobla con cada aumento de 10años en la edad del paciente al diagnóstico55. La frecuencia de anomalías funcionales detectadas mediante manometría esofágica de alta resolución también aumenta con la duración de la enfermedad56. Algunos datos preliminares muestran la capacidad de los esteroides tópicos y del tratamiento dietético para revertir la remodelación esofágica en niños57,58. No existe prueba alguna de que la EoE sea una condición premaligna.
Por su carácter crónico y progresivo, la EoE impacta sobre la calidad de vida y el ajuste psicosocial de los niños afectados y sus familias, produciendo ansiedad y depresión, deterioro del sueño y problemas escolares. Entre los adultos, la EoE afecta al funcionamiento psicosocial, pero no al bienestar físico o al funcionamiento mental. La ansiedad derivada de las incertidumbres sobre la evolución de la enfermedad a largo plazo, el uso prolongado de fármacos o de dietas altamente restrictivas y el riesgo de impactación alimentaria obstaculiza las interacciones sociales. La calidad de vida empeora en todas las edades en los casos con síntomas esofágicos más pronunciados y enfermedad histológica activa4.
Tratamiento de la esofagitis eosinofílicaEl tratamiento de la EoE comprende el uso de fármacos o de modificaciones dietéticas capaces de inducir y mantener la remisión de los síntomas y del infiltrado inflamatorio eosinofílico del esófago, y de dilatación endoscópica para resolver las estenosis o el calibre disminuido del esófago, como consecuencia del proceso de remodelado fibroso del órgano.
Tratamiento con inhibidores de la bomba de protonesEntre los fármacos con capacidad antiinflamatoria útiles en la EoE, varios ensayos clínicos y estudios prospectivos en adultos y niños han demostrado que el tratamiento con IBP es capaz de inducir la remisión histológica de la enfermedad (definida como una reducción del infiltrado eosinofílico por debajo de los 15 por CGA) en el 50-57% de los pacientes59-61. El primer estudio prospectivo realizado en pacientes pediátricos también mostró una tasa de remisión histológica equivalente al 47%61. Una reciente revisión sistemática con metaanálisis, con la inclusión de 33 estudios con 619 pacientes con EoE, demostró que los IBP inducían la remisión histológica (definida por <15 eosinófilos por CGA) en el 50,5% (IC95%: 42,2-58,7%) y mejoría sintomática en el 60,8% (IC95%: 48,38-72,2%) de los pacientes tratados, sin documentar diferencias significativas respecto a la edad de los pacientes, el diseño del estudio o el tipo de IBP evaluado. Sin embargo, sí se observó una tendencia hacia una mayor eficacia cuando se repartió la dosis total en dos tomas al día, y entre los pacientes con un reflujo gastroesofágico patológico en la pH-metría62. Las dosis recomendadas de IBP en adultos comprenden omeprazol 20-40mg dos veces al día o equivalente; en niños, 1-2mg/kg de omeprazol o equivalente.
Al interrumpir el tratamiento farmacológico, los síntomas y la eosinofilia esofágica recurren típicamente tras un periodo de 3 a 6meses12. La estrategia terapéutica a largo plazo para los tratamientos farmacológicos, por tanto, consiste en emplear dosis mínimas eficaces para mantener la remisión. Una reciente serie prospectiva en niños evidenció que el 78% permanecían en remisión tras un año con la mitad de la dosis empleada para la inducción61. En adultos, el tratamiento con IBP a la mitad de las dosis iniciales mantiene la remisión clínica e histológica en al menos el 75% de los pacientes tras al menos un año de seguimiento63,64. Entre los pacientes recidivantes, la mayoría recupera la remisión después de la escalada de dosis. No existen datos publicados sobre problemas de seguridad de los IBP en pacientes con EoE.
Corticoides tópicosAunque todavía no existe ninguna formulación específica aprobada y comercializada para tratar la EoE, hasta la fecha se han realizado 13 ensayos aleatorizados en niños y adultos con corticoides tópicos, resumidos en varias revisiones sistemáticas y metaanálisis65-69. Estos estudios han confirmado la elevada eficacia de estos fármacos para inducir la remisión histológica en la EoE. Sin embargo, la interpretación comparativa de los resultados es compleja por las variaciones en los criterios de inclusión, fármacos utilizados (fluticasona o budesonida), dosis diarias, duración del tratamiento (de 2 a 12 semanas), modos de aplicación del fármaco (inhaladores con polvo seco, suspensiones de viscosidad variable o comprimidos efervescentes bucodispersables), y los criterios para definir remisión histológica (de <1 a <20 eosinófilos por CGA).
El sistema de liberación del fármaco a lo largo del esófago resulta esencial para alcanzar una adecuada y mantenida cobertura de la mucosa del órgano, evitando el depósito del corticoide en otros tejidos. Un ensayo clínico que comparó la eficacia de 1mg de budesonida administrado dos veces como solución viscosa frente a aerosol demostró una tasa de remisión histológica completa significativamente mayor en el primer grupo (64% vs. 27%). El tiempo de contacto del fármaco con la mucosa medido mediante escintigrafía fue significativamente más prolongado en los pacientes tratados con budesonida viscosa, y especialmente en el esófago distal69. Los métodos de administración del corticoide tópico, por tanto, determinan el tiempo de contacto del fármaco con la mucosa y la mayor tasa de remisión histológica. Una nueva fórmula de budesonida en investigación, administrada en comprimidos efervescentes orodispersables específicamente diseñados para la liberación del fármaco en el esófago, ha demostrado capacidad para inducir remisión histológica universal en toda la longitud del esófago tras solo 2semanas de tratamiento70.
A diferencia de la remisión histológica, los datos sobre la eficacia de los corticoides tópicos en la resolución de los síntomas son menos sólidos, sin que varios ensayos pudieran demostrar ventajas significativas frente a placebo. El uso de escalas no validadas para evaluar los síntomas, la inclusión de pacientes con enfermedad más grave o no considerar las adaptaciones en el comportamiento alimentario de los pacientes para minimizar la disfagia son posibles explicaciones que están siendo solventadas en estudios más recientes71.
Aunque los datos disponibles son más escasos, el tratamiento con corticosteroides tópicos también resulta efectivo para mantener la remisión de la enfermedad a largo plazo en los pacientes respondedores a ellos72-74.
Los corticoides tópicos deglutidos para el tratamiento de la EoE parecen mostrar un perfil de seguridad favorable, sin efectos adversos graves, y similar al documentado en los pacientes tratados con placebo, según los datos obtenidos de los ensayos clínicos realizados hasta la fecha. La candidiasis esofágica es el efecto adverso más frecuente (5-10%), siendo en la mayoría de los casos asintomática y encontrada incidentalmente durante la valoración endoscópica tras el tratamiento. Las fórmulas viscosas, bucodispersables o en aerosol no han mostrado diferencias en la frecuencia de candidiasis asociada. Pequeñas series recientes de pacientes pediátricos tratados de manera prolongada con corticoides tópicos han generado cierta incertidumbre respecto a la potencial supresión del eje hipofiso-suprarrenal75, que no ha sido confirmado en otras series76 y ensayos clínicos frente a placebo70,71. En todo caso, la reducción de los niveles de cortisol plasmático ha sido el único efecto documentado, sin signos clínicos de insuficiencia suprarrenal o impacto sobre el crecimiento74. Hasta que se disponga de datos sólidos de ensayos clínicos a largo plazo, podría aconsejarse la monitorización de cortisol sérico en los niños con EoE que están recibiendo dosis altas de corticoides tópicos deglutidos por largos períodos, o en caso de uso concomitante de corticoides inhalados/nasales para otras alergias asociadas10.
Tratamiento dietéticoEl atractivo del tratamiento dietético para la EoE procede de la ausencia de efectos adversos si se garantiza la nutrición adecuada, de su alta eficacia potencial comparable o superior a la de algunas opciones farmacológicas, con un menor coste para los sistemas sanitarios. En las dos décadas de historia de la EoE se han evaluado varias intervenciones dietéticas, que comprenden la alimentación exclusiva mediante una fórmula elemental, la eliminación dirigida de alimentos en función de los resultados de las pruebas de alergia, y la eliminación empírica de los alimentos más probablemente causantes de EoE.
La dieta elemental, desprovista de capacidad antigénica, como alimentación exclusiva para niños con EoE proporcionó la primera prueba sobre la eficacia de una intervención dietética para inducir la remisión de la EoE77, y es la intervención dietética con la mayor eficacia78, capaz de inducir remisión histológica en el 90,8% (IC95%: 84,7-95,5%) de los pacientes con EoE de todas las edades. Sin embargo, varias desventajas limitan su uso en la práctica clínica, incluyendo su mal sabor —que requiere el uso frecuente de sonda nasogástrica—, la escasa de adherencia, sus efectos psicológicos y sociales al evitar todo consumo de alimentos convencionales, y su alto coste. Solo debería considerarse el uso de la dieta elemental exclusiva tras el fracaso de un tratamiento farmacológico y con otras dietas de eliminación, especialmente en niños de corta edad y durante un tiempo limitado10.
La eliminación de alimentos basada en los resultados de las pruebas de alergia alimentaria de prick cutáneos o con parches epicutáneos fue evaluada por vez primera en 2002. Tras excluir una media de cinco alimentos, se logró la remisión histológica en el 49% de los pacientes pediátricos tratados79, documentada mediante endoscopia. La atribución de la causa alimentaria específica para la EoE entre los pacientes respondedores causantes en cada caso se basó exclusivamente en la recurrencia de los síntomas tras la reintroducción de alimentos, reportada por los padres, sin realización de biopsias esofágicas. Una década más tarde, el mismo grupo de investigación actualizó sus resultados a una eficiencia global del 53%80. Sin embargo, diversos estudios han mostrado peores resultados con esta estrategia. Un metaanálisis reveló que la eficacia global de la dieta de eliminación dirigida por pruebas cutáneas para logar remisión histológica era del 45,5% (IC95%: 35,4-55,7%), con una gran heterogeneidad (I2: 75%) indicativa de una baja reproducibilidad78. Las tasas de eficacia fueron significativamente menores en adultos que en niños (32,2% vs. 47,9%). La eliminación de alimentos guiada por microarrays de IgE a partir de muestras de sangre logró la remisión de la EoE en solo el 7% de los pacientes adultos, llevando a la interrupción precoz de un estudio81. La capacidad predictiva de una combinación de los resultados de las pruebas de alergia en piel y de análisis de sangre con mediciones de reacciones inmediatas o tardías para identificar los alimentos responsables de la EoE (definidos mediante reintroducción secuencial en respondedores a dieta empírica de 6 alimentos) fue totalmente insatisfactoria82. Por estas razones, la Academia Europea de Alergia e Inmunología Clínica (EAACI) ha recomendado no realizar estas pruebas para tratar de identificar los alimentos responsables de la EoE26 porque su precisión diagnóstica es insuficiente para diseñar dietas eficaces.
Debido a la inviabilidad de la dieta elemental en la práctica clínica y a la baja sensibilidad y especificidad de las pruebas cutáneas de alergia para identificar los alimentos causantes de EoE, en 2006 se probó la eficacia de una dieta de eliminación empírica de seis alimentos (consistente en suprimir de la dieta los seis alimentos más comúnmente asociados con alergia en la población pediátrica de Chicago: proteína de leche de vaca, trigo, huevo, soja, frutos secos, y pescado y mariscos)83, logrando la remisión histológica de la enfermedad en el 74% de los niños tratados. Resultados similares han sido obtenidos en pacientes de todas las edades, y resumidos en un metaanálisis de siete estudios observacionales que proporcionó una eficacia homogénea (I2=0%) del 72% (IC95%: 66-78%) en niños y adultos78. La reintroducción secuencial de cada uno de los alimentos excluidos bajo control endoscópico e histológico permite identificar con certeza a los alimentos responsables de la EoE en cada paciente84. Sin embargo, el alto grado de restricción dietética y el gran número de endoscopias necesarias para completar este proceso, unido al hecho de que la mayoría de los pacientes que responden tendrán únicamente uno o dos alimentos causantes de su EoE, ha llevado a esquemas más sencillos, como la dieta de eliminación de cuatro alimentos (leche, trigo, huevo y leguminosas/soja), con una eficacia global para lograr la remisión de la EoE del 54% en adultos85 y del 64% en niños86. Más recientemente, un estudio multicéntrico prospectivo ha evaluado sobre 120 pacientes de todas las edades la eficacia de una dieta de eliminación de dos alimentos (leche y cereales con gluten), seguida por una de cuatro alimentos en los casos sin resolución histológica, y reservando la dieta de seis alimentos como última opción de rescate, logrando tasas de remisión clínica e histológica del 43, del 60 y del 79%, respectivamente, reduciendo además en un 20% el número de endoscopias y el tiempo de proceso diagnóstico, respecto a comenzar con una dieta de seis alimentos87.
Una vez identificados los alimentos responsable de la EoE en cada paciente particular (el 90% de los respondedores a una dieta empírica de eliminación de dos o cuatro alimentos tendrán únicamente uno o dos alimentos causantes), la evitación a largo plazo mantiene la remisión de la enfermedad. Dos estudios realizados en adultos mostraron que todos los adultos que evitaron el(los) alimento(s) responsable(s) mostraron remisión clínica e histológica de su EoE hasta 3años después88,89, sin necesidad de fármacos. En niños, se ha informado del mantenimiento de la remisión tras un seguimiento de hasta 4años90.
Dilatación endoscópica en la esofagitis eosinofílicaLa dilatación con balones, bujías o dilatadores rígidos es el único tratamiento endoscópico disponible para la EoE. Su eficacia ha sido plasmada en un metaanálisis de 27 estudios observacionales sobre un total de 845 pacientes y 1.820 dilataciones esofágicas. Se documentó una mejoría sintomática en el 95% de los pacientes (IC95%: 90-98%), con una duración del efecto de alivio sintomático muy variable. Las complicaciones fueron infrecuentes, incluyendo perforación (0,38% de los casos), hemorragia (0,05%) y hospitalización (0,67%), sin mortalidad alguna91. La dilatación esofágica no controla la inflamación crónica que contribuye al remodelado esofágico, por lo que no debería emplearse de manera aislada sin un tratamiento antiinflamatorio (IBP, corticoides tópicos o dieta) eficaz concomitante.
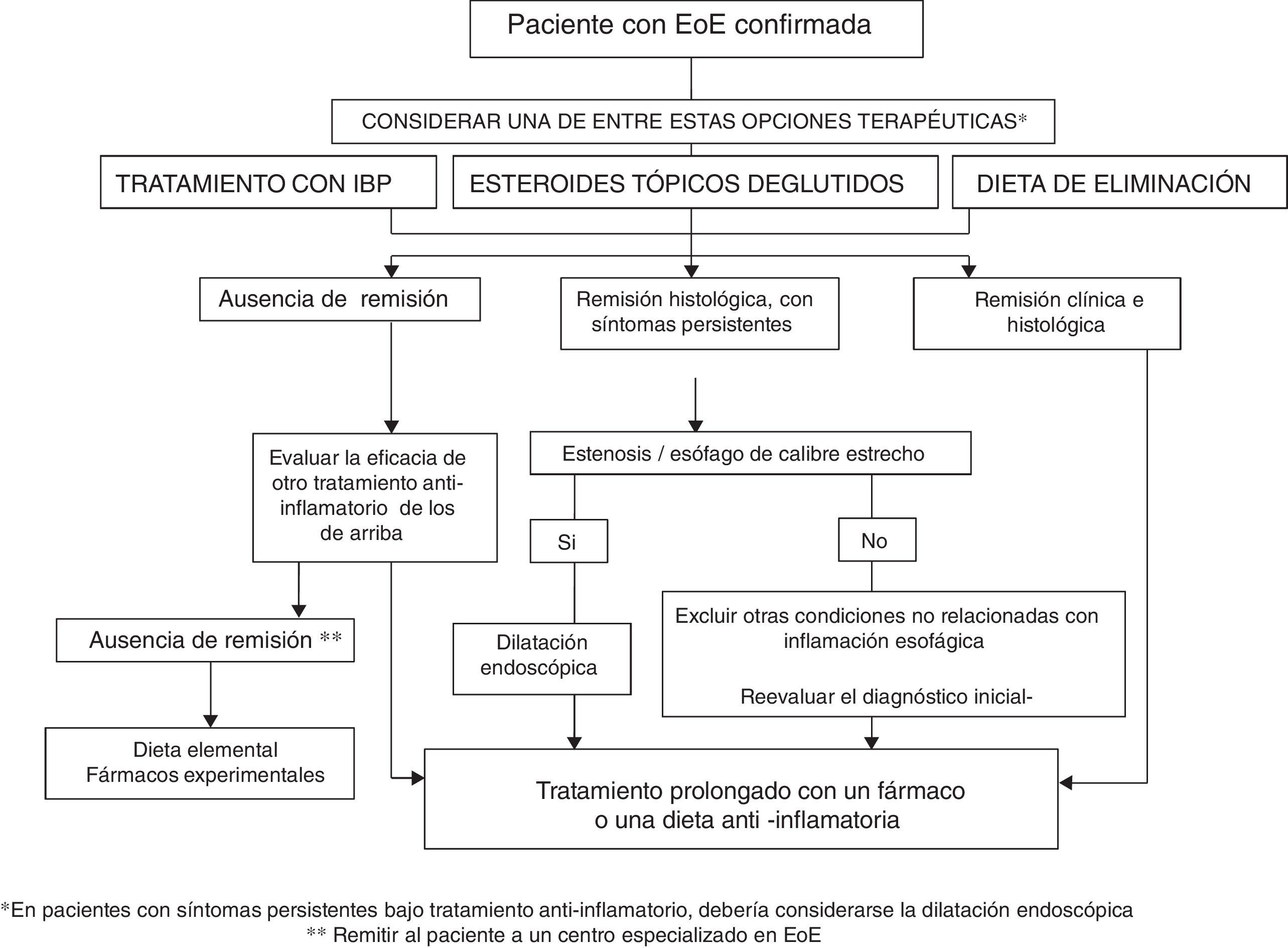
¿Cómo elegir el tratamiento para un paciente con esofagitis eosinofílica?La EoE es una enfermedad crónica en la que la inflamación esofágica progresa con el tiempo hacia la remodelación fibrótica, conduciendo a esófagos de calibre estrecho y estenosis esofágicas. La actividad inflamatoria y la remodelación fibrosa pueden remitir con el tratamiento antiinflamatorio con IBP, esteroides tópicos o dietas, mientras que las estenosis pueden resolverse mediante dilatación endoscópica. Haciendo una analogía terapéutica con la enfermedad inflamatoria intestinal92, en todos los pacientes con EoE se debería contemplar un tratamiento dirigido a resolver la inflamación esofágica (cicatrización mucosa) más una dilatación endoscoópica en caso de presentar hallazgos fibroestenóticos. La figura 1 muestra el algoritmo propuesto para el tratamiento de la EoE.
Como opción de primera línea con capacidad antiinflamatoria podría considerarse tanto la dieta como los esteroides tópicos o los IBP. La elección de la terapia debe ser discutida individualmente con el paciente, pero por su bajo coste, seguridad, comodidad y moderada eficacia, los IBP podrían constituir una opción inicial razonable. Tras un periodo de 6 a 12semanas la eficacia del tratamiento inicial debería evaluarse mediante endoscopia. En caso de falta de respuesta al tratamiento con IBP, la elección entre corticoides tópicos deglutidos o dieta debe de nuevo discutirse individualmente con el paciente y su familia, y puede depender de la edad (los adolescentes y adultos jóvenes suelen mostrar pobre adherencia a la dieta), de la gravedad de la enfermedad (los síntomas graves deben ser tratados preferentemente con corticoides tópicos), del estilo de vida del paciente, de sus preferencias y de su capacidad para entender el etiquetado de los alimentos. La opción terapéutica podría cambiar con el tiempo debido a los efectos adversos, la falta de voluntad del paciente para continuar, el impacto negativo en la calidad de vida o los recursos de la familia. Dos series recientes han informado que los pacientes con EoE que responden a la dieta o a esteroides tópicos también pueden conseguir la remisión con IBP, y viceversa93,94.
Se debería ofrecer una dilatación endoscópica a todos los pacientes con anomalías fibroestenóticas (incluyendo un esófago con calibre menor de <13mm) que condicionen disfagia o impactaciones alimentarias, pese a utilizar tratamiento dietético o farmacológico. La dilatación endoscópica no debe ser la única intervención, pues carece de efecto sobre la inflamación esofágica. En caso de una estenosis esofágica severa y sintomática, la dilatación conjuntamente con corticoides tópicos podría lograr rápidamente la remisión clínica, endoscópica e histológica de la EoE.
Otros tratamientos para la esofagitis eosinofílicaLa eficacia de azatioprina o 6-mercaptopurina en la EoE ha sido evaluada solo en una pequeña serie de casos, mostrando que estos fármacos inducían y mantenían la remisión libre de esteroides de la enfermedad por un periodo de hasta 5años, con recidiva tras la suspensión del tratamiento95.
Cromoglicato sódico y los antihistamínicos no tienen efecto alguno sobre los síntomas o la eosinofilia esofágica39; por su parte, el antagonista de los leucotrienos montelukast no ha mostrado capacidad ninguna para inducir ni para mantener la remisión inducida por corticosteroides tópicos96,97. Un antagonista selectivo de CRTH2 evaluado en un ensayo aleatorizado frente a placebo mejoró modesta aunque significativamente los síntomas y la inflamación esofágica, sin alcanzar su normalización98.
Varios agentes biológicos, derivados de estudios para el asma grave, han sido también evaluados en la EoE. La eficacia de los anticuerpos monoclonales anti-interleucina (IL)-5 mepolizumab y reslizumab se ha evaluado en niños, adolescentes y adultos con EoE en tres ensayos aleatorizados doble ciego99-101. En comparación con placebo, no mostraron mejoría sintomática en dos de los tres estudios, si bien en todos los casos se documentó una reducción significativa de la infiltración eosinofílica, sin alcanzar remisión histológica. Un anticuerpo anti-IL-13 (QAX576) recientemente evaluado en un ensayo clínico frente a placebo mostró reducción del recuento medio de eosinófilos del 60% y de la expresión de genes implicados en la fisiopatología de la EoE en las biopsias del esófago, sin mejoría en cuanto a los síntomas102. Otros fármacos anti-IL-13 están actualmente bajo evaluación. Omalizumab, un anticuerpo anti-IgE, tampoco pudo demostrar efectos relevantes sobre los síntomas esofágicos o la eosinofilia esofágica, comparado con placebo, en otro ensayo clínico27. Finalmente, dos dosis de infliximab, un agente anti-factor de necrosis tumoral-alfa, no condujeron a mejoría clínica ni histológica en una serie de 3 adultos con EoE103.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en cuanto al contenido de este artículo.