La enfermedad celíaca (EC) presenta un amplio espectro clínico, y existen formas asintomáticas u oligosintomáticas difíciles de identificar. Dado que los pacientes celíacos no tratados pueden presentar complicaciones graves, es importante diagnosticar estas formas precozmente. Por esto, se ha establecido que en grupos de riesgo, como la diabetes mellitus de tipo 1 (DM1), se realice un cribado de EC mediante la determinación en suero de anticuerpos antigliadina, antitransglutaminasa tisular (ATG) y antiendomisio (EMA) de clase IgA.
En el presente estudio determinamos los citados anticuerpos a 463 pacientes con DM1 y, a los que presentaban positividad para alguno de ellos, se les propuso la realización de una endoscopia con toma de biopsias de duodeno distal, y se clasificaron las lesiones histológicas, cuando existieron, según la clasificación de Marsh.
Sesenta y dos de los 463 (13,4%) pacientes presentaron al menos uno de los 3 anticuerpos positivo y, de ellos, 42 accedieron a la realización de la endoscopia. En 14 pacientes (3% de los diabéticos) se encontraron alteraciones histológicas compatibles con EC. La mayoría de estos 14 pacientes no refería síntomas relacionados con la enfermedad, aunque varios presentaban alteraciones analíticas presentes frecuentemente en la EC. La existencia de datos clinicoanalíticos compatibles con EC fue independiente del grado de lesión histológica. Al analizar la sensibilidad y el valor predictivo positivo para cada anticuerpo, los ATG y EMA fueron los más sensibles, si bien la facilidad técnica de detección de los ATG mediante técnicas de ELISA hace, en nuestra opinión, que sea el de elección para la realización del cribado.
Celiac disease (CD) presents a wide clinical spectrum. There are asymptomatic or oligosymptomatic forms, which are difficult to diagnose. Since patients with untreated CD can develop severe complications, early diagnosis of these forms is important. Consequently, in groups at risk for CD, such as patients with type 1 diabetes (DM1), screening through determination of antigliadin (AGA), anti-tissue transglutaminase (ATG) and antiendomysial antibodies (EMA) is recommended. In the present study, 463 DM1 patients were screened for these antibodies. Patients who were positive for one or more were offered an upper endoscopy to obtain distal duodenum biopsies. Histological lesions, when present, were classified using Marsh's classification. Of the 463 patients, 62 (13.4%) were positive for at least one of the three antibodies, and 42 accepted to undergo an endoscopy. Fourteen patients (3% of the DM1 patients) were histologically diagnosed with CD. Most of these patients had no symptoms of CD, although some showed laboratory findings frequent in CD. The presence of clinical or analytical data compatible with CD was independent of the grade of histological lesions. Finally, we calculated the sensitivity and positive predictive value for each antibody. The most sensitive were ATG and EMA. Because of the technical simplicity of determining ATG with ELISA, in our opinion, this test should be the option of choice for screening.
La enfermedad celíaca (EC) es una enfermedad de base autoinmunitaria que se da en pacientes genéticamente predispuestos y cuyo factor ambiental desencadenante es el gluten1–4. Se estima que su prevalencia en la población general caucásica es de aproximadamente el 1%1,3,5–7. Es conocido, además, que existen grupos de riesgo en los que la prevalencia de esta enfermedad es mayor, como por ejemplo, en los familiares de primer grado de los pacientes celíacos o en personas con otras enfermedades, sobre todo autoinmunitarias, entre ellas la diabetes mellitus de tipo 1 (DM1)1,2,5,8–14.
En los últimos años, conforme se ha ido conociendo más acerca de la EC, se ha ido ampliando el espectro histológico y clínico de esta enfermedad.
A nivel histológico, según la clasificación de Marsh, existen 4 grados de lesión15: tipo 1: infiltrativo (aumento del número de linfocitos intraepiteliales); tipo 2: hiperplásico (hiperplasia de las criptas); tipo 3: atrófico (atrofia de las vellosidades, subdividida en: parcial, subtotal y total), y tipo 4: atroficohipoplásico (atrofia completa de la mucosa y la submucosa).
A nivel clínico, además de la forma clásica de malabsorción, se han descrito formas asintomáticas y formas oligosintomáticas difíciles de diagnosticar1,4,5,16. La EC puede, además, presentar complicaciones, algunas de ellas graves e irreversibles, que se pueden evitar con un tratamiento adecuado, por lo que es importante el diagnóstico precoz de estas formas poco sintomáticas. Entre estas complicaciones destaca el linfoma T asociado a enteropatía, así como otro tipo de tumores, la osteoporosis, las alteraciones neurológicas, etc17–23. En el grupo de los pacientes diabéticos con EC, además de estas complicaciones, se ha descrito un aumento del número de hipoglucemias en relación con una absorción errática de los nutrientes13,17.
Por tanto, la EC cumple los requisitos necesarios de los programas de cribado mundial5: es una enfermedad común, que causa morbilidad en la población afectada, de difícil detección precoz desde el punto de vista clínico y que, si no se diagnostica, puede desarrollar complicaciones difíciles de tratar. Además, tiene un tratamiento efectivo y para su detección existen pruebas de cribado sencillas y sensibles.
Por todo lo expuesto, se recomienda que al menos en grupos de riesgo para EC, como por ejemplo, en el grupo de pacientes con DM1, se haga sistemáticamente cribado de esta enfermedad mediante la determinación de anticuerpos (antigliadina [AGA], antiendomisio [EMA] y antitransglutaminasa tisular [ATG]), para así poder obtener beneficio de una dieta sin gluten, que permitirá la mejoría de la sintomatología, un mejor control de la diabetes y evitará complicaciones futuras5,6,8–14,17,24.
Objetivos del estudioLos objetivos del presente trabajo han sido estudiar la prevalencia y las características de la EC en pacientes adultos con DM1 en la población de Navarra, ya que existen pocos datos sobre esta asociación en nuestro medio, y analizar la sensibilidad y el valor predictivo positivo (VPP) de cada uno de los anticuerpos utilizados en su cribado a fin de rentabilizar al máximo su utilización.
Material y métodosEstudiamos la posible existencia de EC en una muestra constituida por 464 pacientes adultos diagnosticados de DM1. Se excluyó a un paciente del análisis por diagnosticarse de EC antes del diagnóstico de DM1. A los restantes 463 pacientes se les determinaron los marcadores serológicos de EC según las siguientes técnicas:
- •
Los AGA IgA y ATG IgA se determinaron mediante kits comerciales de ELISA (ORGENTEC Diagnostika GMBH). En el caso de la ATG IgA, se utilizó como sustrato antígeno recombinante humano. Se consideraron títulos positivos unas cifras superiores a 10U/ml en ambos casos.
- •
Los EMA IgA se determinaron mediante inmunofluorescencia indirecta, y se utilizó como sustrato esófago de mono. Se consideró positiva la detección de cualquier titulación.
Los pacientes que presentaban positividad para cualquiera de los 3 anticuerpos se enviaron a la consulta de digestivo, donde se valoró la existencia de síntomas o signos indicativos de EC, como diarrea, intolerancia alimentaria, ferropenia o anemia y alteraciones de las pruebas hepáticas. A todos ellos se les propuso la realización de una endoscopia alta, previa firma del consentimiento informado. Durante el procedimiento se tomaron 4 muestras de duodeno distal que posteriormente se remitieron al servicio de anatomía patológica para estudio microscópico. El diagnóstico de EC se basó en los hallazgos histológicos característicos, y el grado de lesión histológica se clasificó según la clasificación de Marsh15.
Para el análisis de los datos se utilizó el programa informático SPSS versión 15.0.
ResultadosEl 58% de los pacientes estudiados eran varones y el 42% eran mujeres, la mediana de edad del conjunto fue de 37 años (rango: 18–80).
1. Prevalencia y distribución de los pacientes con anticuerpos de enfermedad celíaca positivos: De los 463 pacientes, 62 (13,4%) presentaron positividad para al menos uno de los 3 anticuerpos determinados. De ellos, 20 rechazaron la endoscopia, mientras que a los 42 restantes (67,7%) se les realizó una endoscopia alta con toma de 4 muestras en el duodeno distal. En total, 14 pacientes presentaron datos histológicos compatibles con EC, lo que representa el 3% de los diabéticos incluidos en el estudio (14 de 463), el 22,6% de los diabéticos con anticuerpos positivos (14 de 62) y el 33,33% de los diabéticos que aceptaron hacerse endoscopia (14 de 42).
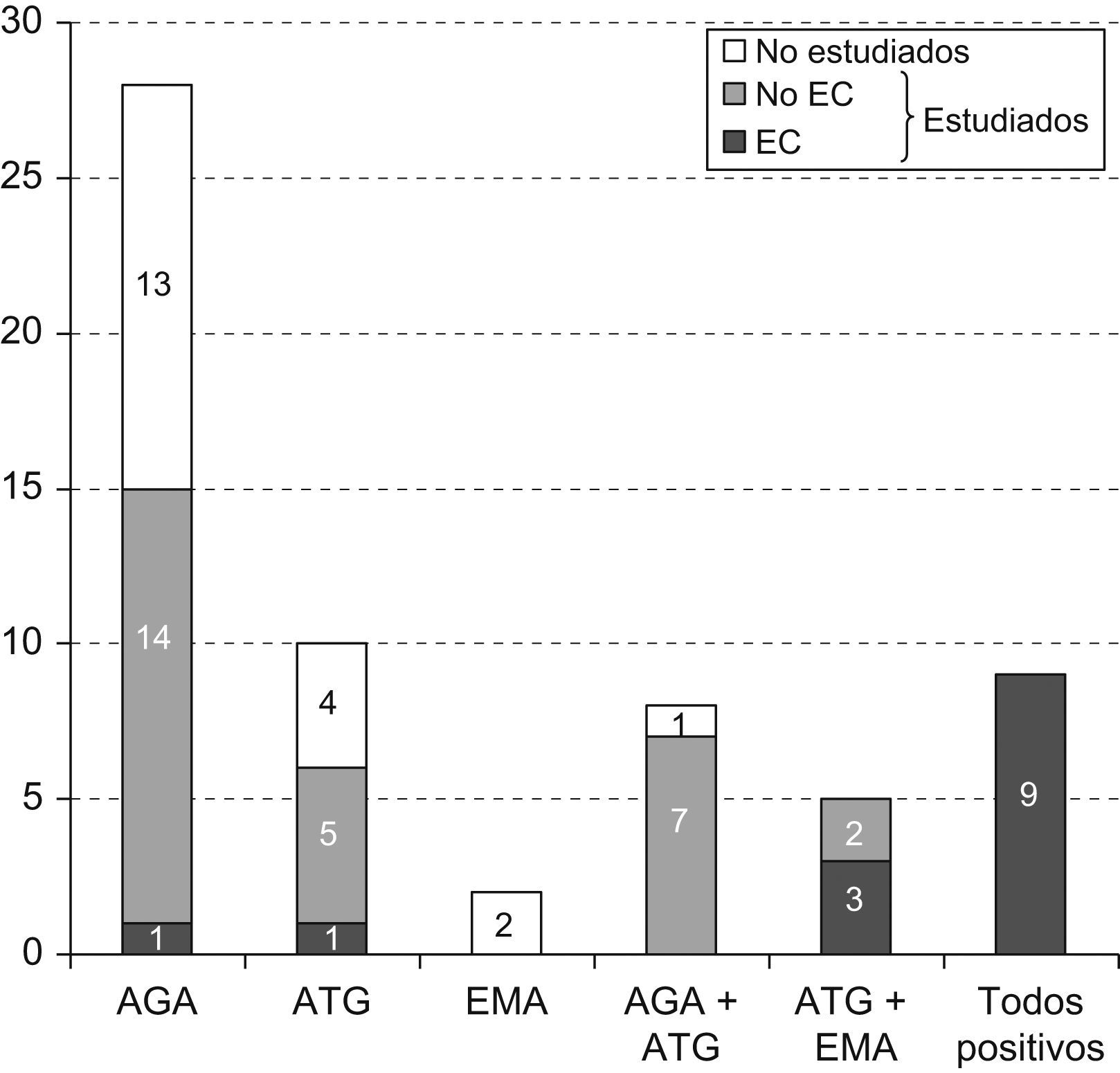
La positividad para cada uno de los anticuerpos se distribuyó como se muestra en la figura 1, donde se especifica además el número de pacientes biopsiados y el número de pacientes diagnosticados de EC en cada grupo.
Histológicamente, el único paciente con positividad sólo para AGA y un paciente con sólo ATG positivo presentaban estadio Marsh 2. Tres pacientes con ATG y EMA positivos presentaban estadio Marsh 3. En los 9 pacientes restantes diagnosticados de EC, todos los anticuerpos fueron positivos, uno de ellos presentaba estadio Marsh 2 y 8 presentaban estadio Marsh 3.
2. Correlación con los hallazgos en la endoscopia: Sólo 4 de los 14 pacientes (28,6%) con hallazgos histológicos de EC tenían hallazgos endoscópicos indicativos de la enfermedad, y todos ellos mostraron aplanamiento de los pliegues, que microscópicamente correspondió en los 4 casos con un estadio histológico Marsh 3 (3a, 3b y 2 casos 3c). El resto de los casos presentaba una mucosa duodenal macroscópicamente normal.
3. Perfil clínico de los pacientes diabéticos con enfermedad celíaca: El 67% de los pacientes diagnosticados de EC eran mujeres y el 33% eran varones. La mediana de edad fue de 33 años (rango: 19–73).
Nueve de los 14 pacientes (64,3%) diagnosticados de EC presentaban algún síntoma o signo relacionado con la enfermedad (fig. 2).
4. Sensibilidad y valor predictivo positivo de los anticuerpos: Finalmente, estudiamos la sensibilidad y el VPP de cada anticuerpo para el diagnóstico de EC. Dado que no se ha hecho endoscopia con toma de biopsias a los pacientes con anticuerpos negativos, no podemos asegurar a ciencia cierta que estos pacientes no sean celíacos (verdaderos negativos) y, por tanto, la especificidad y el valor predictivo negativo no son calculables.
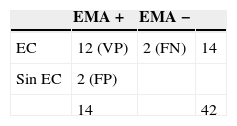
En total, independientemente de la positividad para otros anticuerpos, 31 de los 42 pacientes estudiados tenían AGA positivos y 10 de ellos se diagnosticaron de EC (tabla 1), lo que supone para los AGA una sensibilidad del 71,4% (IC del 95%: 41,9–91,6) y un VPP del 32,2% (IC del 95%: 16,7–51,4). Veintisiete pacientes presentaban ATG positivos y 13 de ellos se diagnosticaron de EC (tabla 2), lo que supone para los ATG una sensibilidad del 92,9% (IC del 95%: 66,1–99,8) y un VPP del 48,1% (IC del 95%: 28,7–68,1). Finalmente, 14 pacientes presentaban EMA positivos y 12 de ellos se diagnosticaron de EC (tabla 3), lo que supone para los EMA una sensibilidad del 85,7% (IC del 95%: 57,2–98,2) y un VPP del 85,7% (IC del 95%: 57,2–98,2).
La prevalencia de EC hallada en nuestra muestra de pacientes con DM1 mediante cribado con los 3 anticuerpos (AGA, ATG y EMA) es del 3% (14 pacientes de 463), aunque ya que no obtuvimos histología de todos los pacientes con anticuerpos positivos, probablemente la prevalencia sea mayor. Además, si incluimos al paciente diagnosticado de EC antes del diagnóstico de DM1, la prevalencia de EC en nuestra población de DM1 es de al menos el 3,2% (15/464). Esta prevalencia es claramente superior a la descrita en la población general (1%)1,3,5–7 y se encuentra dentro del rango descrito por otros estudios realizados en pacientes con DM1 (1–8%)8–13,17.
Por otra parte, dado que nuestros resultados se basan en un estudio transversal, con una única determinación de anticuerpos a cada paciente y que distintos estudios han demostrado que pacientes diabéticos que inicialmente presentan anticuerpos de EC negativos pueden positivizarlos posteriormente y desarrollar la enfermedad, existe la posibilidad de que en un futuro la prevalencia de EC en la misma muestra de diabéticos sea mayor que la obtenida en el estudio actual. Por esto, se recomienda la determinación seriada de estos anticuerpos en el tiempo, si bien no se conoce cuál sería la periodicidad idónea para realizarlo8,11,13.
Únicamente en 4 de los 14 pacientes celíacos se encontraron en la endoscopia hallazgos macroscópicos compatibles con EC, y la mucosa fue de aspecto normal en los otros 10 pacientes. En los 4 pacientes en los que hubo concordancia entre los hallazgos de la endoscopia y los hallazgos de la biopsia, el estadio de la lesión histológica era avanzado (Marsh 3). Sin embargo, en otros 7 pacientes con estadio Marsh 3 no se encontraron alteraciones macroscópicas, lo que parece indicar que la valoración endoscópica de la mucosa intestinal tiene un papel limitado en la sospecha de EC y demuestra que, ante la sospecha clínica, independientemente de los hallazgos endoscópicos, es fundamental la toma de biopsias y el estudio histológico posterior.
En nuestra muestra, sólo 2 de los 14 pacientes se encontraban sintomáticos (diarrea) en el momento del diagnóstico de EC y 5 no presentaban ninguna alteración clínica ni analítica. En el estudio no se valoró el cumplimiento de la dieta sin gluten indicada a los pacientes. Sin embargo, en un estudio en el que se compara el seguimiento de una dieta sin gluten entre un grupo de adolescentes diagnosticados de EC por cribado y otro grupo diagnosticado por presentar síntomas, se observa una clara diferencia en el seguimiento de una dieta sin gluten, a favor de los que presentaban síntomas en el momento del diagnóstico25. Por esto, en un estudio futuro sería interesante analizar el cumplimiento de una dieta sin gluten en estos pacientes, con el fin de conocer el impacto real de un programa de cribado de este tipo.
Clásicamente, se ha considerado EC únicamente cuando existe atrofia vellositaria en la biopsia, es decir, a partir del estadio Marsh 3. Los estadios previos, en los que existen lesiones incipientes en la mucosa, se han considerado como una enfermedad latente o potencial, que cursa sin síntomas, pero que posteriormente puede desarrollar mayor lesión histológica y una EC establecida. Sin embargo, en los últimos años este aspecto es motivo de discusión. Así, en diversos estudios se observa que pacientes con EC en estadios uno y 2 de Marsh pueden llegar a presentar los mismos síntomas y en igual proporción que los pacientes con lesión histológica en estadios más avanzados, y que estos síntomas responden igualmente a una dieta sin gluten26–29. En nuestro estudio los 3 pacientes con lesión histológica leve (2 en estadio Marsh 1 y uno en estadio Marsh 2) presentaban algún síntoma o signo (un paciente diarrea, otro anemia ferropénica y otro ferropenia sin anemia), mientras que 5 pacientes en estadio Marsh 3 no presentaron ninguna alteración. Por tanto, si hasta ahora se consideraba que únicamente se benefician del tratamiento los pacientes que presentan EC con atrofia vellositaria en la biopsia, parece razonable cambiar este planteamiento, y en aquellos pacientes que presentan lesiones histológicas en estadios iniciales, hacer un equilibrio personalizado de riesgos y beneficios a la hora de proponer el seguimiento de una dieta sin gluten.
A la hora de simplificar y mejorar la eficiencia de los programas de cribado de EC, es interesante poder basarse en la determinación de un único anticuerpo, en vez de los 3 utilizados clásicamente. En los estudios de cribado, interesa no dejar pacientes afectados sin diagnosticar, por lo que se debe elegir aquel anticuerpo que aporte una mayor sensibilidad, para en un segundo tiempo, mediante la obtención de histología, descartar los falsos positivos o confirmar el diagnóstico.
En nuestro estudio, los AGA han mostrado tener una sensibilidad moderada (71%), por lo que parece poco adecuado basar el cribado de la enfermedad en su determinación.
Según lo descrito en la literatura médica, los ATG y EMA presentan una sensibilidad superponible (el 93 y el 86%, respectivamente, en nuestro estudio), y existe una cierta variabilidad entre los distintos laboratorios de acuerdo con el sustrato que se utilice para su análisis1–3,30–33. La determinación de EMA requiere utilizar como sustrato esófago de mono o cordón umbilical humano, y además, se analiza mediante inmunofluorescencia indirecta, técnica en la que el entrenamiento, la experiencia del operador, la fuente de luz, el nivel de luz del ambiente y la dilución inicial31 pueden influir. La determinación de ATG, sin embargo, se hace mediante ELISA al utilizar transglutaminasa de cobaya o transglutaminasa recombinante humana, y debido a la facilidad de su determinación, su menor coste, el potencial de automatización, la objetividad de interpretación y los requisitos de aprendizaje reducidos, se considera en este momento la determinación de elección para el cribado de EC3,5,30,32,33.
Aun así, en nuestro estudio destaca la existencia de un considerable número de pacientes (14/27) con ATG positivo y sin datos indicativos de EC en la biopsia, hallazgo que no concuerda con lo descrito previamente en la literatura médica, donde el VPP del test no es inferior al 80%, incluso en poblaciones de bajo riesgo34. Al comparar la mediana de los niveles de ATG en los pacientes diabéticos no celíacos (mediana: 15U/ml; rango: 11–71) con los de los celíacos (mediana: 141U/ml; rango: 19–203), encontramos diferencias estadísticamente significativas entre estos valores (p<0,001). Sin embargo, al modificar el punto de corte a un valor mayor para aumentar el VPP y la especificidad, perdemos sensibilidad, ya que en nuestro caso tenemos un paciente celíaco con una cifra de ATG de 19U/ml y, como ya se ha explicado previamente, lo que más interesa de un test de cribado es una alta sensibilidad.
ConclusionesLos pacientes con DM1 constituyen un grupo de riesgo para el desarrollo de EC, y su prevalencia es 3 veces mayor que en la población general.
Los hallazgos endoscópicos no son útiles para el diagnóstico de EC en pacientes con DM1 y anticuerpos positivos, y es imprescindible la toma de biopsias para estudio histológico ante la sospecha clinicoanalítica de EC.
La mayoría de los pacientes con DM1 diagnosticados de EC mediante el método de cribado con anticuerpos no presenta clínica, aunque varios de ellos presentan alteraciones analíticas frecuentes en la EC. Además, la presencia o no de síntomas en el momento del diagnóstico es independiente del grado de lesión histológica.
La sensibilidad de los anticuerpos ATG y EMA, a la hora de detectar una EC en pacientes con DM1, es similar, y la determinación de ATG, en la que se utiliza un antígeno recombinante como sustrato, es más fácil, de interpretación más objetiva y automatizable y de menor coste. Por tanto, consideramos que este anticuerpo es el único que se debe solicitar en el cribado de EC en este grupo de pacientes.