INTRODUCCIÓN
El conocimiento de la eficacia metabólica del hígado en pacientes con procesos neoplásicos sometidos a tratamientos con fármacos altamente tóxicos, así como en pacientes con enfermedades no oncológicas pero tratados con citostáticos, es de gran importancia práctica.
El uso de la vinorelbina, un alcaloide semisintético de la vinca (Vinca rosae), se ha extendido rápidamente para el tratamiento del linfoma maligno, cáncer de mama y cáncer de pulmón no microcítico1-3. Este fármaco muestra neurotoxicidad reducida en comparación con otros alcaloides de la vinca y la toxicidad que limita su dosis parece ser la neutropenia4,5. Como los otros alcaloides de la vinca, se elimina a través del metabolismo hepático y por excreción biliar6,7. Parece que la isoenzima del sistema hepático P-450 más activa en el ser humano es la CYP3A48,9. En las instrucciones de administración contenidas en la ficha técnica del fármaco y en diversas publicaciones10,11 se recomienda la reducción de la dosis en los pacientes con disfunción hepática.
De todos los fármacos empleados en la valoración de la capacidad metabólica oxidativa hepática, el más utilizado es la antipirina, y es la prueba de referencia12-16 en la búsqueda de relaciones tanto entre sus parámetros farmacocinéticos y los datos bioquímicos como con hallazgos histológicos en las biopsias, observaciones clínicas o supervivencias en distintas hepatologías: cirrosis17-19, hígado graso20, disfunción hepática inducida por la administración de fármacos14,21-23, anestesiología24, pediatría25,26, entre otros.
La antipirina o fenazona es un derivado pirazolónico utilizado desde hace unos 100 años como antipirético, antiinflamatorio y analgésico. En Occidente no se utiliza desde hace años, puesto que con otros compuestos del grupo (aminopirina, dipirona) produce agranulocitosis, pero aún se emplea en el tercer mundo. En los países occidentales se utiliza como test de función hepática. Se ha establecido que en el ser humano es metabolizada por al menos 6 isoenzimas del sistema P-450: CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19 y CYP3A427, y en ratas Wistar por CYP1A2, CYP2C, CYP3A3 y CYP3A428. En esta especie la cinética de eliminación de la antipirina refleja ampliamente el grado de oxidación; por lo tanto la fenazona es básica como modelo en el estudio de los factores que influyen en la oxidación de fármacos in vivo.
Por todo lo expuesto anteriormente, el objetivo de nuestro estudio ha sido la evaluación del efecto de la vinorelbina sobre la farmacocinética de la antipirina en ratas, e intentar relacionar los datos indicativos de la capacidad de síntesis proteica, destrucción de los hepatocitos y de la función metabolizadora con los parámetros farmacocinéticos de la antipirina como marcador hepático.
MATERIAL Y MÉTODOS
Animales y tratamiento
Se ha dispuesto de un total de 36 ratas de la especie Rattus norvegicus, variedad albina, raza Wistar. Todos los animales, tanto controles como experimentales, tenían un peso inicial promedio (± desviación estándar) de 203,34 ± 31,46 g (intervalo de confianza del 95%, 172,51-234,17) y entre 8 y 10 semanas de edad. Se les suministró agua y comida ad libitum. Su acondicionamiento se realizó según las normas habituales para roedores (temperatura de 22 a 24 °C y fotoperíodo de 12 h). Se distribuyeron las ratas en 4 series, según el tiempo (en semanas) de tratamiento ya sea con ClNa o con vincrelbina: a las ratas de la serie control de una semana se les administraron 100 µl de ClNa al 0,9% por vía intravenosa, en la semana siguiente se les realizó el estudio farmacocinético con la administración intravenosa de antipirina (10 mg/kg) y se recogieron muestras de sangre a las 0,5, 1, 2, 3 y 5 h, y al finalizar este estudio se efectuaron las determinaciones bioquímicas; a las ratas control de 2 semanas se les administró una dosis de 100 µl de ClNa al 0,9% cada semana; las ratas tratadas con uno y 2 ciclos recibieron, en vez de ClNa, vinorelbina por vía intravenosa (30 mg/m2). El estudio farmacocinético se realizó siempre al finalizar el tratamiento, ya fuera de 1 o de 2 ciclos.
Técnicas analíticas
Para las determinaciones bioquímicas séricas se utilizó un autoanalizador de bioquímica sérica Technicon DAX 2000®. Para medir la actividad de protrombina se utilizó un equipo compuesto por un FP 401 Incubator® y un FP 910 Coagulation Analyzer Labsystems®.
La determinación de antipirina y fenacetina (utilizada como referencia interna) en suero se realizó mediante cromatografía líquida de alta resolución. La columna utilizada fue una LiCHrospher 100 RP-18 (5 µm) LiCHroCART 250-4, que utiliza como fase móvil una mezcla que contiene un 45% de metanol y un 55% (v/v) de un tampón fosfato de 67 mM a pH de 7. Esta fase se hace pasar por una bomba de cromatografía a un flujo constante de 0,8 ml/min hasta alcanzar presiones de 3.000 psi. La inyección de la muestra en el sistema es de un volumen de 50 µl y la lectura se realiza a una longitud de onda de 254 nm. El tiempo de retención es de 6,10 min para la antipirina y de 10 min para la fenacetina. Se emplea un método de extracción conocido29, con ligeras modificaciones. A 100 µl de suero se le añaden 50 µl de fenacetina (20 µg/ml), 100 µl de NaOH 1 N y 8 ml de diclorometano. Se agita y centrifuga. Se recoge la fase orgánica y se evapora bajo corriente de nitrógeno a sequedad. Se reconstituye con 200 µl de fase móvil inyectando 50 µl.
Cálculos farmacocinéticos
El cálculo de los parámetros farmacocinéticos de antipirina se realizó según un modelo monocompartimental con administración intravenosa. Se calcularon los siguientes parámetros:
1. Constante de eliminación (Kel): la pendiente de la recta que se obtiene por medio del ajuste por mínimos cuadrados de los puntos obtenidos al representar el logaritmo de la concentración frente al tiempo.
2. El área bajo la curva desde tiempo cero hasta infinito se estima por integración trapezoidal: (AUC)0-(infinity) = AUC0-t + Ct/Kel; donde Ct de la última concentración de antipirina.
3. Vida media de eliminación (t1/2) = 0,693/Kel18,30.
4. Volumen aparente de distribución (Vd) = Cl/Kel.
5. Aclaramiento plasmático (Cl) = D/AUC, donde D es la dosis administrada y el AUC se calcula mediante el método trapezoidal con extrapolación al infinito.
Análisis estadístico
Los valores de la muestra o de las características de la muestra se describen mediante la media (± desviación estándar) y se extrapolan a la población general mediante el intervalo de confianza del 95%. Se comprobó el supuesto de normalidad mediante el test de de Shapiro-Wilks. Se verificó la homogeneidad de variancias entre los resultados de cada distribución mediante el test de Levene. El cálculo de la significación estadística entre la media de los 2 grupos controles y los 2 tratados, tanto para un ciclo como para 2, se realizó mediante las pruebas de la t de Student-Fisher y U de Mann-Whitney.
La relación entre las distintas pruebas bioquímicas de función hepática y los parámetros farmacocinéticos de antipirina se efectuó mediante el coeficiente de correlación de Pearson y el coeficiente de correlación de Spearman. En todos los casos se aceptó como significativo un valor de p < 0,05.
RESULTADOS
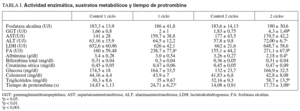
Como se puede observar en la tabla I, la administración de vinorelbina en 1 y 2 ciclos no cambió la actividad de la creatinfosfocinasa, aspartatoaminotransferasa y lactatodeshidrogenasa. Igualmente los valores medios de fosfatasa alcalina en las ratas control, tanto de un ciclo como de 2 ciclos, no presentaron diferencias estadísticamente significativas entre ambos. En cambio aumentó de forma estadísticamente significativa en las ratas tratadas con respecto a las controles (p < 0,05 en un ciclo; p < 0,01 en 2 ciclos). Por su parte, la gammaglutamiltranspeptidasa (GGT) no cambió en las ratas tratadas con un ciclo de vinorelbina, pero aumentó significativamente (p < 0,01) en las tratadas con 2 ciclos.
No se encontraron diferencias significativas respecto a la alaninaaminotransferasa (ALT) entre controles y ratas tratadas con un ciclo de vinorelbina; sin embargo, hubo diferencias significativas entre las ratas tratadas con 2 ciclos de vinorelbina y sus controles (p < 0,05).
En la tabla I se observa que en los valores medios de albúmina las diferencias entre las ratas tratadas con 2 ciclos y sus controles fueron muy significativas (p < 0,01). También hubo diferencias significativas con respecto a las concentraciones séricas de triglicéridos entre el grupo tratado con 2 ciclos de vinorelbina y sus controles (p < 0,01).
Por lo que se refiere a la actividad de protrombina (tabla I), al final del tratamiento con un ciclo de vinorelbina se halló significativamente disminuida (p < 0,001). Igual sucedió en las ratas tratadas con 2 ciclos de vinorelbina (p < 0,05).
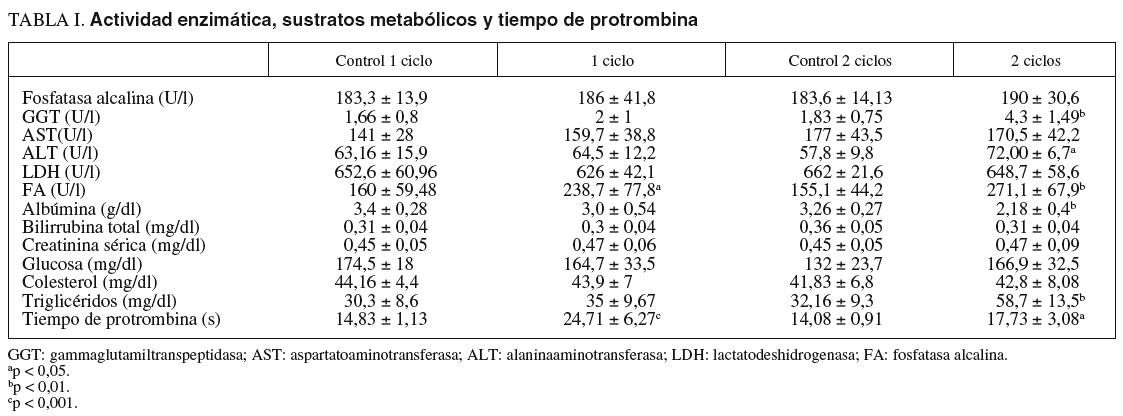
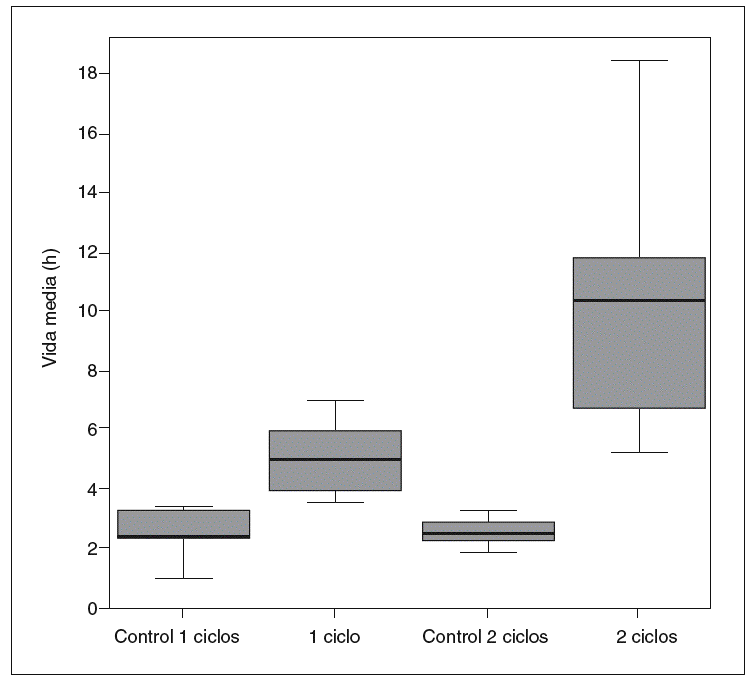
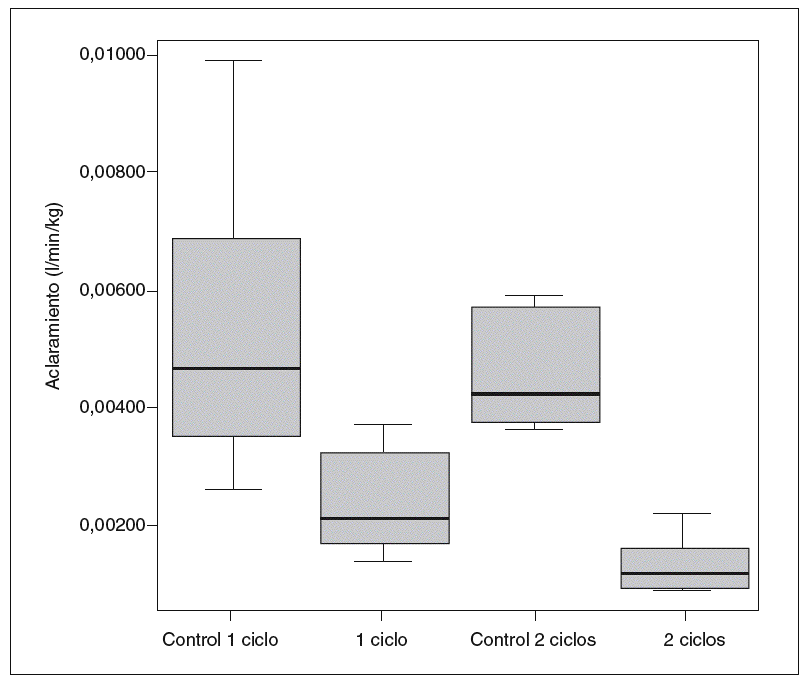
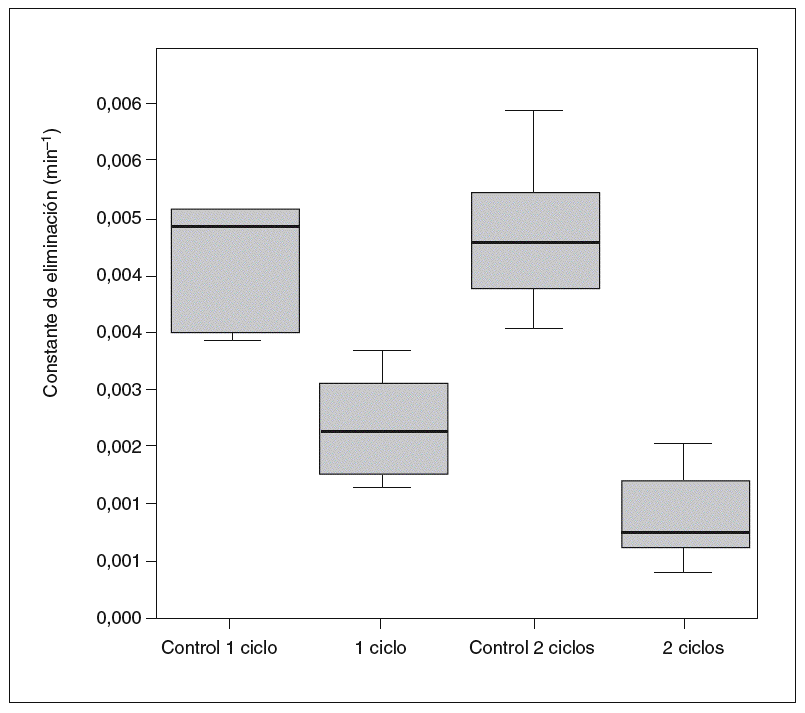
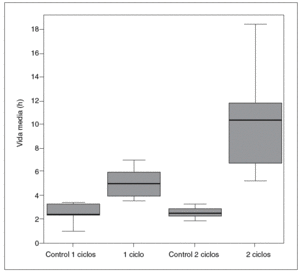
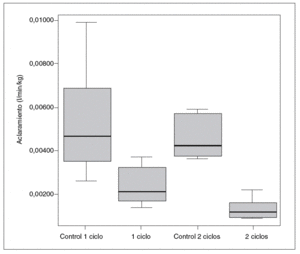
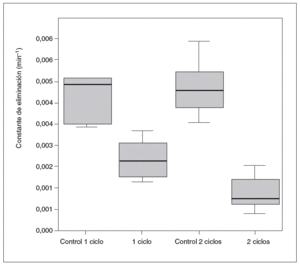
Por otro lado, la cinética de la antipirina varió significativamente después de la administración de vinorelbina. En la tabla II se recogen los datos farmacocinéticos obtenidos. Las comparaciones entre los distintos grupos en cuanto a la vida media de la antipirina, su aclaramiento y su constante de eliminación pueden verse en las figuras 1-3.
Fig. 1. Vida media de la antipirina.
Fig. 2. Aclaramiento plasmático de antipirina.
Fig. 3. Constante de eliminación de antipirina.
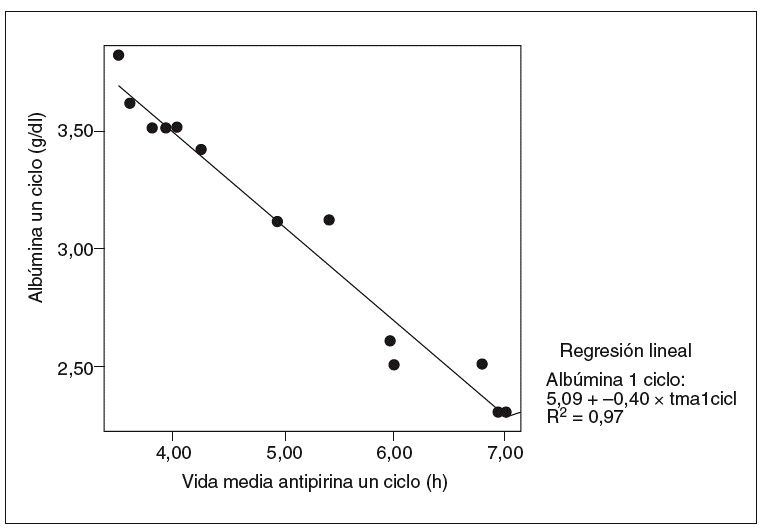
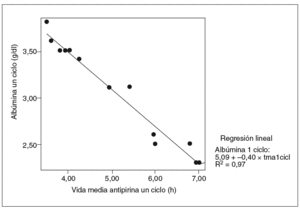
Fig. 4. Correlación entre la vida media de la antipirina y albúmina en un ciclo (correlación de Pearson = 0,98; p < 0,01). tmanc: vida media de antipirina un ciclo.
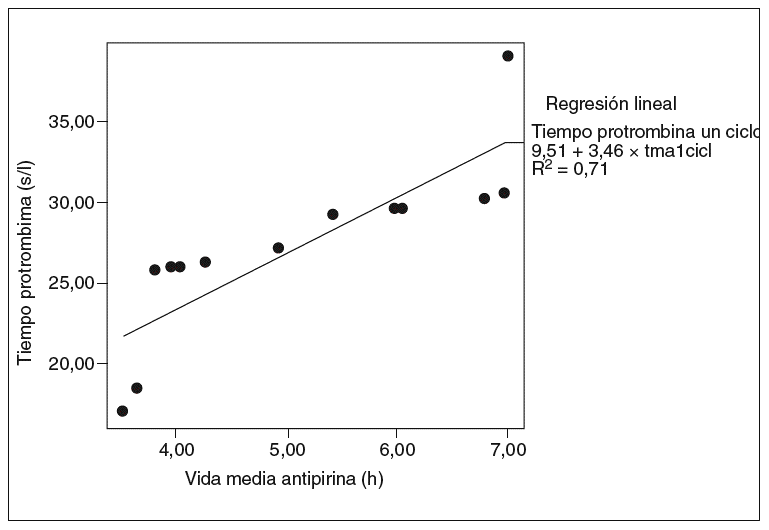
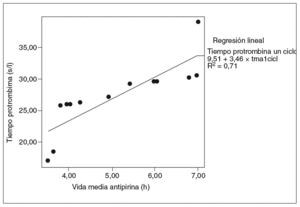
Fig. 5. Correlación entre la vida media de la antipirina y el tiempo de protrombina en un ciclo (correlación de Pearson = 0,84; p < 0,01). tma1cicl: vida media de antipirina un ciclo.
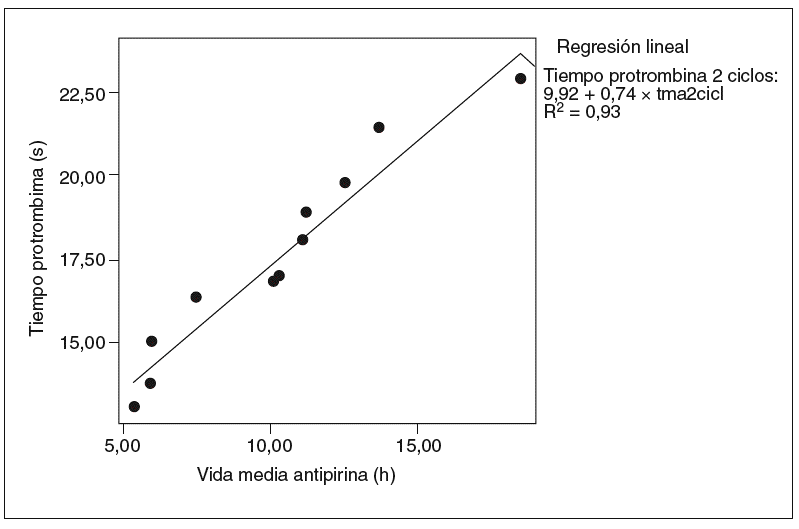
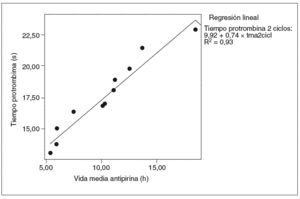
Fig. 6. Correlación entre la vida media de la antipirina y el tiempo de protrombina en 2 ciclos (correlación de Pearson = 0,96; p < 0,01). tma2cicl: vida media de antipirina 2 ciclos.
Se halló una correlación estadísticamente significativa entre la vida media de la antipirina y la tasa sérica de albúmina, pero sólo en el grupo de ratas tratadas (coeficiente de correlación de Pearson = 0,98; p < 0,01) (fig. 4). Asimismo se observó una buena correlación entre el aumento de la vida media de la antipirina y el aumento del tiempo de protrombina en todas las ratas tratadas con vinorelbina, tanto en las de un ciclo (fig. 5) como en las de 2 (fig. 6).
DISCUSIÓN
El aumento significativo de la fosfatasa alcalina en las ratas tratadas tanto con un ciclo como con 2 no llegó a triplicar el valor normal en ambos casos, lo que coincide con lo comunicado por otros autores31,32. Una variación de estas características (en las que los valores de la fosfatasa alcalina no superan 3 veces los valores normales) se puede producir en otras enfermedades sin afectación hepática8.
En cuanto a la GGT y ALT, únicamente se vieron alteradas en las ratas tratadas con 2 ciclos. En el caso de la GGT indicaría un compromiso hepático moderado, ya que el aumento es igual al observado en enfermos con cáncer de mama y metástasis hepáticas, y en otro grupo con enfermedad extrahepática, ambos tratados con vinorelbina8. El grado de significación de las diferencias con respecto a la ALT fue pequeño, lo que podría indicar una incipiente lesión hepática, como se señala en otros estudios33,34.
Con respecto a los valores medios de albúmina, las diferencias muy significativas entre las ratas tratadas con 2 ciclos y sus controles indican una disfunción hepática al final del tratamiento. En cambio, en procesos cirróticos provocados por el empleo de hepatotoxinas la hipoalbuminemia se observa desde el inicio del tratamiento y se mantiene hasta el final35.
La elevación de triglicéridos en el grupo tratado con 2 ciclos de vinorelbina coincide con lo comunicado por Dianzani36, quien describe estas acumulaciones observadas en esteatosis.
La disminución del tiempo en que la protrombina pasó a trombina en los 2 grupos tratados puede deberse a una síntesis inadecuada de los factores de coagulación por insuficiencia hepática. Estos resultados coinciden con los descritos por Eguchi et al37 en un estudio sobre trasplantes de hepatocitos aislados en ratas con insuficiencia hepática fulminante.
El tratamiento con vinorelbina mostró una acentuada disminución de la eliminación plasmática de antipirina. Tras el tratamiento con vinorelbina el aclaramiento de antipirina disminuyó en un 59,26% en las ratas con un ciclo de vinorelbina y en un 74,08% en las tratadas con 2 ciclos. En nuestro estudio la vida media de la antipirina aumentó de forma muy significativa en las ratas tratadas con respecto a sus controles, al igual que en otros estudios en ratas tratadas con vincristina, análoga de la vinorelbina22, y con 5-fluorouracilo y ciclofosfamida38. Estos resultados son semejantes a los obtenidos por otros autores en estudios con diversas sustancias de características fisiológicas semejantes39,40. Incluso se pueden comparar con los descritos por Zhu et al30 en ratas a las que se indujo una grave intoxicación hepática por tetracloruro de carbono.
La relación estadísticamente significativa entre la cinética de eliminación de la antipirina, la tasa sérica de albúmina en las ratas tratadas con un ciclo y el aumento del tiempo de protrombina en los 2 grupos de ratas tratadas, que también se ha encontrado en pacientes con hepatopatías crónicas y cirrosis41,42, refleja la estrecha relación entre la eliminación de antipirina y los datos bioquímicos indicativos de la capacidad de síntesis hepática. No obstante, dicha disminución de la síntesis hepática en el caso de la albúmina sólo fue significativa en las ratas tratadas con 2 ciclos; en cuanto al tiempo de protrombina, hubo relaciones con la cinética de la antipirina en las ratas tratadas tanto con uno como con 2 ciclos, pero las diferencias más significativas (p < 0,001) se dieron entre las ratas de un ciclo y sus controles. En las tratadas con 2 ciclos las diferencias fueron menores (p < 0,05). Al estudiar la cinética de eliminación de la antipirina vimos que las diferencias eran claramente significativas en las ratas tratadas con un ciclo y esas diferencias se mantuvieron e incluso aumentaron en las ratas tratadas con 2 ciclos.
Las pruebas bioquímicas para valorar la función hepática son poco específicas y poco sensibles para predecir la capacidad de síntesis de sustancias endógenas por el hígado. Además, son poco útiles para calcular la reserva hepática para metabolizar fármacos. La biotransformación de la antipirina depende de la actividad microsómica ligada al P-450 y, por lo tanto, su cinética de eliminación está claramente influida por la inhibición o inducción que fármacos o sustancias exógenas puedan ejercer sobre la actividad del sistema enzimático de la fracción microsómica hepática.
La prueba de la antipirina permite la detección temprana de disfunción oxidativa producida por vinorelbina, con una escala sensitiva, lo cual podría ser muy útil en la monitorización de la posología de este fármaco, con el fin de individualizar las dosis, y así evitar intoxicaciones e infradosificaciones, tanto en los pacientes sin signos clínicos de hepatopatía previa a la administración del antineoplásico como en aquellos en quienes se sospecha una lesión hepática preexistente.
La determinación de la eliminación de antipirina antes y después del tratamiento con antineoplásicos y con fármacos eliminados por la misma subfamilia que la antipirina proporciona una información directa del estado metabólico del hígado como resultado del tratamiento, de forma que en la utilización de esta prueba en humanos cada paciente puede ser su propio control.