Los antivirales de acción directa son muy potentes y tienen una barrera genética elevada. Por este motivo, los factores que influyen en la curación de la hepatitis C han disminuido y han ido perdiendo importancia. Factores del huésped como la presencia de cirrosis, la raza y la adherencia al tratamiento influyen en la tasa de respuesta viral sostenida. La adherencia junto a los errores de tratamiento y las interacciones farmacológicas son importantes, especialmente en pacientes de edad avanzada. Factores virales como la carga viral, el genotipo o la presencia de resistencias basales impactan en la tasa de respuesta, pero se minimizan utilizando regímenes pangenotípicos. La simplificación del tratamiento y la alta eficacia de los nuevos tratamientos antivirales permitirán la universalización del tratamiento y aspirar a la eliminación de la infección en las próximas décadas.
Información sobre el suplemento: este artículo forma parte del suplemento titulado “El valor de la simplicidad en el tratamiento de la hepatitis C”, que ha sido patrocinado por Gilead.
© 2019 Elsevier España, S.L.U. Todos los derechos reservados.
Direct-acting antiviral agents are highly potent drugs with a strong genetic barrier. Consequently, the factors influencing hepatitis C cure have been reduced and have progressively lost importance. Host factors, such as the presence of cirrhosis, race, and treatment adherence, influence sustained viral response. Adherence, together with treatment errors and drug interactions, are also important, especially in older patients. Viral factors, such as viral load, genotype, and the presence of baseline resistances affect the response rate but their influence can be minimised by using pan-genotypic regimens. Treatment simplification and the high efficacy of new antiviral treatments will allow treatment universalisation and will hopefully enable elimination of the infection in the next few decades.
Supplement information: This article is part of a supplement entitled “The value of simplicity in hepatitis C treatment”, which is sponsored by Gilead.
© 2019 Elsevier España, S.L.U. All rights reserved.
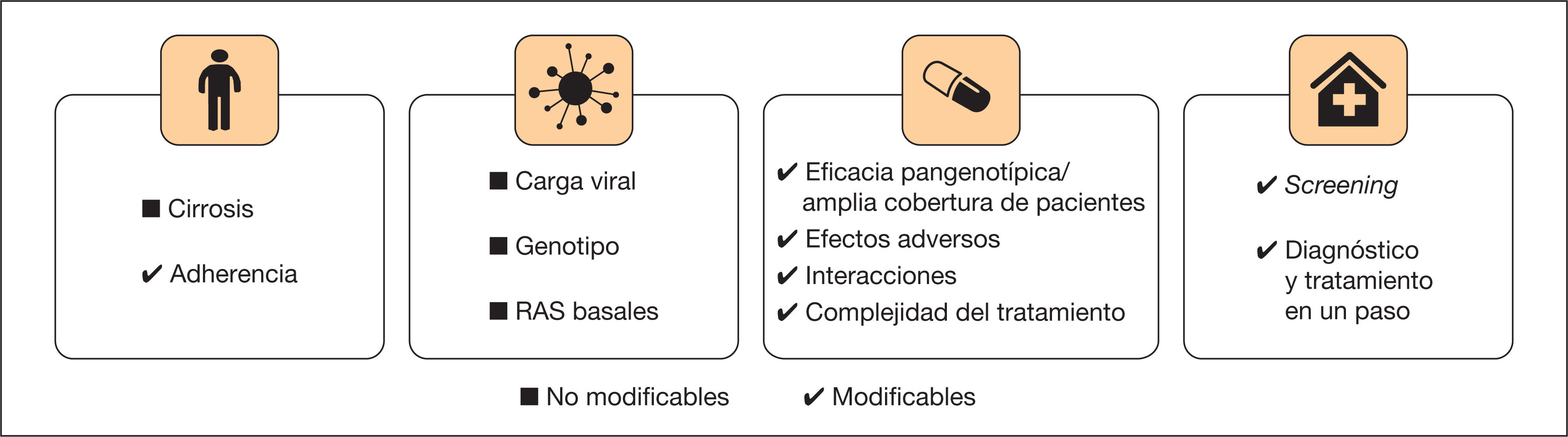
Con la llegada de los antivirales de acción directa (AAD), los factores que influyen en la posibilidad de alcanzar una respuesta viral sostenida (RVS) han disminuido con respecto a los tratamientos anteriores basados en interferón (IFN). La variabilidad en la respuesta en los distintos ensayos clínicos permitió identificar distintas características del huésped, del virus y del tratamiento que ayudaban a predecir no solo la respuesta a los tratamientos antivirales, sino también el propio curso de la enfermedad1. Algunos de los factores que actualmente siguen jugando un papel para conseguir la erradicación del virus dependen del régimen elegido (fig. 1).
Factores del huéspedLos factores predictivos tienen especial importancia cuando en el tratamiento antiviral se utilizan fármacos con poca eficacia y con importantes efectos adversos (EA), como eran los esquemas de tratamiento basados en la utilización de IFN y ribavirina (RBV). Por ello, en la medida en que la potencia antiviral del fármaco aumenta, los factores dependientes del huésped tienen un menor peso en la consecución de la RVS. Se puede considerar, por tanto, que, con la llegada de los AAD, la adherencia al tratamiento o la presencia de cirrosis siguen siendo factores del huésped determinantes para alcanzar una RVS, mientras que otros, como el polimorfismo del gen IL28B, la resistencia a la insulina o determinadas comorbilidades han perdido relevancia2,3.
Los beneficios de los AAD en los pacientes con cirrosis se ponen de manifiesto en numerosos estudios4-11, consiguiendo en general tasas de RVS equiparables a la de los pacientes sin cirrosis8. La presencia de fibrosis avanzada (F3) o cirrosis en pacientes genotipo 3 tiene un impacto en la RVS con determinados regímenes (glecaprevir/pirbentasvir [G/P]) y por ello es necesario prolongar la duración del tratamiento de 8 a 12 semanas. En el caso de pacientes no respondedores a un tratamiento con IFN, la duración debe ser de 16 semanas12-14. La presencia de cirrosis descompensada determina la utilización de un régimen que no contenga un inhibidor de la proteasa y la adición de RBV12.
Otro factor dependiente del huésped en el que podemos incidir y modificar es la adherencia al tratamiento. Actualmente, la mayoría de pacientes pendientes de tratar presentan poca fibrosis y están asintomáticos. Algunos presentan diferentes comorbilidades y están polimedicados15,16.
Estas características pueden favorecer que el paciente tenga poca conciencia de su enfermedad hepática y por tanto comprometer la adherencia17. El irregular cumplimiento terapéutico puede penalizar la respuesta virológica y propiciar la aparición de variantes asociadas a la resistencia (VAR)18,19. No obstante, el estudio SIMPLIFY en pacientes usuarios activos de drogas inyectadas tratados con sofosbuvir/velpatasvir (SOF/VEL) durante 12 semanas demostró que no había diferencias significativas entre los pacientes con o sin un buen cumplimiento con el régimen terapéutico, incluso en pacientes con dosis perdidas de > 7 días consecutivos20. Otro estudio, denominado ANCHOR, con el mismo régimen antiviral que el estudio previo identificó 9 pacientes con interrupciones de 10 o más días consecutivos (10-196 días), sin modificar la duración total del tratamiento, y mostró que 5 de estos pacientes alcanzaron RVS12, desconociéndose la respuesta en un paciente21. Estos hallazgos son importantes teniendo en cuenta que el aumento de pacientes usuarios de drogas que reciben tratamiento es significativo15,16. A día de hoy se desconoce específicamente el impacto de la no adherencia o falta de persistencia cuando la duración del tratamiento es menor de 12 semanas.
La adherencia puede mejorar si el seguimiento del tratamiento se realiza por un equipo multidisciplinar que incluya médicos, enfermería y farmacólogos clínicos22,23. Un aspecto importante relacionado con el huésped es la presencia de comorbilidades. La aparición de los AAD ha cambiado no solo las expectativas de curación, sino también las perspectivas de supervivencia, en aquellos que presentan enfermedades autoinmunes y reumatológicas24,25, coinfección por virus de la inmunodeficiencia humana (VIH)26,27, neoplasias hematológicas y pacientes con deterioro de la función renal28,29. Sin embargo, en muchos casos, la presencia de comorbilidades implica polimedicación, que puede complicar también la adherencia al tratamiento30. Por ello, es importante utilizar pautas de tratamiento sencillas, a ser posible de un único comprimido, para ayudar al cumplimiento y minimizar los posibles efectos indeseables y las interacciones.
El excelente perfil de tolerabilidad de los AAD y su alta eficacia han cambiado radicalmente las perspectivas de curación en determinados colectivos. Es el caso de los pacientes añosos que presentan importantes comorbilidades y polimedicación asociada, lo que favorece los errores en la medicación e interacciones medicamentosas16,30,31. Así, en este grupo de pacientes, las pautas de medicación deben ser sencillas. En pacientes con hepatitis C, la edad no parece ser un factor asociado con la RVS32.
Otro grupo que se ha visto beneficiado de los tratamientos con AAD, son los pacientes candidatos a trasplante de órgano sólido, pues el tratamiento libre de IFN simplifica su manejo al disminuir el riesgo de interacciones con los inmunosupresores, especialmente con tacrolimus, o los inhibidores m-TOR, everolimus o sirolimus33,34.
Para alcanzar el objetivo de la OMS (Organización Mundial de la Salud) de eliminación del virus de la hepatitis C (VHC), no se debe excluir del tratamiento a los usuarios de drogas por vía parenteral (UDVP) ni a la población reclusa35. Con los actuales AAD, 2 ensayos clínicos han demostrado la eficacia y seguridad en pacientes UDVP. El estudio C-EDGE CO-STAR, realizado en pacientes con terapia sustitutiva de opiáceos (TSO), demostró tasas de RVS12 del 94%36. El estudio SIMPLIFY demostró tasas de RVS del 94% en consumidores activos de drogas por vía intravenosa37. Un estudio realizado en una cárcel de España, en población reclusa, con un 58% de UDVP, reveló una RVS del 96,2%38.
En el tratamiento de los UDVP hay que tener en cuenta que, además del abuso de alcohol y drogas, estos pacientes presentan comorbilidades frecuentes (VIH) y están polimedicados36,37. Las drogas inyectadas de uso común son la cocaína, la heroína y las anfetaminas, que no tienen interacción con los actuales AAD. Tampoco existe interacción de los AAD con la metadona o la buprenorfina35. Hay que prestar una atención importante a los psicofármacos, de uso común en esta población, pues presentan interacciones importantes con determinados AAD35.
Factores viralesLa relevancia de los factores virales dependientes ha decrecido de modo notable con la introducción de los AAD. Tanto es así, que en cohortes de vida real no se identifica ningún factor viral capaz de predecir la RVS18. No obstante, la no adecuación a las guías clínicas es un factor que impacta en la RVS, y por ello hay tres factores virales a tener en cuenta a la hora de decidir la estrategia terapéutica con AAD: el genotipo viral, la carga viral y la presencia de sustituciones asociadas a resistencia (RAS)12,39,40.
Aunque el genotipado viral es una herramienta diagnóstica muy estandarizada y los procedimientos para realizarlo están ampliamente difundidos, sus resultados no están completamente exentos de discordancias y errores41, especialmente si se toma como referencia la secuenciación del genoma viral, que se considera la técnica patrón. Una importancia particular tienen los errores en el subtipado en pacientes con genotipo 1. Ciertas técnicas, como LiPA-2, pueden identificar erróneamente genotipos tanto 1a como 1b, cosa que puede suceder hasta en el 23% de los diagnósticos de infección por VHC genotipo 1b41,42. Este es un error clave en el caso de regímenes que modifican su pauta según el subtipo de genotipo 1, como es el caso de elbasvir/grazoprevir (EBR/GZR)40. En este sentido, se puede afirmar que con los nuevos fármacos pangenotípicos, ni el subtipo ni el genotipo son ya un factor predictor de respuesta. Sin embargo, en los pacientes genotipo 3 sin cirrosis y con RAS basales en NS3 o NS5A, la eficacia de G/P durante 8 semanas fue del 86 y el 76%, respectivamente13. Dado que no se recomienda la realización de resistencias basales, las guías recomiendan la utilización de este régimen a 12 semanas en todos los pacientes genotipo 3 sin cirrosis12,13.
La utilización de cualquiera de los 2 regímenes pangenotípicos (G/P o SOF/VEL) durante 12 semanas permite iniciar el tratamiento sin conocer el genotipo o prescindir de su realización mediante estrategias de simplificación, particularmente importantes en el acceso al tratamiento de poblaciones vulnerables, y conseguir la eliminación del VHC. En este sentido, cuando el acceso al Fibroscan® sea una barrera para iniciar el tratamiento, algunos autores sugieren la utilización de marcadores serológicos como el APRI o FIB-4 para conocer el grado de fibrosis43,44.
Respecto a la carga viral, es interesante destacar que con tratamientos libres de IFN, el valor predictivo de respuesta de la carga viral basal se ha reducido notablemente. De hecho, con los fármacos pangenotípicos, la carga viral basal no afecta a la RVS12. En el caso de EBR/GZR, en enfermos con carga viral basal > 800.000 UI/ml y presencia de RAS basales, infectados por VHC genotipo 1a o 4, se debe añadir al tratamiento RBV y administrarlo durante 16 semanas, a menos que se pueda excluir la presencia de RAS en GT1a12,40.
Actualmente, la determinación de la carga viral durante el tratamiento, únicamente tiene significado en el contexto de querer valorar la adherencia al tratamiento. Los ensayos clínicos con diversas combinaciones han demostrado que la probabilidad de lograr RVS no guarda relación con la cinética viral durante el tratamiento45,46. Incluso un nivel bajo de viremia al finalizar el tratamiento no predice que el paciente no consiga RVS47. Por ello, si se quiere simplificar el tratamiento al máximo, la única determinación de carga viral que sería estrictamente necesaria, aparte de la basal, sería la que se efectúa 12 semanas después de concluir el tratamiento12.
Las RAS basales en pacientes naïve a AAD que ocurren espontáneamente durante la historia natural de la infección tienen una importancia clínica menor que las que surgen tras un fracaso al tratamiento, excepto en casos concretos, como las VAR basales a EBR y a G/P12. Las RAS basales a inhibidores nucleótidos o no nucleótidos de NS5B son muy infrecuentes, incluso usando técnicas con un umbral de sensibilidad menor del 1%48. Por el contrario, las RAS a NS5A son comunes. En pacientes con genotipo 1a se observan entre el 7 y el 16%, dependiendo del área geográfica, y la frecuencia en Europa es del 14%. En infecciones por genotipo 1b oscilan entre el 16 y el 19%, y se detectan en el 17% de los casos en Europa49. En España, la prevalencia de RAS basales en la región de NS5A es del 13,3%, y del 6,2% para la región NS350. Desde el punto de vista práctico, y de acuerdo con las guías de la AEEH/SEIMC12, no es necesaria la determinación de las RAS basales.
Los fracasos del tratamiento ocurren con más frecuencia cuando coexisten varios factores del huésped, virales o del tratamiento, y suelen estar relacionados con la recaída y, con menos frecuencia, con el breakthrough (replicación viral durante el tratamiento)47. Ante un fallo o fracaso a un tratamiento con alguna de las combinaciones aprobadas de AAD, se debe asegurar, en primer lugar, que el fallo a los AAD es una verdadera recidiva y no un error de subtipado o genotipado, una infección mixta por varios genotipos, una reinfección, la falta de adherencia del paciente, o se puede deber a una interacción farmacológica que haya disminuido la concentración plasmática del AAD.
En los pacientes con fallo previo a AAD, la combinación de SOF/VEL/voxilaprevir es un excelente tratamiento de rescate, simple y con eficacia bien documentada en pacientes que han fracasado a combinaciones con inhibidores a NS5A51. Conocer el perfil de resistencias del paciente individual antes del retratamiento es útil, pero no imprescindible para realizarlo12.
Factores del tratamientoEn relación con los factores del tratamiento, con los actuales AAD se ha conseguido eliminar el uso de RBV, reducir las interacciones farmacológicas, disminuir la complejidad del tratamiento simplificando la posología, disminuir los EA y acortar el período de tratamiento a 8-12 semanas12. Se ha buscado acortar la duración del tratamiento a 4-6 semanas combinando 4 AAD sin éxito, con tasas de RVS del 29 y el 59% con 4 y 6 semanas, respectivamente52.
La complejidad del régimen terapéutico (número de tomas, número de comprimidos y duración) junto con la aparición de EA (episodios gastrointestinales tales como diarrea o náuseas, astenia, fatiga, exantema o hiperbilirrubinemia) tienen influencia negativa en la adherencia53,54.
Factores asociados al acceso al tratamientoPara alcanzar la eliminación es necesario que todos los sujetos infectados por el VHC accedan al tratamiento con AAD. Se estima una prevalencia de anticuerpos anti-VHC en España del 0,56-1,54%, de los que el 31,5% de ellos son virémicos55. Entre enero de 2015 y septiembre de 2018, un total de 117.452 pacientes han recibido tratamiento en España con los nuevos AAD56.
Existen aún barreras para alcanzar la eliminación de la hepatitis C, entre las que se incluyen la baja tasa de diagnóstico y el circuito de derivación57. Se estima que 1 de cada 3 pacientes desconoce su estado58 y que el 50% de los pacientes diagnosticados nunca se ha derivado a un centro especializado59. Un estudio reciente ha demostrado que los pacientes con serología anti-VHC positiva sin confirmación de viremia progresan en su grado de fibrosis si no reciben tratamiento, teniendo entre 2 y 4 veces mayor riesgo de desarrollar fibrosis significativa y cirrosis, respectivamente60.
Los actuales AAD permiten simplificar el circuito de tratamiento en 2 visitas: a) diagnóstico de infección activa e inicio de tratamiento; b) confirmación de la curación43. La implantación del diagnóstico en un único paso puede conseguir que más pacientes accedan al tratamiento, ya que su implantación redujo el porcentaje de pacientes no derivados al especialista del 43 al 23%61. Una posible solución para reducir ese 23% sería implantar la “derivación en un paso”, una alerta tanto al médico que solicitó la serología como al especialista. Por otro lado, la evaluación de la fibrosis puede hacerse mediante marcadores serológicos y los nuevos AAD pangenotípicos permiten iniciar el tratamiento sin conocer el genotipo43,44, simplificando el diagnóstico e inicio del tratamiento en una única visita. Sin embargo, para acceder a determinadas poblaciones vulnerables podría ser necesario que el diagnóstico y el tratamiento se hicieran en sus propios centros de atención43.
Conflicto de interesesJosé Castellote y Francisco Gea han recibido financiación no condicionada a resultados de Gilead Sciences para el desarrollo del proyecto. Han colaborado además como ponentes y/o investigadores para Abbvie, Gilead Sciences y Merck Sharp and Dohme.
Luis Morano ha recibido financiación no condicionada a resultados de Gilead Sciences para el desarrollo del proyecto. Ha colaborado además como ponente, consultor y/o investigador para Abbvie, Gilead Sciences, Merck Sharp and Dohme, Bristol-Myers Squibb, Janssen, Boehringer Ingelheim, Novartis y Roche Farma.
Rosa M. Morillas ha recibido financiación no condicionada a resultados de Gilead Sciences para el desarrollo del proyecto. Ha colaborado además como ponente para Gilead, Merck, AbbVie e Intercept, y ha participado en consultorías para AbbVie, Gilead e Intercept.
Juan Antonio Pineda y María Buti han recibido financiación no condicionada a resultados de Gilead Sciences para el desarrollo del proyecto. Han realizado además labores de consultoría para Bristol-Myers Squibb, AbbVie, Gilead Sciences, Janssen y Merck Sharp and Dohme.
Mercedes Vergara ha recibido financiación no condicionada a resultados de Gilead Sciences para el desarrollo del proyecto. Ha colaborado además como ponente para Abbvie y Gilead Sciences, durante el presente proyecto.
Información sobre el suplementoEste artículo forma parte del suplemento titulado “El valor de la simplicidad en el tratamiento de la hepatitis C”, que ha sido patrocinado por Gilead.