ESTRUCTURA DEL PÁNCREAS EXOCRINO
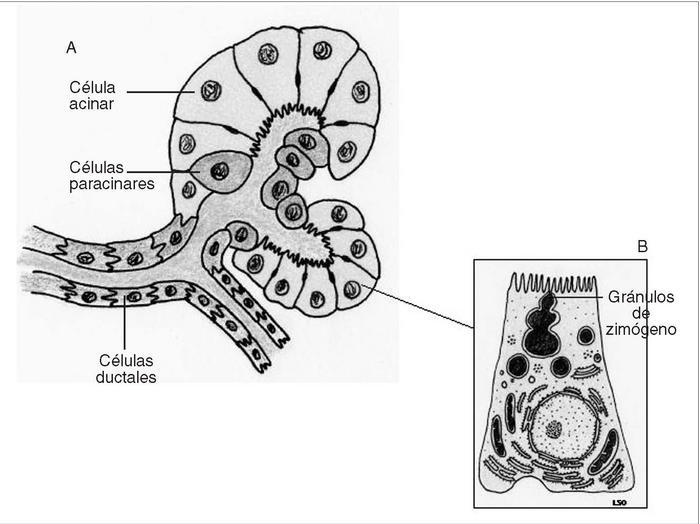
El páncreas es una glándula mixta compuesta por 2 tipos de tejido, endocrino y exocrino, que se agrupan formando lóbulos macroscópicamente visibles y separados entre sí por septos de tejido conjuntivo que contienen vasos sanguíneos, linfáticos y nervios. En humanos, aproximadamente un 80-85% del volumen pancreático está compuesto por la porción principal de tejido que es de naturaleza exocrina, un 10-15% corresponde a la matriz extracelular y los vasos, mientras que la porción endocrina constituye alrededor del 2%1 . Las células endocrinas se sitúan en el espesor del tejido exocrino formando acumulaciones que se denominan islotes de Langerhans, de los que hay alrededor de un millón, distribuidos por toda la glándula y rodeados por una rica red capilar donde realizan su secreción. El páncreas exocrino está formado por los ácinos y el sistema ductal2 . Cada unidad funcional básica está formada por células secretoras acinares, células centroacinares y células ductales, dispuestas en grupos redondeados o tubulares (fig. 1A). Las células acinares tienen morfología poligonal o piramidal, con el vértice dirigido hacia la luz central del ácino. El núcleo se localiza en situación basal y el citoplasma contiene abundante retículo endoplásmico rugoso que le confiere una intensa basofilia. Las células acinares tienen además un aparato de Golgi grande, rodeado de numerosos gránulos acidófilos o gránulos de zimógeno, que están provistos de membrana, y que contienen en su interior las enzimas constituyentes de la secreción pancreática (fig. 1B). En la membrana basolateral de las células acinares hay receptores para las hormonas y los neurotransmisores que regulan su secreción3 . Las células ductales y centroacinares tienen características similares: son cuboideas, con citoplasma claro, núcleo ovalado, aparato de Golgi y retículo endoplasmático poco
Correspondencia: Dr. L. Aparisi. Servicio de Aparato Digestivo. Hospital Clínico. Avda. Blasco Ibáñez, 17. 46010 Valencia. España. Correo electrónico: aparisi_lui@gva.es
desarrollados y sin gránulos. La diferencia entre ambos tipos celulares reside en su localización con respecto a las células acinares. Las centroacinares se localizan hacia la luz del ácino al inicio de los conductos intercalares, mientras que las ductales forman estos conductos intercalares. Los conductos intercalares concurren para formar los conductos intralobulares, que a su vez van confluyendo para formar los interlobulares. Finalmente, éstos irán convergiendo hasta formar los conductos pancreáticos principales, el de Wirsung y el de Santorini.
SECRECIONES DEL PÁNCREAS EXOCRINO
Características del jugo pancreáticoEl jugo pancreático es un líquido incoloro, acuoso, de densidad entre 1.007 y 1.035 según la concentración de proteínas, con pH alcalino, que contiene 2 tipos de secreciones: la enzimática y la hidroelectrolítica. La enzimática es la causante de la hidrólisis de las sustancias nutritivas de los alimentos, mientras que la hidroelectrolítica actúa como vehículo de la enzimática y proporciona un medio alcalino, necesario para la actuación de las enzimas. Para ello se precisa la neutralización del quimo ácido procedente del estómago que entra en el duodeno, gracias a la alta concentración de bicarbonato tan característica de esta secreción4 . El volumen de secreción de jugo pancreático oscila entre 0,2-0,3 ml/min en condiciones basales y 5 ml/min cuando se estimula de forma adecuada; el volumen total diario oscila entre 1 y 4 l1,5-7 .
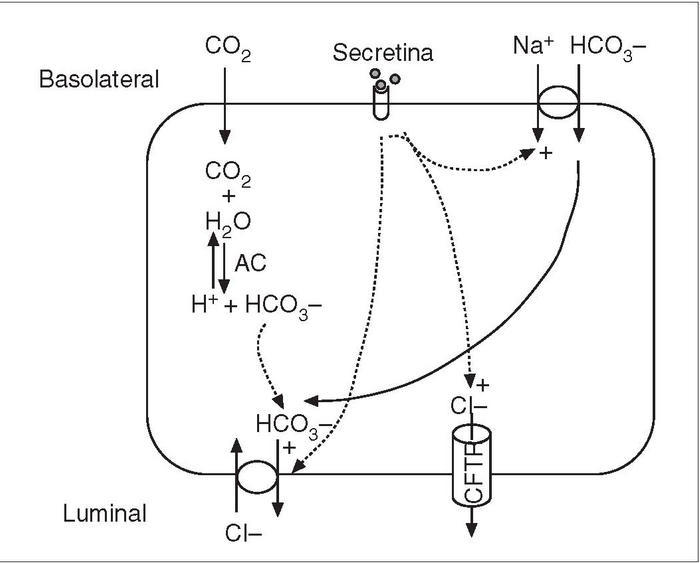
Secreción hidroelectrolíticaLas células centroacinares y las ductales son las encargadas de la secreción hidroelectrolítica del páncreas exocrino. Esta secreción está constituida principalmente por agua, en un 98%, y es muy rica en sodio y bicarbonato. Los cationes se encuentran en concentraciones relativamente constantes similares a las del plasma; los principales son sodio (154 ± 7 mEq/l), potasio (4,8 ± 0,9 mEq/l), calcio (1,7 ± 0,3 mEq/l) y magnesio (0,27 ± 0,08 mEq/l) 8 . En cuanto a los aniones, son fundamentalmente el cloro y el bicarbonato. Este último procedente tanto de la hidratación del CO 2 catalizada por la anhidrasa carbónica (especialmente la isoenzima II), presente en las células ductales y centroacinares, como por cotransporte con Na + a través de la membrana basolateral 9,10 . El cloro y el bicarbonato se encuentran en concentraciones variables; con el flujo de secreción aumenta la de bicarbonato, y disminuye proporcionalmente la de cloro para mantener su suma constante (154 ± 10 mEq/l) 7 .
Figs. 1A y B. Esquema de la estructu ra microscópica del ácino pancreático y de la célula acinar.
Fig. 2. Mecanismo de secreción de bicarbonato en las células ductales del páncreas. Efecto de la secretina. AC: anhidrasa carbónica; CFTR: regulador de la conductancia transmembrana de la fibrosis quística.
La secreción hidroelectrolítica es estimulada principalmente por la secretina, que controla, por tanto, el volumen de jugo pancreático. Esta hormona provoca el aumento de secreción de bicarbonato por las células ductales y centroacinares al activar la adenilciclasa y aumentar el adenosín monofosfato cíclico (AMPc)6 . El mecanismo por el cual el AMPc aumenta la secreción de bicarbonato implica principalmente la activación de un tipo de canal de cloro en la membrana luminal, identificado como el regulador de la conductancia transmembrana de la fibrosis quística, cuya alteración está relacionada con esta emfermedad. La activación de este canal de cloro aumenta la secreción de este anión en la luz ductal, y como este incremento está acoplado a un intercambiador de Cl– /HCO3 de la membrana luminal, se produce la sustitución de cloro por bicarbonato; el resultado final es el aumento de bicarbonato en la luz ductal6 . La secretina, además de activar al intercambiador de Cl– /HCO3 en la membrana luminal, estimula al cotransportador de Na+ -HCO3 en la membrana basolateral. Ambos efectos favorecen la secreción de HCO3 hacia la luz ductal (fig. 2). Finalmente, se ha propuesto la existencia de un gradiente electroquímico que a su vez favorecería la secreción de HCO3 a través de canales de conductancia a aniones10 .
Secreción enzimáticaEl páncreas posee una gran capacidad de síntesis de proteínas, y de hecho se considera que es el órgano que mayor cantidad de proteínas produce por gramo de tejido. Las células acinares son las encargadas de la síntesis y la secreción de las enzimas y proenzimas, que según la función que desarrollan se clasifican en 4 grupos: proteolíticas, lipolíticas, glucolíticas y nucleolíticas (tabla I). La síntesis de las enzimas digestivas tiene lugar en el retículo endoplásmico rugoso, desde donde son transportadas al aparato de Golgi. Allí experimentan diversas modificaciones postraduccionales, especialmente glicosilación, se concentran y, posteriormente, son transportadas a los gránulos de zimógeno. La secreción de las enzimas digestivas tiene lugar mediante exocitosis, que incluye el desplazamiento de los gránulos secretores hacia la membrana apical, y el reconocimiento de un lugar de la membrana plasmática para la fusión. La especificidad de la expresión de las enzimas digestivas en los ácinos se debe a la presencia del PCE (pancreas consensus element) en los promotores de los genes, el cual regula la transcripción de sus ARN mensajeros (ARNm)11 . El factor transcripcional PTF-1 es esencial para la expresión de las enzimas digestivas y está presente de forma selectiva en el páncreas exocrino donde se une al PCE. La mayoría de las enzimas pancreáticas se secretan en forma de zimógenos o proenzimas inactivas, para evitar la autodigestión y la consiguiente lesión del propio páncreas. Junto con estas proenzimas, el páncreas secreta el péptido inhibidor de tripsina, que evita su activación antes de llegar al duodeno. A este nivel el tripsinógeno se convierte en tripsina por acción de la enterocinasa o enteropeptidasa de la mucosa duodenal, y esta tripsina produce la activación en cascada del resto de las proenzimas pancreáticas. En la activación del tripsinógeno a tripsina se liberan pequeños péptidos denominados péptidos de activación del tripsinógeno. Las enzimas proteolíticas activas procedentes del jugo pancreático pueden ser de 2 tipos: endopeptidasas —mayoritariamente serinproteasas— y exopeptidasas. Las endopeptidasas hidrolizan enlaces peptídicos en lugares específicos de las cadenas polipeptídicas, y en este caso son la tripsina, la quimotripsina y la elastasa. La tripsina escinde enlaces peptídicos de los que forma parte el grupo carboxílico de un aminoácido básico, como la lisina o la arginina4 . La quimotripsina hidroliza enlaces peptídicos en los que intervienen grupos carbonilo de aminoácidos aromáticos. La elastasa humana presenta 2 isoformas: la elastasa 1 o proteasa E y la elastasa 2. La proteasa E actúa específicamente en enlaces en los que participan la alanina, la isoleucina, la valina y los hidroxiaminoácidos. En cambio, la elastasa 2 actúa en la proteína elastina hidrolizando preferentemente enlaces peptídicos de los que forma parte un aminoácido neutro con radical alifático4 . Las exopeptidasas del jugo pancreático son la carboxipeptidasa A y B. La primera hidroliza enlaces peptídicos en el extremo carboxiterminal, liberando cualquier tipo de aminoácido excepto arginina, lisina y prolina. La carboxipeptidasa B también hidroliza enlaces peptídicos carboxiterminales, pero sólo cuando el aminoácido carboxiterminal es arginina o lisina. En cuanto a las enzimas glucolíticas, la amilasa es una α-1,4-glucosidasa que participa en la digestión de los polisacáridos hidrolizando enlaces α-1-4. Por lo que respecta a las enzimas lipolíticas, la lipasa pancreática actúa sobre los triacilglicéridos para dar ácidos grasos libres y monoacilglicéridos. Para que la lipasa sea plenamente activa requiere de la denominada activación de interfase con la colipasa, formando un complejo de anclaje en la interfase hidrófoba/hidrofílica, en presencia de sales biliares. La colipasa es una glucoproteína hidrófoba formada a partir de la procolipasa de la secreción pancreática por acción de la tripsina. La fosfolipasa A2 hidroliza el enlace éster en posición 2 de los fosfolípidos para liberar ácidos grasos y lisofosfolípidos. Esta enzima tiene una gran importancia en la patogenia de las enfermedades pancreáticas por su capacidad para destruir las membranas fosfolipídicas y para dar lugar a la lisolecitina, con efecto citotóxico por su marcado efecto detergente5 . La actividad de la carboxilesterasa está muy aumentada en presencia de sales biliares y actúa principalmente hidrolizando ésteres de colesterol y de retinol4 . La secreción enzimática también incluye ribonucleasas y desoxirribonucleasas, que son fosfodiesterasas capaces de hidrolizar los enlaces fosfodiésteres de los ácidos nucleicos. Por tanto, las enzimas digestivas pancreáticas participan en la hidrólisis tanto de proteínas como de glúcidos, lípidos y ácidos nucleicos, y desempeñan un papel clave en la digestión de los principios inmediatos.
TABLA I. Enzimas del jugo pancreático
REGULACIÓN DE LA SECRECIÓN DEL PÁNCREAS EXOCRINO
Fases de la secreción del páncreas exocrinoEn la secreción del páncreas exocrino se distinguen 2 períodos, el interdigestivo y el digestivo-posprandial12 . En el período interdigestivo la secreción pancreática es escasa, cíclica y está relacionada con las 4 fases interdigestivas de la motilidad gastrointestinal, y es máxima en la fase III13 . La duración y la tasa de secreción durante estas fases varían considerablemente incluso en los mismos individuos, y dependen de la hora del día, el estado de conciencia y el tiempo de ayuno. Se considera que este período interdigestivo está bajo el control de mecanismos nerviosos y hormonales. La regulación nerviosa se realiza mediante control principalmente parasimpático, con conexiones enteropancreáticas. El sistema nervioso simpático influye inhibiendo la secreción y la motilidad interdigestiva. Las hormonas con un mayor papel en este período son la motilina y el polipéptido pancreático, que estimulan e inhiben, respectivamente, la secreción. Se considera que esta regulación interdigestiva es importante para desalojar o limpiar el tracto gastrointestinal superior de partículas alimentarias, descamación celular y flora intestinal. Así, cuando sucede una alteración en la regulación hay frecuentemente un sobrecrecimiento bacteriano. En el período digestivo se produce la mayor secreción exocrina del páncreas, inducida por los estímulos hormonales y nerviosos provocados por los alimentos. Clásicamente se reconocen en este período 3 fases: cefálica, gástrica e intestinal. La fase cefálica es desencadenada por vía vagal mediante un estímulo psíquico, la vista, el olfato y, especialmente, la masticación. La fase gástrica está mediada por un mecanismo colinérgico, tras la distensión gástrica, además de que la llegada del bolo alimenticio al estómago libera gastrina, estímulo, aunque débil, de la secreción pancreática. El ritmo de vaciamiento de los alimentos desde el estómago modula la siguiente fase o fase intestinal, que constituye el período en que se produce el mayor flujo de secreción pancreática exocrina. La cuantía de la secreción pancreática en esta fase depende de los principios inmediatos que llegan al duodeno (tipo, cantidad, propiedades físicas), de la concentración de sales biliares, de la secreción ácida que llega del estómago y de la concentración de las propias enzimas pancreáticas en la luz intestinal. La secreción pancreática está mayoritariamente regulada por el área duodenal. En ella, la liberación de colecistoquinina (CCK) causa más de la mitad de la secreción enzimática posprandial, actuando indirectamente mediante un mecanismo reflejo colinérgico duodenopancreático14 .
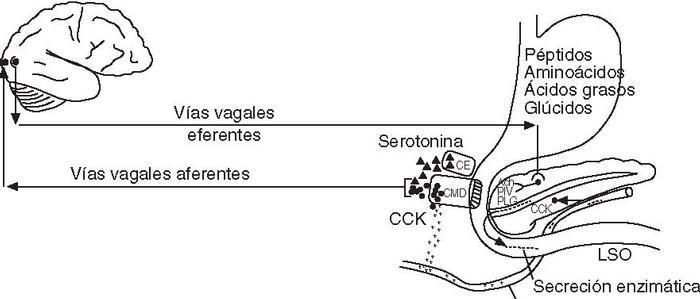
Regulación neurohormonalLas secreciones del páncreas exocrino están reguladas principalmente por 2 hormonas intestinales: la secretina, que estimula la secreción hidroelectrolítica, y la CCK, que estimula la secreción rica en enzimas. La secretina se libera hacia la sangre por la mucosa del intestino delgado como respuesta a los productos de digestión de los lípidos y, sobre todo, al ácido, mientras que la CCK se libera por el intestino delgado como respuesta a los productos de digestión de los lípidos y de las proteínas. Otras hormonas con efecto en la secreción pancreática exocrina son la insulina, que la estimula, y el glucagón, la somatostatina y el polipéptido pancreático (PP), que la inhiben. La regulación nerviosa corre a cargo del sistema nervioso parasimpático, que estimula la secreción a través de vías vagales colinérgicas, y el simpático, que inhibe la secreción. La acetilcolina es el neurotransmisor más importante en la regulación de la secreción pancreática exocrina. No obstante, no podemos olvidar el papel de los neuropéptidos, que también son liberados por la importante inervación del páncreas4,5 . El polipéptido intestinal vasoactivo (PIV) es el neuropéptido que desempeña el papel más importante en la regulación, y su acción es estimular la secreción hidroelectrolítica. El polipéptido liberador de gastrina (PLG) estimula la secreción enzimática, mientras que el neuropéptido Y inhibe la secreción exocrina, principalmente por su potente acción vasoconstrictora. En cualquier caso, la regulación hormonal no se puede separar de la nerviosa ya que están íntimamente relacionadas. De hecho, tal y como se comenta más adelante, la CCK ejerce sus acciones indirectamente actuando sobre las aferencias vagales. El estudio reciente más profundo de los receptores de CCK en células acinares ha permitido demostrar la existencia de una relación muy estrecha entre la regulación hormonal y el control nervioso de la secreción pancreática exocrina en condiciones fisiológicas. Así, se ha observado que la CCK actúa a través de las vías vagales colinérgicas para estimular la secreción pancreática exocrina14 . Se han encontrado 2 tipos de receptores de CCK en los ácinos pancreáticos: receptores CCK-A o de tipo 1, y receptores CCK-B o de tipo 2. Los receptores CCK-A son específicos de la CCK, mientras que tanto la gastrina como la CCK se unen a los CCK-B con alta afinidad15 . Los receptores CCK-A son mayoritarios en ácinos pancreáticos de roedores y en nervios aferentes del vago, pero los ácinos humanos carecen de receptores CCK-A funcionales y sólo expresan los receptores CCK-B. Los ácinos humanos muestran una intensa respuesta a la activación de receptores colinérgicos muscarínicos, pero no responden a concentraciones fisiológicas de CCK y sólo lo hacen a muy altas concentraciones de esta hormona. Aunque los receptores de la CCK son diferentes en roedores y en humanos, el mecanismo productor de las acciones fisiológicas de esta hormona es similar en ambas especies. La atropina inhibe completamente la secreción pancreática de enzimas inducida por dosis fisiológicas de CCK, que originan concentraciones hormonales similares a las posprandiales, tanto en ratas como en humanos14 . La vagotomía tiene el mismo efecto en ratas16 . Estos resultados indican que la estimulación de la secreción pancreática por la CCK tiene lugar de forma indirecta por vías colinérgicas vagales. Además, se ha demostrado que estas vías vagales aferentes tienen su origen en la mucosa gastroduodenal16 . Anteriormente ya se conocía que la CCK actúa por medio de las vías vagales aferentes para producir saciedad y disminuir el vaciado gástrico. Los receptores CCK-A pueden presentar un estado de alta afinidad y otro de baja afinidad. El efecto de la CCK en la secreción pancreática está mediado por los receptores CCK-A vagales de alta afinidad, mientras que su efecto en la saciedad está mediado por los receptores CCK-A vagales de baja afinidad 14 . Estos efectos de la CCK se atribuyen a la hormona liberada endógenamente en el organismo, que es heterogénea ya que está formada por diversos polipéptidos, de los que destacan las formas CCK58, CCK-33 y CCK-8. Por otro lado, la secreción pancreática posprandial rica en enzimas está controlada principalmente tanto por la CCK de las células de la mucosa duodenal como por la serotonina liberada por las células enterocromafines de la mucosa intestinal, que estimula el reflejo vagovagal y activa las neuronas posganglionares colinérgicas del páncreas 14 . La serotonina es liberada por las células cromafines ante estímulos osmóticos, mecánicos o por la presencia de glúcidos —especialmente disacáridos—, y actúa de forma paracrina activando las terminales vagales aferentes de la mucosa intestinal (fig. 3). La interacción sinérgica entre la CCK y la serotonina en las vías aferentes vagales explicaría la intensa secreción pancreática posprandial que tiene lugar con un pequeño incremento de la CCK plasmática en el período posprandial 14 .
Fig. 3. Regulación neurohormonal de la fase intestinal de la secreción enzi mática del páncreas. Ach: acetilcolina; CE: célula enterocromafín; CMD: cé lula de la mucosa duodenal; CCK: colecistocinina; PIV: polipéptido inhibidor vasoactivo; PLG: polipéptido liberador de gastrina.
Regulación por retroalimentación
La secreción pancreática exocrina también está regulada por retroalimentación negativa por las enzimas pancreáticas en el duodeno, particularmente por la tripsina. De hecho, cuando se deriva la secreción fuera del duodeno se incrementa la secreción pancreática, y la administración intraluminal de tripsina puede inhibir tanto esta secreción como el incremento de la CCK. Por tanto, después de las comidas la tripsina que queda libre inhibe la secreción de CCK y la secreción pancreática. Dos péptidos intraluminales, uno de ellos denominado péptido liberador de CCK, parecen mediar el efecto de la tripsina en la secreción enzimática17 . Ambos péptidos estimulan la secreción de CCK y son inactivados por la tripsina. También se ha descrito un péptido liberador de secretina intraluminal que participaría en el efecto de la tripsina en la secreción hidroelectrolítica. Este péptido activa la secreción de se-cretina y es inactivado por la tripsina18 . Por otro lado, existe un mecanismo de retroalimentación negativa que implica al páncreas endocrino. La estimula-
Vasos sanguíneos
ción vagal colinérgica que se produce en el período posprandial no solamente estimula a los ácinos pancreáticos, sino que también actúa en los islotes de Langerhans para que secreten el PP. Esta hormona actúa de forma presináptica en las vías vagales reduciendo la liberación de acetilcolina y, por tanto, inhibe la secreción hidroelectrolítica y enzimática del páncreas exocrino6 .
Inhibición por nutrientes y sales biliaresSe han descrito efectos inhibidores de la secreción pancreática exocrina por parte de nutrientes, sales biliares y algunas hormonas gastrointestinales. Los aminoácidos y la glucosa disminuyen la secreción pancreática. Así, un aumento de los valores sanguíneos de aminoácidos o la hiperglucemia producen inhibición de la secreción pancreática inducida por la ingesta o por estimulación con CCK. El glucagón y la somatostatina parecen mediar la inhibición por aminoácidos y glucosa, mientras que el péptido YY causaría un efecto inhibidor de los ácidos grasos. La concentración de sales biliares en el duodeno también afecta a la secreción pancreática. Así, un aumento de su concentración en el duodeno provoca una disminución en la tasa de secreción enzimática del páncreas y, por el contrario, su disminución produce un aumento de la liberación de CCK y de la secreción enzimática19 . Finalmente, la infusión intracolónica de ácido oleico también inhibe la secreción pancreática exocrina, al igual que la perfusión de hidratos de carbono o grasas en el íleon a suficiente concentración. No obstante, cuando se perfunden hidratos de carbono a concentraciones fisiológicas en el íleon en la fase posprandial, se observa un incremento selectivo de la amilasa con una disminución global del resto de la secreción enzimática20 .
Vías de señalización intracelular en la regulación y la secreción de las células acinares
Los mecanismos de señalización intracelular implicados en la estimulación neurohormonal de las células acinares se han demostrado con el uso de preparaciones in vitro de células acinares de animales de experimentación. Mediante el uso de ligandos marcados radiactivamente y de antagonistas específicos, se han caracterizado los receptores de la CCK, la secretina, la acetilcolina, la neuromedina C (PLG o equivalente de bombesina en mamíferos), la sustancia P y el PIV6,15 . Estos receptores están situados en la membrana plasmática basolateral de las células acinares y están acoplados a proteínas G. Se dividen en 2 categorías: en una de ellas están los receptores de secretina y PIV, y en la otra los receptores de la CCK, la acetilcolina, la bombesina y la sustancia P6 . La unión de la secretina o del PIV a su receptor da lugar a la activación de la adenilatociclasa, con el consiguiente incremento del AMPc intracelular y activación de las proteincinasas dependientes de AMPc. En la segunda categoría de receptores, la unión del ligando específico estimula el metabolismo de los fosfoinositoles de membrana, lo que conduce a un incremento del Ca2++ citoplasmático. Concretamente, se produce la hidrólisis del fosfatidilinositol 4,5-difosfato mediante la fosfolipasa C, liberando 1,2-diacilglicerol e inositol 1,4,5-trifosfato. Este último induce la liberación intracelular de calcio desde depósitos no mitocondriales, dando lugar a la activación de proteinquinasas dependientes del calcio y de la calcineurina (o proteinfosfatasa 2B)15 . Por otro lado, el diacilglicerol activa la proteinquinasa C. Todos estos mecanismos mencionados participan en la secreción enzimática de las células acinares. Además, existe un efecto sinérgico en la secreción cuando actúan simultáneamente agonistas que actúan vía AMPc junto con agonistas que lo hacen vía Ca2++6 . Por ello, la combinación de pequeños aumentos de ambos tipos de hormonas puede producir un incremento significativo de la secreción en condiciones fisiológicas.
INTEGRACIÓN DE LA FUNCIÓN EXOCRINA PANCREÁTICA EN LOS PROCESOS DIGESTIVOS. RESERVA FUNCIONALLa perfusión en el duodeno de lípidos, proteínas y glúcidos produce diferentes respuestas secretorias. Las grasas producen una intensa y duradera respuesta secretora; las proteínas también producen estímulo de la secreción aunque de menor cuantía; los glúcidos son los que menos duración e intensidad secretoria producen. Los lípidos constituyen, generalmente, una de las mayores fuentes calóricas de la ingesta. En el mundo occidental la ingesta de grasas varía por término medio entre 90 y 140 g/día, a los que se añaden unos 40-50 g depositados en el intestino de carácter endógeno. La mayor parte está compuesta por triglicéridos (TG), cuya digestión y absorción se efectúa con una gran eficacia. La hidrólisis de los TG se inicia mediante la lipasa gástrica (resistente al pH ácido), previa emulsión del bolo alimenticio en el estómago, lo que supone un 20-30% de la digestión lipídica total. La digestión de los lípidos se produce mayoritaria-mente en el duodeno y en el yeyuno. Para ello, se necesita el concurso simultáneo de diferentes agentes, como las sales biliares —que permiten la emulsión con formación de micelas mixtas de lípidos-sales biliares, aumentando la superficie sobre la que actúan las enzimas digestivas—, el bicarbonato —que mantiene el pH duodenal por encima de 5—, la colipasa pancreática —cofactor de activación de la lipasa—, y especialmente de la lipasa pancreática, que efectúa la hidrólisis de los triglicéridos. El páncreas dispone funcionalmente de una gran reserva secretora que rebasa hasta 10 veces las necesidades digestivas de la nutrición normal, tanto de lípidos como de proteínas. De esta forma, cuando esta capacidad se reduce a menos del 10%, aparece esteatorrea y creatorrea, los signos característicos de la insuficiencia pancreática21 . Adicionalmente, la fosfolipasa A2 hidroliza los fosfolípidos y la carboxilesterasa contribuye a la absorción de las vitaminas liposolubles. En general, la digestión de las grasas no tiene mecanismos complementarios en la mucosa intestinal, por lo que un fallo significativo de la reserva funcional exocrina del páncreas producirá su deficiente digestión, en contra de lo que ocurre con las proteínas y los hidratos de carbono, donde existen mecanismos compensatorios en la pared intestinal. Las proteínas de la dieta suponen en el mundo occidental, por término medio, unos 70-100 g/día, a lo que se añaden unos 30-50 g de proteína endógena (secreciones, descamación celular, moco, etc.). Su digestión se produce por la secreción gástrica, pancreática y de la mucosa intestinal. Las diferentes proteasas que proceden de la secreción pancreática —tripsina, quimotripsina, elastasa, carboxipeptidasas— normalmente hidrolizan mayoritariamente las proteínas de la ingesta. Al igual que con la lipasa, para que se realice la acción hidrolítica de estas enzimas es necesario un pH superior a 5 en la luz intestinal. La existencia de mecanismos compensatorios a esta acción de las enzimas pancreáticas, como la pepsina gástrica —resistente a pH ácido—, y las dipeptidasas y tripeptidasas de la mucosa intestinal permiten que la insuficiencia pancreática en la digestión de las proteínas sea menos frecuente. Por lo general, en los países occidentales los glúcidos constituyen entre el 40 y el 50% de las calorías ingeridas, entre 200 y 300 g/día. Son consumidas principalmente en forma de polisacáridos —almidón—, y además como disacáridos —lactosa, sacarosa— o monosacáridos —glucosa, fructosa—. Su digestión se produce inicialmente por la α-amilasa salival, sobre todo parotídea, que al llegar al estómago es progresivamente inactivada por el pH ácido, y posteriormente en el duodeno por la secreción pancreática de α-amilasa, enzima que escinde las uniones α-1-4 glucosídicas, completando la digestión las disacaridasas y la α-dextrinasa del borde en cepillo de la mucosa intestinal. La digestión y absorción de los principios inmediatos es normalmente muy eficiente y casi completa en el yeyuno; las cantidades anómalamente altas en el íleon tienen un efecto inhibidor de la secreción pancreática, como ya se ha señalado anteriormente. Aunque hay ciertas evidencias de la adaptación de la secreción pancreática a la dieta en función de su composición en principios inmediatos, existen controversias entre los resultados obtenidos en animales y en humanos. En animales de experimentación, el incremento de la ingesta de un nutriente induce un aumento de las enzimas que lo hidrolizan, con disminución del resto de las enzimas digestivas22 . En humanos se ha observado que aumentando la proporción calórica de lípidos y proteínas de la dieta durante 2 semanas se induce un aumento global del volumen de secreción de las enzimas pancreáticas. Sin embargo, cuando este incremento de la proporción calórica es efectuado con glúcidos, con reducción de lípidos y proteínas, disminuye subsiguientemente la secreción pancreática —incluida la amilasa— tanto del período posprandial como del interdigestivo23 .