INTRODUCCIÓN
El cáncer de páncreas es una enfermedad sumamente devastadora con unas tasas de supervivencia global al año inferiores al 20% y de un 3-5% a los 5 años. En la Unión Europea, España es uno de los países que presenta las tasas de incidencia más bajas, alrededor del 5 por 100.000 habitantes y año. La mortalidad global es muy similar a la incidencia1,2 . Más del 90% de los tumores malignos pancreáticos son adenocarcinomas y tienen su origen en el epitelio ductal1 ; consecuencia de ello es la posibilidad de que, por un mecanismo de obstrucción, puedan manifestarse como pancreatitis aguda (aunque no es la forma más frecuente) o desarrollar insuficiencia pancreática exocrina, a pesar de que éste no es el único factor que puede originar una reducción de la secreción. Los tratamientos que se emplean con intención curativa o, como mínimo, para prolongar la supervivencia son la cirugía, la quimioterapia y la radioterapia. El éxito de estos tratamientos está en relación con el diagnóstico temprano, el grado de invasividad del tumor y de su capacidad para desarrollar metástasis. No obstante, sólo un 20-30% de los pacientes serán tributarios de cirugía debido a la extensión del tumor en el momento del diagnóstico3 . El período de supervivencia de los enfermos con tumores no resecables se relaciona con la existencia de metástasis y con su performans status o condición física basal4 . Ésta puede estar condicionada por la consunción que produce el desarrollo del tumor, pero también por la presencia de insuficiencia pancreática exocrina, que potenciará la desnutrición y la evolución desfavorable. La aparición de insuficiencia pancreática exocrina en el curso de esta enfermedad puede ser consecuencia de la localización del tumor o por efecto de la cirugía a que requirió someterse al paciente. Su tratamiento se realiza mediante suplementos de enzimas pancreáticas y, aunque no es determinante del pronóstico del paciente, puede contribuir a mejorar su calidad de vida, por lo que es muy importante considerarla en el momento de decidir la terapéutica a que se someterá al enfermo.
FISIOPATOLOGÍAEl cáncer pancreático provoca una desnutrición progresiva del paciente, en parte debido al déficit de secreción de enzimas pancreáticas, pero también debida a los vómitos y la inapetencia que puede producir el tratamiento con quimioterapia y radioterapia y, también, al afecto consuntivo de la progresión del propio tumor. La aparición de insuficiencia pancreática exocrina en el curso de un cáncer de páncreas es un hecho frecuente y puede explicarse por diversas causas. Ésta puede deberse a un mecanismo de obstrucción del conducto pancreático, que puede empeorar por el desarrollo de una pancreatitis crónica distal por esa obstrucción, como consecuencia de la ictericia obstructiva causada por el tumor o por efecto de la cirugía de resección en la glándula pancreática.
Obstrucción del conducto pancreático por el tumorComo se ha comentado, más del 90% de los tumores pancreáticos se originan en el epitelio ductal, por lo que producen con frecuencia obstrucción. Si ésta tiene lugar en el conducto pancreático principal, el volumen de la secreción pancreática se ve disminuido, con lo que la cantidad de enzimas pancreáticas que llegan al duodeno se ve reducida. Esta disminución se identifica cuando la obstrucción afecta a más del 60% de la longitud del conducto de Wirsung, como demostraron DiMagno et al5 en un estudio que relacionaba la longitud del conducto pancreático principal, opacificado mediante una colangiopancreatografía retrógrada endoscópica (CPRE), y la capacidad de secreción del páncreas exocrino, midiendo el volumen, el bicarbonato, la lipasa y la tripsina. No obstante, la esteatorrea no se hace evidente hasta que la capacidad funcional del páncreas se ve reducida a un 10% 6 . Por ello, los tumores localizados en la porción cefálica o próxima a ella son los que provocan más disminución de la secreción y con mayor frecuencia aparición de esteatorrea (tabla I).
TABLA I Frecuencia de la esteatorrea en enfermedades Pancreatitis crónica secundaria a la obstrucción pancreática y biliar
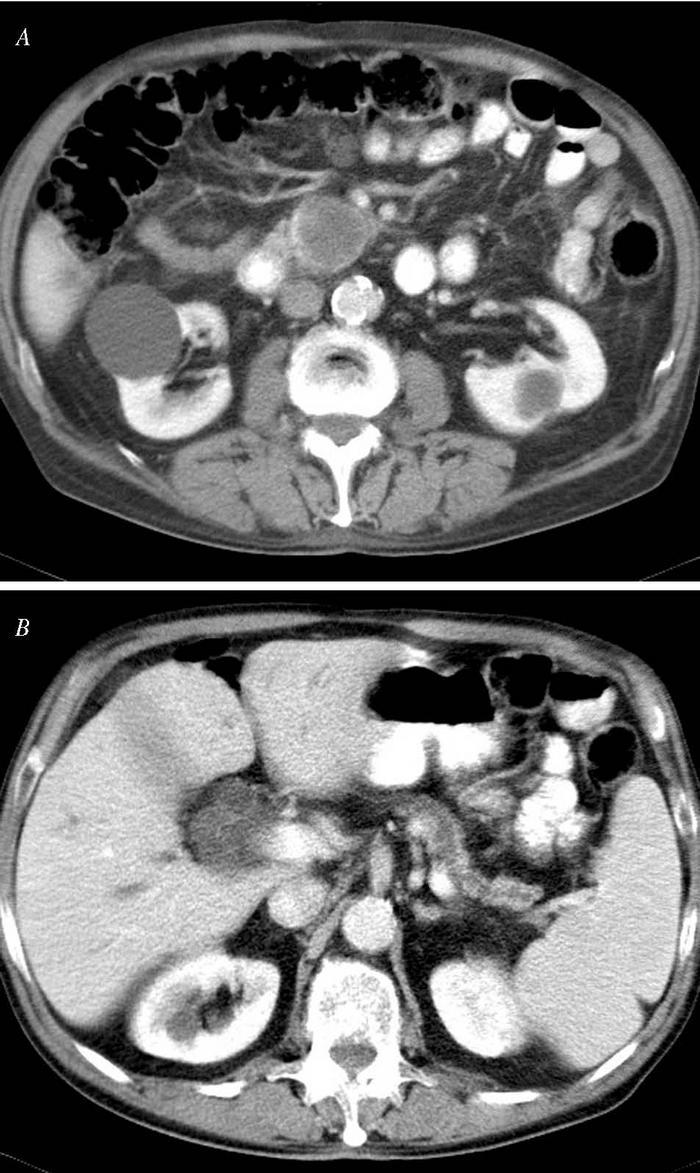
Fig. 1. A: tomografía computarizada (TC) que muestra una cabeza pancreática aumentada de tamaño y de densidad heterogénea compatible con una neoplasia. B: TC del mismo paciente, en un corte más craneal, que permite observar una dilatación del conducto de Wirsung con atrofia del parénquima pancreático secundaria a la obstrucción causada por el tumor.
Cuando la obstrucción es muy intensa y actúa durante suficiente tiempo puede provocar, distalmente a ella, cambios en el parénquima glandular propios de la pancreatitis crónica obstructiva. La principal característica de ésta es que no desarrolla calcificaciones y los tapones intraductales son menos frecuentes que en la pancreatitis crónica alcohólica7 . Este hecho puede contribuir a hacer más manifiesta la insuficiencia pancreática exocrina, ya que al efecto de obstrucción se añade la incapacidad de los ácinos pancreáticos para segregar enzimas, ya sea por atrofia del parénquima o porque se ha sustituido por tejido fibroso (fig. 1).
Ictericia obstructivaAlrededor del 80% de los tumores pancreáticos que se originan en la cabeza de la glándula infiltran el colédoco terminal. Esto provoca colestasis o ictericia de tipo obstructivo, especialmente en los tumores mayores de 2 cm, lo cual condiciona una disminución de la llegada de ácidos biliares a la luz intestinal8 . Es conocido que éstos son necesarios para la solubilización de los lípidos de la dieta. La falta o disminución de los ácidos biliares en el duodeno impide que las grasas puedan ser hidrolizadas por la lipasa pancreática, lo que condiciona la aparición de esteatorrea. En esta situación también se ve afectada la absorción de las vitaminas liposolubles (A, D, K y E).
Efecto de la cirugíaSólo entre el 20 y el 30% de los cánceres de páncreas tienen condiciones adecuadas para realizar una cirugía presuntamente curativa3 . En estos casos el tratamiento indicado es la resección pancreática más o menos amplia según la localización del tumor, lo que comporta una reducción del parénquima pancreático y la consecuente disminución de la secreción y aparición de insuficiencia exocrina pancreática9 . La intensidad de ésta depende del tipo y la extensión de la resección quirúrgica y aparece inequívocamente si excede el 75% de la glándula. En estos casos la esteatorrea no es infrecuente y suele ser difícil de controlar. Según la extensión de la resección puede aparecer diabetes, que contribuye a un peor control del estado de nutrición del paciente10 . Desde el punto de vista nutricional, no debe olvidarse el efecto de la cirugía, como el traumatismo derivado del propio acto quirúrgico, los días de ayuno postoperatorio y las posibles complicaciones, frecuentes en este tipo de intervención. En este momento evolutivo de la enfermedad tiene que valorarse la situación catabólica del paciente y sopesar la necesidad de instaurar nutrición parenteral en el período preoperatorio, para que pueda enfrentarse a la cirugía con un mejor estado físico, lo que condicionará un postoperatorio más satisfactorio.
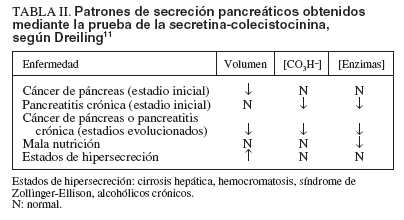
TABLA II. Patrones de secreción pancreáticos obtenidos mediante la prueba de la secretina-colecistocinina, según Dreiling11
DIAGNÓSTICO
Una amplia gama de técnicas, de mayor o menor complejidad, permite conocer el estado de la función exocrina pancreática. Algunas de ellas consiguen identificar estados iniciales de disfunción pancreática, mientras que otras detectan estadios evolucionados de insuficiencia pancreática exocrina. Los diversos métodos para el estudio de la función exocrina pancreática se han descrito ampliamente en el artículo correspondiente, por lo que aquí únicamente se comentarán los que contribuyan a dar información del estado funcional en el caso de los tumores pancreáticos. La prueba de la secretina combinada con colecistocinina (CCK) o con ceruleína representa el patrón de referencia para el resto de las técnicas en el estudio de la función exocrina. La secretina es una hormona que estimula las células de los ductos, que son las que segregan agua y bicarbonato. La colecistocinina y la ceruleína estimulan las células acinares, que son las responsables de liberar las distintas enzimas. Por ello, esta técnica muestra una visión global del estado funcional pancreático. En 1975, Dreiling11 utilizó este método para la valoración de la función exocrina pancreática, y describió diferentes patrones de secreción relacionándolos con diversas enfermedades. Así, estableció 5 tipos de respuesta a esta prueba: a) déficit cuantitativo: el volumen de secreción está disminuido pero no las concentraciones de bicarbonato y de enzimas; se observa en las fases iniciales de cáncer de páncreas por el efecto de la obstrucción del conducto de Wirsung provocada por el tumor; b) déficit cualitativo: el volumen de la secreción es normal y la concentración de bicarbonato y de enzimas está disminuida; se observa en fases poco avanzadas de la pancreatitis crónica; c) déficit total: están disminuidos todos los parámetros de la secreción; es propio de la pancreatitis crónica avanzada y del cáncer de páncreas evolucionado, cuando la obstrucción del conducto pancreático principal es casi total o ha ocasionado una pancreatitis crónica secundaria a la obstrucción; d) déficit enzimático aislado: los valores de las enzimas están disminuidos de forma aislada; aparece en determinados estados de malnutrición, y e) estados de hipersecreción: los volúmenes de secreción están aumentados con concentraciones normales de bicarbonato y de enzimas; se ha observado en la cirrosis hepática, la hemocromatosis, el síndrome de Zollinger-Ellison, así como en alcohólicos crónicos que aún no han desarrollado una insuficiencia pancreática (tabla II). Este mismo autor observó un 5% de falsos positivos y de falsos negativos mediante esta técnica en el conjunto de las diferentes enfermedades pancreáticas. Cuando analizó aisladamente los resultados obtenidos en el cáncer de páncreas, observó que los tumores localizados en la cabeza pancreática presentaban un 5% de falsos negativos y que este porcentaje aumentaba al 17 y 19% si se localizaban en el cuerpo y la cola, respectivamente12 . Sin embargo, posteriormente, otros autores han obtenido resultados erróneos hasta en el 30% de los pacientes con cáncer de páncreas5,13 . Otras técnicas empleadas en el estudio de la función exocrina pancreática, como la determinación de la elastasa y la quimotripsina fecales, las pruebas del BT-ácido paraaminobenzoico (PABA) y del pancreolauril, las pruebas del aliento con distintos sustratos, la cuantificación de la grasa fecal y de la tripsina sérica, sirven para evidenciar con mayor o menor precisión estados más o menos evolucionados de insuficiencia pancreática exocrina (véase el artículo correspondiente), ya sea en el cáncer de páncreas por obstrucción del conducto de Wirsung y/o por la pancreatitis crónica obstructiva que aquélla pueda condicionar. Estas técnicas, sin embargo, sólo indican insuficiencia pancreática pero no pueden dilucidar si ésta se debe a un mecanismo de obstrucción en la secreción. No obstante, en 1986 nuestro grupo14 observó que la evaluación de la función exocrina pancreática mediante la combinación de 2 técnicas (BT-PABA y tripsina sérica) permitía identificar a los pacientes que presentaban obstrucción del conducto pancreático principal. Así, los enfermos que presentaban valores de BT-PABA por debajo del límite de la normalidad y concentraciones elevadas de tripsina sérica mostraron, al efectuarles una CPRE, diferentes cambios patológicos en el conducto de Wirsung. Diez de ellos tenían pancreatitis crónica con cálculos intraductales, otro presentaba un seudoquiste que comprimía el conducto y 3 tenían cáncer de páncreas que provocaba su estenosis. Los pacientes con pancreatitis crónica normalizaron la función exocrina pancreática después de la reabsorción espontánea del seudoquiste, en 3 pacientes después de un período prolongado de abstención alcohólica y en 4 después de una descompresión quirúrgica del conducto mediante una pancreatoyeyunostomía laterolateral; 3 requirieron pancreatectomía subtotal, por lo que quedaron con valores inferiores a los normales tanto de BT-PABA como de tripsina sérica. Los pacientes con un carcinoma pancreático tuvieron una supervivencia de 5, 6 y 7 meses, por lo que no se repitieron las pruebas de función exocrina. Todo ello relacionaba este patrón de secreción pancreática con la existencia de obstrucción en el conducto pancreático; sin embargo, no se pudo determinar la enfermedad que la provocaba. Recientemente se ha descrito una modificación de la prueba de la secretina/CCK que permite identificar la insuficiencia pancreática tanto en la pancreatitis crónica como en el cáncer de páncreas, pero no consigue tampoco diferenciar a cuál de estas 2 enfermedades se debe la disfunción pancreática. La técnica consiste en inyectar 1 CU/kg de hormona por vía intravenosa, mientras se practica una endoscopia alta, y recolectar el jugo duodenal durante 10 min15 .
TRATAMIENTOEl paciente con cáncer pancreático está sometido a diversos factores que afectan intensamente a su estado nutricional; mantenerlo adecuadamente contribuirá a mejorar su calidad de vida y a conseguir que pueda enfrentarse a los distintos tratamientos a los que deberá someterse con un mejor estado físico. Recordemos que la insuficiencia pancreática exocrina producida por los diferentes mecanismos ya descritos, el efecto de la cirugía (traumatismo quirúrgico, ayuno postoperatorio y complicaciones), los vómitos y la inapetencia alimentaria que inducen los tratamientos con radioterapia y quimioterapia, sin olvidar el estado catabólico favorecido por el propio tumor, son factores que, si no se toman medidas adecuadas para evitarlos, contribuyen a deteriorar su estado general. No obstante, los facultativos deben adelantarse a la aparición de este problema, ya que el paciente que se enfrenta a una cirugía tan agresiva como la pancreática o al tratamiento adyuvante o paliativo con un buen estado de nutrición disminuye el riesgo de complicaciones, mejora la calidad de vida y puede alargar su supervivencia. Un hecho importante en estos pacientes, que no debe olvidarse, es el efecto que la progresión tumoral produce en su estado físico y cuya consecuencia final será la aparición de un estado caquéctico, que tiene lugar por la progresiva pérdida de tejido adiposo y de masa muscular esquelética. La caquexia no es necesariamente un fenómeno tardío ligado a la progresión tumoral, aunque con frecuencia se asocia con la muerte. Cerca del 90% de los pacientes con cáncer de páncreas tiene una pérdida de peso en el momento del diagnóstico que puede llegar a ser del 14% de su peso basal16 . La caquexia puede aparecer incluso en ausencia de anorexia, lo que sugiere el efecto de mediadores catabólicos producidos por el propio tumor. Estos pacientes generan un factor que estimula la hidrólisis de los triglicéridos en el tejido adiposo y otro factor circulante inductor de proteólisis (PIF) que es específico de los estados caquécticos, que produce una disminución de la síntesis proteica en el músculo, mientras el catabolismo de la proteína está aumentado. Ambos factores se excretan por la orina; el PIF se ha detectado en la orina del 80% de los pacientes con cáncer de páncreas17 . Algunos estudios han demostrado que el ácido eicosapentanoico (EPA) (ácido graso poliinsaturado) tiene un efecto regulador en la degradación pero no sobre la síntesis proteica18 . Así, un estudio en pacientes con cáncer de páncreas no resecable demostró que la administración de 12 g/día de aceite de pescado, que contiene un 18% de EPA y un 12% de ácido docosahexaenoico, conseguían que una pérdida de peso de 2,9 kg/mes experimentada antes de la suplementación pasara a una ganancia ponderal de 0,3 kg/mes en los 3 meses siguientes a aquélla19 . Para confirmar si este efecto era debido al EPA, estos mismos autores realizaron un segundo estudio utilizando como ácido graso libre EPA al 95% puro. Los pacientes recibieron una dosis máxima de 6 g/día. La pérdida de peso antes de administrar el EPA fue de 2 kg/mes de media, mientras que después de la suplementación su peso era estable, con una ganancia de 0,5 kg después de 4 semanas20 . Otro factor que interviene en el deterioro del estado nutricional de estos pacientes es la insuficiencia pancreática exocrina debida a las diferentes causas que han sido analizadas con anterioridad. Su tratamiento viene definido por la administración de suplementos de enzimas pancreáticas por vía oral. El tipo de preparado galénico que actualmente se aconseja son las cápsulas entéricas con pancreatina contenida en micro-microesferas. Esta forma de presentación permite la disolución de la cápsula de gelatina en un medio ácido con la consecuente liberación de microesferas. Éstas tienen un diámetro de 1-3 mm, lo cual facilita que se mezclen fácilmente con el quimo y traspasen sin dificultad el píloro. Al llegar al duodeno, su cubierta, formada por polímeros resistentes al ácido y a la pepsina, se rompe en el medio alcalino, lo que permite que se liberen las enzimas pancreáticas que hidrolizarán los diferentes principios inmediatos para que puedan ser absorbidos. Las mediciones intraluminales de actividad enzimática sugieren que más del 60% de la lipasa contenida en las microesferas sobrevive a su paso por la cavidad gástrica21 . Por otro lado, los datos proporcionados por los estudios de dosis-respuesta indican que es posible reducir la esteatorrea de forma importante, aunque es difícil conseguir que llegue a normalizarse por completo22,23.
Una consideración especial merece la administración de estos preparados en los pacientes en los que se ha efectuado una intervención de Whipple. En ella, a la resección de la cabeza pancreática se añade la extirpación del tercio distal del estómago y del duodeno, lo que comporta una reducción de la secreción ácida gástrica, por lo que es posible que la administración de los suplementos enzimáticos no consiga los resultados esperados (disminución de la esteatorrea y mejora del estado de nutrición) puesto que la falta de acidez gástrica puede impedir la disolución de la cápsula de gelatina que contiene las microesferas. En estos casos la administración de las cápsulas sin el recubrimiento capsular puede mejorar su eficacia. Un problema adicional, en el caso de la resección pancreática extensa, es la disminución de la secreción de bicarbonato pancreático, lo que puede dificultar la disolución de la cubierta de gelatina que recubre las microesferas; aunque esta deficiencia se ve compensada por la secreción biliar. Son escasos los estudios que han analizado la utilidad de los suplementos enzimáticos en la insuficiencia pancreática exocrina secundaria al cáncer de páncreas. Hace años Pérez et al24 demostraron que la absorción de grasas y proteínas mejoraba en los enfermos con insuficiencia pancreática grave o moderada al administrar pancreatina por vía oral. Más recientemente, Bruno et al25 realizaron un estudio aleatorizado, doble ciego, utilizando altas dosis de preparados de pancreatina en cápsulas entéricas con microesferas frente a placebo, en pacientes con cáncer de cabeza de páncreas no resecable. La dosis empleada fue de 50.000 U Ph.Eur. de lipasa y 2.500 U Ph.Eur. de proteasas en cada una de las principales comidas y de la mitad de dosis en las comidas intermedias. Observaron que mientras los pacientes que recibieron placebo presentaban una pérdida del 3,7% respecto al peso inicial, después de 8 semanas de tratamiento los enfermos tratados con enzimas tuvieron una ganancia ponderal del 1,2%. El coeficiente de absorción de grasas y la ingesta diaria de energía también eran mejores en los pacientes tratados. Los autores concluyen que es posible prevenir la pérdida de peso en los pacientes con cáncer de cabeza de páncreas no resecable mediante la administración de suplementos de enzimas pancreáticas al menos durante un determinado período. Otros autores26 han observado, mediante un estudio piloto, una supervivencia de hasta 3 años en el 36% de los pacientes con cáncer pancreático inoperable, al administrarles un tratamiento nutricional agresivo con aporte de enzimas pancreáticas y suplementos nutricionales. Para mejorar la absorción de nutrientes, además del tratamiento sustitutivo con enzimas pancreáticas es aconsejable sustituir parte del contenido graso de la dieta por triglicéridos de cadena media. Ello facilita la absorción de los lípidos, sin necesidad de la intervención de la lipasa pancreática, y mejora el aporte calórico. Por otro lado, la reducción del contenido de grasas de la dieta a 50-75 g/día consigue una reducción del número de deposiciones en los casos de esteatorrea, lo que mejora la confortabilidad del paciente.
CONCLUSIÓNLa insuficiencia pancreática en los pacientes con cáncer de páncreas es una situación frecuente, ya sea causada por la obstrucción del conducto de Wirsung, con o sin pancreatitis crónica secundaria provocada por el propio tumor, o por efecto de la resección quirúrgica. El tratamiento de esta alteración es fundamental, ya que puede mejorar el estado físico del paciente y alargar incluso su supervivencia. En caso de esteatorrea el tratamiento consiste en reducir el contenido graso de la dieta, con el fin de disminuir el número de deposiciones, por lo que mejora la comodidad del paciente. Esta reducción debe sustituirse por triglicéridos de cadena media, con lo que se mejora el aporte calórico. El déficit de enzimas pancreáticas, que son las causantes directas de la insuficiencia exocrina pancreática, se trata con la administración, por vía oral, de cápsulas con alto contenido en suplementos de enzimas. Su administración en los pacientes que han sufrido una intervención de Whipple puede ser que no dé los resultados apetecidos, puesto que la reducción de la secreción ácida gástrica impide la disolución del recubrimiento capsular para la posterior liberación de las microesferas. En este caso deberán administrarse sin este recubrimiento.
No debe olvidarse que el factor caquectizante tumoral desempeña un papel importante en esta enfermedad. La administración de dosis elevadas de EPA a una alta concentración parece revertir el estado catabólico que presentan los pacientes, aunque se requerirán estudios más amplios para poder afirmarlo con rotundidad. La finalidad que se persigue es mejorar el estado nutricional del enfermo, para que pueda enfrentarse a todas las medidas terapéuticas (cirugía, quimioterapia y radioterapia) con un buen estado físico, mejorar su calidad de vida y, como objetivo final, alargar la supervivencia.
Correspondencia: Dr. S. Navarro Colás. Servicio de Gastroenterología. Institut de Malalties Digestives. Hospital Clínic. Villarroel, 170. 08036 Barcelona. España. Correo electrónico: snavarro@clinic.ub.es