Los síntomas que con mayor frecuencia aparecen en el cáncer de páncreas son el dolor abdominal, la pérdida de peso o la ictericia. La hemorragia digestiva alta por rotura de varices gástricas es una entidad mucho menos prevalente en estos pacientes. Este hallazgo requiere descartar siempre la presencia de trombosis de la vena esplénica. Presentamos el caso de un varón joven que acude a urgencias por hematemesis en el que las pruebas diagnósticas acabaron dilucidando un linfoma pancreático primario (LPP) que provocó trombosis de la vena esplénica, circulación colateral y varices gástricas aisladas sangrantes. Hasta hoy no hemos encontrado en la literatura médica ningún LPP que se exprese inicialmente de este modo. Finalmente realizamos una revisión de la literatura médica e incidimos en la importancia de descartar la trombosis de la vena esplénica en pacientes con varices gástricas aisladas y unas nociones acerca del diagnóstico y tratamiento del LPP.
In patients with pancreatic cancer, the most frequent symptoms are abdominal pain, weight loss and jaundice. Upper gastrointestinal bleeding produced by gastric varices is a rare entity in these patients and requires the presence of splenic vein thrombosis (SVT) to be excluded. We describe the case of a young man who presented to the emergency department with hematemesis. Diagnostic tests revealed primary pancreatic lymphoma (PPL), which provoked splenic vein thrombosis, collateral circulation and the formation of isolated bleeding gastric varices. To date, we have found no reports in the literature of PPL with this form of presentation. Finally, we review the literature, with emphasis on the importance of excluding splenic vein thrombosis in patients with isolated gastric varices, and discuss certain features of the diagnosis and treatment of PPL.
La mayoría de los pacientes con cáncer de páncreas comienzan con síntomas tales como dolor abdominal, pérdida de peso o ictericia según la localización. Sin embargo, existen otros síntomas asociados que se expresan en menor frecuencia pero que deben hacer pensar en su posible etiología. Uno de estos síntomas es la hemorragia digestiva alta producida por varices gástricas. El hallazgo de varices gástricas aisladas obliga a descartar la presencia de trombosis de la vena esplénica (TVE). Hay muchas causas que provocan dicha entidad. Entre éstas destacan las pancreatitis crónicas o las neoplasias pancreáticas, sobre todo el adenocarcinoma1. En cambio, existen otras estirpes tumorales que también pueden provocarla, tales como el linfoma primario de páncreas. Por ello, esta asociación nos parece de especial interés. Describimos a continuación el caso de un varón joven que acude a urgencias por un cuadro de hemorragia digestiva alta acompañada de dolor en el hipocondrio izquierdo de semanas de evolución. Las exploraciones diagnósticas determinaron que se trataba de un linfoma pancreático que había provocado una TVE, y conformaba circulación colateral y subsiguientes varices gástricas aisladas que motivaron la hemorragia. Éste fue el síntoma inicial que llevó al diagnóstico de la masa pancreática. Hasta la fecha no hemos encontrado en la bibliografía ningún LPP que comience de este modo.
Observación clínicaPaciente de 31 años que acude a urgencias por presentar cuadro de hematemesis y melenas. Entre sus antecedentes personales destacan diabetes mellitus de tipo 1 de reciente diagnóstico (15 días antes de su ingreso), es fumador de medio paquete al día y está en tratamiento con insulina lantus y de acción rápida desde hace un mes.
El paciente presenta en la mañana del día de su ingreso 2 vómitos de sangre roja precedidos de vómitos de características alimentarias. No presenta cortejo vegetativo acompañante ni alteraciones del hábito intestinal. Asimismo, refiere que desde hace 2 meses lleva presentando dolor en la zona del hipocondrio izquierdo irradiado a la espalda y a la fosa renal izquierda de características inflamatorias, que no se modifica con los movimientos, que no tiene relación con la ingestión y cuya intensidad llega a despertarlo por las noches. Ha estado en tratamiento con antiinflamatorios y fisioterapia sin mejoría alguna.
A la exploración física, el paciente presenta un buen estado general, está afebril, consciente, orientado y colaborador, bien hidratado y perfundido, aunque con ligera palidez mucocutánea. La presión arterial es de 126/81mmHg y la frecuencia cardíaca de 76lpm. La auscultación cardiorrespiratoria es normal y el abdomen es blando y depresible, doloroso a la palpación en el hipocondrio izquierdo, no se palpan masas ni visceromegalias. Presenta una cicatriz de traumatismo superficial en el hemitórax izquierdo y hematomas superficiales en el mesogastrio por las inyecciones de insulina. La exploración de miembros inferiores es normal.
En la analítica presenta una hemoglobina de 10,2g/dl, hematocrito del 30,6%, VCM de 86fl, recuento de leucocitos de 7.300×103/μl y recuento de plaquetas de 297.000×103/μl. El estudio de coagulación presenta una actividad de protrombina del 72%, ratio internacional normalizada (INR) de 1,1 y tiempo de tromboplastina parcial activada (TTPa) ratio de 0,9. La bioquímica presenta como hallazgos más relevantes una glucosa de 232mg/dl, urea de 46mg/dl, creatinina de 0,74mg/dl, proteína C reactiva de 94UI, y resultaron normales las aminotransferasas, la amilasa, la bilirrubina y las enzimas de colestasis.
Dentro de las exploraciones complementarias se realiza una endoscopia digestiva alta precoz en la que aparecen restos hemáticos digeridos desde el esófago medio que se desprenden fácilmente con el lavado. El esófago y la unión gastroesofágica no presentan lesiones. El estómago también presenta un gran coágulo que ocupa gran parte de la curvatura menor y que se consigue retirar explorando la cavidad gástrica en su totalidad sin encontrar lesiones. La motilidad y distensibilidad gástricas están conservadas. El píloro es céntrico y permeable. El bulbo y la segunda porción duodenal no presentan lesiones, pero también existen restos hemáticos oscuros. En retrovisión, en la zona subcardial se aprecia un patrón de pliegues engrosados.
Ante los hallazgos de la endoscopia, se procede al ingreso del paciente en la unidad de hemorragia digestiva y se instaura un tratamiento con perfusión de pantoprazol de forma empírica. Al día siguiente del ingreso se realiza una ecografía abdominal en la que aparecen como únicos hallazgos relevantes una esplenomegalia de 17cm y una masa hipoecogénica situada entre el riñón y el bazo de unos 8×6cm de diámetro, de bordes irregulares y algunos ecos hiperecogénicos en su interior.
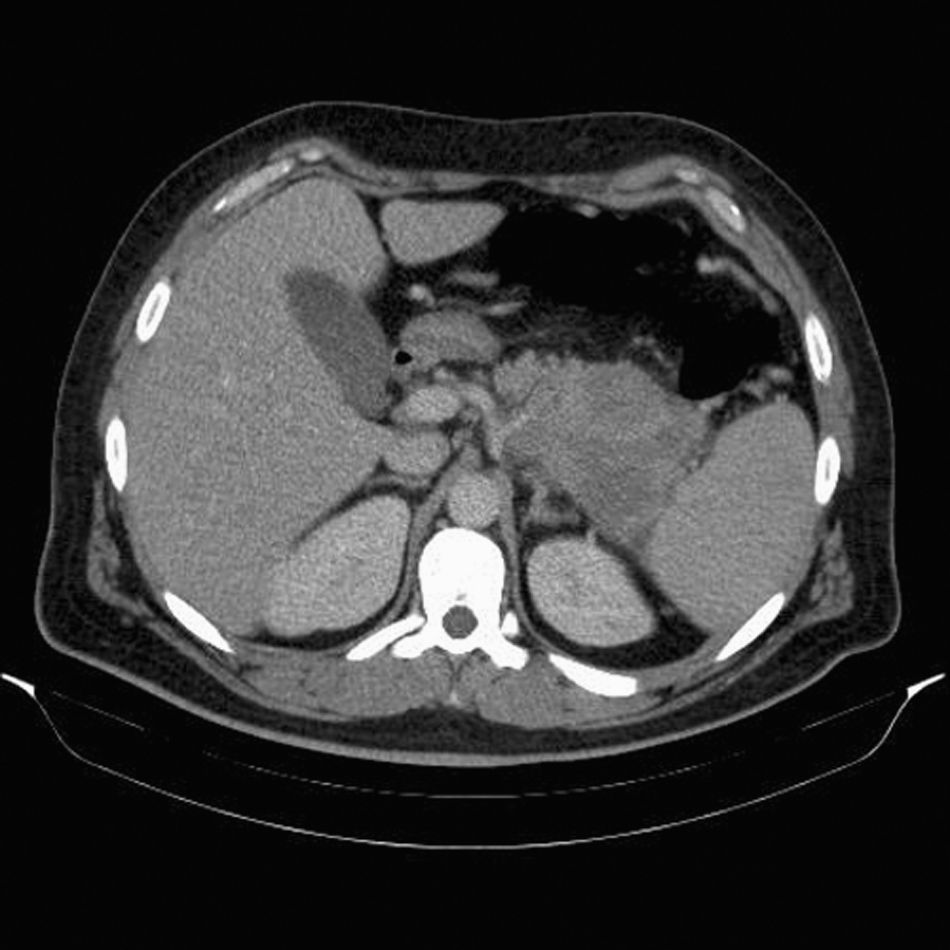
Se realizó además una tomografía computarizada (TC) toracoabdominopélvica en la que se aprecia una gran masa en el cuerpo y en la cola del páncreas que infiltra y obstruye los vasos esplénicos (arteria y vena esplénicas), lo que provoca esplenomegalia y circulación de derivación (fig. 1). La infiltración vascular se aprecia desde la salida de la arteria esplénica y del tronco celíaco. Se aprecia además una adenopatía en el ligamento gastrohepático de 16mm y adenopatías retroperitoneales de hasta 1cm. En la grasa mesentérica del vacío lumbar derecho se aprecia una masa de unos 43mm en relación con las asas de delgado que provoca reacción fibrosa perilesional (metástasis o tumor carcinoide). Se completa el estudio con una TC del cuello y del tórax donde se aprecian múltiples y grandes adenopatías de aspecto maligno de hasta 3cm en la cadena yugular izquierda. No se aprecian nódulos pulmonares.
Ante la presencia de adenopatías cervicales, se realiza también una ecografía de la cadena ganglionar cervical en la que se aprecian múltiples adenopatías laterocervicales de aspecto maligno y hay una de mayor tamaño, de hasta 3×3,7cm que muestra datos de necrosis en su interior.
Se realiza una biopsia quirúrgica de las adenopatías cervicales que viene informada como infiltración por linfoma T anaplásico de células grandes y alto índice proliferativo.
Ante la estabilidad clínica y analítica del paciente, se retiró la perfusión de pantoprazol y se reinició la tolerancia oral sin incidencias. El paciente no presentó nuevas exteriorizaciones hemorrágicas espontáneas ni requirió transfusiones sanguíneas. Posteriormente, pasó a planta de hospitalización convencional y una vez obtenido el resultado de la biopsia se trasladó al paciente al servicio de hematología para inicio de tratamiento quimioterápico.
DiscusiónLa oclusión de la vena esplénica es frecuentemente el resultado de una enfermedad pancreática. La etiología más común es la pancreatitis, pero el cáncer de páncreas y otras etiologías también pueden provocar oclusión de la vena esplénica1–6.
Cuando ocurre dicha trombosis, se desarrollan colaterales para llevar la sangre alrededor de la vena esplénica ocluida. El típico paso en el que se forman las varices gástricas aisladas es por las venas gástricas posteriores y cortas que en circunstancias normales drenan sangre del fundo gástrico a la vena esplénica. En el esófago distal, las colaterales portosistémicas conectan las venas gástricas cortas con el sistema ácigos. Las colaterales esplenoportales descomprimen las venas gástricas cortas a través de la vena coronaria al sistema portal y vía arcada gastroepiploica a la vena mesentérica superior. En ambos casos las venas gástricas cortas hipertensivas provocan aumento de la presión en las venas submucosas del fundo gástrico, lo que provoca las varices7.
A veces una vena gastroepiploica aumentada de tamaño hallada en una laparotomía es el único hallazgo de TVE oculta. Las varices esofágicas aisladas, aunque infrecuentes en la TVE, pueden ocurrir en casos en los que la vena coronaria se une a la vena esplénica proximal a la obstrucción. Esta variante anatómica se ha reportado en alrededor del 17% de los casos.
Al contrario que en la hipertensión portal (HTP) generalizada, en la TVE el flujo de la vena coronaria es hepatópeto en vez de hepatófugo.
El hecho de que esta HTP “localizada” provoque varices gástricas y no esofágicas se debe a que el flujo hepatópeto de la circulación portal permanece intacto.
Se pueden producir vías de formación de colaterales alternativas al descomprimir la vena esplénica. La vena gastroepiploica izquierda puede formar colaterales a la cólica izquierda y la vena mesentérica inferior8, lo que disminuye el flujo de la vena porta. En la HTP presinusoidal, sin embargo, hay una disminución paradójica en el tono arteriolar esplácnico que provoca un aumento del flujo portal que empeora el estado hipertensivo portal y contribuye a la circulación hiperdinámica asociada a la HTP presinusoidal9.
La prevalencia estimada de varices gástricas en pacientes con HTP está entre el 17 y el 20%10,11, con una incidencia anual en pacientes tratados por varices esofágicas de aproximadamente el 9%12. Cuando están presentes el riesgo de hemorragia está entre el 4 y el 65% a los 2 años10,11.
Los pacientes cirróticos pueden presentar hemorragia varicosa en ausencia de estigmas de hepatopatía crónica en un 15% de los casos13. Las varices gástricas aisladas pueden apreciarse en alrededor del 5% de los pacientes cirróticos y en alrededor del 10% de los pacientes con HTP no cirrótica14.
Y es que la HTP siniestra o izquierda causada por TVE puede ocasionar una hemorragia gastrointestinal masiva de las varices esofágicas o gástricas o de la gastropatía de la HTP.
Al contrario de los pacientes con HTP generalizada, la mayoría de los pacientes con TVE están asintomáticos y tienen una función hepática normal.
La TVE debe sospecharse en los siguientes grupos de pacientes:
- 1.
pacientes con una historia de pancreatitis y diagnóstico de hemorragia digestiva alta reciente;
- 2.
pacientes con esplenomegalia, pero sin HTP, cirrosis o enfermedad hematológica y,
- 3.
pacientes con varices gástricas aisladas8.
Por tanto, podemos concluir que la presencia de varices gástricas aisladas en la endoscopia de un paciente con hemorragia digestiva alta es indicación de que se debe investigar la presencia de TVE15. Sin embargo, como en nuestro paciente, las varices gástricas son frecuentemente difíciles de identificar por la habitual afectación de las venas gástricas cortas que discurren por la subserosa, bajo los pliegues mucosos engrosados. Por lo tanto, producen muy escasa deformidad mucosa y dilatación varicosa. Incluso en pacientes con cáncer avanzado de la cola pancreática rara vez las varices son detectadas.
Ku et al han propuesto que la oclusión vascular esplénica ocurre en varias fases16:
- a)
Fase 1: la vena esplénica se ocluye parcialmente y se desarrollan las varices gástricas y la esplenomegalia.
- b)
Fase 2: la lesión obstructiva ocluye completamente la vena esplénica, mientras que la arteria esplénica permanece intacta. El flujo colateral resultante aumenta las varices gástricas y la esplenomegalia.
- c)
Fase 3 (también llamada la fase de vanishing o de desvanecimiento): la oclusión de la arteria esplénica llega a imponerse a la obstrucción de la vena. Las varices gástricas consecuentemente aumentan y la esplenomegalia empieza a disminuir17.
Estas oclusiones vasculares pueden ocurrir por invasión directa del tumor o por compresión extrínseca de los vasos.
Por lo tanto, es importante recordar que la TVE no es un signo específico de malignidad, sino más frecuentemente resultado de la inflamación localizada secundaria a una pancreatitis. Sin embargo, en una arteriografía, el acúmulo de venas peripancreáticas o el crecimiento intravenoso del tumor son muy indicativos de malignidad y de irresecabilidad18,19.
La arteriografía mesentérica está considerada como la prueba gold standard para el diagnóstico de la TVE. Sin embargo, otras pruebas de imagen como la ecografía con Doppler color y la TC son frecuentemente diagnósticas22–25.
La resonancia magnética y la ecoendoscopia también son útiles para la evaluación de la vascularización peripancreática20–25.
Un tratamiento adecuado de la hemorragia de varices gástricas incluye el establecimiento del diagnóstico de la TVE y la búsqueda de enfermedad subyacente (tabla 1).
Causas frecuentes de trombosis de la vena esplénica
| Pancreatitis (el 56%, causa más frecuente) |
| Carcinoma de páncreas (el 9%, segunda causa más frecuente) |
| Iatrogénicas (esplenectomía, cateterización de la vena umbilical, resección gástrica o shunts portosistémicos) |
| Aneurismas de la arteria esplénica |
| Úlceras gástricas |
| Fibrosis retroperitoneal |
| Enfermedad de Hodgkin |
| Tumores retroperitoneales |
| Linfomas pancreáticos |
| Trasplante de páncreas |
| Idiopáticas o de origen desconocido |
La esplenectomía permanece como el medio más seguro de prevenir las recurrencias, sobre todo en los pacientes con alto requerimiento transfusional y que tienen una historia de episodios de hemorragia26.
Nuevos abordajes, como el uso de coils de Gianturco que reducen el flujo a través del parénquima esplénico, también se han usado con éxito como medida temporal o definitiva en pacientes con alto riesgo quirúrgico. La embolización de la arteria esplénica es menos deseable por el alto riesgo de formación de abscesos esplénicos.
En nuestro paciente el diagnóstico definitivo de la biopsia quirúrgica de la adenopatía cervical fue el de linfoma T anaplásico de células grandes. La mayoría de los linfomas pancreáticos son de tipo no hodgkiniano. Los linfomas de Hodgkin rara vez afectan a órganos extralinfáticos, mientras que los no hodgkinianos sí los afectan. De hecho, más del 25% de los linfomas no hodgkinianos se originan de órganos extralinfáticos de los que alrededor del 30% afectan al páncreas27.
El LPP es muy raro (menos del 1%)28. En una revisión de 207 casos de cáncer de páncreas sólo se encontraron 3 casos de linfoma pancreático29. Con punción-aspiración con aguja fina de 1.050 casos de lesiones pancreáticas, Volmar et al encontraron sólo 14 casos (1,3%)30. En la clínica el LPP es a menudo mal diagnosticado como un carcinoma de páncreas31.
En efecto, la presentación clínica del LPP puede ser difícil de distinguir del adenocarcinoma de páncreas sin un diagnóstico anatomopatológico definitivo. Si tan solo se tienen en cuenta los síntomas, las pruebas de imagen y los marcadores tumorales, en ausencia de un diagnóstico anatomopatológico de un sospechoso adenocarcinoma, se puede emitir un diagnóstico erróneo en una minoría de pacientes potencialmente curables. La apariencia de la masa en la TC puede ayudar a distinguir ambas entidades, pero no es definitivo32.
El Ca 19-9 es el marcador más útil en el adenocarcinoma, pero puede elevarse también en otras enfermedades malignas del tracto digestivo superior, ampulomas, colangiocarcinomas, cistodenocarcinomas mucinosos y también en el LPP33.
La mayoría de los casos de LPP requieren laparotomía exploradora para el diagnóstico, pero a veces ésta puede evitarse mediante la biopsia no operatoria y la nueva modalidad de tratamiento combinado. La punción con aguja fina del páncreas guiada radiológicamente es una técnica muy útil que requiere experiencia del radiólogo y de los citopatólogos para obtener un diagnóstico a partir de una pequeña cantidad de tejido3. La ultrasonografía endoscópica ha aumentado enormemente la sensibilidad del diagnóstico y la obtención de tejido34–39.
El diagnóstico de LPP puede ser extremadamente difícil al usar como única tinción la hematoxilina-eosina y puede imitar al carcinoma pobremente diferenciado y al sarcoma reticular40, por lo que el análisis inmunohistoquímico y la citometría de flujo son esenciales41.
Debe destacarse que el diagnóstico citológico puede no ser adecuado para el diagnóstico y caracterización de una masa abdominal, por lo que debe considerarse la biopsia tisular. Asimismo, en ocasiones puede requerirse la laparotomía para llegar al diagnóstico.
El tratamiento del LPP permanece controvertido. La mayoría de los pacientes reciben tratamiento con radioterapia y quimioterapia sin necesidad de cirugía. La literatura médica actual indica que esta opción de tratamiento da un pronóstico favorable comparable o mejor que el de las series quirúrgicas. La mayoría de las series recientes no recomiendan la cirugía a no ser que el diagnóstico por métodos no quirúrgicos no sea definitivo42–44.
Por otro lado, la cirugía en los LPP es difícil, porque suelen ser tumores grandes y habitualmente asociados a tejido pancreático normal, lo que conlleva un alto riesgo de fístula pancreática postoperatoria45.
El papel de la radioterapia es limitado y necesita consensuarse46. Su papel en linfomas de alto grado en estadios tempranos permanece controvertido. En los localizados de grado intermedio-avanzado, la quimioterapia con el régimen CHOP (ciclofosfamida, adriamicina, vincristina y prednisona) junto con radioterapia adyuvante se ha mostrado superior a la quimioterapia aislada47.
La quimioterapia intensiva sin radioterapia se ha mostrado asimismo superior al régimen CHOP más radioterapia48. En general, se aboga por usar un tratamiento multimodal con quimioterapia y radioterapia.
La sepsis biliar es un problema potencial del tratamiento multimodal en estos pacientes, debido a la frecuente presencia de prótesis biliares y por el riesgo de neutropenia. El reconocimiento precoz y el tratamiento de las complicaciones biliares es importante para permitir el tratamiento posterior49.
En resumen, el hallazgo de unas varices gástricas aisladas hace preceptivo descartar la presencia de TVE secundaria a enfermedad pancreática, en especial si hay síntomas asociados como el dolor abdominal o la alteración del metabolismo hidrocarbonado. Además de las causas más prevalentes (pancreatitis y adenocarcinoma pancreático) hay que pensar en otras etiologías, como el linfoma pancreático cuya forma de presentación en el caso descrito (hemorragia digestiva por varices gástricas) es de especial particularidad.