Describir la incidencia a los 2 años de nuevas enfermedades inflamatorias mediadas por inmunidad (espondiloartritis, uveítis, psoriasis) en la cohorte de pacientes con enfermedad inflamatoria intestinal (EII) del estudio AQUILES.
Material y métodosDurante un periodo de 2 años se siguieron 341 pacientes con EII (53% mujeres, edad media 40 años) diagnosticados de enfermedad de Crohn (60,5%), colitis ulcerosa (38,1%) y colitis indeterminada (1,4%). Los nuevos diagnósticos durante el seguimiento de los pacientes se basaron en los informes de los respectivos especialistas (reumatólogos, oftalmólogos y dermatólogos).
ResultadosSe establecieron 22 nuevos diagnósticos de enfermedades inflamatorias mediadas por inmunidad en 21 pacientes (incidencia acumulada: 6,5% [intervalo de confianza del 95% —IC 95%—: 3,7-9,2], tasa de incidencia: 26 casos por 10.000 pacientes-año). La mayoría de los diagnósticos fueron nuevos casos de espondiloartritis (n=15). La incidencia acumulada de nuevos diagnósticos de enfermedades inflamatorias mediadas por inmunidad fue similar en pacientes con enfermedad de Crohn (5,8%, IC 95%: 3,4-9,9) y en pacientes con colitis ulcerosa (7,7%, IC 95%: 4,2-13,6). En el análisis multivariable la incidencia de nuevas enfermedades inflamatorias mediadas por inmunidad se asoció a historia familiar de EII (odds ratio=3,6, IC 95%: 1,4-9,4) y a la presencia de manifestaciones extraintestinales de EII (odds ratio=1,8, IC 95%: 0,7-5,2).
ConclusionesEn pacientes con EII la incidencia de nuevas enfermedades inflamatorias mediadas por inmunidad a los 2 años de seguimiento fue del 6,5%, siendo más frecuentes en pacientes con manifestaciones extraintestinales de EII e historia familiar de EII.
To describe the 2-year incidence of new immune-mediated inflammatory diseases (spondylarthritis, uveitis, psoriasis) in the cohort of patients with inflammatory bowel disease (IBD) included in the AQUILES study.
Materials and methodsOver a 2-year period, 341 patients with IBD (53% women, mean age 40 years) diagnosed with Crohn's disease (60.5%), ulcerative colitis (38.1%) and indeterminate colitis (1.4%) were followed up. New diagnoses made during follow-up were based on reports of the corresponding specialists (rheumatologists, ophthalmologists, and dermatologists).
ResultsA total of 22 new diagnoses of immune-mediated inflammatory diseases were established in 21 patients (cumulative incidence of 6.5%, 95% confidence interval [CI] 3.7-9.2, incidence rate of 26 cases per 10,000 patient-years). Most diagnoses were new cases of spondylarthritis (n=15). The cumulative incidence of new diagnoses of immune-mediated inflammatory diseases was similar in patients with Crohn's disease (5.8%, 95% CI 3.4-9.9) and in patients with ulcerative colitis (7.7%, 95% CI 4.2-13.6). On multivariate analysis, the incidence of new immune-mediated inflammatory diseases was significantly associated with a family history of IBD (odds ratio=3.6, 95% CI 1.4-9.4) and the presence of extraintestinal manifestations of IBD (odds ratio=1.8, 95% CI .7-5.2).
ConclusionsIn patients with IBD, the incidence of new immune-mediated inflammatory diseases at 2 years of follow-up was 6.5%. These diseases were more frequent in patients with extraintestinal manifestations of IBD and a family history of IBD.
La enfermedad inflamatoria intestinal (EII) incluye un grupo de afecciones clínicamente heterogéneas con potencial de desarrollo de manifestaciones sistémicas1,2. El espectro clínico de dichas manifestaciones extraintestinales puede variar desde cuadros transitorios leves a lesiones muy graves, a veces más incapacitantes que la propia EII3. Por otra parte, la máxima expresividad de la EII puede no coincidir con la clínica de la enfermedad extraintestinal. Asimismo, el uso creciente de fármacos biológicos (anti-factor de necrosis tumoral [TNF] alfa) en la enfermedad de Crohn y en la colitis ulcerosa, aunque ha supuesto un cambio espectacular en el control y resultados terapéuticos de estas enfermedades, también ha alertado acerca de los efectos adversos a largo plazo, especialmente del riesgo de neoplasias malignas y linfoma4,5.
Globalmente, se ha descrito que entre un 30% y un 40% de los pacientes con EII desarrollan manifestaciones inflamatorias extraintestinales3,6, aunque durante el periodo de seguimiento, Veloso et al7., en un estudio prospectivo de 792 pacientes con EII, observaron un aumento de la probabilidad acumulada de desarrollar manifestaciones extraintestinales del 12% al 30% durante un seguimiento de 20 años. Un 5% a un 20% de pacientes con EII desarrollan enfermedades del aparato locomotor, incluyendo síndromes periféricos y axiales, generalmente formando parte del grupo de las espondiloartropatías seronegativas8,9. Alrededor de un 10% presentan alteraciones cutáneas (pioderma gangrenoso, psoriasis) que pueden ser específicas, reactivas o asociadas o inducidas por el tratamiento de la EII con corticoides y fármacos anti-TNFα10,11. Las manifestaciones oftalmológicas, principalmente en forma de episcleritis, escleritis y uveítis aparecen en torno al 12% de los pacientes con EII12–14.
Por otra parte, algunas enfermedades extraintestinales asociadas a la EII son realmente enfermedades inflamatorias con entidad propia, que pueden seguir su curso de forma independiente a la EII, por lo que se les ha denominado genéricamente «enfermedades inflamatorias mediadas por inmunidad» (EIMI)15,16. Un mejor conocimiento de la frecuencia y coexistencia de estas enfermedades es indispensable para desarrollar estrategias de detección precoz y enfoque terapéutico, frecuentemente multidisciplinar, de las mismas. En línea con este hecho el objetivo del estudio fue describir la incidencia de nuevas EIMI (espondiloartritis, psoriasis y uveítis) en la cohorte de pacientes con EII incluida en el estudio AQUILES a los 2 años de seguimiento.
Material y métodosEl estudio AQUILES se diseñó como un estudio observacional de 3 cohortes independientes de pacientes definidas por el diagnóstico de la enfermedad principal en el momento de su inclusión en el estudio. Dichas cohortes comprendían pacientes diagnosticados de EII, espondiloartritis y psoriasis. El estudio se llevó a cabo en 15 hospitales españoles, con la participación de los departamentos de gastroenterología, reumatología y dermatología en condiciones de la práctica clínica habitual. Los pacientes fueron incluidos en el estudio durante el periodo comprendido entre marzo de 2008 y diciembre de 2010. El protocolo fue aprobado por los comités de ética de los hospitales participantes y el estudio se efectuó cumpliendo con las normas de buenas prácticas clínicas. Los pacientes fueron incluidos en el estudio en función del diagnóstico principal efectuado por gastroenterólogos, reumatólogos o dermatólogos, y el seguimiento fue realizado por el mismo especialista que los incluyó en la cohorte. Los datos basales referidos a las 3 cohortes de pacientes han sido publicados previamente17–19.
El objetivo del presente estudio fue determinar la incidencia de nuevas EIMI (espondiloartritis, psoriasis y uveítis) a los 2 años de seguimiento en la cohorte de pacientes con EII. En esta cohorte se incluyeron pacientes adultos de 18 o más años de edad, en los que un especialista en enfermedades del aparato digestivo hubiera establecido el diagnóstico de EII, incluyendo enfermedad de Crohn, colitis ulcerosa o colitis indeterminada. El diagnóstico de EII podía haberse efectuado previamente (es decir, ya conocido en el pasado) o de novo en pacientes visitados por primera vez en la consulta de enfermedades del aparato digestivo de los hospitales participantes. Los pacientes que a juicio del investigador presentaban algún inconveniente que impidiera su seguimiento durante 2 años fueron excluidos de la cohorte. El seguimiento de los pacientes se realizó de forma completamente prospectiva por gastroenterólogos en las unidades de enfermedad inflamatoria intestinal de los centros participantes en el estudio, siguiendo un protocolo de recogida de datos consensuado por las 3 especialidades involucradas. No se realizó, no obstante, seguimiento multidisciplinar por otros especialistas, salvo en los pacientes que ya tenían diagnosticada alguna otra EIMI, y tampoco se realizaron pruebas protocolizadas de cribado para detectar estas enfermedades. Durante el seguimiento los nuevos diagnósticos de EIMI se basaron en los informes de los respectivos especialistas, oftalmólogos para la uveítis, dermatólogos para la psoriasis y reumatólogos para la espondiloartritis, a los que los pacientes fueron derivados en caso de presentar sintomatología.
Análisis estadísticoLas variables cualitativas se describen con su frecuencia absoluta y su porcentaje. Las variables continuas se presentan con la media y la desviación estándar (DE) o con la mediana y el rango intercuartílico (RIC) (percentiles 25 y 75) cuando no se ajustaban a una distribución normal. Las diferencias en la incidencia acumulada de manifestaciones extraintestinales en las distintas entidades de EII se analizaron con la prueba de Chi cuadrado (χ2). Se empleó un modelo de regresión logística para determinar las variables demográficas y clínicas que se asociaban de forma independiente a la incidencia de nuevas manifestaciones extraintestinales, presentándose la razón de razones (odds ratio [OR]) ajustada y los intervalos de confianza (IC) del 95%. La significación estadística se estableció con valor de p inferior a 0,05. Los resultados se analizaron con el paquete estadístico Statistical Package for the Social Sciences versión 15.0 para Windows.
ResultadosUn total de 341 pacientes realizaron el seguimiento de 2 años, mientras que 185 pacientes de los que se recogió información basal no fueron seguidos. Entre los pacientes seguidos había más pacientes con enfermedad de Crohn y con diagnóstico ya conocido de EII. Entre los no seguidos hubo más pacientes con colitis ulcerosa y con enfermedad de diagnóstico nuevo.
Entre los 341 pacientes con seguimiento de 2 años los diagnósticos de EII fueron enfermedad de Crohn (60,5%; n=206), colitis ulcerosa (38,1%; n=130) y colitis indeterminada (1,4%; n=5). La edad media fue 39,6 años (DE: 13,5). El 47% eran mujeres y el 53% varones. El 73% fueron pacientes con enfermedad ya conocida y el 27% nuevos diagnósticos de EII. La mediana de duración de la enfermedad de los pacientes con diagnóstico ya conocido fue 6,7 años (RIC: 2,7 a 11,8 años). El 16% tenía historia familiar de EII y el 15% presentó manifestaciones extraintestinales de EII. El 24,6% eran fumadores activos y el 29,6% exfumadores. Al inicio del seguimiento un 14,4% de los pacientes tenía otra EIMI (espondiloartritis un 10,6% de los casos, psoriasis un 3,5%, uveítis un 1,5% y pioderma gangrenoso un 0,6%) y los tratamientos basales que los pacientes estaban siguiendo eran los siguientes: aminosalicilatos (66,3%), corticoides (12,3%), inmunosupresores (41,9%), biológicos (17,9%) y antibióticos (1,8%).
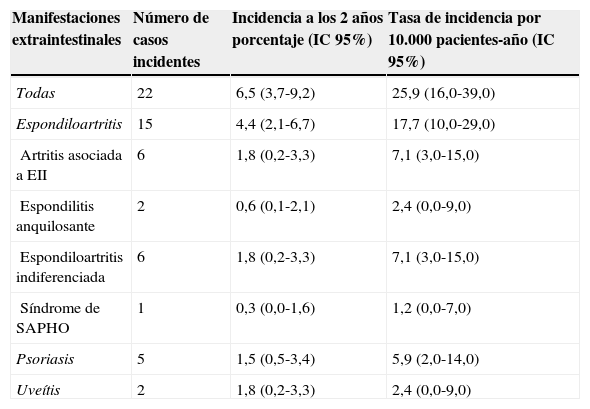
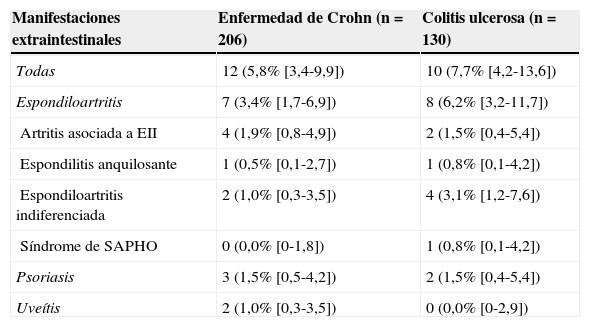
La media de seguimiento fue de 25 meses. Durante este periodo se observaron 22 nuevos diagnósticos de EIMI en 21 pacientes, con una incidencia acumulada del 6,5% (IC 95%: 3,7-9,2) y una tasa de incidencia de 26 casos por 10.000 pacientes-año (IC 95%: 16-39). La incidencia de cada entidad se detalla en la tabla 1; la mayoría fueron nuevos casos de espondiloartritis. Los 5 nuevos casos de psoriasis diagnosticados no estuvieron relacionados con el tratamiento con fármacos anti TNF-alfa. No hubo diferencias significativas en la incidencia de nuevas EIMI entre los pacientes con enfermedad de Crohn (incidencia acumulada 5,8%) y los pacientes con colitis ulcerosa (7,7%) (tabla 2).
Incidencia acumulada a los 2 años de seguimiento de nuevas enfermedades inflamatorias mediadas por inmunidad en la cohorte de pacientes con EII del estudio AQUILES
| Manifestaciones extraintestinales | Número de casos incidentes | Incidencia a los 2 años porcentaje (IC 95%) | Tasa de incidencia por 10.000 pacientes-año (IC 95%) |
|---|---|---|---|
| Todas | 22 | 6,5 (3,7-9,2) | 25,9 (16,0-39,0) |
| Espondiloartritis | 15 | 4,4 (2,1-6,7) | 17,7 (10,0-29,0) |
| Artritis asociada a EII | 6 | 1,8 (0,2-3,3) | 7,1 (3,0-15,0) |
| Espondilitis anquilosante | 2 | 0,6 (0,1-2,1) | 2,4 (0,0-9,0) |
| Espondiloartritis indiferenciada | 6 | 1,8 (0,2-3,3) | 7,1 (3,0-15,0) |
| Síndrome de SAPHO | 1 | 0,3 (0,0-1,6) | 1,2 (0,0-7,0) |
| Psoriasis | 5 | 1,5 (0,5-3,4) | 5,9 (2,0-14,0) |
| Uveítis | 2 | 1,8 (0,2-3,3) | 2,4 (0,0-9,0) |
No hubo nuevos diagnósticos de pioderma gangrenoso.
EII: enfermedad inflamatoria intestinal; SAPHO: sinovitis, acné, pustulosis, hiperostosis y osteítis.
Incidencia acumulada a los 2 años de seguimiento de nuevas enfermedades inflamatorias mediadas por inmunidad en pacientes con enfermedad de Crohn y colitis ulcerosa incluidos en la cohorte de pacientes con EII del estudio
| Manifestaciones extraintestinales | Enfermedad de Crohn (n=206) | Colitis ulcerosa (n=130) |
|---|---|---|
| Todas | 12 (5,8% [3,4-9,9]) | 10 (7,7% [4,2-13,6]) |
| Espondiloartritis | 7 (3,4% [1,7-6,9]) | 8 (6,2% [3,2-11,7]) |
| Artritis asociada a EII | 4 (1,9% [0,8-4,9]) | 2 (1,5% [0,4-5,4]) |
| Espondilitis anquilosante | 1 (0,5% [0,1-2,7]) | 1 (0,8% [0,1-4,2]) |
| Espondiloartritis indiferenciada | 2 (1,0% [0,3-3,5]) | 4 (3,1% [1,2-7,6]) |
| Síndrome de SAPHO | 0 (0,0% [0-1,8]) | 1 (0,8% [0,1-4,2]) |
| Psoriasis | 3 (1,5% [0,5-4,2]) | 2 (1,5% [0,4-5,4]) |
| Uveítis | 2 (1,0% [0,3-3,5]) | 0 (0,0% [0-2,9]) |
Porcentajes en paréntesis e IC 95% entre corchetes. Sin diferencias significativas en todas las comparaciones entre los grupos de enfermedad de Crohn y colitis ulcerosa.
SAPHO: sinovitis, acné, pustulosis, hiperostosis y osteítis.
La incidencia a los 2 años de nuevas EIMI fue similar en varones y mujeres, en pacientes con enfermedad previa o de nuevo diagnóstico, o con distinta duración de la enfermedad (<4, 4-8 y>8 años). Sin embargo, la incidencia fue superior en pacientes con enfermedad familiar de EII frente a aquellos sin historia familiar (15,7% vs. 4,8%, p=0,004), así como en pacientes con otras manifestaciones extraintestinales en comparación con pacientes sin otras manifestaciones extraintestinales (11,5% vs. 5,2%, p=0,080). Además, los pacientes no fumadores desarrollaron nuevas enfermedades inflamatorias mediadas por inmunidad con menos frecuencia (1,2%) que los ex-fumadores (8,9%) y fumadores actuales (71%) (p=0,077). La incidencia en pacientes con o sin otra enfermedad inflamatoria mediada por inmunidad al inicio del seguimiento fue del 10,2% y 5,5%, respectivamente (p=0,203). No se observaron diferencias en la incidencia de nuevas EIMI en pacientes tratados o no con aminosalicilatos, inmunosupresores o biológicos.
En el análisis multivariable que incluyó edad, sexo, historia familiar de enfermedad, duración de la enfermedad, la presencia de manifestaciones extra-intestinales asociadas a la EII, y las 2 enfermedades de base (enfermedad de Crohn y colitis ulcerosa) los factores predictivos independientes de desarrollo de nuevas enfermedades mediadas por inmunidad fueron la historia familiar de EII (OR=3,6; IC 95%: 1,4-9,4) y la presencia de manifestaciones extraintestinales de EII (OR=1,8; IC 95%: 0,7-5,2).
DiscusiónLos resultados obtenidos a los 2 años de seguimiento en una cohorte de 341 pacientes con EII demuestran la posibilidad de aparición de nuevas enfermedades inflamatorias mediadas por inmunidad (espondiloartritis, psoriasis, uveítis) durante el curso de la enfermedad, con una incidencia acumulada del 6,5%.
Cabe destacar que la espondiloartritis en general fue la EIMI más frecuente a lo largo de los 2 años de seguimiento de los pacientes con EII, con una incidencia acumulada del 4,4%. Los síntomas músculo-esqueléticos son manifestaciones extraintestinales frecuentes en pacientes con EII. La artropatía relacionada con la EII comprende un grupo de artritis inflamatorias, entre las que se incluyen la espondilitis anquilosante, artritis reactiva, artritis psoriásica y espondiloartritis indiferenciada20. Recientemente, un panel de expertos italianos ha desarrollado un algoritmo terapéutico en el que se integran los diferentes escenarios clínicos de las espondiloartritis asociadas a la EII21. La prevalencia de manifestaciones reumáticas en pacientes con EII suele oscilar del 30% al 40%22,23, siendo similar en pacientes con enfermedad de Crohn y colitis ulcerosa. Asimismo, los síntomas esqueléticos tienen una importante repercusión en la calidad de vida de los pacientes (incluyendo la incapacidad laboral)24.
Nuestro estudio aporta datos respecto a la tasas de incidencia de las diferentes entidades de espondiloartritis en pacientes con EII a lo largo del seguimiento. No se observaron diferencias significativas en la distribución de dichas enfermedades entre los grupos de pacientes con enfermedad de Crohn y colitis ulcerosa, aunque los pacientes con colitis ulcerosa presentaron una mayor frecuencia de espondiloartritis indiferenciada, y los pacientes con enfermedad de Crohn una mayor incidencia de artritis asociada a EII.
Los nuevos diagnósticos de uveítis y psoriasis fueron infrecuentes, con tasas de incidencia acumulada del 1,8% y 1,5%, respectivamente. En contraste con la uveítis asociada a la espondiloartritis, que suele ser anterior, unilateral, de comienzo brusco y duración limitada, los pacientes con EII frecuentemente presentan uveítis bilateral, posterior, de inicio insidioso y evolución crónica25. En este sentido, la estrecha colaboración entre oftalmólogos y gastroenterólogos es clínicamente relevante respecto al pronóstico a largo plazo de la uveítis. Sin embargo, no hay consenso con respecto a la necesidad de cribado rutinario o si es conveniente efectuar una exploración oftalmoscópica de forma sistemática en pacientes con EII. En nuestro estudio es posible que algunos brotes leves de uveítis subclínicos o asintomáticos hayan pasado desapercibidos, por lo que la incidencia acumulada de uveítis a los 2 años podría haber estado infravalorada.
La psoriasis se ha descrito como EMI que puede coexistir con la EII y como complicación asociada al tratamiento anti-TNFα26,27. Conviene aconsejar a los pacientes para acudir al dermatólogo ante la presencia de alteraciones cutáneas, incluso si son de carácter leve. En nuestra serie no observamos ningún caso de aparición de novo de pioderma gangrenoso, una de las enfermedades cutáneas más frecuentes en pacientes con EII28,29. Se ha descrito que el sexo femenino, el diagnóstico de enfermedad de Crohn, la edad joven en el momento del diagnóstico de EII y la presencia concomitante de otras enfermedades inflamatorias mediadas por inmunidad son factores predictores de pioderma gangrenoso y eritema nudoso en pacientes con EII30.
Como limitaciones del presente estudio es importante destacar que los diagnósticos de nuevas EIMI se realizaron a través de los informes de los especialistas, y que no se había establecido un protocolo previo de búsqueda activa de dichas enfermedades mediante pruebas diagnósticas adicionales para todos los pacientes, sino solo cuando el paciente presentaba signos sugestivos de enfermedad. Asimismo, aunque los pacientes eran atendidos en condiciones de práctica clínica, todos ellos pertenecían al entorno hospitalario, por lo que podrían no ser representativos de la población general de pacientes con EII. Finalmente, 185 pacientes no fueron seguidos en el estudio. Si bien los motivos de no seguimiento no se recogieron en el estudio, la información recogida indica un mayor porcentaje de nuevos diagnósticos de EII y de colitis ulcerosa que hicieron su seguimiento posterior en consultas ambulatorias y no en el hospital, lo que refuerza el argumento de que los datos obtenidos son representativos de una población hospitalaria, pero no del universo de pacientes con EII.
En conclusión, los pacientes con EII (sin preferencia entre los afectos de enfermedad de Crohn o colitis ulcerosa) pueden desarrollar enfermedades inflamatorias mediadas por inmunidad, especialmente espondiloartritis, durante el curso crónico de su enfermedad de base. Ello determina un perfil clínico con expresividad en diferentes órganos y aparatos, lo que obliga a un enfoque integral en el diagnóstico y tratamiento del paciente con EII.
FinanciaciónEl estudio AQUILES fue financiado por Merck Sharp & Dohme de España.
Conflicto de interesesCristina Romero, Berta Juliá y Luis Cea-Calvo son empleados a tiempo completo en Merck Sharp & Dohme de España. Los autores del manuscrito fueron también investigadores del estudio y ellos o su institución recibieron una remuneración como investigadores por la inclusión de pacientes en el estudio. Ignacio Marín-Jiménez y Rosario García-Vicuña declaran haber recibido honorarios en concepto de asesoría o por presentaciones en actividades educativas. El resto de autores declara no tener conflicto de intereses.
Agradecemos a los investigadores su colaboración en la inclusión y seguimiento de los pacientes del estudio. El análisis estadístico fue realizado por Cristina Fernández Pérez (Alalás, S.A.) y la redacción del manuscrito contó con la colaboración de la Dra. Marta Pulido y Content Ed Net Communications, Madrid.