La triple terapia con telaprevir o boceprevir ha resultado efectiva en el tratamiento de la hepatitis C crónica, con porcentajes de respuesta de hasta el 88%. Se asocia a importantes efectos adversos y supone un alto impacto económico.
ObjetivoValorar el coste-efectividad y la seguridad de telaprevir y boceprevir.
MétodosEstudio observacional retrospectivo. Se incluyó a pacientes que iniciaron tratamiento con inhibidores de proteasa antes del 31 de julio del 2013. Se valoraron la respuesta virológica sostenida, el coste por paciente curado y el coste de las medidas para el manejo de los efectos adversos.
ResultadosSe incluyó a 59 pacientes, 35 con telaprevir (59,3%) y 24 con boceprevir (40,7%). Obtuvieron respuesta virológica sostenida 38 (64,4%) pacientes, 24 (68,6%) con telaprevir y 14 (58,3%) con boceprevir. El coste por paciente curado fue 43.555 € (IC del 95%, 35.389-51.722 €), sin diferencias significativas entre telaprevir, 43.494 € (IC del 95%, 34.795 €-55.092 €), y boceprevir, 42.005 € (IC del 95%, 32.122-64.243 €). El coste medio por paciente del manejo de los efectos adversos supuso 1.500 €, con un máximo 11.374 €. Para el tratamiento de los efectos adversos requirieron ingreso hospitalario 8 (13,6%) pacientes, visitas a Urgencias 22 (37,3%) pacientes y visitas médicas adicionales 26 (44,1%) pacientes.
ConclusionesEl tratamiento con triple terapia basada en telaprevir o boceprevir ha supuesto un alto coste por paciente curado. Los efectos adversos desarrollados han requerido que un alto número de pacientes necesiten medidas de soporte, cuyo coste hay que añadir al del tratamiento con triple terapia.
Triple therapy with telaprevir or boceprevir has proven to be effective in the treatment of chronic hepatitis C with response rates of up to 88%. However, the treatment may be associated with important adverse effects and a high economic impact.
ObjectiveTo assess the cost-effectiveness and safety of triple therapy with telaprevir or boceprevir for the treatment of chronic hepatitis C.
MethodsRetrospective observational study. We included all patients who had started treatment with protease inhibitors before July 31st, 2013. We evaluated sustained virological response, the cost per patient achieving sustained virological response, and the cost of the supportive treatment for adverse events associated with triple therapy.
ResultsFifty-nine patients were included; 35 had been treated with telaprevir (59.3%) and 24 with boceprevir (40.7%). Sustained virological response was achieved by 38 (64.4%) patients: 24 (68.6%) patients in the telaprevir treatment arm and 14 (58.3%) patients in the boceprevir treatment arm. The cost per patient with sustained virological response was 43,555 € (95% CI 35,389-51,722 €). There were no statistically significant differences between the overall costs of therapy with telaprevir, 43,494 € (95% CI 34,795 €-55,092 €) versus boceprevir, 42,005 € (95% CI 32,122-64,243€). The mean cost of supportive care per patient was 1,500 €, while the maximum cost was 11,374 €. Due to adverse events, 8 (13.6%) patients required hospital admission, 22 (37.3%) patients attended the accident and emergency department, and 26 (44.1%) patients needed additional medical consultations.
ConclusionsThe treatment of triple therapy with telaprevir or boceprevir resulted in high cost per patient with sustained virological response. Due to adverse events, a high number of patients required supportive care, whose costs should be added to those of triple therapy.
La infección por el virus de la hepatitis C (VHC) es una de las principales causas de enfermedad hepática crónica. Se estima que en el mundo aproximadamente 160 millones de personas tienen infección crónica por el VHC1.
El VHC es un virus ARN caracterizado por la alta heterogeneidad de su secuencia. Se han descrito 7 genotipos, del 1 al 7, y un gran número de subtipos2. El genotipo 1 es el más prevalente, con una mayor proporción del genotipo 1b en Europa y 1a en Estados Unidos o Canadá3.
La hepatitis C aguda raramente es grave y sus síntomas se manifiestan entre el 10 y el 50% de los casos4. La progresión a infección crónica o persistente ocurre aproximadamente en 3 cuartas partes de los casos. Si no mejora, la hepatitis C crónica progresa a cirrosis en varias décadas; de media del 10 al 20% de los pacientes desarrollan cirrosis en los 20-30 años de infección5. El riesgo de desarrollar hepatocarcinoma es entre el 1 y el 5% anual en los enfermos que presentan cirrosis. Los pacientes diagnosticados de hepatocarcinoma presentan un alto riesgo de mortalidad, que llega a ser el 33% en el primer año tras el diagnóstico6.
El objetivo principal de la terapia frente al VHC es curar la infección, que está generalmente asociada con la resolución de la enfermedad hepática en pacientes que no han desarrollado cirrosis. Los pacientes cirróticos siguen en riesgo de desarrollar complicaciones que amenazan su vida, aunque a un ritmo menor cuando la infección viral se ha erradicado. La obtención de respuesta virológica sostenida (RVS), definida como ARN del VHC indetectable 24 semanas tras la finalización del tratamiento, supone la curación mantenida en el 99% de los pacientes7.
En el año 2011 fueron autorizados 2 inhibidores de proteasa de primera generación, telaprevir y boceprevir, para el tratamiento de la infección del VHC genotipo 1. Estos 2 fármacos son antivirales de acción directa de primera generación, cuya diana es la serín proteasa NS3/4A. Ambos se utilizan en combinación con peginterferón alfa y ribavirina8. Estos regímenes con triple terapia han resultado efectivos en pacientes que nunca han sido tratados previamente, y en los ya tratados, incluso en aquellos que habían tenido respuesta nula a la doble terapia con peginterferón y ribavirina. En los ensayos pivotales las RVS alcanzadas en pacientes naïve eran del 63-66% en el caso de boceprevir9 y hasta el 75% en el de telaprevir10,11. Los pacientes infectados por VHC genotipo 1 sin respuesta al tratamiento previo con doble terapia, la triple terapia con telaprevir o boceprevir consigue porcentajes de RVS de entre el 29 y el 88%11,12.
La triple terapia puede asociarse a ciertos efectos indeseables, como el exantema (telaprevir), que hasta en un 5% de los casos puede ser grave, la anemia (telaprevir y boceprevir) o disgeusia (boceprevir)13. En los estudios pivotales de telaprevir y boceprevir, más de un tercio de los pacientes desarrollaron anemia (hemoglobina < 10g/dL), con proporciones que variaban del 29 al 49%9-12,14.
El coste previsto del tratamiento con la triple terapia se estimó entre 29.929 y 30.468 € con telaprevir, y de 23.831 a 26.004 € con boceprevir, según el tipo de paciente (naïve o pretratado)15. Ambos fármacos se han considerado coste-efectivos por diversos autores e instituciones15,16, aunque la información del coste en su utilización en la práctica clínica real es limitada.
Por otra parte, la incorporación reciente en la práctica clínica en España de nuevos antivirales de acción directa, como sofosbuvir, simeprevir o daclatasvir, así como las combinaciones de ledispavir/sofosbuvir o ombitasvir/paritaprevir/ritonavir con o sin dasabuvir, ofrece una alternativa para el tratamiento con regímenes libres de interferón. Han mostrado alta efectividad con menor número y gravedad de efectos secundarios17. También se prevé que se incremente de forma significativa el coste, aunque los datos publicados muestran que se trata de tratamientos coste-efectivos18.
El objetivo principal del presente estudio es valorar el coste-efectividad de la triple terapia con telaprevir o boceprevir en el tratamiento de los pacientes con hepatitis C crónica en la práctica clínica real. Los objetivos secundarios son evaluar la efectividad y la toxicidad del tratamiento, así como las medidas para necesarias para el manejo de los efectos adversos y sus costes.
Se espera que los resultados de efectividad y toxicidad del estudio no difieran significativamente de los publicados en los ensayos clínicos. Los costes de los tratamientos farmacológicos deberían ser similares tanto si se utiliza telaprevir como boceprevir.
Material y métodosEstudio observacional retrospectivo, desarrollado entre marzo del 2012 y diciembre del 2014. El ámbito del estudio fue la consulta de hepatitis víricas del Servicio de Aparato Digestivo del Hospital General Universitario Gregorio Marañón.
Se incluyó a los pacientes monoinfectados por el VHC que iniciaron tratamiento antes del 31 de julio del 2013 con triple terapia, basada en boceprevir o telaprevir, para el tratamiento de la hepatitis C crónica. Para el acceso a los datos de las historias clínicas se siguieron los protocolos establecidos por el centro sanitario. La decisión de utilizar uno u otro inhibidor de la proteasa se hizo de acuerdo con el criterio del médico prescriptor.
Se registraron en una base de datos Excel variables demográficas (fecha de nacimiento, sexo, peso), farmacoterapéuticas (fecha de inicio del tratamiento, inhibidor de la proteasa utilizado, tipo de interferón pegilado, dosis de ribavirina inicial, duración del tratamiento, motivo de la suspensión, tipo de paciente en relación con la respuesta previa a biterapia), analíticas (nivel de hemoglobina, neutrófilos y plaquetas al inicio del tratamiento, polimorfismo de la interleucina 28B) y variables relacionadas con la hepatitis (carga viral inicial, clasificación del grado fibrosis, valor del fibroscan al inicio del tratamiento).
Las variables seleccionadas para evaluar la efectividad del tratamiento fueron la respuesta virológica al final del tratamiento, la respuesta virológica 12 semanas postratamiento y la RVS. La respuesta se define como la presencia de ARN del VHC indetectable y se evaluó en cada uno de los momentos definidos: final del tratamiento, 12 y 24 semanas postratamiento, respectivamente.
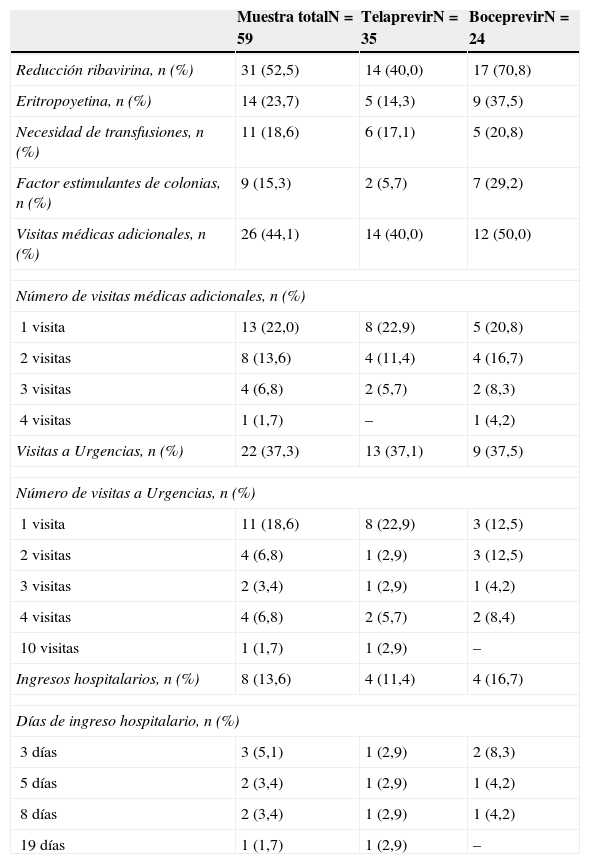
Las variables seleccionadas para evaluar la seguridad fueron presencia y grado de anemia, neutropenia, trombocitopenia y exantema. Además, se registraron las medidas de soporte necesarias para el manejo de los efectos adversos: reducción de la dosis de ribavirina, uso de eritropoyetina y de factores estimulantes de colonias, necesidad de transfusiones de concentrados de hematíes, visitas a Urgencias, ingresos hospitalarios y visitas médicas adicionales.
El cálculo de los costes de los tratamientos farmacológicos se realizó a partir de las dispensaciones registradas en el programa de pacientes externos y el precio unitario de compra del medicamento. Este precio unitario incluía el 4% de IVA y resultaba de aplicar el descuento del 7,5%, del Real Decreto Ley 8/2010, y los descuentos oficiales al precio financiado de compra del medicamento. Se calculó el coste medio por paciente curado a partir del coste medio del tratamiento con triple terapia. Para ello se multiplicó este coste por el número de pacientes a tratar para que uno alcance RVS.
Se calculó el coste medio por paciente del manejo de efectos adversos. Para ello se tuvieron en cuenta los costes de las siguientes medidas: transfusiones de concentrados de hematíes, visitas a Urgencias, ingresos hospitalarios, visitas médicas adicionales, y los tratamientos farmacológicos de soporte (factores estimulantes de la eritropoyesis y factores estimulantes de colonias). El coste del concentrado de hematíes, de cada visita a Urgencias, de la consulta médica adicional y el de la estancia media de hospitalización fueron facilitados por el Departamento de Contabilidad de nuestro centro.
Las variables presentadas se estudiaron en la muestra global y fueron estratificadas según el tipo de inhibidor de proteasa utilizado (telaprevir o boceprevir). Las variables cualitativas se expresan como número de casos (N) y/o proporciones (%). Para las variables cuantitativas con distribución normal se utiliza la media ± desviación estándar (DE) y para aquellas que no tenían distribución normal, la mediana y el rango intercuartil (RIC). Se comprobó que las variables seguían una distribución normal mediante el test de Kolmogorov-Smirnov.
El tamaño muestral resultó del total de pacientes que habían sido tratados con telaprevir o boceprevir en nuestro centro y que habían iniciado el tratamiento antes del 31 de julio del 2013, de forma que en el momento del análisis de los datos, todos los pacientes habían cumplido 24 semanas postratamiento.
El análisis estadístico se realizó con el programa SPSS versión 18.
ResultadosSe incluyeron a 59 pacientes, 43 (72,9%) hombres y 16 (27,1%) mujeres. La edad media ± DE fue de 55,6 ± 8,2 años.
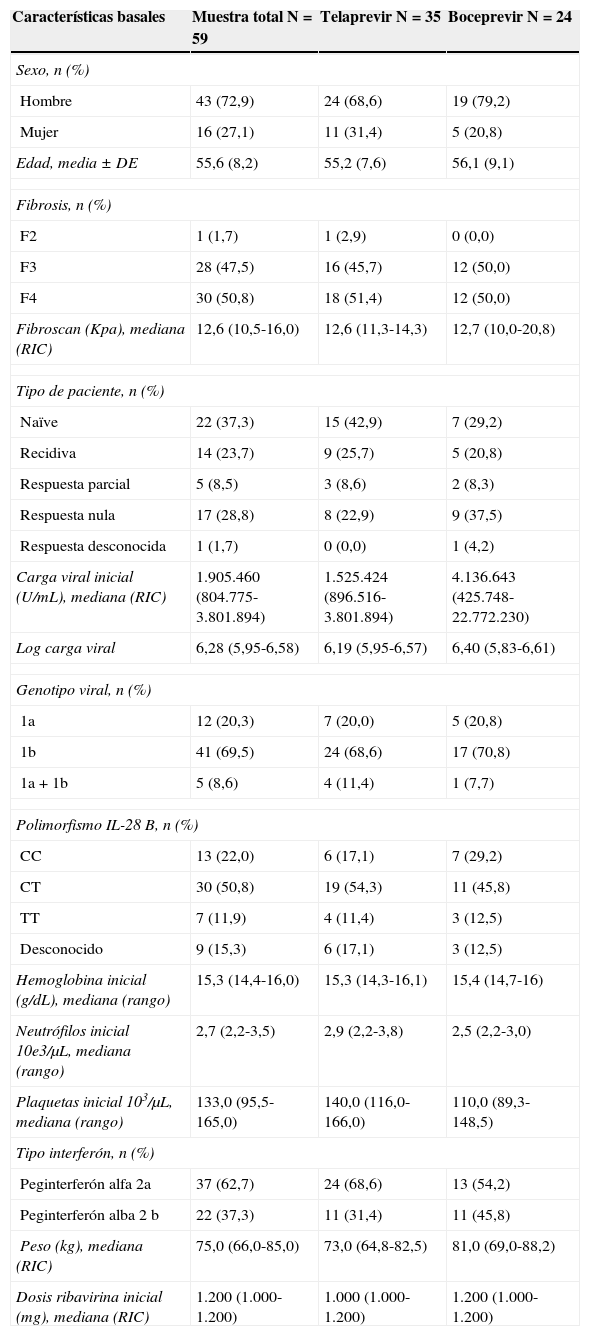
Se utilizó telaprevir en 35 (59,3%) pacientes y boceprevir en 24 (40,7%). El nivel de plaquetas y neutrófilos al inicio del tratamiento era inferior en el grupo de pacientes con boceprevir comparado con el de telaprevir. Las características demográficas, de la enfermedad y relacionadas con el virus, los datos iniciales de laboratorio y del tratamiento prescrito, en la muestra total y por tipo de inhibidor de la proteasa, se presentan en la tabla 1.
Características de los participantes del estudio, en la muestra total y en los grupos con telaprevir y boceprevir
| Características basales | Muestra total N=59 | Telaprevir N=35 | Boceprevir N=24 |
|---|---|---|---|
| Sexo, n (%) | |||
| Hombre | 43 (72,9) | 24 (68,6) | 19 (79,2) |
| Mujer | 16 (27,1) | 11 (31,4) | 5 (20,8) |
| Edad, media ± DE | 55,6 (8,2) | 55,2 (7,6) | 56,1 (9,1) |
| Fibrosis, n (%) | |||
| F2 | 1 (1,7) | 1 (2,9) | 0 (0,0) |
| F3 | 28 (47,5) | 16 (45,7) | 12 (50,0) |
| F4 | 30 (50,8) | 18 (51,4) | 12 (50,0) |
| Fibroscan (Kpa), mediana (RIC) | 12,6 (10,5-16,0) | 12,6 (11,3-14,3) | 12,7 (10,0-20,8) |
| Tipo de paciente, n (%) | |||
| Naïve | 22 (37,3) | 15 (42,9) | 7 (29,2) |
| Recidiva | 14 (23,7) | 9 (25,7) | 5 (20,8) |
| Respuesta parcial | 5 (8,5) | 3 (8,6) | 2 (8,3) |
| Respuesta nula | 17 (28,8) | 8 (22,9) | 9 (37,5) |
| Respuesta desconocida | 1 (1,7) | 0 (0,0) | 1 (4,2) |
| Carga viral inicial (U/mL), mediana (RIC) | 1.905.460 (804.775-3.801.894) | 1.525.424 (896.516-3.801.894) | 4.136.643 (425.748-22.772.230) |
| Log carga viral | 6,28 (5,95-6,58) | 6,19 (5,95-6,57) | 6,40 (5,83-6,61) |
| Genotipo viral, n (%) | |||
| 1a | 12 (20,3) | 7 (20,0) | 5 (20,8) |
| 1b | 41 (69,5) | 24 (68,6) | 17 (70,8) |
| 1a+1b | 5 (8,6) | 4 (11,4) | 1 (7,7) |
| Polimorfismo IL-28 B, n (%) | |||
| CC | 13 (22,0) | 6 (17,1) | 7 (29,2) |
| CT | 30 (50,8) | 19 (54,3) | 11 (45,8) |
| TT | 7 (11,9) | 4 (11,4) | 3 (12,5) |
| Desconocido | 9 (15,3) | 6 (17,1) | 3 (12,5) |
| Hemoglobina inicial (g/dL), mediana (rango) | 15,3 (14,4-16,0) | 15,3 (14,3-16,1) | 15,4 (14,7-16) |
| Neutrófilos inicial 10e3/μL, mediana (rango) | 2,7 (2,2-3,5) | 2,9 (2,2-3,8) | 2,5 (2,2-3,0) |
| Plaquetas inicial 103/μL, mediana (rango) | 133,0 (95,5-165,0) | 140,0 (116,0-166,0) | 110,0 (89,3-148,5) |
| Tipo interferón, n (%) | |||
| Peginterferón alfa 2a | 37 (62,7) | 24 (68,6) | 13 (54,2) |
| Peginterferón alba 2 b | 22 (37,3) | 11 (31,4) | 11 (45,8) |
| Peso (kg), mediana (RIC) | 75,0 (66,0-85,0) | 73,0 (64,8-82,5) | 81,0 (69,0-88,2) |
| Dosis ribavirina inicial (mg), mediana (RIC) | 1.200 (1.000-1.200) | 1.000 (1.000-1.200) | 1.200 (1.000-1.200) |
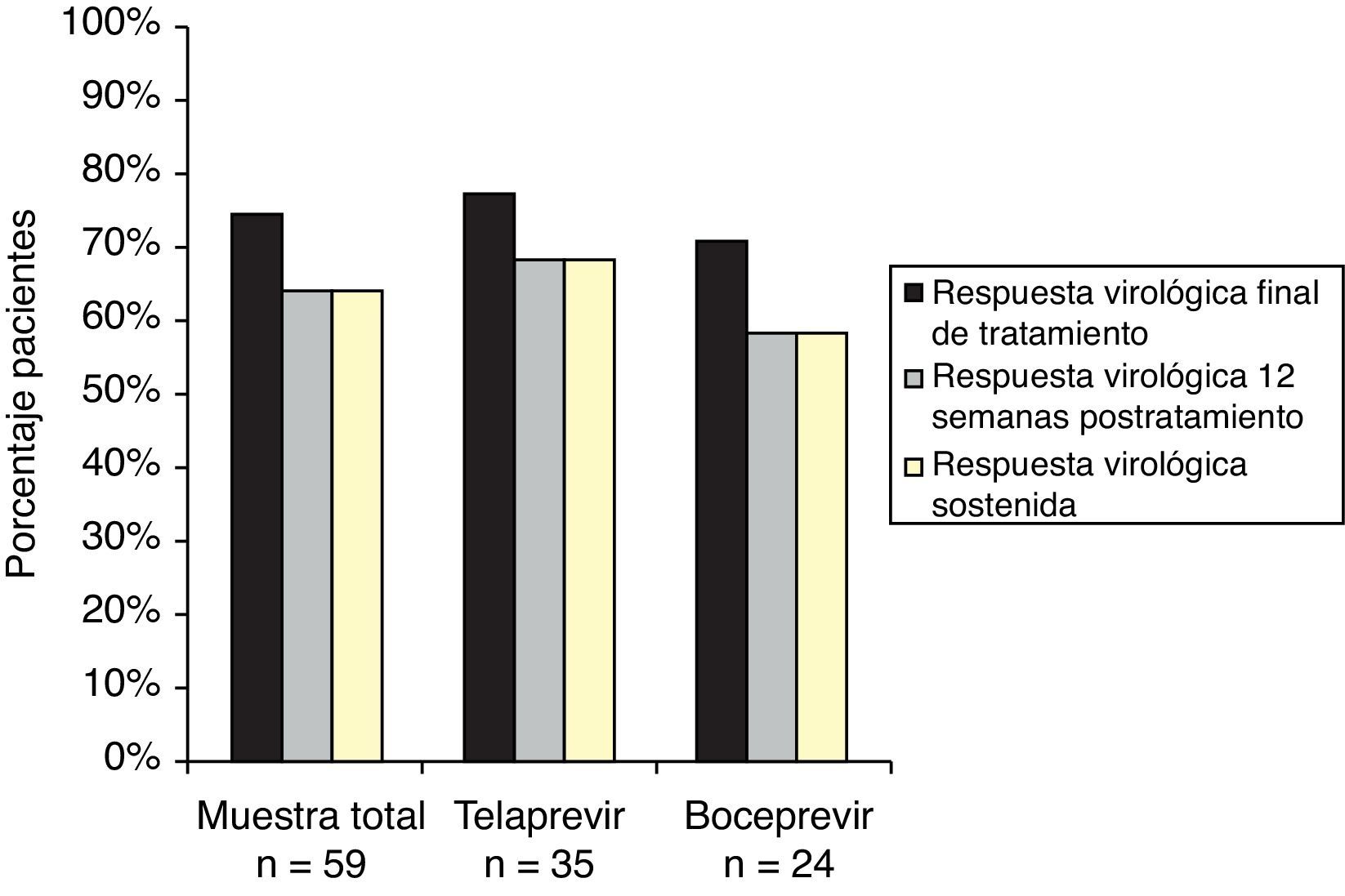
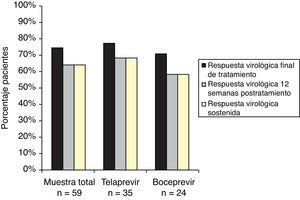
Al final de tratamiento 44 (74,6%) pacientes tuvieron respuesta virológica, 27 (77,1%) con telaprevir y 17 (70,8%) con boceprevir. Todos los pacientes, 38 (64,4%, IC del 95%, 52,2-76,6), que tuvieron respuesta virológica a las 12 semanas postratamiento también alcanzaron la RVS. En el grupo de telaprevir, 24 (68,6%, IC del 95%, 53,2-84,0) pacientes alcanzaron la RVS, y en el de boceprevir, 14 (58,3%, IC del 95%, 38,6-78,1) (fig. 1).
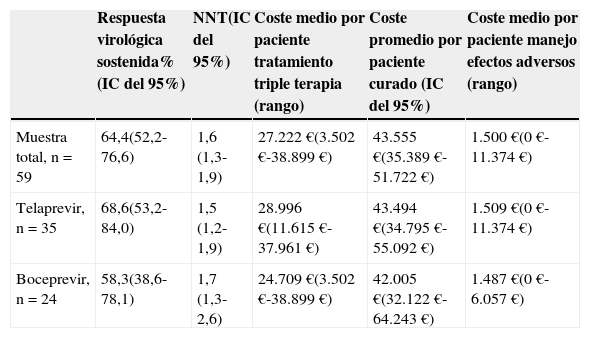
El coste medio por paciente tratado fue 27.222 €, el valor mínimo 3.502 € y el máximo 38.899 €. En el grupo con telaprevir cada paciente costó una media de 28.996 € (mínimo 11.615 €, máximo 37.961 €), mientras que en el de boceprevir 24.709 € (mínimo 3.502 €, máximo 38.899 €).
En la muestra total el coste medio por paciente curado fue 43.555 € (IC del 95%, 35.389-51.722 €). En el grupo con telaprevir, el coste medio por paciente curado ascendió a 43.494 € (IC del 95%, 34.795 €-55.092 €), mientras que en el grupo con boceprevir fue 42.005 € (IC del 95%, 32.122 €- 64.243 €). El coste medio por paciente del manejo de los efectos adversos fue 1.500 €, con un máximo 11.374 €: mientras que con telaprevir resultó 1.509 € (máximo 11.374 €), con boceprevir fue 1.487 € (máximo 6.057 €). Los números necesarios de pacientes a tratar, junto con los costes para cada uno de los fármacos, se presentan en la tabla 2.
Número necesario de pacientes a tratar para que uno alcance respuesta virológica sostenida y coste por cada paciente curado en la muestra total, grupo de telaprevir y boceprevir
| Respuesta virológica sostenida% (IC del 95%) | NNT(IC del 95%) | Coste medio por paciente tratamiento triple terapia (rango) | Coste promedio por paciente curado (IC del 95%) | Coste medio por paciente manejo efectos adversos (rango) | |
|---|---|---|---|---|---|
| Muestra total, n=59 | 64,4(52,2-76,6) | 1,6 (1,3-1,9) | 27.222 €(3.502 €-38.899 €) | 43.555 €(35.389 €-51.722 €) | 1.500 €(0 €-11.374 €) |
| Telaprevir, n=35 | 68,6(53,2-84,0) | 1,5 (1,2-1,9) | 28.996 €(11.615 €-37.961 €) | 43.494 €(34.795 €-55.092 €) | 1.509 €(0 €-11.374 €) |
| Boceprevir, n=24 | 58,3(38,6-78,1) | 1,7 (1,3-2,6) | 24.709 €(3.502 €-38.899 €) | 42.005 €(32.122 €-64.243 €) | 1.487 €(0 €-6.057 €) |
NNT: número necesario de pacientes a tratar.
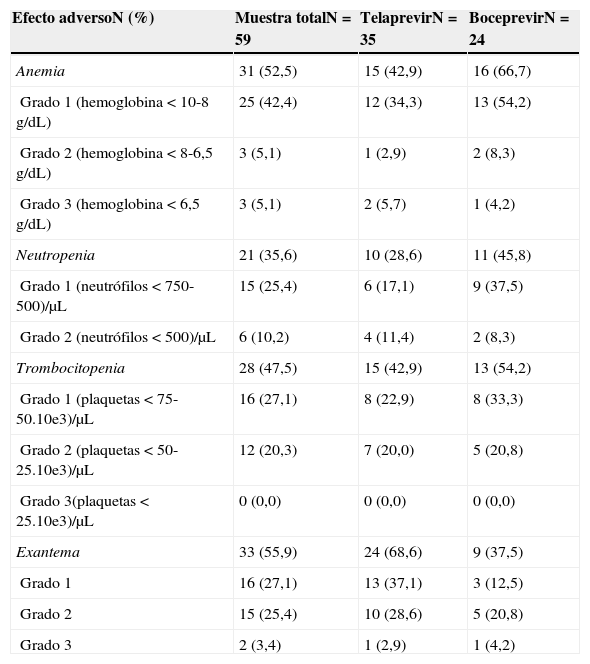
Los efectos adversos más frecuentes fueron el exantema y la anemia. La presencia de exantema estuvo presente en 24 (69,6%) de los pacientes tratados con telaprevir y en 9 (37,5%) de los de boceprevir. Desarrollaron anemia 16 (66,7%) pacientes con boceprevir y 15 (42,9%) pacientes con telaprevir. La presencia y los grados de anemia, neutropenia, trombocitopenia y exantema se presentan en la tabla 3.
Presencia de efectos adversos y gravedad, en la muestra total y en los grupos con telaprevir y boceprevir
| Efecto adversoN (%) | Muestra totalN=59 | TelaprevirN=35 | BoceprevirN=24 |
|---|---|---|---|
| Anemia | 31 (52,5) | 15 (42,9) | 16 (66,7) |
| Grado 1 (hemoglobina < 10-8g/dL) | 25 (42,4) | 12 (34,3) | 13 (54,2) |
| Grado 2 (hemoglobina < 8-6,5g/dL) | 3 (5,1) | 1 (2,9) | 2 (8,3) |
| Grado 3 (hemoglobina < 6,5g/dL) | 3 (5,1) | 2 (5,7) | 1 (4,2) |
| Neutropenia | 21 (35,6) | 10 (28,6) | 11 (45,8) |
| Grado 1 (neutrófilos < 750-500)/μL | 15 (25,4) | 6 (17,1) | 9 (37,5) |
| Grado 2 (neutrófilos < 500)/μL | 6 (10,2) | 4 (11,4) | 2 (8,3) |
| Trombocitopenia | 28 (47,5) | 15 (42,9) | 13 (54,2) |
| Grado 1 (plaquetas < 75-50.10e3)/μL | 16 (27,1) | 8 (22,9) | 8 (33,3) |
| Grado 2 (plaquetas < 50-25.10e3)/μL | 12 (20,3) | 7 (20,0) | 5 (20,8) |
| Grado 3(plaquetas < 25.10e3)/μL | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Exantema | 33 (55,9) | 24 (68,6) | 9 (37,5) |
| Grado 1 | 16 (27,1) | 13 (37,1) | 3 (12,5) |
| Grado 2 | 15 (25,4) | 10 (28,6) | 5 (20,8) |
| Grado 3 | 2 (3,4) | 1 (2,9) | 1 (4,2) |
La mediana de la duración del tratamiento fue 46,6 semanas (RIC 29,0-47,9 semanas), 47,0 semanas (RIC 29,1-47,9 semanas) en los pacientes en tratamiento con telaprevir y 39,9 semanas (RIC 27,3-47,7 semanas) en los que recibieron boceprevir. Un total de 16 (27,1%) pacientes suspendieron el tratamiento antes de 48 semanas, 12 (20,3%) por recurrencia viral y 4 (6,8%) por efectos adversos. Entre los pacientes con recurrencia viral, ningún paciente suspendió tras la fase de lead-in, 6 (10,2%) suspendieron tras 4 semanas de triple terapia, 2 (3,4%) en la semana 12 y 4 (6,8%) pacientes en semana 24.
Se redujo la dosis de ribavirina hasta en 17 (70,8%) pacientes del grupo boceprevir. El uso de eritropoyetina y de factores estimulantes de colonias fue necesario en 9 (37,5%) y 7 (29,2%) pacientes de este grupo, respectivamente. En el grupo de telaprevir fue necesario reducir la dosis de ribavirina en 14 (40,0%) pacientes, mientras se utilizó la eritropoyetina en 5 (41,3%) pacientes y los factores estimulantes de colonias en 2 (5,7%) pacientes.
Debido a efectos adversos, 8 (13,6%) pacientes requirieron ingreso durante el tratamiento, cuyas duraciones variaron desde 3 hasta 19 días. Necesitaron visitas a Urgencias 22 (37,3%) pacientes, 13 (37,5%) del grupo telaprevir y 9 (37,1%) de los pacientes con boceprevir. Además, 14 (41,2%) pacientes del grupo de telaprevir y 12 (50,0%) del grupo de boceprevir necesitaron entre 1 y 10 visitas médicas adicionales para el manejo de los efectos adversos. Las medidas farmacológicas utilizadas para el tratamiento de los efectos adversos, así como la asistencia sanitaria no prevista para el manejo de los efectos adversos, se presentan en la tabla 4.
Medidas farmacológicas de soporte para el tratamiento de los efectos adversos, en la muestra total y en los grupos con telaprevir y boceprevir
| Muestra totalN=59 | TelaprevirN=35 | BoceprevirN=24 | |
|---|---|---|---|
| Reducción ribavirina, n (%) | 31 (52,5) | 14 (40,0) | 17 (70,8) |
| Eritropoyetina, n (%) | 14 (23,7) | 5 (14,3) | 9 (37,5) |
| Necesidad de transfusiones, n (%) | 11 (18,6) | 6 (17,1) | 5 (20,8) |
| Factor estimulantes de colonias, n (%) | 9 (15,3) | 2 (5,7) | 7 (29,2) |
| Visitas médicas adicionales, n (%) | 26 (44,1) | 14 (40,0) | 12 (50,0) |
| Número de visitas médicas adicionales, n (%) | |||
| 1 visita | 13 (22,0) | 8 (22,9) | 5 (20,8) |
| 2 visitas | 8 (13,6) | 4 (11,4) | 4 (16,7) |
| 3 visitas | 4 (6,8) | 2 (5,7) | 2 (8,3) |
| 4 visitas | 1 (1,7) | – | 1 (4,2) |
| Visitas a Urgencias, n (%) | 22 (37,3) | 13 (37,1) | 9 (37,5) |
| Número de visitas a Urgencias, n (%) | |||
| 1 visita | 11 (18,6) | 8 (22,9) | 3 (12,5) |
| 2 visitas | 4 (6,8) | 1 (2,9) | 3 (12,5) |
| 3 visitas | 2 (3,4) | 1 (2,9) | 1 (4,2) |
| 4 visitas | 4 (6,8) | 2 (5,7) | 2 (8,4) |
| 10 visitas | 1 (1,7) | 1 (2,9) | – |
| Ingresos hospitalarios, n (%) | 8 (13,6) | 4 (11,4) | 4 (16,7) |
| Días de ingreso hospitalario, n (%) | |||
| 3 días | 3 (5,1) | 1 (2,9) | 2 (8,3) |
| 5 días | 2 (3,4) | 1 (2,9) | 1 (4,2) |
| 8 días | 2 (3,4) | 1 (2,9) | 1 (4,2) |
| 19 días | 1 (1,7) | 1 (2,9) | – |
Se han presentado los datos de coste-efectividad y toxicidad de la triple terapia basada en telaprevir o boceprevir para el tratamiento de la hepatitis C crónica de pacientes monoinfectados en un hospital terciario.
Los resultados de coste-efectividad presentados son los primeros datos que muestran el gasto global que supone el tratamiento en la práctica clínica real de pacientes con fibrosis avanzada F3 y F4. No se puede concluir que el coste por paciente curado sea favorable para alguno de los 2 inhibidores de proteasa, ya que los IC de los resultados de ambos fármacos se solapan. Sería necesario incluir un mayor número de pacientes en el estudio para obtener estimaciones más precisas.
Podemos decir que los costes por paciente curado se aproximan a los datos que habían sido previamente calculados por otros autores a partir de las tasas de RVS alcanzadas en los ensayos clínicos. Según estos cálculos, cada paciente curado costaría entre 40.090 € y 47.395 € si se trataba con telaprevir, y entre 36.825 € y 41.607 € si fuera con boceprevir19, según si el paciente era naïve o pretratado. Estos datos se habían obtenido de pacientes que en global tenían grados de fibrosis menos avanzadas que los pacientes del presente estudio. Además, en este estudio se ha estimado que los costes del manejo de los efectos adversos puede suponer un incremento medio del coste del tratamiento de 1.500 €, aunque se ha visto que es muy variable entre los distintos pacientes. El mayor coste máximo del manejo de los efectos adversos en el grupo de telaprevir puede deberse a un ingreso con una duración de 19 días debido a un proceso infeccioso relacionado con la terapia antiviral.
Otros datos publicados han mostrado resultados de coste-utilidad por debajo del umbral de eficiencia para las intervenciones médicas en España20. Las cifras estimadas de coste por año de vida ajustado por calidad (AVAC) en pacientes que nunca habían sido tratados se situaban entre los 18.288 € y los 33.751 €20,21.
Las evaluaciones económicas disponibles del uso de los regímenes libres de interferón, que incluyen la combinación de sofobuvir y simeprevir en genotipo 1, han estimado un coste por cada paciente curado del grupo de respondedores nulos dentro del rango calculado en nuestro estudio (57.144 €)22. Esta cifra resulta inferior al estimar el coste por AVAC (11.255 $) y se prevé que pueda ser más favorable que la de los estudios de coste-utilidad con boceprevir y telaprevir18.
Los resultados de efectividad de este estudio son similares a los de los ensayos pivotales, a pesar de que los pacientes incluidos en el presente estudio son aparentemente más graves que los tratados en dichos ensayos. En otra cohorte más numerosa que la de nuestro estudio, se alcanzaron RVS inferiores (50% con boceprevir y 52% con telaprevir)23, pero dentro o cerca del IC de nuestros resultados.
En nuestro estudio, la RVS fue del 68,6% en el grupo de telaprevir y la RVS fue del 58,3% en el grupo de pacientes de nuestro estudio tratados con boceprevir. Esta menor respuesta con boceprevir podría explicarse por el nivel basal inferior de plaquetas de los pacientes de este grupo.
Los datos de toxicidad del tratamiento con inhibidores de proteasa en los pacientes de este estudio muestran algunas variaciones en el perfil de seguridad de ambos fármacos en pacientes con fibrosis avanzada en la práctica clínica. Por una parte, en la cohorte francesa CUPIC, en las primeras 16 semanas de tratamiento los porcentajes de pacientes con anemias más graves resultaron similares; el 11,6% de los pacientes con telaprevir y el 4,4% de los que tuvieron boceprevir llegaron a niveles de hemoglobina inferiores a 8g/dL24. Sin embargo, por otra parte, en ninguno de nuestros pacientes se registró exantema grado 3, mientras que en la cohorte CUPIC estuvo presente en el 4,8% de los pacientes tratados con telaprevir24.
Destaca el alto porcentaje de pacientes que manifestó neutropenia durante el tratamiento (35,6%) que llegó a ser grave (< 500/μL) en el 20,3% de los mismos. Encontramos que la presencia de trombocitopenia es similar a la de otros registros25 y superior a la que encontramos en los ensayos clínicos pivotales. Este hecho puede explicarse porque se partió de un nivel inicial de plaquetas inferior y por tratarse de un efecto adverso más común entre los pacientes cirróticos26, que suponían la mitad de la población en nuestro estudio.
Dentro del uso de tratamiento de soporte para los efectos adversos hematológicos (anemia, neutropenia y trombocitopenia), la adición de eritropoyetina al tratamiento fue similar a lo que encontramos en otros estudios11,23,26; sin embargo, llama la atención que al 52,5% de los pacientes hubiera que reducirles la dosis de ribavirina. Tanto el uso de eritropoyetina como la reducción de la ribavirina fueron más frecuentes en el grupo de boceprevir, lo que indica que el manejo de la anemia provocada por este fármaco requiere más ajustes en el tratamiento. La presencia de un mayor porcentaje de pacientes que requirieron una reducción de la dosis de ribavirina en el presente estudio en comparación con otros se puede explicar, en parte, porque durante las fechas de nuestro estudio se publicaron otros que mostraban que bajar la dosis de ribavirina hasta cierta dosis no influye de modo significativo sobre la RVS27,28.
Entre las limitaciones del estudio se incluye que los datos recogieron de forma retrospectiva a partir de los registros de la historia clínica. Este hecho puede haber supuesto la infraestimación de los efectos adversos en relación con el registro de forma prospectiva en el mismo momento de la consulta con el paciente.
Además, en nuestro estudio, la selección de un tratamiento u otro dependía del criterio clínico de los distintos médicos de la unidad de hepatología. Al no tratarse de un estudio aleatorizado, no se puede excluir la presencia de factores de confusión y/o sesgos de selección y análisis. Tampoco se han podido ajustar los resultados por las características basales de los pacientes, tal como se hizo en el estudio de Backus et al.23. Estos autores concluyeron, al aplicar modelos multivariables, que utilizar telaprevir en vez de boceprevir se asociaba de forma estadísticamente significativa a la RVS.
Sería necesario disponer de estudios con diseños prospectivos y aleatorizados que valoraran los resultados en salud y costes de los tratamientos con los demás antivirales de acción directa que están ya disponibles, o que lo estarán próximamente.
Por tanto, el tratamiento con triple terapia basada en telaprevir o boceprevir ha supuesto un alto coste por paciente curado. Los efectos adversos desarrollados han requerido que un significativo número de pacientes necesiten medidas de soporte, cuyo coste hay que añadir al del tratamiento con triple terapia.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesÁlvaro Giménez Manzorro ha participado en advisory boards y como ponente en reuniones científicas organizadas por MSD, y en advisory boards de la compañía Janssen Cilag.
Gerardo Clemente Ricote ha participado como ponente en reuniones científicas organizadas por MSD.
El resto de los autores carecen de conflictos de intereses.
A todo el Servicio de Farmacia y el Servicio de Aparato Digestivo, por su inestimable apoyo y por su colaboración en el registro de los datos. Además, al Departamento de Estadística de la Fundación para la Investigación del Hospital General Universitario Gregorio Marañón, por el tratamiento estadístico de los resultados.