INTRODUCCION
La función más estudiada del tracto gastrointestinal es la digestión y absorción de nutrientes para satisfacer las necesidades metabólicas que requieren el normal crecimiento y desarrollo del organismo. Además, la mucosa intestinal constituye una barrera protectora contra la presencia constante de antígenos alimentarios y microorganismos de la luz intestinal. Ya desde el nacimiento, se ponen en marcha mecanismos madurativos y adaptativos para mantener una barrera mucosa intestinal íntegra y activa e incorporar una población bacteriana normal estable. La protección frente a los agentes potencialmente dañinos se establece mediante diversos factores, como la saliva, el ácido gástrico, el peristaltismo, el moco, las enzimas proteolíticas, la flora intestinal, la capa de células epiteliales y el sistema inmunológico intestinal1.
SISTEMA INMUNOLÓGICO INTESTINAL
El tejido linfoide asociado a la mucosa intestinal (GALT) representa la mayor masa de tejido linfoide en el organismo y, por tanto, constituye un elemento de gran importancia en la capacidad inmunológica total del huésped. Las funciones reguladoras de la respuesta inmunitaria intestinal ocurren en dos tipos de compartimentos: los tejidos linfoides organizados en forma de agregados, como los folículos asociados a las placas de Peyer y los ganglios linfáticos mesentéricos, o los tejidos linfoides difusos distribuidos en la lámina propia de la mucosa o en el epitelio intestinal (linfocitos intraepiteliales). El intestino delgado contiene alrededor de 250 placas de Peyer (agregados de 5 o más folículos) y miles de folículos solitarios, que en el colon se encuentran aún en mayor cantidad. Cada folículo se asocia a un epitelio especializado (células M) encargado de transportar los antígenos a su través hasta contactar con el tejido linfoide. En todas las zonas del intestino, el sistema inmunológico está continuamente procesando antígenos de la luz, por lo que los folículos linfoides de la mucosa presentan un alto grado de activación. Una vez activados por el contacto con los antígenos, los linfocitos T y B de las placas de Peyer adyacentes a las células M proliferan en forma de un clon antígeno-específico, pasan a la sangre y, desde allí, migran nuevamente a la lámina propia. La lámina propia aloja a los linfocitos T CD4+ y es el lugar donde los linfocitos B se transforman en células plasmáticas productoras de IgA secretora específica contra los diferentes antígenos2. En la superficie mucosa existe una gran producción de IgA secretora que, a diferencia de la IgA circulante, es resistente a la proteólisis intraluminal y no activa la vía del complemento, por lo que no induce inflamación. Estas características, originadas en su estructura dimérica o polimérica, la hacen ideal como mecanismo de protección en las superficies mucosas en contacto continuo con estímulos antigénicos. Los linfocitos intraepiteliales tienen una cinética distinta y su origen no está del todo claro, aunque algunos estudios en ratones sugieren que pueden originarse in situ a partir de progenitores locales3.
Todas las evidencias disponibles hasta el momento sugieren que el sistema inmunológico intestinal responde activamente a los antígenos alimentarios y de la flora normal sin inducir enfermedad, lo que se ha denominado inflamación fisiológica, proceso mediado en parte por el mecanismo de tolerancia oral a los antígenos.
TOLERANCIA ORAL
El término puede definirse como la respuesta fisiológica a los antígenos alimentarios y a la flora comensal mediante la inducción de un estado específico de ausencia de respuesta inmunológica2. Por el contrario, los antígenos de microorganismos patógenos inducen potentes respuestas inmunitarias en el intestino, lo que indica que el sistema inmunológico intestinal es capaz de procesar y distinguir entre los antígenos inocuos y los potencialmente lesivos. En realidad, una definición mejor de la tolerancia oral sería la de tolerancia sistémica obtenida de manera oral, ya que el proceso se hace efectivo no sólo a nivel local sino sistémicamente. El mecanismo de la tolerancia oral puede tener implicaciones clínicas muy importantes en las enfermedades en las que el proceso puede estar alterado, como en la enfermedad de Crohn, en la que puede existir una intolerancia a la flora normal, o en la enfermedad celíaca, que se caracteriza por intolerancia al gluten. Los mecanismos que inducen la tolerancia no están aún demasiado claros. Algunos estudios sugieren que la inducción de tolerancia depende del tipo de exposición al antígeno4,5. Así, la administración de dosis altas de antígeno induciría un mecanismo de deleción o anergia de los linfocitos, mientras que la administración repetida del antígeno a dosis bajas podría inducir la tolerancia a través de mecanismos reguladores celulares o bioquímicos. La deleción consiste en la eliminación de los clones de linfocitos T específicos para un antígeno mediante apoptosis y la anergia, la falta de respuesta a un antígeno que pasa a la sangre en grandes cantidades en ausencia de una respuesta inflamatoria que sirva de estimulación a los linfocitos. Otra alternativa a la deleción o la anergia para la eliminación de linfocitos T específicos es la inducción de células reguladoras con actividad inhibidora. Estas células inhibidoras son fundamentalmente linfocitos T CD4+ del tipo Thelper 3 (Th3), que ejercen su función a través de la liberación de citocinas supresoras, como la IL-10 y el TGFβ6. Muchas de las alteraciones en la inmunorregulación que inducen una sensibilización a antígenos (alergia) en vez de un proceso de tolerancia suceden durante la infancia. Los mecanismos de exclusión, eliminación y regulación inmunológica son incompletos durante un período tras el nacimiento lo que, en algunos casos, puede conducir a una incorporación aberrante de antígenos. La inmadurez inmunológica se caracteriza por una disminución de la producción de IgA y una alteración en la respuesta inmunológica celular que hace que predomine un perfil Th2. Este predominio induce un aumento de la producción de IgE y, posiblemente, una respuesta atópica ante todo tipo de antígenos, incluyendo los de origen alimentario.
Por tanto, probablemente el proceso de incorporación y presentación del antígeno en el epitelio intestinal es el punto crítico para inducir tolerancia o una respuesta inmunológica específica.
PAPEL DE LAS CÉLULAS EPITELIALES EN LA REGULACION INMUNITARIA DEL INTESTINO
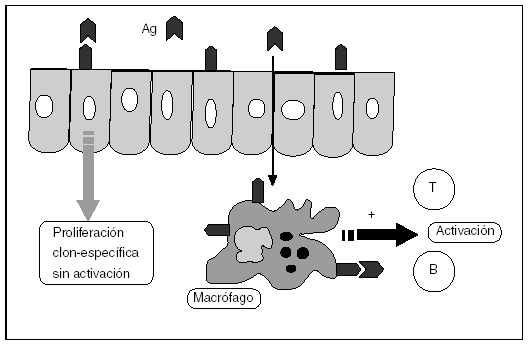
En virtud de su localización anatómica, la célula epitelial intestinal tiene la capacidad de desempeñar un papel de gran importancia en la inmunomodulación del intestino, ya que constituye la puerta de entrada para los antígenos luminales alimentarios y bacterianos7. El punto clave de la regulación inmunitaria del intestino será, por tanto, la interacción entre la célula epitelial que controla el acceso a los diferentes compartimentos de la mucosa y las células inmunológicas que median las respuestas inflamatorias o tolerantes. La célula epitelial tiene no sólo la capacidad de procesar y transportar activamente los antígenos hacia la lámina propia sino, además, de actuar como presentadora de antígeno, aunque de una manera un tanto especial. Un estudio reciente8 demostró que linfocitos T antígeno-específicos se transformaban en no respondedores o anérgicos cuando era únicamente la célula epitelial la que presentaba el antígeno. Aunque se producía una importante proliferación del clon específico, no se desencadenaba una respuesta inflamatoria contra las células epiteliales (fig. 1). Aparentemente, en condiciones normales, la presentación del antígeno luminal no patógeno por la célula epitelial conduciría a la inactivación o supresión de la respuesta inmunitaria. Sin embargo, en condiciones patológicas, como la enfermedad de Crohn, estos mecanismos reguladores probablemente fallan, conduciendo a una situación en la que la célula epitelial es obviada y los antígenos bacterianos contactan directamente con células presentadoras de antígeno «profesionales» que inducen una respuesta inflamatoria local.
Fig. 1. Interacción antígeno-célula epitelial8.
INTERACCION BACTERIAS-SISTEMA INMUNOLÓGICO INTESTINAL
El intestino humano está habitado por un complejo y dinámico ecosistema bacteriano. El intestino grueso puede contener más de 400 especies bacterianas distintas, incluyendo los microorganismos residentes y un espectro variable de especies transitorias que ocupan de forma temporal un lugar funcionalmente vacío. Además de formar una barrera física de membranas celulares y tight junctions, el epitelio dispone de métodos activos para reprimir a las bacterias, siendo capaz de discriminar entre la flora residente y los microorganismos patógenos. Las vías y métodos de señalización que determinan estas funciones de interacción son lo que se ha denominado cross-talk epitelio-bacteria, que se produce no sólo en condiciones patológicas, sino como parte de la fisiología normal del intestino9.
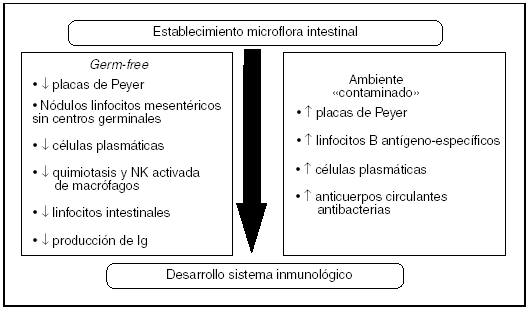
Fisiológicamente, el establecimiento de la microflora intestinal comienza ya en el nacimiento y determina el desarrollo del sistema inmunológico intestinal. Estudios en animales neonatos y en animales germ-free han demostrado que la interacción entre el epitelio y la flora es esencial para el desarrollo normal del sistema inmunitario, tanto humoral como celular. Cuando el intestino de mamíferos es colonizado por nuevas especies bacterianas tras el nacimiento, aumenta el número de células plasmáticas a lo largo del intestino, la producción de anticuerpos circulantes específicos antibacterias y se estimula la producción en los centros germinales de las placas de Peyer de células B antígeno-específicas10. En ausencia de microflora intestinal, los animales presentan un sistema inmunitario intestinal infradesarrollado: disminución de las placas de Peyer, nódulos linfáticos mesentéricos sin centros germinales ni células plasmáticas, quimiotaxis y actividad natural killer macrofágica disminuida y un número muy reducido de linfocitos intestinales. Además, estos animales no producen IgA y poca IgG y se inhibe la formación de granulocitos en la médula ósea. Sin embargo, cuando se les introduce en un ambiente convencional «contaminado», el sistema inmunológico intestinal se desarrolla rápidamente y comienza la producción de una gran variedad de isotipos de anticuerpos, incluyendo anticuerpos específicos contra las bacterias de la propia flora (fig. 2). Esta interacción entre el sistema inmunológico intestinal y las bacterias de la flora mantiene una activación del tejido linfoide asociado a la mucosa a lo largo de toda la vida. La mayor parte de la investigación relacionada con este tema ha estado centrada hasta el momento en dilucidar los mecanismos por los que las bacterias patógenas interactúan con el sistema inmunitario. Su conocimiento puede ayudar a entender también cómo se produce esta interacción, en condiciones fisiológicas, con las bacterias no patógenas.
Fig. 2. Interacción bacterias-sistema inmunológico tras el nacimiento.
Inmunidad innata
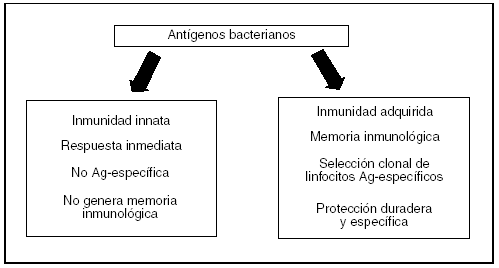
La respuesta defensiva del huésped contra los microorganismos patógenos se basa en dos componentes bien diferenciados: la respuesta inmunológica innata y la respuesta adaptativa o adquirida. La respuesta adaptativa se caracteriza por una selección clonal de linfocitos antígeno-específicos que, a largo plazo, originan una protección duradera y específica. Por el contrario, la respuesta inmunitaria innata no es específica del patógeno que invade y no genera memoria inmunológica11,12.
La función esencial de la inmunidad innata es su capacidad de provocar una respuesta rápida contra el microorganismo patógeno sin necesidad de inducción o maduración de linfocitos, por lo que constituye la primera línea de defensa contra las enfermedades infecciosas. La inmunidad innata está mediada fundamentalmente por leucocitos (granulocitos y macrófagos), células que fagocitan y destruyen a los patógenos y que, al mismo tiempo, coordinan respuestas adicionales mediante la liberación de mediadores inflamatorios y citocinas como el TNFα y la IL-1. En el macrófago, célula presentadora de antígeno, el microorganismo es degradadado y los fragmentos que resultan se presentan al linfocito T para iniciar la activación de la respuesta inmunitaria adaptativa y el establecimiento de una inmunidad protectora a largo plazo, creando una intersección entre los dos tipos de inmunidad. Si hablamos en términos filogenéticos, la inmunidad innata es mucho más antigua que la adaptativa, ya que esta última sólo aparece en animales vertebrados (fig. 3).
Fig. 3. Respuesta inmunitaria ante los antígenos bacterianos.
El condicionante imprescindible de la respuesta inmunitaria innata es la capacidad de reconocer de modo innato los productos microbianos que, por otra parte, son demasiado numerosos. Un sistema inmunológico funcional debe ser capaz de tener un mecanismo de reconocimiento de patógenos, a la vez que mantiene la tolerancia contra los «elementos propios». La sensibilidad y especificidad de esta importante función se mantienen, al menos en parte, por la capacidad de reconocer los patrones específicos microbianos. Por este motivo, el primer reto al que se enfrenta la inmunidad innata es la discriminación de un gran número de patógenos mediante un número restringido de receptores. El problema se ha resuelto mediante la creación de unos receptores que reconocen fragmentos de los microorganismos patógenos que no se encuentran en las células eucariotas y que están sometidos a pocas mutaciones, ya que forman parte de estructuras esenciales para la vida de los mismos y que han sido llamados pathogen-associated molecular patterns (PAMP). A los receptores que los reconocen se ha denominado, por tanto, pattern recognition receptors (PRR). Los PAMP incluyen componentes de la pared celular de bacterias, como el lipopolisacárido (LPS), los peptidoglicanos o los ácidos teicoicos y otros componentes de hongos, levaduras y protozoos. Existen dos tipos fundamentales de PRR, los que median los mecanismos de fagocitosis y los que inducen vías de activación de mediadores proinflamatorios. La primeras investigaciones sobre estos receptores se realizaron en la mosca Drosophila, que carece de inmunidad adquirida, y ha dado lugar al descubrimiento de toda una familia de estos receptores de membrana denominados toll-like receptors (TLR). Hasta el momento, se han descrito diez diferentes TLR en mamíferos y se ha descubierto parte de sus mecanismos de acción. La activación del receptor de membrana inicia una cascada intracelular de cinasas que produce una translocación de factores de transcripción desde el citoplasma al núcleo. El factor de transcripción mejor conocido es el NF-kappa-β, que promueve la activación de genes para la producción de un gran número de mediadores y citocinas, como el TNF-α, IL-6, IL-1, IL-8 o IL-12. Por otra parte, estimula moléculas necesarias para la activación de los linfocitos T por las células presentadoras de antígenos, creando un vínculo entre la detección del microorganismo patógeno, la inmunidad innata y la adquirida. En humanos, los TLR mejor conocidos son el TLR4 y el TLR2. El TLR4 funciona como un receptor para el LPS de las bacterias gramnegativas, mientras que el TLR2 reconoce múltiples productos de bacterias grampositivas, micobacterias y levaduras. Los TLR se expresan tanto en tejido linfoide como no linfoide y su patrón de expresión varía según el tipo celular y el tejido estudiado. Los diferentes tipos de TLR se expresan en monocitos, neutrófilos, células NK, células B, células dendríticas, células endoteliales y también en las células epiteliales intestinales.
La superficie luminal del intestino y del colon está continuamente expuesta a bacterias comensales gramnegativas y, por tanto, al LPS, lo que debería inducir la activación de los TLR y la estimulación de la liberación de mediadores proinflamatorios. Sin embargo, las células epiteliales intestinales expresan concentraciones bajas de este tipo de receptores para mantener una situación de «ausencia de respuesta»13,14. Situaciones patológicas, como la enfermedad inflamatoria intestinal, se asocian con una sobrexpresión de algunos TLR (TLR4), dando lugar a una reactividad anormal ante las bacterias de la propia flora, lo que sugiere que una alteración en la inmunidad innata podría contribuir a la patogenia de la enfermedad15. La demostración reciente de que una cepa de Escherichia coli no patógena tiene un efecto beneficioso en la colitis ulcerosa sugiere la idea de que los «probióticos» podrían alterar la expresión de los receptores de la inmunidad innata o reconocer receptores alternativos a los de las bacterias patógenas.
Inmunidad adquirida
Además de la inmunidad innata, en el organismo se ha desarrollado un sistema inmunológico adquirido o adaptativo para proteger las superficies mucosas. Al contrario de lo que sucede con la inmunidad innata, la inmunidad adquirida es específica contra el antígeno y genera memoria inmunológica, por lo que induce una defensa duradera. Este tipo de inmunidad es protagonizado fundamentalmente por la inmunoexclusión de antígenos por anticuerpos, mayoritariamente del tipo IgA secretora que es producida localmente por los linfocitos B. El proceso se inicia mediante el contacto del antígeno con los linfocitos de las placas de Peyer y de los folículos, generando la proliferación de un clon antígeno-específico que pasa a la sangre, se distribuye como células de memoria sistémicamente y vuelve a la lámina propia, donde se aloja de forma definitiva. Ante una nuevo contacto con el antígeno, los linfocitos T proliferan, y se desencadenan una respuesta inmunológica celular y un estímulo para que los linfocitos B se transformen en células plasmáticas productoras de IgA secretora antígeno-específica16. El hecho de que la estimulación de linfocitos antígeno-específicos que se produce localmente en el intestino se haga efectiva también sistémicamente ha dado lugar a un campo muy relevante de investigación, como es el de las vacunas administradas oralmente. Este proceso de inmunoexclusión de antígenos sucede no sólo en condiciones patológicas (p. ej., infección por una bacteria patógena) sino en condiciones fisiológicas. En un estudio realizado en voluntarios sanos, se analizaron por citometría de flujo los diferentes tipos de inmunoglobulinas que recubren las bacterias de las heces. La mayor parte de las bacterias está recubierta de IgA y menos de IgG e IgM, por lo que se induce una exclusión de la bacteria sin generar un proceso inflamatorio epitelial17. La IgA secretora, al contrario que la IgG o M, por su estructura, no activa vías de inflamación como la del complemento, lo que la hace ideal para proteger superficies mucosas en continuo contacto con antígenos. Por el contrario, en pacientes con enfermedad inflamatoria intestinal los linfocitos intestinales producen una alta concentración de IgG que va dirigida contra bacterias no patógenas de la propia flora comensal18. Estos hallazgos sugieren que en la enfermedad inflamatoria intestinal existe una alteración en la tolerancia a la propia flora, lo que condiciona una respuesta inflamatoria en la mucosa. En el mismo sentido, Duchmann et al demostraron que las células mononucleares de la mucosa intestinal inflamada de pacientes con enfermedad inflamatoria intestinal proliferaban cuando se exponían in vitro a antígenos bacterianos de la flora autóloga. Sin embargo, las células de las áreas de mucosa no afectada de los mismos pacientes, de pacientes en remisión y de controles sanos no proliferaban ante las bacterias autólogas19.
PROBIOTICOS
La demostración de que la microflora intestinal es de gran importancia en el desarrollo del sistema inmunológico y en el mantenimiento de los procesos inmunológicos normales locales y sistémicos ha fomentado la investigación sobre microorganismos con posibles efectos inmunológicos beneficiosos. Los probióticos son microorganismos vivos que, ingeridos en cantidad adecuada, ejercen efectos beneficiosos para la salud más allá de sus propiedades puramente nutricionales20. Aunque clásicamente el concepto de probiótico se ha asociado con los lactobacilos y bifidobacterias, actualmente podemos incluir en el término a otras cepas bacterianas no patógenas, como alguna cepa de Escherichia coli u otros microorganismos no bacterianos, como Saccharomyces boulardii. En diferentes estudios, tanto en animales como en humanos, distintas cepas de microorganismos probióticos han demostrado su capacidad para modular las respuestas inmunológicas cuando son administrados por vía oral. Ciertos probióticos son capaces de producir una estimulación de la inmunidad innata y de la inmunidad adquirida o específica, confiriendo al huésped un aumento de su resistencia a microorganismos patógenos. En otras situaciones patológicas, los probióticos pueden inducir efectos opuestos, como la inhibición de reacciones de hipersensibiliad o de falta de tolerancia (alergia) o induciendo un efecto antiinflamatorio. Este espectro tan complejo de efectos sobre la inmunidad del huésped es lo que confiere a los probióticos su carácter de inmunomoduladores.
Probióticos: estimulación de la inmunidad innata
Como se ha explicado anteriormente, la inmunidad innata provoca una respuesta rápida no específica contra los microorganismos patógenos, por lo que constituye la primera línea de defensa contra las enfermedades infecciosas. La inmunidad innata está mediada fundamentalmente por leucocitos (granulocitos y macrófagos), células que fagocitan y destruyen a los patógenos y que, al mismo tiempo, coordinan respuestas adicionales mediante la liberación de mediadores inflamatorios y citocinas.
Estudios in vitro, fundamentalmente con células de procedencia murina, demostraron que el cultivo de macrófagos o leucocitos con distintas cepas de probióticos inducía un aumento en la respuesta inmunológica innata, estimulándose la liberación de diferentes mediadores como el TNF-α, IL-6, óxido nítrico (NO), IL-12 o IFN-γ21,22. Sin embargo, los resultados de los estudios cuando las bacterias son administradas por vía oral son más contradictorios. Tejada-Simon et al23 no encontraron ningún cambio en la síntesis de citocinas e inmunoglobulinas por las células inmunológicas del bazo, las placas de Peyer y los ganglios linfáticos cuando los ratones eran alimentados con distintos probióticos durante 2 semanas. Sin embargo, cuando el efecto era analizado ex vivo en leucocitos extraídos de los animales, algunos probióticos inducían una estimulación de la síntesis de citocinas y otros una atenuación de la misma24. Por el contrario, Ha et al25 demostraron que en animales alimentados con yogur durante 2-4 semanas se producía una disminución de la expresión de ARN para distintas citocinas, siendo este efecto más prominente sobre el TNF-α.
Diferentes estudios in vitro efectuados en humanos con células mononucleares de sangre periférica demostraron que la exposición a bacterias grampositivas de la propia flora o a diferentes especies de lactobacilos eran capaces de estimular la inmunidad innata mediante la inducción de la liberación de TNF-α, IL-10, IL-12, IL-18 o IFN-γ26-28.
Sin embargo, los estudios que pueden tener mayor relevancia son los llevados a cabo mediante la administración oral del probiótico, generalmente en leche fermentada, ya que es la forma fisiológica en la que estas bacterias pueden interactuar con el sitema inmunológico del huésped. Se han llevado a cabo múltiples estudios con diferentes bacterias: Bifidobacterium lactis HN019, Lactobacillus rhamnosus HN001, Lactobacillus johnsonii La1 o Lactobacillus GG y en algunos de ellos se ha comparado su efecto con el placebo de una manera aleatoria y doble ciego29-34. En todos los estudios, en general, se observan hallazgos similares en su efecto sobre la respuesta inmunitaria innata: aumento de linfocitos totales, CD4, CD25 y células NK, de la capacidad fagocítica de mononucleares y polimorfonucleares, de la actividad antitumoral NK y de la actividad bactericida. Sólo en un estudio en el que se administró Lactobacillus casei Shirota35 no se evidenció ningún efecto en la inmunidad no específica. La mayoría de los estudios anteriormente reseñados se ha realizado en voluntarios sanos de edad avanzada, ya que el tratamiento con probióticos podría constituir una alternativa efectiva y segura para estimular un sistema inmunitario funcionalmente en declive, lo que se ha denominado «inmunosenescencia».
El concepto de inmunomodulación queda patente en un estudio de Pelto et al36, en el que se administró leche con Lactobacillus GG ATCC 53103 a sujetos sanos y a pacientes con alergia a la leche. El efecto sobre la inmunidad se valoró mediante la expresión de receptores de fagocitosis antes y después de la ingestión de leche. Mientras que en los sujetos sanos se producía un aumento en la expresión de los receptores con el probiótico, en los pacientes alérgicos el Lactobacillus GG revertía el aumento de expresión de los receptores inducido por la leche. Probablemente, los efectos inmunomoduladores de los probióticos dependen, por una parte, del estado inmunológico basal del huésped y de la cepa específica estudiada. Por tanto, las indicaciones de la aplicación en humanos deberán establecerse en función de estos dos conceptos.
Probióticos: efectos sobre la inmunidad adquirida
Al contrario que la inmunidad innata, la inmunidad adquirida está dirigida específicamente contra el antígeno y genera memoria inmunológica, por lo que induce una defensa duradera. Este tipo de inmunidad está protagonizado sobre todo por la inmunoexclusión de antígenos por anticuerpos, en su mayoría del tipo IgA secretora, que se produce localmente por los linfocitos B. El uso de probióticos para estimular la inmunidad adquirida tiene como objetivo mejorar la respuesta del huésped ante antígenos patógenos, es decir, prevenir o tratar las enfermedades infecciosas. En ratones, la ingestión de un yogur con Lactobacillus acidophilus y Bifidobacterium produce un aumento en la respuesta inmunitaria específica (IgA) local y sistémica cuando son inmunizados con toxina de cólera por vía oral37. En humanos, en voluntarios sanos, la administración conjunta de Salmonella typhi atenuada por vía oral y leche fermentada con Lactobacillus acidophilus y bifidobacterias inducía un aumento 4 veces mayor de la IgA específica que en el grupo control38. Los resultados no han podido ser reproducidos con Lactococcus lactis ni Lactobacillus GG, aunque los sujetos que consumían este último presentaban una tendencia a producir una mayor concentración de IgA específica39.
Ya que los probióticos son capaces de estimular la inmunidad específica contra microorganismos patógenos, parte de la investigación ha ido dirigida al tratamiento de enfermedades infecciosas, fundamentalmente gastrointestinales. En este campo, el tema mejor estudiado es el de la diarrea infecciosa en niños, sobre todo la diarrea por rotavirus. Desde hace más de 10 años existen estudios con distintas cepas de probióticos que demuestran que su administración desde el inicio de los síntomas reduce la duración y la frecuencia de la diarrea y disminuye el tiempo de hospitalización40-43. Recientemente se ha publicado un metaanálisis que valora los resultados de los estudios publicados y que confirma que los Lactobacillus son seguros y efectivos en el tratamiento de la diarrea aguda infecciosa en los niños44. Según los resultados de dos estudios realizados en niños hospitalizados, la administración de Bifidobacterium bifidus y Streptococcus termophilus45o Lactobacillus GG46 reduce, además, el riesgo de diarrea nosocomial y gastroenteritis por rotavirus durante el ingreso. El beneficio terapéutico obtenido con los probióticos en la diarrea aguda infecciosa se relaciona directamente con una estimulación de la inmunidad humoral inespecífica y específica. Este hecho se refleja en un aumento del número total de células secretoras de inmunoglobulinas, del número de células secretoras de inmunoglobulinas específicas contra el rotavirus y de IgA en suero47,48. Por este motivo, los probióticos, y en concreto el Lactobacillus GG, podrían utilizarse como potenciadores de la vacuna contra rotavirus, ya que inducen un aumento en la seroconversión49. Además, este efecto es más patente cuando se utilizan bacterias vivas50 y se acompaña de una disminución en la excreción de virus en las heces, que sugiere un mecanismo de inmunoexclusión51. En conclusión, todos los datos acumulados hasta el momento demuestran que los probióticos son eficaces en el tratamiento de la diarrea aguda infecciosa infantil.
Los resultados del tratamiento con probióticos en otras enfermedades infecciosas, como la diarrea por Clostridium difficile, son prometedores. Sin embargo, los datos para la prevención de la diarrea del viajero son aún muy limitados. La investigación más reciente sugiere la potencial aplicación de los probióticos en el desarrollo de nuevas vacunas, como la generada mediante la administración intranasal de un Lactobacillus plantarum recombinante productor de toxina tetánica52.
Probióticos y tolerancia oral a los antígenos
Las alteraciones en la inmunorregulación que inducen una sensibilización a antígenos (alergia) sobrepasando los mecanismos de tolerancia suceden fundamentalmente durante la infancia. Los mecanismos de exclusión, eliminación y regulación inmunológica son incompletos durante un período tras el nacimiento lo que, en algunos casos, puede conducir a una incorporación aberrante de antígenos. Es precisamente tras el nacimiento cuando numerosos antígenos de la dieta se incorporan por primera vez e interaccionan con el sistema inmunitario intestinal. Estudios realizados en ratones sugieren que algún factor en la flora intestinal es el que promueve la tolerancia oral a los antígenos. En un estudio realizado en ratones normales y en ratones germ-free, la ingestión de ovoalbúmina por vía oral inducía una respuesta diferente ante la inmunización peritoneal con la misma sustancia en los dos grupos. Mientras que en el grupo de ratones normales inducía un falta de respuesta en la producción de IgG, que se mantenía durante 3 meses, en el grupo de ratones germ-free esta falta de respuesta sistémica se mantenía sólo durante 1-3 semanas53. También en ratones, la introducción de antígenos extraños, como la leche de vaca en el período neonatal, induce un aumento de permeabilidad que se asocia a una infiltración eosinofílica de la mucosa intestinal54. Sin embargo, la adición de Lactobacillus GG a la leche revierte este defecto de permeabilidad, asociándose a un aumento en el número de células productoras de anticuerpos antibetalactoglobulina, es decir, estimulando la respuesta inmunitaria antígeno-específica55.
Por otra parte, las bacterias de la flora y, en concreto los probióticos, son capaces de inducir un cambio en el perfil inmunológico inducido por los antígenos. En ratones a los que se administraba ovoalbúmina intraperitonealmente, la administración conjunta de Lactobacillus casei Shirota por vía oral inducía un descenso en la IgE sérica y en la IgE producida en respuesta a la reestimulación con ovoalbúmina. Además, el patrón de secrección de citocinas por las células inmunitarias de los ratones expuestos al probiótico cambiaba de Th2 a Th1, lo que promueve un comportamiento más tolerogénico56.
Todos estos estudios sugieren que los probióticos pueden ejercer un efecto regulador sobre los mecanismos inmunológicos responsables de la tolerancia a los antígenos, por lo que podrían ser beneficiosos en el campo de las enfermedades atópicas o alérgicas. En los últimos años se han publicado diferentes estudios clínicos relacionados con este tema. En un estudio aleatorizado, doble ciego y controlado con placebo se estudió el efecto de la suplementación dietética con probióticos (Bifidobacterium lactis Bb12 y Lactobacillus casei GG) en 27 niños con eccema atópico en los primeros meses de vida. Los niños cuya dieta se suplementó con probióticos presentaron una mejoría significativa en la escala utilizada para valorar el eccema atópico, con la práctica desaparición del mismo a los 2 meses. Además, estos resultados clínicos se relacionaban con una disminución de los marcadores inflamatorios relacionados con la alergia, como la proteína eosinofílica X57. En un estudio similar del mismo grupo, también en niños con dermatitis atópica, la ingestión de Lactobacillus GG inducía un aumento en suero de la citocina antiinflamatoria IL-1058. Este hecho sugiere que los probióticos son capaces de inhibir respuestas inflamatorias más allá del ambiente intestinal a través de la modulación de la liberación de mediadores.
Si los resultados del tratamiento con probióticos en las enfermedades atópicas son esperanzadores, todavía son más llamativos los obtenidos en la prevención primaria de las mismas. En un estudio aleatorizado, doble ciego y controlado con placebo se administró Lactobacillus GG prenatalmente a madres con un familiar de primer grado o su pareja afectados de enfermedad atópica, y en el período posnatal a sus hijos durante 6 meses59. De esta manera, se seleccionaron niños con alta probabilidad de presentar eccema atópico crónico, que es la manifestación alérgica más común en los primeros años de vida. La diferencia entre los dos grupos fue significativa, ya que la frecuencia de aparición de eccema atópico a los 2 años de vida en el grupo Lactobacillus GG fue la mitad de la del grupo placebo (15/64 frente a 31/68). Recientemente se ha publicado un estudio con un diseño similar, pero en el que sólo la dieta de las madres era suplementada con el Lactobacillus GG, tanto en el período del embarazo como en el de la lactancia60. El riesgo de padecer eccema atópico en los niños a los 2 años de edad fue significativamente inferior en el grupo cuyas madres tomaron el probiótico (15 frente a 47%). La ingesta del Lactobacillus GG se relacionaba, además, con un incremento en la concentración de TGFß (citocina antiinflamatoria) en la leche materna.
Los resultados de todos estudios sugieren que, realmente, la administración de determinados probióticos son de utilidad en el tratamiento y prevención de las enfermedades atópicas.
Probióticos y efecto antiinflamatorio
Aunque los probióticos son capaces de estimular la inmunidad innata y específica, en determinadas situaciones patológicas o determinadas cepas bacterianas, pueden ejercer efectos intestinales claramente antiinflamatorios. Las implicaciones que puede tener este aspecto en enfermedades como la enfermedad inflamatoria intestinal son de gran relevancia, ya que en la etiopatogenia de la misma convergen probablemente una falta de tolerancia a la flora y una respuesta inflamatoria exagerada.
En un estudio realizado con linfocitos T CD4+ aislados de bazo murino, una cepa de Lactobacillus paracasei inhibía marcadamente la actividad proliferativa de los linfocitos que se acompañaba de una disminución global de las citocinas Th1 y Th2. Sin embargo, la IL-10 mantenía las concentraciones y el TGFβ era estimulado de una forma dependiente de la dosis, lo que sugiere que esta bacteria puede tener un efecto antiinflamatorio y promotor de la tolerancia61. En otro modelo in vitro de cocultivo de células epiteliales CaCO-2 con leucocitos humanos se investigó también la interacción de bacterias patógenas y no patógenas con el epitelio y el sistema inmunitario en un intento de imitar la situación real en el intestino62. En este estudio, Lactobacillus sakei, bacteria utilizada en la fermentación de alimentos, ejercía un efecto proinflamatorio similar al de una cepa no patógena de Escherichia coli en cuanto a la liberación de citocinas por las células epiteliales. Por el contrario, una cepa de Lactobacillus johnsonii de origen intestinal no inducía la liberación de TNF-α o IL-1β, pero sí la del TGFβ, presentando un perfil global antiinflamatorio.
Además de los estudios in vitro, distintos modelos experimentales animales, fundamentalmente de colitis, han demostrado la utilidad de los probióticos en el control de la inflamación intestinal. En el modelo de colitis en la rata inducido por ácido acético, la administración de Lactobacillus reuteri R2LC inmediatamente tras la inducción prevenía la instauración de la colitis63. De la misma forma, en el modelo de enterocolitis en ratas inducida con metrotexato intraperitoneal, la ingestión de Lactobacillus plantarum, disminuía la severidad de la colitis64. El modelo más interesante para estudiar el papel de la flora en la inflamación de la mucosa intestinal es, quizás, el de los ratones deficientes en IL-10. Estos ratones desarrrollan una colitis crónica similar a la enfermedad de Crohn humana en presencia de bacterias (no en condiciones germ-free) y que se previene y trata con antibióticos65-67. Los ratones deficientes en IL-10 presentan, en el período neonatal, concentraciones disminuidas de lactobacilos en colon y un aumento de bacterias adheridas y translocadas en la mucosa colónica, desarrollando una colitis a las 4 semanas de vida. La repoblación del colon con Lactobacillus sp. atenúa la colitis y disminuye la translocación y adherencia de otras bacterias68. Además, el tratamiento de estos ratones con VSL#3, un preparado liofilizado con 8 bacterias diferentes, induce una normalización de la función epitelial, de la permeabilidad de la mucosa y una reducción en la secrección de TNF-α e IFN-γ69. Otros estudios similares con diferentes modelos y diferentes bacterias han llegado a conclusiones similares70-72.
En un intento de valorar realmente el efecto antiinflamatorio de ciertos probióticos en la enfermedad inflamatoria intestinal humana, en un estudio llevado a cabo en nuestro laboratorio, se ha investigado el efecto de ciertas bacterias sobre la liberación de TNF-α por la mucosa intestinal de pacientes con enfermedad de Crohn73. Se obtuvieron piezas quirúrgicas de íleon de pacientes con enfermedad de Crohn que no habían respondido al tratamiento convencional. La mucosa se cultivó durante 24 h con diferentes bacterias con propiedades probióticas conocidas. La liberación de TNF-α por la mucosa inflamada de pacientes con enfermedad de Crohn se redujo significativamente al cultivarla con Lactobacillus casei. Además, la incubación con L. casei redujo el número de células CD4 y la expresión de TNF-α en los linfocitos intraepiteliales.
Los estudios con pacientes con enfermedad inflamatoria, aunque prometedores, aún son escasos, por lo que los resultados deben ser tomados con cautela. En niños con enfermedad de Crohn, Lactobacillus GG administrado durante 6 meses inducía una disminución de la permeabilidad de la mucosa intestinal además de una reducción en el índice de actividad clínica74. En dos estudios en los que se asociaba la administración de Saccharomyces boulardii al tratamiento convencional de la enfermedad de Crohn, se demostró el efecto beneficioso de la levadura, tanto en el control de los síntomas del brote agudo como en la reducción de la tasa de recidiva a largo plazo75,76.
En pacientes con colitis ulcerosa se han publicado dos estudios en los que se compara la eficacia de una cepa de Escherichia coli no patógena (Nissle 1917) con la mesalacina en la inducción y mantenimiento de la remisión77,78. La tasa de recidiva conseguida con el probiótico fue similar en ambos grupos, lo que sugiere que el tratamiento con probióticos puede suponer una alternativa como mantenimiento de la remisión en pacientes con colitis ulcerosa. Por el contrario, la adición de la bacteria al tratamiento estándar de la colitis ulcerosa activa no modificó la tasa de remisión ni el tiempo en conseguirla.
Los resultados obtenidos con un mezcla de probióticos (VSL#3) en el tratamiento de mantenimiento de pacientes con pouchitis crónica recidivante han resultado más llamativos79. La pouchitis es una de las complicaciones a largo plazo más frecuentes de los pacientes con reservorio ileoanal y se ha relacionado con una alteración en el equilibrio bacteriano local. Al final del período de estudio, 9 meses, sólo el 15% de los pacientes en el grupo tratado con VSL#3 presentó una recidiva comparado con el 100% de los pacientes en el grupo placebo. Además, todos los enfermos que respondieron al tratamiento con probióticos presentaron una recidiva en los 4 meses siguientes tras suspenderlo. La misma mezcla de probió ticos, en un estudio abierto con 20 pacientes con colitis ulcerosa en remisión, alérgicos o intolerantes al 5-ASA, demostró ser eficaz como tratamiento de mantenimiento80.
CONCLUSIONES
La flora intestinal desempeña un papel fundamental en el desarrollo, maduración y continua remodelación del sistema inmunitario que comienza en el nacimiento y se mantiene a lo largo de toda la vida.
Los resultados de todos los estudios mencionados anteriormente indican que los probióticos poseen una variedad muy amplia de efectos inmunorreguladores, y que éstos difieren cuando se aplican en la población sana o en pacientes con enfermedades inmunoinflamatorias.
Los probióticos han demostrado ser de utilidad en el tratamiento y la prevención de la diarrea infecciosa en niños, así como de la enfermedad atópica. Probablemente, podrán ser aplicados también en las enfermedades inflamatorias intestinales. El conocimiento de los efectos específicos de cada cepa bacteriana sobre la inmunidad del huésped permitirán su aplicación a mayor escala en situaciones clínicas más concretas.