La hemorragia digestiva alta por varices esofagogástricas (HDA por VEG) puede desencadenar una isquemia hepática aguda (IHA). El objetivo de este estudio fue analizar la incidencia de IHA tras una HDA por VEG, los factores de riesgo y su mortalidad.
Pacientes y métodosEstudio retrospectivo sobre pacientes cirróticos con HDA por VEG. Se clasificaron en 2 grupos, determinados por el desarrollo o no de una IHA. Definimos IHA como AST y ALT por encima de 10 veces el valor basal, descartando otras causas de hepatitis aguda. El tratamiento inicial estándar fue soporte hemodinámico, endoscopia urgente con ligadura con bandas y/o escleroterapia, somatostatina y antibióticos. En caso de fracaso de estas medidas, se recurrió a la implantación de una derivación portosistémcica percutánea intrahepática (DPPI). Ambos grupos (IHA y no-IHA) fueron comparados.
ResultadosDurante un periodo de 5 años, se recogieron 68 pacientes con HDA por VEG. La incidencia de IHA fue del 16,2%. Tras el análisis univariante, los factores asociados con IHA fueron la diabetes mellitus (OR: 7,5; IC: 1,9-29), shock (OR: 8,5; IC: 2,06-34) y la persistencia de la hemorragia (OR: 9, IC: 1,6-49, p=0,03). En el análisis multivariante solo mostraron significación estadística la diabetes mellitus (OR: 8,61; IC: 1,4-52,5) y el shock (OR: 7,58; IC: 1,26-45,51). La mortalidad del grupo de IHA fue mayor (45%) que en el grupo no-IHA (10,5%) (p=0,012).
ConclusionesLa IHA tras una hemorragia digestiva por VEG en el paciente cirrótico ocurrió en el 16,2%, asociándose con un peor pronóstico y una mortalidad del 45%. Nuestros resultados sugieren que la diabetes mellitus y el shock hipovolémico son factores de riesgo para el desarrollo de IHA. La detección precoz de estos pacientes en riesgo podría por tanto ayudar a prevenir la IHA.
Variceal upper gastrointestinal bleeding (UGIB) can trigger acute hypoxic hepatitis (AHH). The aim of this study was to analyse the incidence, associated risk factors and mortality of AHH after variceal UGIB.
Patients and methodsRetrospective study of cirrhotic patients with variceal UGIB, classified into 2 groups according to the development of AHH. AHH was diagnosed when AST and ALT reached levels 10 times above the upper limit of normal, after ruling out other causes of hepatitis. The standard initial treatment consisted of haemodynamic support, emergency endoscopy with rubber band ligation, somatostatin and antibiotics. In the case of failure of primary haemostasis, a transjugular intrahepatic portosystemic shunt (TIPS) was implanted. Both groups (AHH and non-AHH) were compared.
ResultsSixty-eight cirrhotic patients with variceal UGIB admitted to the gastroenterology department of Hospital Ramón y Cajal between January 2007 and March 2012 were analysed. Eleven of these patients (16.2%) developed AHH. Univariate analysis showed the following items as risk factors: diabetes (OR: 7.5; CI: 1.9-29), shock (OR: 8.5; CI: 2.06-34) and persistent bleeding (OR: 9.0, CI: 1.6-49, P=.03). However, multivariate analysis confirmed only diabetes (OR: 8.61; CI: 1.4-52.5) and shock (OR: 7.58; CI: 1.26-45.51) as risk factors. Mortality rate in the AHH group was 45%, compared to 10.5% in the non-HAA group (P=.012).
ConclusionsAHH after variceal UGIB occurred in 16.2% of cirrhotic patients and was associated with a poorer prognosis, with a mortality rate of 45%. Our findings suggest that diabetes and shock are risk factors for the development of AHH. Early identification of at-risk patients could therefore help prevent AHH.
La isquemia hepática aguda (IHA), también llamada hepatitis isquémica o hipóxica, es resultado de la hipoxia del tejido hepático, que produce una necrosis centrolobulillar aguda1. La isquemia-hipoperfusión del tejido hepático no es el único mecanismo implicado, por lo que muchos autores prefieren el nombre de hepatitis hipóxica para esta entidad2. El hígado es mucho más resistente que otros órganos a la hipoperfusión debido a su sistema de doble aporte sanguíneo, constituido el 75% por la vena porta y el 25% por la arteria hepática. Sin embargo, la IHA puede producirse en diferentes situaciones como son la enfermedad cardiovascular, la insuficiencia respiratoria o el shock circulatorio (sepsis, hipovolemia). Según un estudio prospectivo realizado en una unidad de cuidados intensivos durante un periodo de 10 años, su incidencia puede ser de hasta el 0,9%3. La gravedad de esta entidad viene determinada por la enfermedad subyacente, pudiendo llegar a una mortalidad del 72%4.
La IHA se diagnostica al observarse una marcada elevación de transaminasas de forma transitoria en el seno de un cuadro clínico compatible como los anteriormente citados, descartando otras causas de elevación de las mismas5. Este punto de corte ha sido debatido, considerándose razonable para el diagnóstico de IHA la elevación de transaminasas de hasta 10 veces el límite de la normalidad6.
Los pacientes cirróticos tienen una función hepática deteriorada, por lo que parece probable pensar que pueden ser más susceptibles al desarrollo de una IHA que los pacientes que no tienen una hepatopatía previa. En los pacientes cirróticos, debido a la hipertensión portal se pueden desarrollar varices esofágicas y/o gástricas (VEG) en la evolución de su enfermedad. La hemorragia digestiva en estos casos tiene per se una mortalidad del 15%, que puede aumentar hasta el 80% en caso de desarrollo de una IHA7–9. Según Amitrano et al. la incidencia en pacientes cirróticos tras hemorragia digestiva alta (HDA) varía entre el 1,5 y el 12%9. Los factores que se han relacionado con una mayor mortalidad son el INR elevado, puntuación SOFA, terapia renal sustitutiva y shock séptico10,11.
El objetivo de este estudio fue analizar la incidencia y características de la IHA tras una HDA por VEG, así como valorar los factores que se asocian con esta.
Enfermos y métodosSe incluyeron de forma retrospectiva 68 pacientes con cirrosis hepática que presentaron HDA por VEG en un periodo comprendido entre enero de 2007 y marzo de 2012. Se excluyeron los menores de 18 años, trasplantados hepáticos o aquellos en los que no se realizó endoscopia en las primeras 24h de la HDA así como los pacientes de los cuales no se disponían de datos suficientes de la evolución durante el ingreso. El diagnóstico de cirrosis se hizo, bien por biopsia hepática realizada previamente, bien por datos clínico-analíticos y ecográficos. El diagnóstico de hemorragia se llevó a cabo por la presentación clínica y los hallazgos analíticos, y se consideró hemorragia activa por VEG de acuerdo con los criterios de Baveno III12. Para la definición de hemorragia no controlada se utilizaron las recomendaciones del Consenso de Baveno V: presencia de hematemesis fresca o débito por sonda nasogástrica mayor de 100ml tras 2h desde el comienzo de tratamiento farmacológico o endoscópico específico; desarrollo de shock hipovolémico; o descenso de 3g de hemoglobina en un periodo de 24h sin administrar transfusión13. Se consideró recidiva hemorrágica cuando se dieron los supuestos anteriormente mencionados una vez transcurridas 24h de la HDA, inicialmente controlada.
La causa de la hemorragia se filió con la endoscopia oral (endoscopia gastroduodenal), que se realizó en las primeras 12h del episodio en todos los casos. El diagnóstico de IHA se basó en los siguientes criterios: elevación de transaminasas por encima de 10 veces el valor superior de normalidad (AST>500UI/ml y ALT>400UI/ml) y ausencia de otras causas de elevación de transaminasas6. Para ello se realizaron serologías (hepatitis A, hepatitis B, hepatitis C y en algunos casos otras más específicas como hepatitis E, Citomegalovirus o Epstein Barr); determinación de anticuerpos autoinmunes, cerulopasmina, cobre en sangre y en orina y se hizo una anamnesis detallada clínica para descartar causas tóxicas. En ningún caso de IHA se efectuó biopsia hepática.
Todos los pacientes recibieron en el momento agudo de la hemorragia el tratamiento estándar establecido: fluidoterapia, somatostatina (bolo de 500μg seguidos de 6mg/250cc de suero salino fisiológico en perfusión continua a 21ml/h) y profilaxis de infección con cefalosporina de 3.a generación. El tratamiento endoscópico de elección fue la colocación de bandas elásticas asociado o no a inyección de etoxiesclerol, y en aquellos pacientes en los que falló la hemostasia primaria se recurrió a la colocación de una derivación portosistémica percutánea intrahepática (DPPI). Se transfundieron hemoderivados siguiendo las siguientes pautas generales, aunque se individualizó en cada caso según el criterio médico: concentrados de hematíes si Hb<8g/dl, plasma fresco congelado si INR>2 y plaquetas si el recuento plaquetario era menor de 50.000UI/ml.
Se estudiaron diferentes variables clínicas y analíticas de los 68 pacientes con HDA por VEG, comparándose posteriormente entre los pacientes que presentaron IHA y los que no. Las características basales analizadas fueron: edad, sexo, comorbilidad (cardiopatía, enfermedad pulmonar crónica, hipertensión), toma de antiagregantes o anticoagulantes, etiología de la hepatopatía, presencia de hepatocarcinoma y/o de trombosis portal, estadio Child y puntuación MELD. En el momento agudo de la hemorragia se tuvieron en cuenta las constantes vitales (frecuencia cardiaca y presión arterial media, presencia de shock), los hallazgos endoscópicos, la necesidad de transfusión de hemoderivados, así como valores analíticos (hemoglobina, creatinina, transaminasas, lactato deshidrogenasa, glucemia). Se revisó la evolución de las transaminasas tras la admisión en todos los pacientes, identificando el momento de aparición del pico de transaminasas y su evolución posterior. Además se valoró la evolución del paciente hasta el alta de hospitalización o exitus, teniendo en cuenta el desarrollo de complicaciones y los tratamientos recibidos14.
Para el análisis estadístico se utilizó el paquete SPSS 20.00. Las variables cuantitativas se expresaron en medianas (rango intercuartílico) o medias (desviación estándar) y las cualitativas en porcentajes y valores absolutos. Se utilizaron la t de Student y la U Mann Whitney para el análisis de las primeras según procediera y el test de Fisher para las segundas. Se consideró p significativa cuando p<0,05. Se realizó posteriormente un análisis multivariante mediante regresión logística incluyendo las variables estadísticamente significativas en el análisis univariante y aquellas que consideramos relevantes teniendo en cuenta la evidencia científica actual y su plausibilidad biológica.
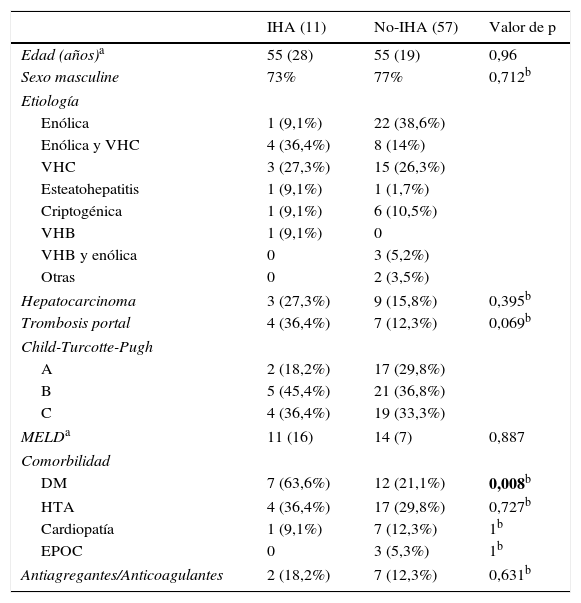
ResultadosDe 68 pacientes analizados, 11 (16,2%) presentaron IHA. Las características demográficas de los pacientes con HDA se muestran en la tabla 1. Se puede observar que ambos grupos estaban constituidos mayoritariamente por hombres (73-77%), siendo la causa de hepatopatía más frecuente el alcohol y el VHC. El grupo de pacientes con IHA presentó una mayor proporción de trombosis portal (36,4 vs. 12,3%; p=0,069) y hepatocarcinoma (27,3 vs. 15,8%) que el grupo no-IHA, aunque no alcanzó significación estadística en el análisis univariante. En cambio, se comprobó que el número de pacientes con diabetes mellitus (DM) fue mayor en el grupo de IHA de forma significativa (OR: 7,5; IC: 1,9-29; p=0,008).
Características demográficas
| IHA (11) | No-IHA (57) | Valor de p | |
|---|---|---|---|
| Edad (años)a | 55 (28) | 55 (19) | 0,96 |
| Sexo masculine | 73% | 77% | 0,712b |
| Etiología | |||
| Enólica | 1 (9,1%) | 22 (38,6%) | |
| Enólica y VHC | 4 (36,4%) | 8 (14%) | |
| VHC | 3 (27,3%) | 15 (26,3%) | |
| Esteatohepatitis | 1 (9,1%) | 1 (1,7%) | |
| Criptogénica | 1 (9,1%) | 6 (10,5%) | |
| VHB | 1 (9,1%) | 0 | |
| VHB y enólica | 0 | 3 (5,2%) | |
| Otras | 0 | 2 (3,5%) | |
| Hepatocarcinoma | 3 (27,3%) | 9 (15,8%) | 0,395b |
| Trombosis portal | 4 (36,4%) | 7 (12,3%) | 0,069b |
| Child-Turcotte-Pugh | |||
| A | 2 (18,2%) | 17 (29,8%) | |
| B | 5 (45,4%) | 21 (36,8%) | |
| C | 4 (36,4%) | 19 (33,3%) | |
| MELDa | 11 (16) | 14 (7) | 0,887 |
| Comorbilidad | |||
| DM | 7 (63,6%) | 12 (21,1%) | 0,008b |
| HTA | 4 (36,4%) | 17 (29,8%) | 0,727b |
| Cardiopatía | 1 (9,1%) | 7 (12,3%) | 1b |
| EPOC | 0 | 3 (5,3%) | 1b |
| Antiagregantes/Anticoagulantes | 2 (18,2%) | 7 (12,3%) | 0,631b |
DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IHA: isquemia hepática aguda; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
En negrita, variables con p significativa.
El grupo de pacientes que desarrollaron una IHA estaba compuesto por 8 hombres y 3 mujeres, con una mediana de edad de 55 (28) años. El cálculo del estadio Child se distribuía de la siguiente forma: 5 estadio B (45,4%), 4 estadio C (36,4%) y 2 estadio A (18,2%). La puntuación MELD era de 11 (16).
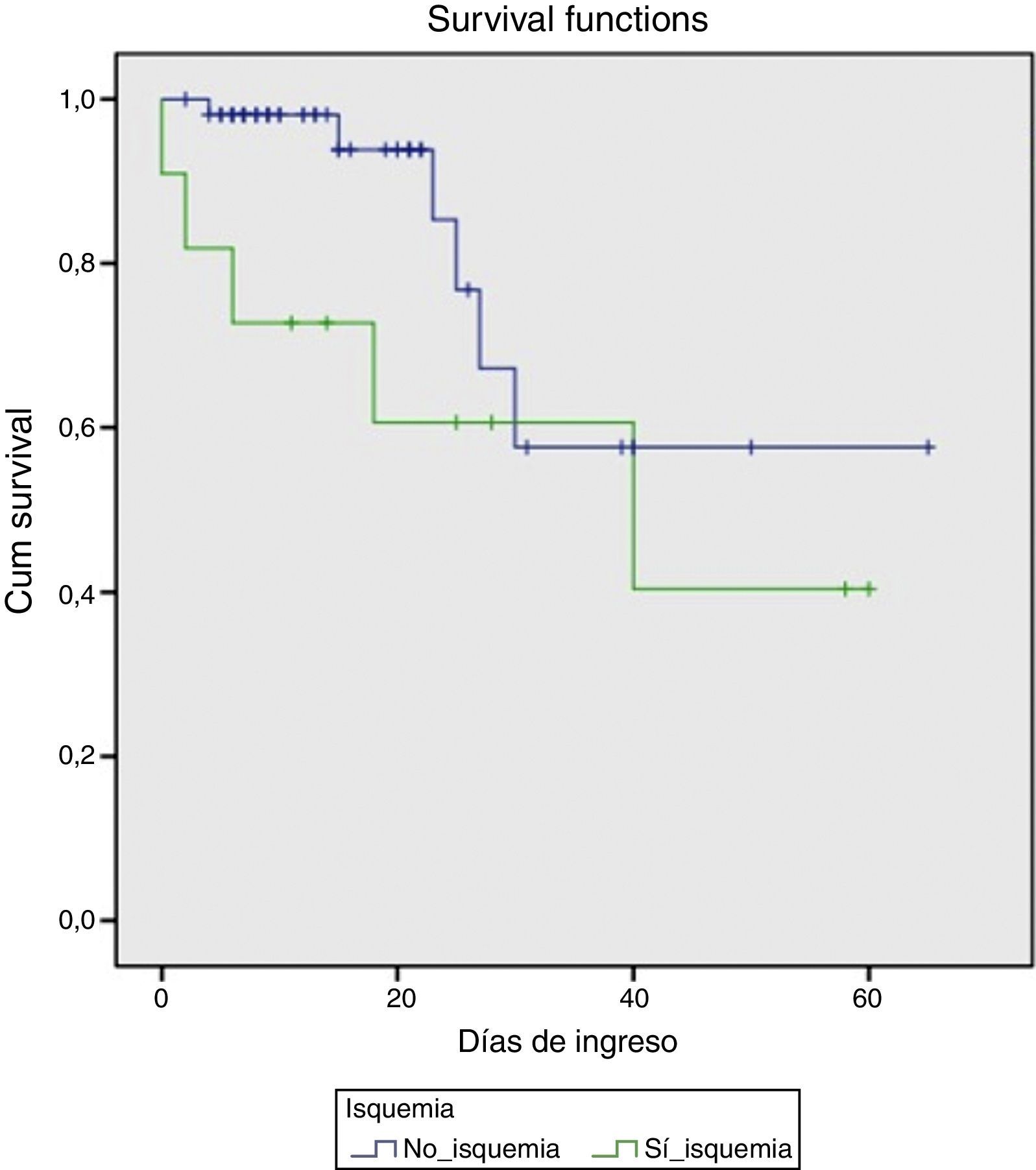
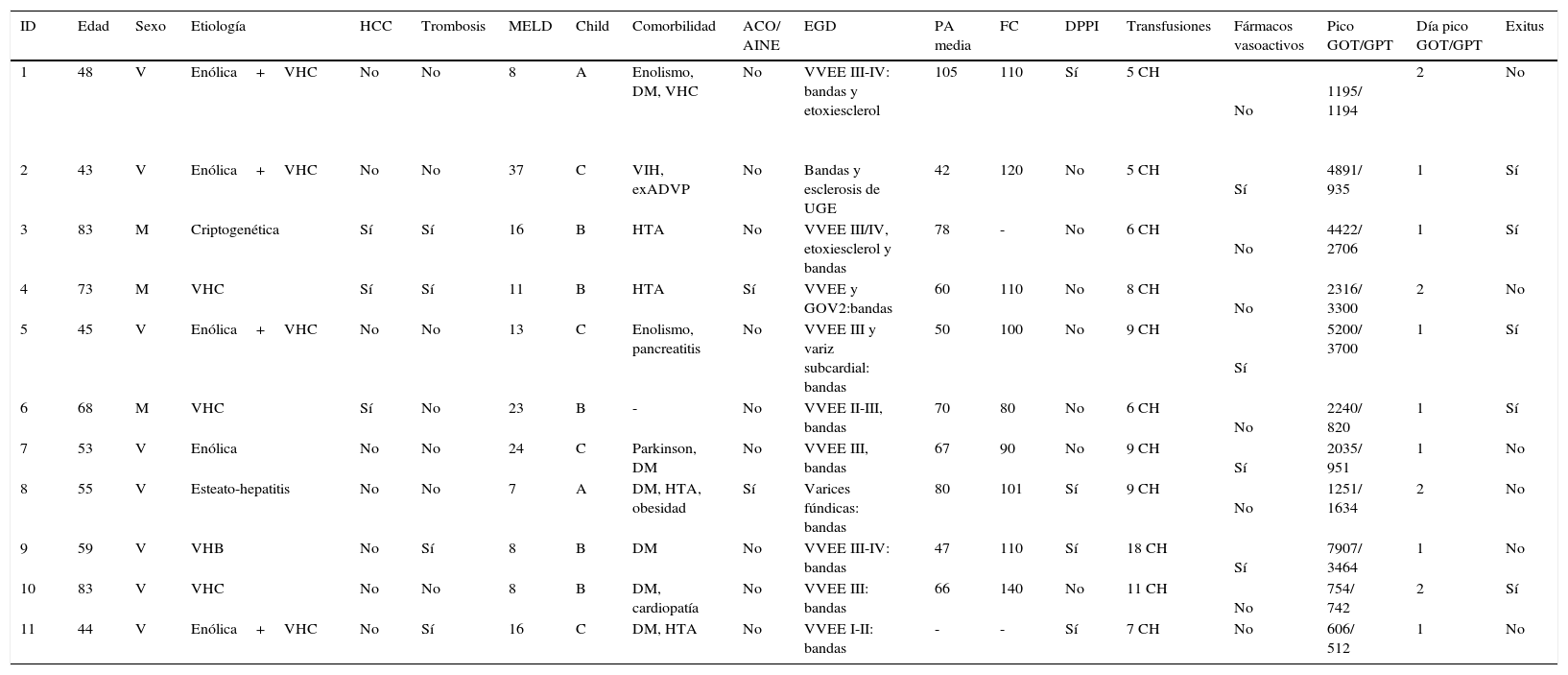
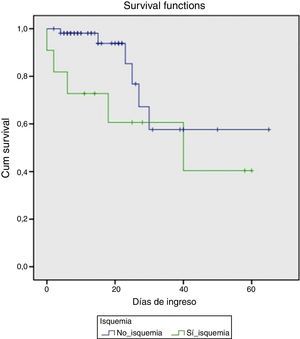
En el momento agudo de la hemorragia los hallazgos endoscópicos fueron los representados en la tabla 2. Se observó hemorragia activa con sangrado en chorro en 8 de los pacientes. En todos los casos se colocaron bandas elásticas y en tres de ellos se complementó la terapéutica con inyección de etoxiesclerol. Posteriormente, 4 pacientes requirieron la implantación de una DPPI, bien debido a un mal control inicial de la hemorragia (días 0 y +1 de la HDA), bien por recidiva hemorrágica (día +4 y +10). Todos ellos fueron supervivientes a los 6 meses. Fue necesaria la transfusión de hemoderivados en todos los casos, con una mediana por paciente de 7 (DE 3) concentrados de hematíes. En cuanto a la evolución analítica de las transaminasas, el pico máximo se alcanzó en el día +1 (7 pacientes) o en el día +2 (4 pacientes). Se observó un descenso progresivo, alcanzando niveles por debajo de 400 el día +5 de media (DE 2) y normalizándose el día +8 (DE 2). Este grupo de pacientes tuvo una mortalidad marcada (45%), comparado con el grupo que no desarrolló una IHA(10,5%), (p=0,012). Las probabilidades de supervivencia en ambos grupos se muestran en la figura 1.
Características de los pacientes que desarrollaron una IHA
| ID | Edad | Sexo | Etiología | HCC | Trombosis | MELD | Child | Comorbilidad | ACO/ AINE | EGD | PA media | FC | DPPI | Transfusiones | Fármacos vasoactivos | Pico GOT/GPT | Día pico GOT/GPT | Exitus |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 48 | V | Enólica+VHC | No | No | 8 | A | Enolismo, DM, VHC | No | VVEE III-IV: bandas y etoxiesclerol | 105 | 110 | Sí | 5 CH | No | 1195/ 1194 | 2 | No |
| 2 | 43 | V | Enólica+VHC | No | No | 37 | C | VIH, exADVP | No | Bandas y esclerosis de UGE | 42 | 120 | No | 5 CH | Sí | 4891/ 935 | 1 | Sí |
| 3 | 83 | M | Criptogenética | Sí | Sí | 16 | B | HTA | No | VVEE III/IV, etoxiesclerol y bandas | 78 | - | No | 6 CH | No | 4422/ 2706 | 1 | Sí |
| 4 | 73 | M | VHC | Sí | Sí | 11 | B | HTA | Sí | VVEE y GOV2:bandas | 60 | 110 | No | 8 CH | No | 2316/ 3300 | 2 | No |
| 5 | 45 | V | Enólica+VHC | No | No | 13 | C | Enolismo, pancreatitis | No | VVEE III y variz subcardial: bandas | 50 | 100 | No | 9 CH | Sí | 5200/ 3700 | 1 | Sí |
| 6 | 68 | M | VHC | Sí | No | 23 | B | - | No | VVEE II-III, bandas | 70 | 80 | No | 6 CH | No | 2240/ 820 | 1 | Sí |
| 7 | 53 | V | Enólica | No | No | 24 | C | Parkinson, DM | No | VVEE III, bandas | 67 | 90 | No | 9 CH | Sí | 2035/ 951 | 1 | No |
| 8 | 55 | V | Esteato-hepatitis | No | No | 7 | A | DM, HTA, obesidad | Sí | Varices fúndicas: bandas | 80 | 101 | Sí | 9 CH | No | 1251/ 1634 | 2 | No |
| 9 | 59 | V | VHB | No | Sí | 8 | B | DM | No | VVEE III-IV: bandas | 47 | 110 | Sí | 18 CH | Sí | 7907/ 3464 | 1 | No |
| 10 | 83 | V | VHC | No | No | 8 | B | DM, cardiopatía | No | VVEE III: bandas | 66 | 140 | No | 11 CH | No | 754/ 742 | 2 | Sí |
| 11 | 44 | V | Enólica+VHC | No | Sí | 16 | C | DM, HTA | No | VVEE I-II: bandas | - | - | Sí | 7 CH | No | 606/ 512 | 1 | No |
ACO: anticoagulantes orales; ADVP: adictos a drogas por vía parenteral; AINE: antiinflamatorios no esteroideos; CH: concentrado de hematíes; DM: diabetes mellitus; DPPI: derivación portosistémica intrahepática; EGD: endoscopia gastroduodenal; FC: frecuencia cardiaca; HCC: hepatocarcinoma; HTA: hipertensión arterial; ID: Paciente; M: mujer; PA: presión arterial; UGE: unión gastroesofágica; V: varón; VVEE: varices esofágicas; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
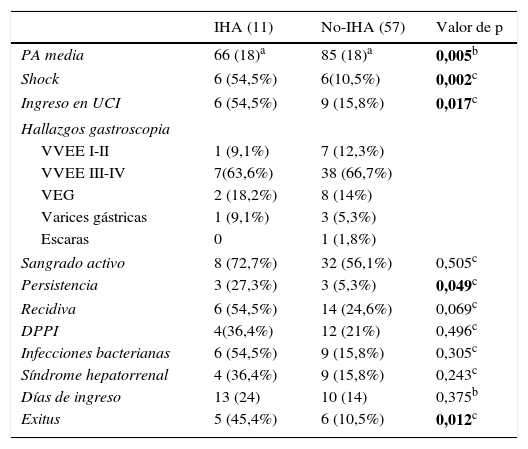
Las características del momento agudo del sangrado así como los valores analíticos y su evolución posterior se recogen en la tabla 3.
Características de la hemorragia y evolución
| IHA (11) | No-IHA (57) | Valor de p | |
|---|---|---|---|
| PA media | 66 (18)a | 85 (18)a | 0,005b |
| Shock | 6 (54,5%) | 6(10,5%) | 0,002c |
| Ingreso en UCI | 6 (54,5%) | 9 (15,8%) | 0,017c |
| Hallazgos gastroscopia | |||
| VVEE I-II | 1 (9,1%) | 7 (12,3%) | |
| VVEE III-IV | 7(63,6%) | 38 (66,7%) | |
| VEG | 2 (18,2%) | 8 (14%) | |
| Varices gástricas | 1 (9,1%) | 3 (5,3%) | |
| Escaras | 0 | 1 (1,8%) | |
| Sangrado activo | 8 (72,7%) | 32 (56,1%) | 0,505c |
| Persistencia | 3 (27,3%) | 3 (5,3%) | 0,049c |
| Recidiva | 6 (54,5%) | 14 (24,6%) | 0,069c |
| DPPI | 4(36,4%) | 12 (21%) | 0,496c |
| Infecciones bacterianas | 6 (54,5%) | 9 (15,8%) | 0,305c |
| Síndrome hepatorrenal | 4 (36,4%) | 9 (15,8%) | 0,243c |
| Días de ingreso | 13 (24) | 10 (14) | 0,375b |
| Exitus | 5 (45,4%) | 6 (10,5%) | 0,012c |
DPPI: derivación portosistémica percutánea intrahepática; PA: presión arterial; UCI: Unidad de Cuidados Intensivos; VEG: varices esofagogástricas; VVEE: varices esofágicas.
En negrita quedan resaltadas las variables con p significativa.
En el análisis univariante, se observó que los pacientes que desarrollaron una IHA presentaron con mayor frecuencia shock hemodinámico (OR: 8,5; IC: 2,06-34;p=0,002) que el grupo no-IHA, con valores de presión arterial media de 85 y 68mmHg respectivamente. Por consiguiente, los primeros requirieron más ingresos en la Unidad de Cuidados Intensivos. (54,5 vs. 15,8%; p=0,017). Asimismo, la hemoglobina basal en el primer grupo presentó valores inferiores (8 vs. 10g/dl; p=0,025).
Por otro lado, la hemorragia fue más persistente en el grupo de isquemia (OR: 9, IC: 1,6-49; p=0,03), aunque no se objetivó una diferencia estadísticamente significativa en la recidiva hemorrágica (OR: 2; IC: 0,6-8; p=0,228).
Durante su evolución, las alteraciones en el metabolismo glucémico se dieron de forma más frecuente en el grupo de IHA (72,7 vs. 35,1%; p=0,041), lo que va en concordancia con la mayor proporción de pacientes diabéticos en este grupo.
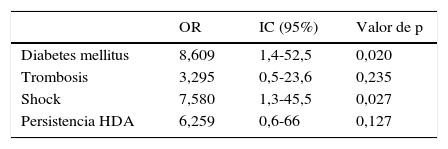
A partir de los datos anteriores se realizó la regresión logística multivariante (tabla 4). Dada la equivalencia de algunas variables, se simplificó el análisis introduciendo aquella más representativa: se utilizó la variable de «shock», obviando la de la presión arterial media y el ingreso en Unidad de Cuidados Intensivos, así como se incluyó la variable «DM», sin considerar las alteraciones glucémicas. Por otro lado, dada la plausibilidad biológica, se incluyó la trombosis portal a pesar de no ser significativa en el análisis univariante. Como resultado, alcanzaron significación estadística la DM (OR: 8,61; IC: 1,4-52,5; p=0,02) y la presencia de shock (OR: 7,58; IC: 1,26-45,51; p=0,03).
DiscusiónLa hemorragia digestiva por VEG es un proceso que conlleva una alteración hemodinámica importante. Los pacientes cirróticos tienen una función hepática ya deteriorada por lo que parece lógico pensar que la susceptibilidad a un daño isquémico puede ser mayor en un paciente de estas características que en personas con función hepática conservada. De acuerdo con esta hipótesis, observamos en nuestro estudio una incidencia del 16,2%. Sin embargo, la literatura ofrece datos controvertidos a este respecto: mientras Fuhrmann et al.4 y Amitrano et al.9 describen una incidencia de IHA en el cirrótico del 15 y 6,8% respectivamente, Henrion et al.8 encuentran este fenómeno como muy infrecuente.
La IHA cursa con un patrón típico de elevación de transaminasas, con un aumento brusco en los primeros días y un descenso gradual posterior15. En nuestra serie comprobamos que el pico máximo se alcanzó el día +1 (7 pacientes) o en el día +2 (4 pacientes) tras la HDA, descendiendo de forma progresiva hasta su normalización el día +8 (DE 2) en todos los pacientes.
Tras el análisis univariante de los datos, observamos que los factores asociados con el desarrollo de una IHA fueron la presencia de DM (OR: 7,5; IC: 1,9-29), shock (OR: 8,5; IC: 2,06-34) y la persistencia de la hemorragia (OR: 9; IC: 1,6-49). La presencia de hepatocarcinoma no mostró una diferencia estadísticamente significativa, como tampoco lo hizo la trombosis portal. Sin embargo, se puede observar que esta última es más frecuente en los pacientes con IHA (36,4 vs. 12,3%; p=0,069). Esto junto con la literatura actual y la plausibilidad biológica, pueden hacer pensar que se trate de un problema de potencia del estudio para alcanzar la significación estadística. Tampoco se encontró entre los posibles factores predictores la puntuación en la escala de Child- Pugh al ingreso.
El análisis multivariante solo confirmó la significación estadística para la presencia de DM (OR: 8,61; IC: 1,4-52,5) y de shock (OR: 7,58; IC: 1,26-45,51).
Estos resultados coinciden parcialmente con los hallados en la serie de Amitrano et al, en la que la DM, la persistencia de la hemorragia y la trombosis portal se identificaron como factores de riesgo estadísticamente significativos.
Teniendo en cuenta la historia natural de la DM, estos resultados resultan plausibles. Los pacientes diabéticos sufren a lo largo de su enfermedad una afectación micro- y macrovascular, desarrollando posteriormente complicaciones como la nefropatía, retinopatía, cardiopatía o arteriopatía diabética. Esta vasculopatía también puede permanecer silente hasta manifestarse en situaciones que alteren el equilibrio hemodinámico, como sería el caso de una HDA por VEG16. Por tanto, dado que los pacientes diabéticos no tienen los mismos mecanismos compensadores que un paciente sin esta enfermedad, ante un caso de hipovolemia, es lógico pensar que puedan tener mayor tendencia al desarrollo de una IHA17.
Por otro lado, la presencia de shock es un indicador de una hemorragia grave y/o del fracaso del sistema cardiovascular para mantener una estabilidad hemodinámica. En ambas situaciones, el fracaso en la perfusión de los tejidos conduce a situaciones de hipoxia, pudiendo desencadenar la IHA.
La IHA, más aún en pacientes cirróticos, conlleva una alta mortalidad, observando en nuestra serie cifras del 45% en el grupo IHA. A pesar de observar una mortalidad alta nuestros datos son más optimistas que los de otros estudios, que llegan a ser del 83%9. Esto podría estar relacionado con la implantación de DPPI en 4 de los pacientes (36%), con una supervivencia a los 6 meses en este grupo del 100%. En 2 de ellos se hizo de una forma precoz (día 0 y día 1) y en los otros 2 de forma más tardía (día +4 y +10). La implantación de DPPI precoz (menos de 72h tras hemorragia digestiva) ha demostrado ser efectiva en el control de la hemorragia digestiva, mejorando las tasas de resangrado y de mortalidad18. Sin embargo, esto no ha sido objeto de este estudio.
La relevancia de este estudio radica en la detección de posibles factores de riesgo para seleccionar a aquellos pacientes con más riesgo de IHA, con el fin de implementar medidas preventivas que eviten el desarrollo de la misma. Actualmente, la mejor estrategia de prevención es evitar la causa, pero sabemos que una vez ocurrido el posible desencadenante se debe intentar mantener el equilibrio hemodinámico en la medida de lo posible en cada paciente. Partiendo de estas premisas y aplicado al paciente cirrótico con HDA por VEG, el control inicial de la hemorragia o la instauración de medidas de forma inmediata en los casos de recidiva es vital para evitar el desarrollo de la IHA y en consecuencia disminuir la mortalidad.
Somos conscientes de las limitaciones del estudio, que impiden sacar conclusiones categóricas del mismo. En primer lugar, al tratarse de un análisis retrospectivo, pueden existir sesgos de selección. Además, el pequeño tamaño muestral resta potencia al estudio. De la misma forma, el pequeño número de casos de IHA limita las posibilidades del análisis multivariante, obteniendo unos valores de OR probablemente sobredimensionados.
En conclusión, a pesar de las limitaciones del estudio, nuestros datos muestran que la incidencia de IHA en el contexto de una hemorragia digestiva por VEG en el paciente cirrótico es del 16,2% y empeora claramente el pronóstico, con una mortalidad del 45%. Nuestros datos muestran que hay factores que se asocian con una mayor incidencia de IHA como son la DM y el shock hipovolémico, por lo que detectar estos pacientes en riesgo puede ser una medida preventiva de IHA. El pequeño tamaño muestral del estudio no permite sacar conclusiones definitivas y sería necesario el desarrollo de estudios multicéntricos con un mayor número de pacientes para comprobar nuestra hipótesis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.