INTRODUCCIÓN
La leishmaniasis es una parasitosis del sistema mononuclear-fagocítico producida por protozoos del género Leishmania, originarios de los roedores que, transmitidos por medio de moscas flebótomos, se han adaptado a los cánidos y también al ser humano, en el que pueden dar lugar a diferentes síndromes. En nuestro medio, la forma clínica más frecuente es la leishmaniasis visceral (LV), o Kala-azar, causada por la Leishmania donovani, que afecta fundamentalmente a individuos con algún tipo de inmunodepresión celular1,2.
Mycobacterium avium complex (MAC) pertenece al grupo de micobacterias ambientales oportunistas, menos virulentas que Mycobacterium tuberculosis, que sólo produce infección sintomática en individuos inmunodeprimidos, en los que puede causar enfermedad pulmonar, ganglionar o diseminada3,4.
El advenimiento de la pandemia producida por el virus de la inmunodeficiencia humana (VIH) ha provocado un cambio en la epidemiología de algunas infecciones, como la LV y las micobacteriosis tuberculosas y no tuberculosas, de manera que el mayor número de casos afecta a este subgrupo de pacientes5,6. Con menor frecuencia se han asociado estas infecciones oportunistas a otras situaciones de inmunodeficiencia, como en pacientes trasplantados, oncológicos en tratamiento con quimioterapia, tratados con esteroides durante períodos largos y en los pacientes con neoplasias hematológicas4,7, como es el caso que nos ocupa. El síndrome de Sézary (SZ) es una enfermedad linfoproliferativa de origen cutáneo, que representa la fase leucémica de la micosis fungoide, cuando se produce una extensión ganglionar, sanguínea y medular8.
Presentamos el caso de un paciente diagnosticado de SZ que se complicó con una coinfección por Leishmania y MAC. La ausencia de infección por el VIH y la afección intestinal por ambos patógenos, documentada por la imagen endoscópica y la identificación histológica del parásito y la micobacteria, justifican el interés de esta comunicación.
CASO CLÍNICO
Varón de 34 años de edad, ex fumador de 20 cigarrillos/día, no bebedor y consumidor ocasional de cocaína y cannabis, sin conductas de riesgo para la infección por el VIH. Había sido diagnosticado en el año 1999 de un SZ con afección ganglionar y medular, para el que había recibido diferentes tratamientos: fotoféresis, interferón-gamma (INF-*) y metotrexato (sin respuesta), clorambucilo y prednisona (con significativa mejoría, aunque esta última tuvo que suspenderse por complicarse con una queratitis herpética). En el año 2002 presentó un cuadro de fiebre, adenopatías, esplenomegalia y pancitopenia, y fue diagnosticado de LV mediante biopsia de médula ósea. La enfermedad fue controlada con anfotericina B liposomal pero en los años 2003 y 2004 la LV recidivó, por lo que se pautó profilaxis con una dosis parenteral del mismo fármaco durante todos los meses. Coincidiendo con la primera recidiva, se cultivó una micobacteria no tipificada en la médula ósea, para la que fue tratado con 4 fármacos tuberculostáticos. Además, durante los diversos ingresos hospitalarios se produjeron bacteriemias por Staphylococcus aureus meticilín-resistentes.
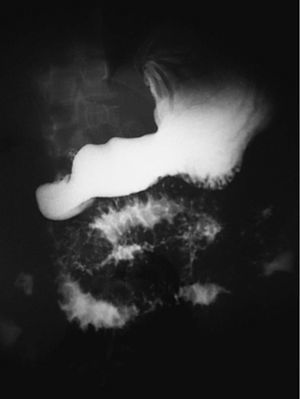
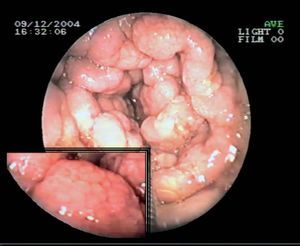
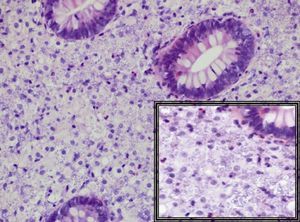
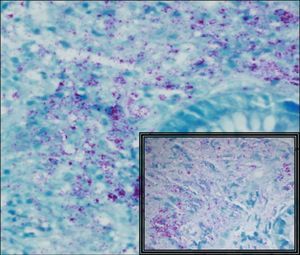
En enero del año 2005 el paciente ingresó en el servicio de dermatología de nuestro hospital para el estudio de múltiples verrugas cutáneas y genitales de difícil tratamiento. El paciente además refería una intensa epigastralgia que empeoraba con la ingesta, náuseas, vómitos y diarrea. Había perdido 14 kg de peso durante los 2 meses previos. Por este motivo, se solicitó una valoración por parte del servicio de medicina del aparato digestivo. A la exploración física destacaba lo siguiente: estado de desnutrición, gran hepatoesplenomegalia no dolorosa, adenopatías inguinales y múltiples verrugas en las regiones acras y los genitales. En la analítica se constató la presencia de una pancitopenia grave (hemoglobina 8,4 g/dl; hematocrito 24%; leucocitos 1.350/µl; plaquetas 86.000/µl), elevación de reactantes de fase aguda (velocidad de sedimentación globular 52 mm/h; proteína C reactiva 40 ng/dl, fibrinógeno 426 mg/dl) y datos de desnutrición (proteínas totales 4,4 g/l; albúmina 1,6 g/l; colesterol 86 mg/dl; triglicéridos 66 mg/dl). El estudio microbiológico de las heces y las serologías para virus y bacterias (incluidas las del VIH y Leishmania), el Mantoux y las tinciones de Ziehl-Nielsen en esputo y orina fueron repetidamente negativos. Se realizó un estudio inmunológico que demostró la presencia de una intensa linfopenia con nula producción de INF-* e interleucina-5. En la tomografía computarizada abdominal, además de hepatosplenomegalia y adenopatías retroperitoneales, destacaba el engrosamiento difuso de la pared intestinal, confirmado en la ecografía abdominal y en el tránsito intestinal baritado (fig. 1). Se realizó una gastroscopia que demostró un notable engrosamiento de los pliegues duodenales, con un patrón en «empedrado y nodular» (fig. 2). En el estudio histológico de las biopsias duodenales obtenidas durante la endoscopia se identificaron parásitos en el interior de los macrófagos, con las características de la Leishmania (fig. 3). También se encontraron granulomas y bacilos ácido-alcohol resistentes tipificados como MAC, mediante tinción de Ziehl-Nielsen (fig. 4). El paciente recibió un nuevo ciclo de anfotericina B liposomal y se añadieron tuberculostáticos (claritromicina, rifabutina y etambutol). Sin embargo, no se obtuvo respuesta, por lo que se planteó un intento terapéutico con miltefosina, un nuevo agente anti-Leishmania en fase de investigación, que el enfermo aceptó, y que está autorizado por el Ministerio de Sanidad para su uso compasivo. Inicialmente, se produjo una importante mejoría de su estado general, de la sintomatología digestiva y de los parámetros nutricionales, por lo que el paciente fue dado de alta tras un ciclo de 20 días de tratamiento con miltefosina, junto con los fármacos tuberculostáticos. Sin embargo, 10 días después, reingresó a causa de una neutropenia febril y una neumonía nosocomial, que no mejoró con antibioterapia de amplio espectro; finalmente, el paciente falleció en situación de distrés respiratorio.
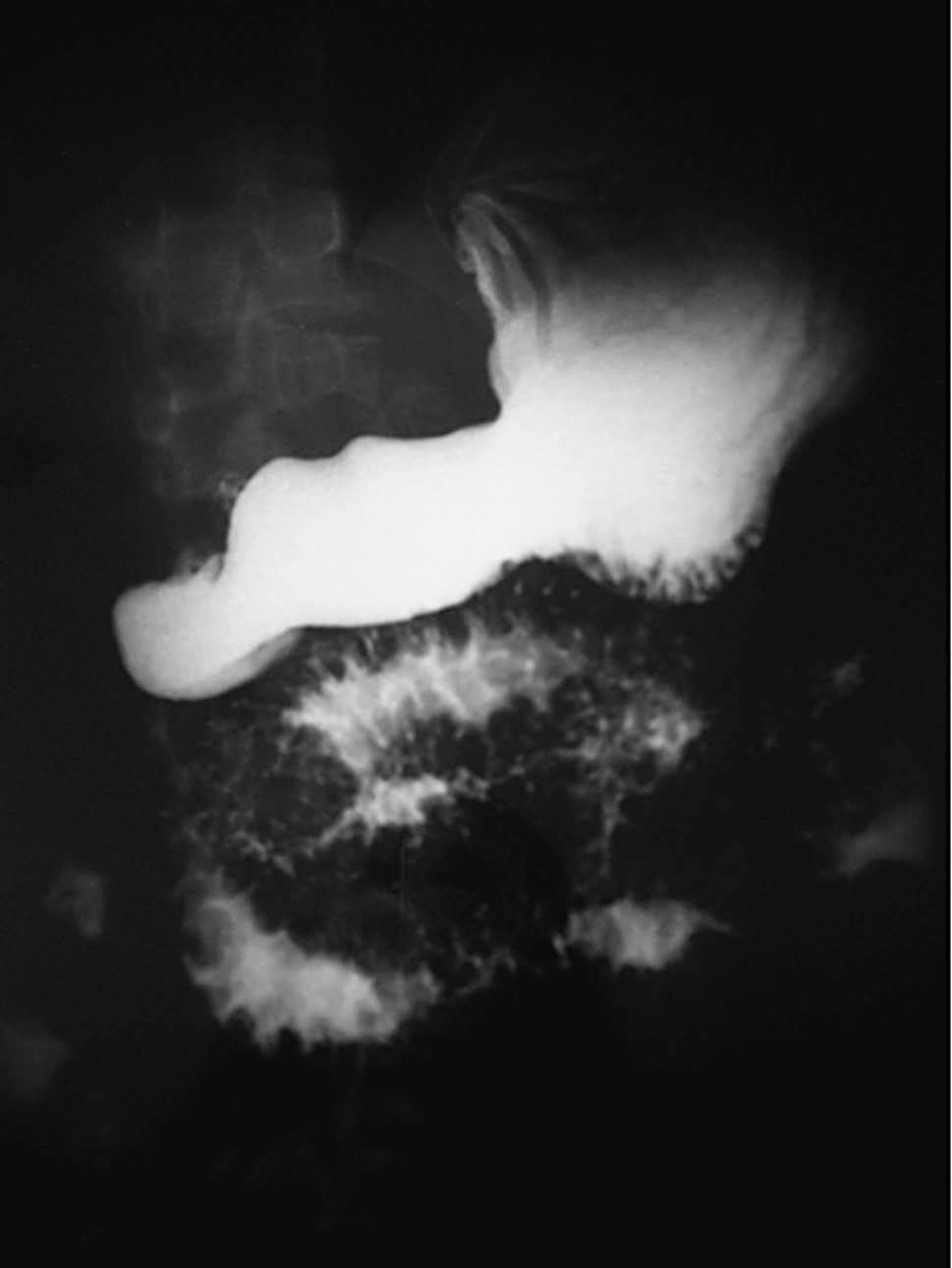
Fig. 1. Tránsito intestinal baritado en el que se observa una afección generalizada del duodeno y el yeyuno con un engrosamiento nodular e irregular de los pliegues mucosos.
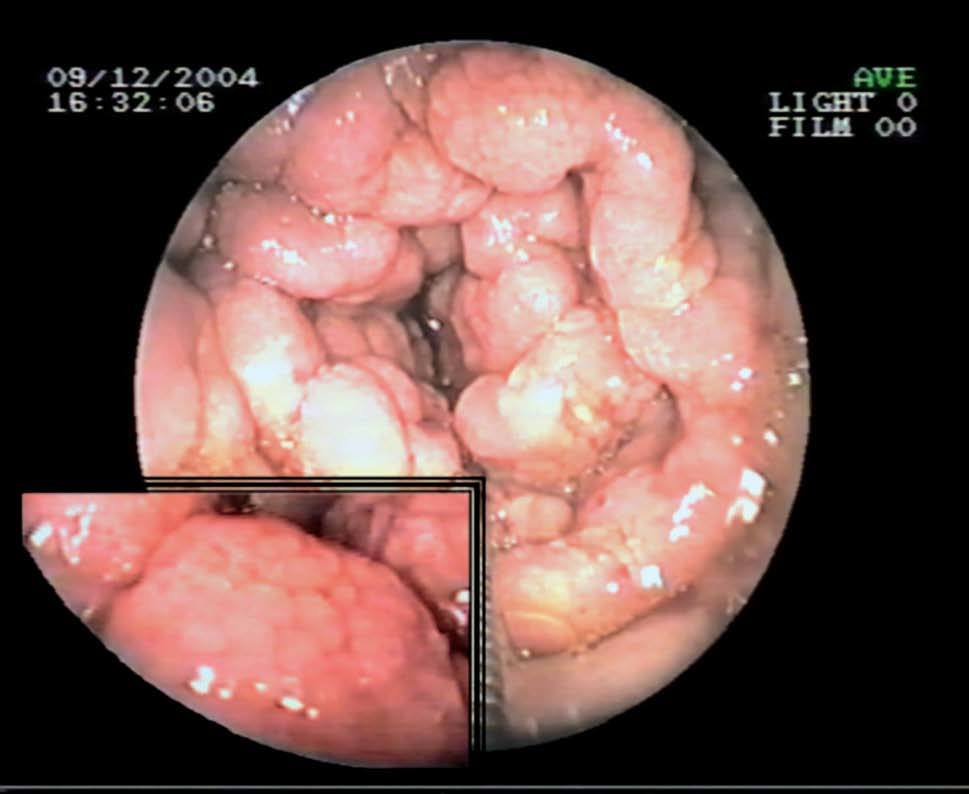
Fig. 2. Endoscopia oral que muestra un notable engrosamiento de los pliegues duodenales con un aspecto «en empedrado» y nodular de la mucosa. Detalle a mayor aumento.
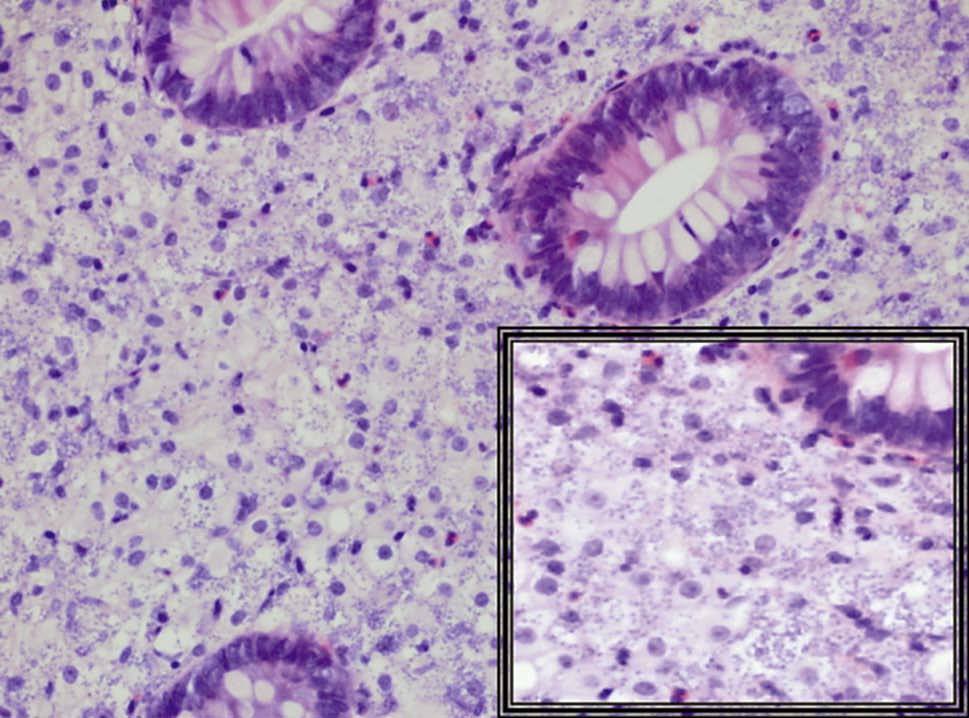
Fig. 3. Mucosa duodenal en cuya lámina propia destaca la abundancia de elementos histiocíticos, con presencia de cuerpos de inclusión basófilos en sus citoplasmas (flecha), que se acompañan de linfocitos de aspecto maduro, células gigantes ocasionales, algunas células plasmáticas y eosinófilos. A mayor aumento es posible identificar las estructuras parasitarias intracitoplasmáticas redondas u ovales, basófilas de 2 4µm de dimensión sin cápsula, con el característico polo denso (flecha).
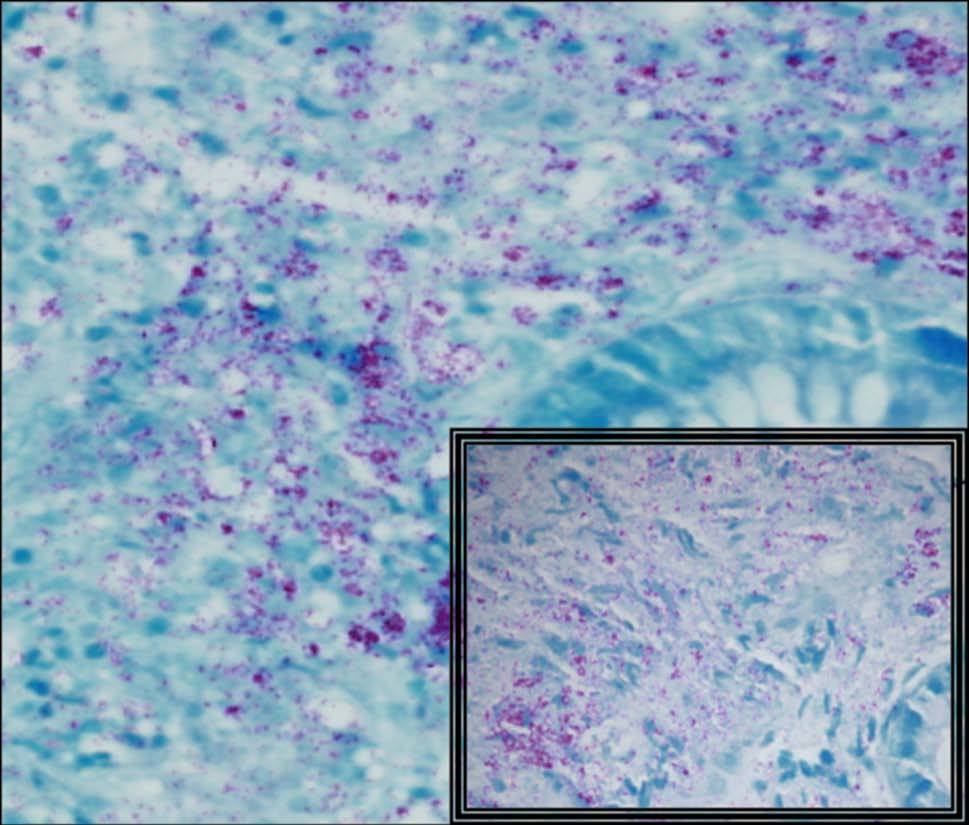
Fig. 4. El estudio histológico profundo demuestra la presencia de granulomas poco definidos, y con la tinción específica de Zielh-Nielsen se detecta la existencia de bacilos ácido-alcohol resistentes (flechas). En el cuadrante inferior derecho (imagen amplificada).
DISCUSIÓN
La LV es endémica en los países del sur de Europa, como España, donde se presenta hasta en el 10% de los pacientes infectados por el VIH, sobre todo en los adictos a drogas por vía parenteral, y con valores inferiores a 200/µl de linfocitos CD45. Los promastigotes flagelados se transmiten al huésped humano por la picadura de la mosca del género flebótomo y se fagocitan por los macrófagos del sistema reticuloendotelial, donde se multiplican. El cuadro clínico típico consiste en fiebre, hepatosplenomegalia, pancitopenia e hipergammaglobulinemia1. La afección gastrointestinal es poco frecuente y suele aparecer en situaciones de inmunosupresión muy avanzada en forma de diarrea, dolor abdominal intenso y malabsorción, secundaria a la infiltración de la pared intestinal por el parásito2,7. El diagnóstico de la LV se basa en la observación histológica del microorganismo en alguno de los tejidos afectados, generalmente la médula ósea. Hay otras técnicas diagnósticas menos empleadas, como los cultivos, la detección de antígenos mediante anticuerpos monoclonales o la reacción en cadena de la polimerasa (PCR). La serología para Leishmania tiene una sensibilidad y una especificidad insuficientes para confirmar el diagnóstico, sobre todo en pacientes inmunodeprimidos, en quienes sólo es positiva en el 22-57% de los casos5,9.
Hay pocos casos publicados de LV con afección gastrointestinal y la mayoría corresponde a pacientes con sida10,11. El duodeno es la localización más frecuente (90%) y generalmente cursa con diarrea, en ocasiones acompañada de malabsorción, y dolor abdominal, que se resuelven con la erradicación del parásito. También se ha descrito afección gástrica en forma de epigastralgia y hemorragia digestiva alta, e incluso esofágica, que se manifiesta por disfagia y odinofagia2,11. El diagnóstico de la LV entérica es histológico, al identificar al parásito en el interior de los macrófagos de la lámina propia intestinal, sin que hasta el momento se haya definido una imagen endoscópica característica de esta invasión. Se han descrito imágenes similares a una gastroduodenitis o a la de una úlcera péptica, pero en el 50% de los casos la visión endoscópica es normal, y el diagnóstico se establece mediante la toma de biopsias11.
La infección por MAC es una micobacteriosis oportunista que ha adquirido una importancia creciente desde la eclosión del sida en la década de los años ochenta. Se trata de un complejo que incluye las especies avium e intracellulare, organismos comensales en el ambiente que son capaces de actuar como patógenos en sujetos inmunodeficientes, en los que pueden producir una enfermedad diseminada con afección medular (pancitopenia), reticulonodular (hepatomegalia, adenopatías) e intestinal (diarrea crónica, malabsorción, dolor abdominal)3. El tracto gastrointestinal es uno de los principales órganos diana del MAC, lo que hace que la endoscopia digestiva adquiera un papel fundamental en el diagnóstico de esta infección, ya que permite la toma de biopsias y la identificación de la micobacteria mediante el estudio histológico de las muestras, su cultivo en medios especiales y el reconocimiento de su genoma por técnicas de hibridación12. Hay pocos casos publicados en los que se haya documentado la imagen endoscópica asociada a la infección intestinal por MAC, y todos ellos se refieren a pacientes con sida12-14. El duodeno suele ser la localización más frecuente, en el que la aparición de nódulos milimétricos blanquecinos o amarillentos se ha propuesto como imagen característica de la infección por MAC, ofreciendo un aspecto similar al descrito para la hiperplasia nodular regenerativa, la linfangiectasia intestinal o la enfermedad de Whipple13,14. Sin embargo, como sucede en la LV, en casi un tercio de los casos la mucosa es endoscópicamente normal; por ello, también se propone la toma de biopsias de forma sistemática siempre que se sospeche la infección por esta micobacteria.
En la bibliografía revisada no hemos encontrado otros casos de coinfección por Leishmania y MAC asociada a otra inmunodeficiencia diferente del sida, ni tampoco de afección intestinal simultánea por ambos patógenos en ausencia del VIH; ambos datos confieren mayor interés al caso que comunicamos. Además, hasta la fecha no se han publicado imágenes endoscópicas que puedan atribuirse a la presencia de Leishmania en el intestino, ni tampoco a la coinfección por ambos agentes15,16. En nuestro caso, la imagen endoscópica no es patognomónica de ningún proceso específico. El patrón en «empedrado y nodular» de la mucosa intestinal es un hallazgo inespecífico que podría deberse a una enfermedad infiltrativa, como la amiloidosis, inflamatoria, como la enfermedad de Crohn, o infecciosa, como sucedió en el caso que nos ocupa. Puesto que la imagen que presentamos no se corresponde con las publicadas en los casos de infección intestinal por MAC, es posible que la infiltración por Leishmania sea la principal responsable de la imagen que hallamos en nuestro caso.
En nuestro paciente, las manifestaciones clínicas son superponibles al cuadro que produce cualquiera de los 2 agentes infecciosos. Tanto la afección intestinal como la hepatosplenomegalia, las adenopatías o la pancitopenia pueden estar causadas por LV o MAC. Además, el propio proceso hematológico podría haberlo justificado.
La micosis fungoide y el SZ son los linfomas extranodales cutáneos de células T más frecuentes. Su incidencia es baja y representan sólo el 0,5% de todos los linfomas no hodgkinianos. La micosis fungoide suele presentarse como una erupción cutánea indolente, de muy largo tiempo de evolución. El SZ es su variante leucémica, más agresiva, caracterizada por la tríada constituida por eritrodermia generalizada, linfadenopatías y células atípicas T en sangre periférica en número mayor al 10% (linfocitos con núcleo cerebriforme, llamadas «células de Sézary»)8. Este síndrome cursa con anomalías del sistema inmunológico, que consisten en la disminución de la respuesta celular T a antígenos, un descenso en la producción de interleucina-12 e INF-* y el deterioro en la citotoxicidad mediada por las células natural-killer (NK)17,18. Estos defectos en la inmunidad celular favorecen el desarrollo de sobreinfecciones por micobacterias y protozoos, como sucedió en nuestro caso.
Hay estudios experimentales realizados en animales que indican que el INF-* es fundamental en la respuesta inmune para el control de la infección por Leishmania19-21 y micobacterias atípicas4. El SZ comparte con el sida una notable disminución de la producción de esta citocina por los macrófagos, hecho que favorece la diseminación del parásito, la poca respuesta al tratamiento y el curso recidivante, como sucedió en el caso que presentamos. De hecho, la recidiva de la LV es la norma en los pacientes inmunodeprimidos, incluso en los que reciben tratamiento profiláctico. En nuestro caso, puesto que el paciente seguía profilaxis para Leishmania y había recibido tratamiento para la micobacteria, nos planteamos la posibilidad de que el cuadro clínico se justificara por el propio SZ, ya que también se ha indicado que puede afectar al tracto gastrointestinal22. Sin embargo, el estudio histológico de la médula ósea y del intestino delgado identificó las formas parasitarias intracitoplasmáticas características y también la infiltración por la micobacteria.
Los antimoniales pentavalentes y la anfotericina B en su forma liposomal constituyen el tratamiento estándar de la LV, aunque se prefiere la segunda por producir menos efectos secundarios. Sin embargo, es posible que la infección permanezca latente a pesar del tratamiento. En sujetos inmunodeprimidos, la ausencia de respuesta terapéutica y las recidivas son muy frecuentes23,24. Por ello, se están investigando nuevos agentes, como la miltefosina, un análogo de la fosfocolina, con actividad anti-Leishmania in vivo e in vitro25,26. Este fármaco ha demostrado en diferentes estudios una eficacia del 90-100%, con las ventajas de poder administrarse en forma oral y en ciclos más cortos, con una buena tolerancia27,28. En los pacientes con infección por el VIH tratados con miltefosina, la tasa de respuesta suele ser menor y el número de recidivas mayor que en los no infectados, aunque no hay estudios comparativos al respecto29. La miltefosina se encuentra en la actualidad en fase II de investigación, por lo que sólo se acepta su uso compasivo. En el paciente del presente caso, las frecuentes recidivas y la mala evolución, a pesar de un nuevo ciclo con anfotericina B, obligaron a realizar un intento terapéutico con este nuevo fármaco, tras obtener su consentimiento y el visto bueno del Ministerio de Sanidad. Si bien la respuesta inicial con este medicamento fue positiva, ya que mejoraron el estado general, los síntomas digestivos y los parámetros nutricionales, el paciente presentó un cuadro séptico de origen respiratorio, que fue la causa final de su muerte.
En conclusión, el diagnóstico de LV y MAC debe considerarse en cualquier paciente inmunodeprimido, infectado o no por el VIH, que presente dolor abdominal, diarrea y/o malabsorción intestinal. El patrón de referencia para el diagnóstico de la leishmaniasis intestinal y de la infección entérica por MAC es el estudio endoscópico con toma de biopsias, incluso cuando el aspecto macroscópico sea normal. La LV que afecta a pacientes inmunodeprimidos suele ser resistente a los tratamientos convencionales y tener un curso recidivante. En estos casos, la miltefosina puede ser una alternativa terapéutica, aunque son necesarios más estudios al respecto.