Aunque el linfoma pancreático primario (LPP) es un tumor maligno infrecuente, el diagnóstico correcto es fundamental ya que su manejo terapéutico difiere del de otros tumores pancreáticos. La punción aspiración con aguja fina guiada por ultrasonografía endoscópica (USE-PAAF) es actualmente la técnica de elección para el diagnóstico de neoplasias de páncreas, resultando de especial utilidad en aquellas lesiones de características o presentación atípica. Sin embargo, la utilidad de la USE-PAAF en el LPP ha sido poco estudiada debido a la rareza de esta entidad.
Se presenta un caso de un paciente con infección VIH y LPP diagnosticado mediante USE-PAAF.
Although primary pancreatic lymphoma (PPL) is a rare malignant tumor, the correct diagnosis is essential since their therapeutic management differs from other pancreatic tumors. The fine needle aspiration cytology guided by endoscopic ultrasonography (EUS-FNA) is currently the preferred technique for the diagnosis of neoplasms of the pancreas, being of particular interest in those pancreatic lesions with atypical characteristics or presentation. However, the usefulness of EUS-FNA in the PPL has been poorly studied because of the rarity of this entity.
We report a case of a patient with HIV infection and PPL diagnosed by EUS-FNA.
Los tumores malignos del páncreas constituyen el 15% de todos los tumores. Dentro de estos, la estirpe epitelial es la más frecuente y el adenocarcinoma es el subtipo histológico más incidente1. Los tumores malignos no epiteliales, comprenden fundamentalmente los linfomas y las metástasis pancreáticas.
El linfoma pancreático es una entidad rara. Aunque, casi el 30% de los linfomas no Hodgkin afectan a la glándula pancreática, menos del 1% se consideran linfomas pancreáticos primarios (LPP)2. Los criterios de LPP incluyen3: 1) masa que afecta predominantemente al páncreas; 2) afectación ganglios peripancreáticos; 3) ausencia de adenopatías palpables; 4) ausencia de afectación mediastínica; 5) ausencia de metástasis hepato-esplénicas, y 6) hemograma dentro de los límites normales. El diagnóstico de esta entidad constituye un verdadero reto. La presentación clínica más frecuente la constituyen signos y síntomas inespecíficos como dolor abdominal o pérdida de peso. Las técnicas de imagen tampoco son de gran utilidad para diferenciar esta entidad de otras más frecuentes como el adenocarcinoma pancreático4. Sin embargo, la ultrasonografía endoscópica (USE) es muy precisa para evaluar el parénquima pancreático y en la actualidad, es la técnica de imagen más sensible para detectar pequeñas masas sólidas de páncreas5. Por otra parte, la aspiración con aguja fina guiada por ultrasonografía endoscópica (USE-PAAF) es una técnica segura y de alta precisión en el diagnóstico de neoplasia maligna pancreática. Actualmente existe escasa información acerca de la utilidad de la PAAF en el diagnóstico de esta entidad y de su impacto en el manejo terapéutico.
Observación clínicaVarón de 34 años de edad, sin hábitos tóxicos con alergia al ácido acetil salicílico y diagnosticado de infección por VIH en mayo de 2009 en tratamiento antirretroviral.
El paciente acudió al servicio de urgencias por clínica de 1 mes de evolución consistente en dolor abdominal en el hipocondrio derecho y episodios autolimitados de fiebre de hasta 38°C. En la última semana inició episodios de dolor epigástrico irradiado a hipocondrio izquierdo y espalda, ictericia progresiva y coluria.
La analítica al ingreso presentaba: hemoglobina 12,6g/dl, leucocitos 8.600/mm3 (938 linfocitos), plaquetas 247.000/mm3, GOT 167U/l, GPT 49U/l, LDH 3.928U/l, lipasa 3.283U/l, amilasa 474U/l, bilirrubina total 9,5U/l (bilirrubina directa 8,2U/l), proteína C reactiva 68,6mg/dl. El resto de los parámetros bioquímicos resultaron dentro de la normalidad. Se realizó inicialmente una ecografía abdominal que demostró una dilatación de las vías biliares intra y extrahepáticas, vesícula biliar de paredes ligeramente engrosadas y masa de unos 8×7cm de tamaño localizada en la cabeza del páncreas. Durante el ingreso se realizó una TC de tórax sin presencia de adenopatías mediastínicas ni infiltrados parenquimatosos, una TC de abdomen con importante dilatación de vía biliar extra e intrahepática, un bazo de 11,8mm, una masa de 10,3×7,5cm que abarcaba el proceso uncinado y la cabeza de páncreas, adenopatías peripancreáticas y ligera cantidad de líquido libre en peritoneo.
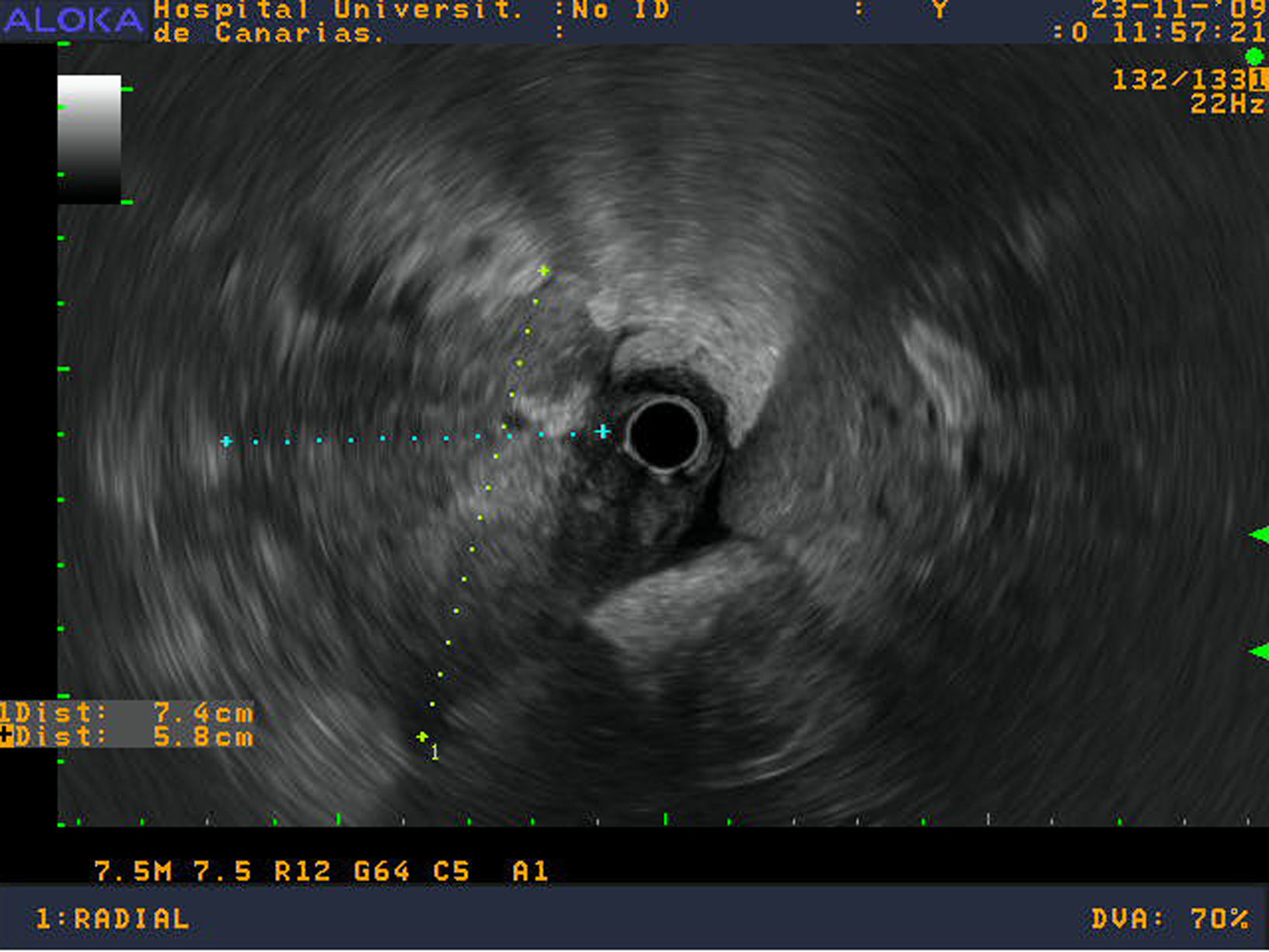
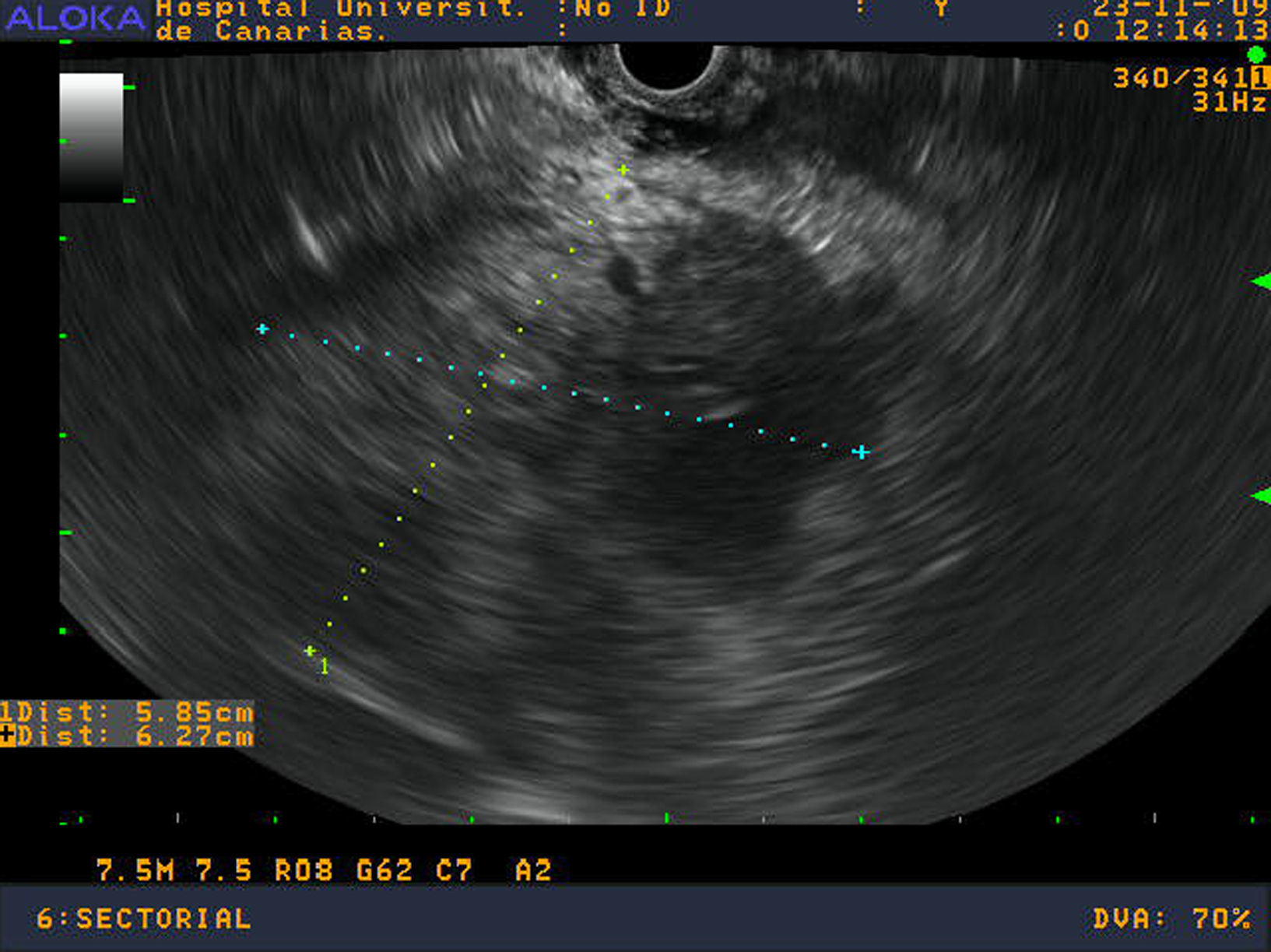
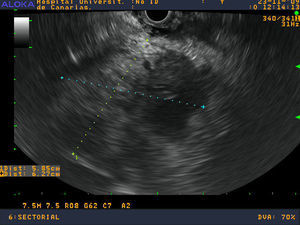
Se realizó una ecoendoscopia digestiva identificando un aumento de toda la cabeza y proceso uncinado pancreático sin poder definir claramente los márgenes de la lesión infiltrando la vena mesentérica superior (figs.1 y 2). Se realizaron 2 PAAF con aguja de 22 Gauge obteniéndose material para estudio citológico y para bloque celular.
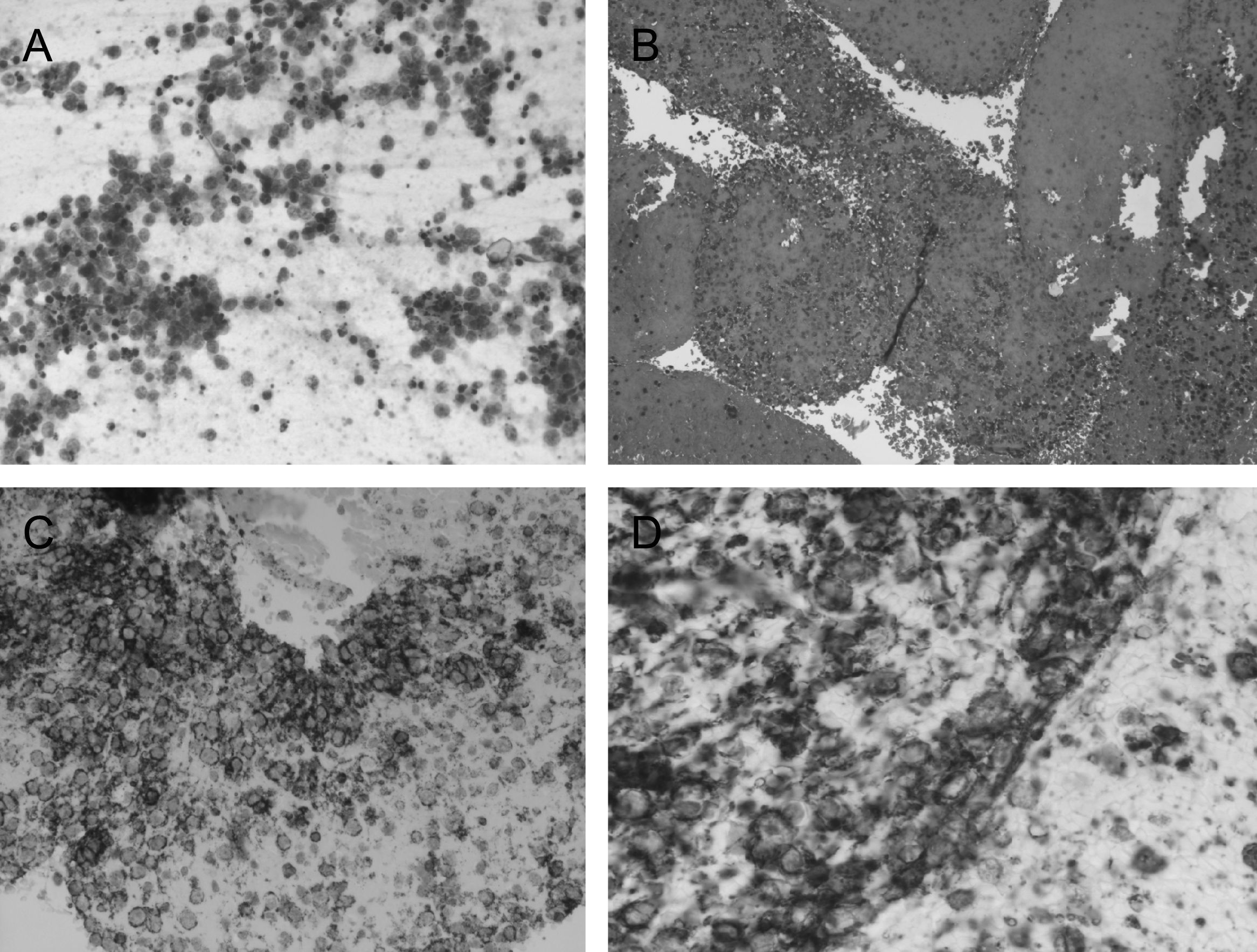
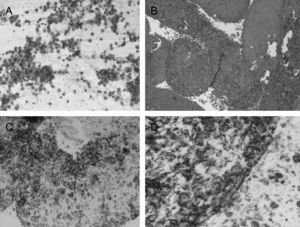
Se estudiaron frotis con técnica de Papanicolau y se obtuvo material para bloque celular que se procesó como biopsia, obteniendo cortes de hematoxilina eosina y para técnicas inmunohistoquímicas, aplicando CD-20, CD-79, CD-3 y pancitoqueratina (fig. 3).
En el estudio microscópico se observó un frotis formado por abundante celularidad de aspecto linfoide, que mostraba talla grande y núcleos atípicos, con uno o varios nucleolos. En el bloque celular se observan las mismas características. Con las técnicas inmunohistoquímicas se demostró positividad de las células neoplásicas, para CD-20 y CD-79. La citoqueratina fue negativa, y el CD-3 marcaba linfocitos pequeños acompañantes. Los hallazgos fueron indicativos de proceso linfoproliferativo, tipo linfoma no Hodgkin de células grandes B. Se realizó además una biopsia de la cresta ilíaca sugestiva de proceso linfoproliferativo de alto grado de malignidad.
Se inició tratamiento quimioterápico con esquema CHOP (ciclofosfamida, adriamicina y vincristina) con una evolución inicial favorable recibiendo tres ciclos de tratamiento y mostrando una respuesta parcial en la TC de abdomen. A los dos meses el paciente inició cuadro de cefalea intensa, y dolor tipo ciático. Se realizó una punción lumbar identificando en la citología infiltración de 99,7% de linfocitos B con fenotipo compatible con linfoma Burkitt. El paciente finalmente falleció por deterioro neurológico progresivo.
DiscusiónEl LPP representa alrededor del 0,5% de los tumores pancreáticos6 habiéndose publicado menos de 150 casos7. Aunque se trata de una entidad rara, el diagnóstico preciso es fundamental, dado que el manejo terapéutico y el pronóstico es radicalmente diferente al de otros tumores pancreáticos mucho más frecuentes como el adenocarcinoma de páncreas. Aunque algunos autores consideran que la pancreatectomía en conjunción con la quimioterapia adyuvante y la radioterapia pueden mejorar la supervivencia3,8, en especial en las masas de gran tamaño, hoy en día el tratamiento estándar para los linfomas no Hodgkin es la quimioterapia con tasas de curación de hasta el 30%, mientras que la cirugía es el tratamiento estándar del adenocarcinoma, con tasas de supervivencia a 5 años de tan solo el 5%9,10.
Se debe de tener en cuenta, que aproximadamente una de cada diez masas pancreáticas no será un adenocarcinoma ductal de páncreas, sino una lesión potencialmente curable lo cual conlleva implicaciones terapéuticas y pronósticas importantes11. De esta forma, el diagnóstico diferencial de masa pancreática, se establece con otras lesiones sólidas de páncreas, siendo el adenocarcinoma de páncreas la más frecuente.
Como ya se ha comentado, no existen, en general, características clínicas o de imagen específicas de estos tumores, aunque sí hay aspectos que pueden orientar el diagnóstico etiológico. La ausencia de una llamativa pérdida de peso, pocos síntomas gastrointestinales, tumores grandes con escasos síntomas, masa en pacientes menores de 40 años o resultados atípicos en la biopsia o citología deberían de hacer sospechar la posibilidad de una lesión pancreática poco frecuente12. Dentro de las lesiones sólidas de páncreas el diagnóstico diferencial se establece entre el adenocarcinoma de páncreas, las metástasis, los tumores neuroendocrinos, tumor pseudopapilar y el linfoma. La ecoendoscopia es una técnica mínimamente invasiva que permite una imagen en tiempo real de la estructura pancreática y se ha mostrado superior al TC helicoidal en la identificación de lesiones pancreáticas de pequeño tamaño13.
En el caso descrito, la edad del paciente hace improbable el diagnóstico de adenocarcinoma de páncreas, más frecuente en edades avanzadas14. En este caso, la USE suele identificar una lesión heterogénea, hipoecoica con respecto al resto del parénquima pancreático y mal delimitada que podría ser similar a la del caso descrito. Las metástasis pancreáticas, son de extremada rareza y se asocian principalmente al antecedente de un hipernefroma (45%), cáncer de pulmón (15%), cáncer de mama (7%) y melanoma (5%) presentando en la mayoría de casos un curso metacrónico (77%) con un periodo de latencia de unos 9 años con respecto al tumor primario15. La imagen por USE más típica es la de una lesión homogénea, de márgenes nítidos y redonda con localización preferente en la cabeza pancreática. En nuestro caso, la ausencia de un antecedente de neoplasia y las características ecoendoscópicas hacían improbable este diagnóstico. Los tumores neuroendocrinos constituyen el 1–2% de los tumores pancreáticos y la mayoría son funcionales (70–85%)16. La imagen habitual por USE es la de una lesión isoecoica o hipoecoica, muy bien delimitada17. Finalmente otros tumores como el tumor pseudopapilar son raros en los varones y en las pruebas de imagen se comportan como lesiones muy bien delimitadas, localizadas en cuerpo o cola pancreática y con pequeñas áreas quísticas en el interior. Otras entidades como el pancreatoblastoma son excepcionales en adultos18.
En el caso presentado, la edad, la infección crónica por VIH y la elevación de la LDH fueron datos claves para orientar el diagnóstico hacia un linfoma pancreático, ya que la sintomatología clásicamente descrita como la fiebre y la sudoración nocturna es excepcional en los linfomas pancreáticos primarios. No se identificaron adenopatías palpables al ingreso, el TC no mostraba datos de extensión a otros órganos y la afectación era mayoritariamente pancreática, por lo que cumple criterios de LPP de gran agresividad, dada la infiltración medular.
La ecoendoscopia mostraba una gran masa heterogénea e hipoecogénica sugestiva de un proceso neoplásico con invasión vascular. Estos datos están en consonancia con otras series que indican una marcada hipoecogenicidad y un tamaño superior a los adenocarcinomas en el momento del diagnóstico10,19. Sin embargo, dado que la imagen no es específica de linfoma, el diagnóstico histológico o citológico es vital para alcanzar un diagnóstico definitivo. La USE-PAAF permite la toma de muestras de tejido con control ecográfico en tiempo real lo cual aumenta la rentabilidad del procedimiento20. Además, ha demostrado ser un procedimiento seguro, fácil y rápido. La sensibilidad, especificidad, valor predictivo positivo y negativo en lesiones pancreáticas son del 64 al 98%, 80 al 100%, 98 al 100% y 16 al 86%, respectivamente21. Varios estudios sugieren que este método de punción debe ser el de elección. Las ventajas sobre los métodos percutáneos incluyen la posibilidad de puncionar tumores pancreáticos muy pequeños y un menor riesgo de siembra22. Un estudio reciente informó de la eficacia de la USE-PAAF en comparación con la ecografía transabdominal y la tomografía computarizada en 1.050 las lesiones pancreáticas. La EUS-PAAF fue el procedimiento más preciso para evaluar las lesiones menores de 3cm (p=0,015)21.
Aunque tradicionalmente la citología por sí sola no se ha considerado adecuada para subclasificar los linfomas, recientemente, el sistema de clasificación Organización Mundial de la Salud introduce nuevos criterios que permiten diagnosticar y clasificar los linfomas según los resultados citológicos y citometría de flujo23. Aunque existen escasos datos acerca de la eficacia de la USE-PAAF combinado con citometría de flujo, los artículos publicados sugieren que es una técnica de gran utilidad. En un estudio retrospectivo reciente, Khashab et al19, compararon la eficacia diagnóstica de la citología obtenida mediante USE-PAAF con la combinación de esta y la citometría de flujo en 16 LPP. El diagnóstico final se obtuvo en 87,5% de los pacientes resultando la combinación USE-PAAF y citometría de flujo superior a la USE-PAAF efectuada de forma aislada (84,6 vs 30,8%; p=0,01). Actualmente, es posible obtener muestras histológicas de tejido mediante USE utilizando una aguja de tipo trucut. Este tipo de muestra puede resultar más adecuada para la tipificación de los linfomas. Sin embargo, este sistema presenta una elevada tasa de fracasos cuando el acceso es vía transduodenal24.
En resumen, aunque la clínica y las pruebas de imagen son útiles para orientar el diagnóstico del PPL, alcanzar un diagnóstico certero es fundamental para el manejo terapéutico del paciente. La USE-PAAF es un procedimiento eficaz y seguro en el diagnóstico del PPL pudiendo evitar laparotomías innecesarias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.