El linfoma colorrectal es una entidad extremadamente infrecuente, representando menos del 0,5% del total de las neoplasias colorrectales primarias. La localización colorrectal supone el 15–20% del total de los linfomas gastrointestinales, tras el estómago y el intestino delgado. Debido a la inespecificidad de los síntomas, la enfermedad suele estar avanzada en el momento del diagnóstico. Primordial interés tienen los criterios de Dawson para diferenciar la afectación colorrectal primaria de la afectación del tracto gastrointestinal secundaria a un linfoma sistémico, dadas sus diferentes connotaciones pronósticas y terapéuticas. Presentamos el caso de un linfoma no hodgkiniano tipo B de localización rectal, de difícil diagnóstico, tratado con esquema poliquimioterapéutico con ciclofosfamida, adriamicina, vincristina, prednisona y rituximab, cuya evolución fue desfavorable.
Colorectal lymphoma is an extremely infrequent entity, representing less than 0.5% of all primary colorectal neoplasms. Colorectal localization accounts for 15–20% of all gastrointestinal lymphomas, after the stomach and small intestine. Because the symptoms are non-specific, this disease is usually diagnosed in the advanced stages. Dawson's criteria are highly useful in the differential diagnosis between primary colorectal involvement and gastrointestinal tract involvement secondary to systemic lymphoma, which is important due to the distinct prognosis and treatment of these entities. We report the case of a B-cell non-Hodgkin's lymphoma that was difficult to diagnose and was treated with R-CHOP polychemotherapy. Outcome was poor.
La afectación colorrectal por linfoma puede acontecer como afectación primaria o bien como manifestación de la enfermedad sistémica. La diferenciación entre ambas es clave a nivel pronóstico y terapéutico. Los linfomas colorrectales primarios (LPC) afectan a varones entre la sexta y la séptima década de la vida. La presentación clínica suele ser dolor abdominal mal localizado, pérdida ponderal y palpación de masa abdominal1. El diagnóstico se establece habitualmente de forma tardía debido a la inespecificidad de los síntomas, a través del estudio histológico de las biopsias realizadas durante la colonoscopia o de la pieza quirúrgica, pues las imágenes endoscópicas remedan con frecuencia a las del adenocarcinoma colorrectal. La supervivencia media de los LPC es del 32–55% a los 5 años tras tratamiento quirúrgico y quimioterapéutico, inferior a la de los linfomas sistémicos o los linfomas primarios digestivos de otras localizaciones2.
Observacion clínicaVarón de 76 años, sin alergias medicamentosas conocidas y con antecedentes quirúrgicos de herniorrafia inguinal izquierda y tratamiento con láser de hipertrofia benigna de próstata. El paciente era exfumador de 40 paquetes/año y consumía más de 60galcohol/día. Estaba en estudio por la consulta de neumología tras evidenciarse persistencia del infiltrado alveolar en el lóbulo inferior derecho (LID), en la radiografía de tórax después de haber estado ingresado previamente en nuestro centro hospitalario por un cuadro de neumonía neumocócica con evolución clínica satisfactoria, la sospecha diagnóstica inicial fue de un carcinoma broncogénico.
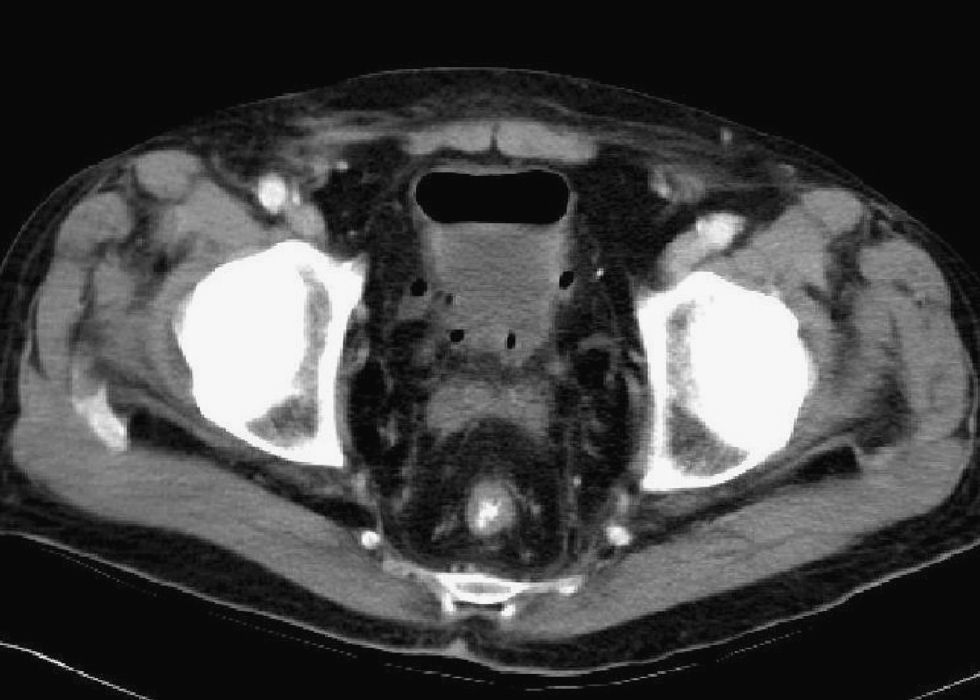
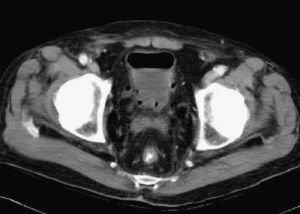
Se remitió al paciente a nuestra Unidad a causa de un cuadro de rectorragias intermitentes de características distales y la visualización en la tomografía axial computarizada (TAC) toracoabdominal de la presencia de un engrosamiento en la zona del recto distal (fig. 1). En dicho estudio se apreciaba también una lesión cavitada pulmonar en el LID de 5,9cm, con un nivel hidroaéreo indicativo de absceso pulmonar. El paciente no refería hiporexia, pérdida de peso ni alteración del ritmo intestinal. La exploración física no revelaba masas abdominales ni adenopatías palpables. En la analítica de sangre destacaba: anemia leve (Hb: 11 g/dl) normocítica normocrónica con ferrocinética normal, gammaglutaril transferasa elevada (117U/l), beta-2-microglobulina elevada (0,49mg/dl [valores normales: 0,08–0,24]), velocidad de sedimentación globular de 120mm/1.ah y el hallazgo de una banda monoclonal de IgG cadena ligera kappa. El resto de los marcadores tumorales fueron negativos, incluyendo el antígeno carcinoembrionario. La serología para el virus de la inmunodeficiencia humana (VIH) fue negativa, la IgM-antiVCA frente al virus de Epstein Barr resultó igualmente negativa, no así la IgG-anticuerpos frente antígeno de la cápside viral (anti-VCA) frente al virus de Epstein Barr que resultó positiva. La IgM frente al citomegalovirus (CMV) fue negativa.
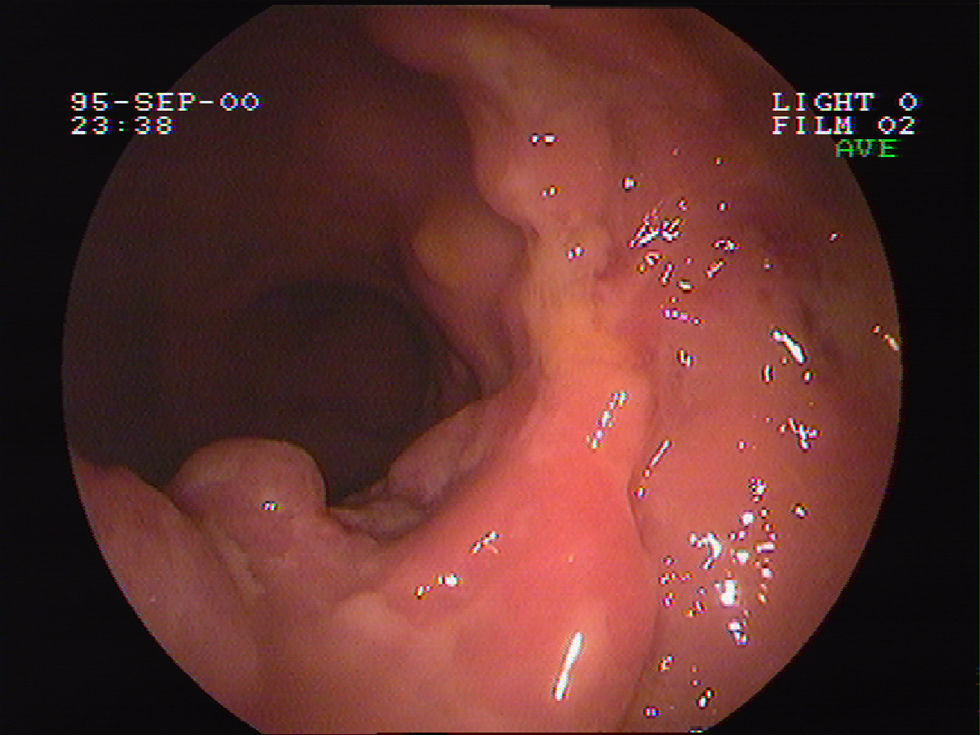
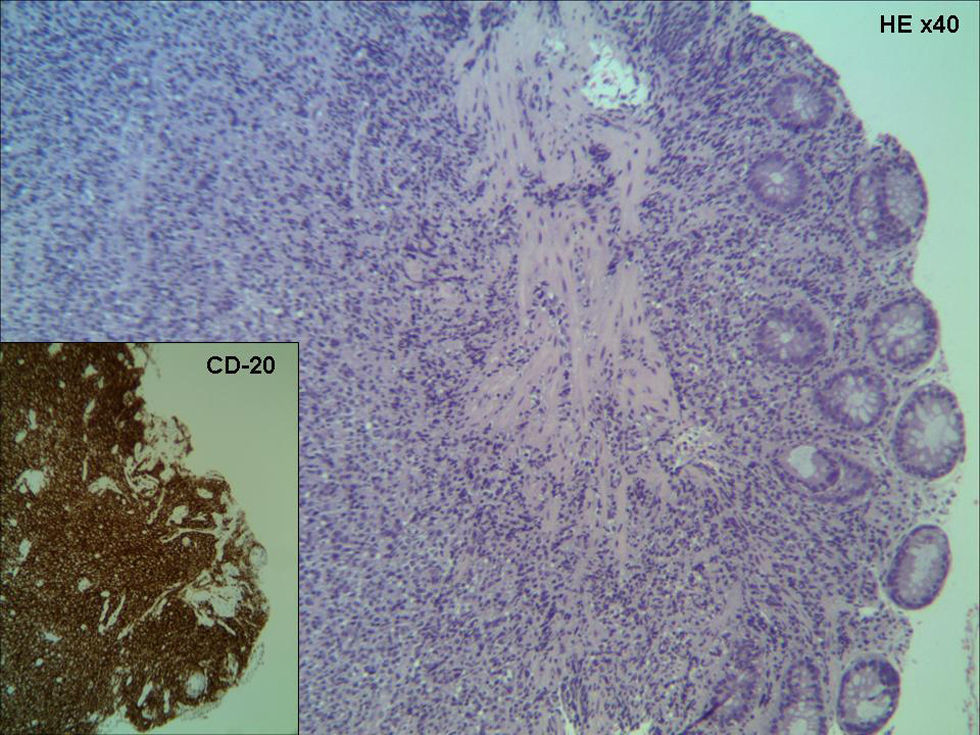
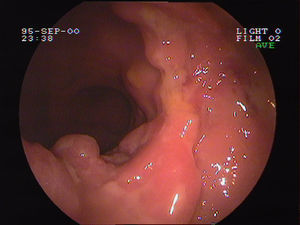
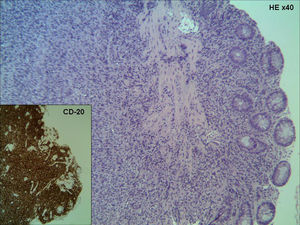
Se realizó una colonoscopia que mostró diverticulosis coli y presencia en la zona rectal de una lesión ulcerada con bordes muy engrosados, de aspecto seudopolipoide y de consistencia blanda, que se extendía desde la línea pectínea hasta unos 7cm de margen anal, con sospecha endoscópica de adenocarcinoma de recto (fig. 2). El estudio histológico de dicha lesión reveló una ulceración inespecífica en mucosa con cambios inflamatorios mixtos. Una segunda colonoscopia presentó hallazgos endoscópicos similares, aunque histológicamente, en esta ocasión, el fondo de la ulceración mucosa evidenció un denso infiltrado linfoide B y T polimorfo siendo los estudios de la reacción en cadena de la polimerasa (PCR) y la inmunohistoquímica no expresivas de monoclonalidad. Además, se detectó, mediante técnicas de PCR e hibridación in situ, la presencia de genoma de CMV. Ante estos hallazgos, y dada la posible existencia de una neoplasia pulmonar primaria o metastásica asociada a la avanzada edad del paciente que conllevaba una situación de inmunosupresión, se decidió iniciar un tratamiento con ganciclovir intravenoso en dosis de 5mg/kg/12h. Un tercer control endoscópico a los 14 días del inicio del tratamiento no mostró cambios respecto a la colonoscopia previa. En esta ocasión, se realizó un mayor número de biopsias, y fue la tinción inmunohistoquímica positiva para cd20 y bcl2, por lo que se estableció el diagnóstico de linfoma no hodgkiniano de grado intermedio, tipo B difuso de células grandes (fig. 3).
Se completó el estudio de extensión mediante tomografía con emisión de positrones en la que se apreció una masa hipermetabólica en la glándula suprarrenal derecha, recto inferior y pulmón derecho. Se realizó una segunda TAC de tórax y abdomen en el que se apreciaba una masa pulmonar de 6,9×7,2cm que afectaba al bronquio del lóbulo inferior derecho, de bordes imprecisos, hipodensa y ocupada por líquido de baja densidad. No se detectaron adenopatías mediastínicas. Se observó un aumento de la glándula suprarrenal derecha de 2,9×1,8cm. Una punción por aspiración de cresta ilíaca presentó una médula ósea normocelular con presencia de las 3 series hematopoyéticas, sin evidencia de infiltración por linfoma. La punción por aspiración de la glándula suprarrenal mostró infiltración linfoide de ésta. Se realizó fibrobroncoscopia que no revelaba lesiones orgánicas mucosas en árbol bronquial derecho. Se procedió a la punción transbronquial guiada por TAC del LID, que fue negativa. Se propuso la realización de una lobectomía reglada para el estudio de la lesión cavitada pulmonar con el objeto de establecer un diagnóstico diferencial entre carcinoma pulmonar epidermoide o una metástasis pulmonar del linfoma rectal, pero el paciente lo desestimó. Según los criterios de Dawson y la estadificación de Ann Arbor modificada por Musshoff, se estableció un diagnóstico de linfoma primario rectal en estadio IV histológico, sin poder confirmarse la afectación pulmonar.
El paciente rechazó el tratamiento quirúrgico y la radioterapia externa, por lo que recibió exclusivamente quimioterapia con régimen de ciclofosfamida, adriamicina, vincristina, prednisona y rituximab, por lo que mejoró la sintomatología rectal. Tras 2 ciclos de tratamiento desarrolló un cuadro de neutropenia febril que evolucionó de forma satisfactoria con tratamiento antibiótico de amplio espectro (imipenem en dosis de 2g intravenosos diarios), factor estimulante de colonias granulocíticas y transfusión de hemoderivados. Posteriormente, el paciente presentó un episodio de hemoptisis masiva e incoercible que provocó su fallecimiento.
DiscusiónLa afectación colónica por un linfoma puede acontecer como afectación primaria, esto es, un LPC, o bien como una manifestación asociada a un linfoma sistémico. El tracto gastrointestinal es la localización extranodal más frecuentemente afectada por el linfoma no hodgkiniano y representa, el colon y el recto, el 10–20% del total de los casos. La localización primaria más frecuente en el tubo digestivo es la gástrica, seguida del intestino delgado y, finalmente, el colon1.
La prevalencia del LPC se sitúa en torno al 0,02 por cada 100.000 habitantes. Los segmentos colorrectales más frecuentemente involucrados son el ciego (57%), el colon ascendente (18%), el colon transverso (10%), el colon descendente (5%) y el recto sigma (10%). Es probable que la afectación cecal sea la localización más frecuente, debido a una mayor acumulación de tejido linfoide en dicha zona2. Se ha estimado en una serie consecutiva de cáncer de recto una prevalencia de linfomas primarios rectales del 0,002%, por lo que la afectación primaria rectal es, si cabe, aún más infrecuente3.
Se han involucrado diversos factores relacionados con el desarrollo del LPC. La inmunosupresión y especialmente la infección por el VIH se han relacionado con linfomas anorrectales, especialmente en la variedad de células pequeñas hendidas4,5. La relación entre la colitis ulcerosa y el linfoma colorrectal es conocida6. Mediante el estudio por PCR en pacientes con colitis ulcerosa de larga evolución, se ha demostrado la existencia de proliferaciones monoclonales linfoides, que podrían predisponer al desarrollo de un LPC7. Sin embargo, es posible que pacientes inicialmente diagnosticados de colitis ulcerosa y que no respondieron al tratamiento médico convencional fueran en realidad pacientes afectados de un LPC, con diagnóstico histológico erróneo1. Se ha descrito recientemente un subtipo de linfoma de tipo B difuso de células grandes conocido como “desorden linfoproliferativo de células B asociado al virus de Epstein Barr” en pacientes mayores de 70 años con afectación extraganglionar frecuente y pronóstico infausto a corto plazo8,9. Al igual que sucede en la zona gástrica, también se ha querido relacionar el LPC con la infección por Helicobacter pylori, incluso se ha comunicado la resolución de un linfoma tras un tratamiento erradicador y una resección endoscópica10,11.
La edad de presentación al diagnóstico del LPC se sitúa entre los 50 y los 70 años, y es más frecuente en varones que en mujeres, con una relación de 2:1. El diagnóstico suele ser tardío por la inespecificidad de los síntomas; el dolor abdominal difuso, la masa abdominal palpable y la pérdida de peso son los síntomas más frecuentes. También se han descrito otros síntomas, tales como diarrea, rectorragia, anemia ferropénica, perforación intestinal e intususcepción2,12,13.
No existe uniformidad de criterios a la hora de clasificar las lesiones visualizadas durante la exploración endoscópica. Myung et al14 diferencian 5 tipos de lesiones: fungoides, infiltrativas, ulcerativas, ulcerofungoides y ulceroinfiltrativas. A diferencia de los linfomas gástricos en los que la forma ulcerativa e infiltrativa es la más frecuente, en el colon la lesión fungoide es la forma más común de presentación. En el caso de nuestro paciente, la lesión endoscópica correspondía al tipo ulceroinfiltrativo, y simulaba un adenocarcinoma de recto.
En ocasiones, el diagnóstico diferencial de las lesiones ulceradas rectales es complejo e incluyen tanto enfermedad maligna (adenocarcinomas o linfomas) como lesiones benignas (inflamatorias, infecciosas, idiopáticas, traumáticas, etc.)15–18 (tabla 1).
Diagnóstico diferencial de las lesiones ulceradas rectales
| Neoplasias | |
| Adenocarcinoma de recto | Masa ulcerada de bordes irregulares y de consistencia dura (tipo II de OMED) que en ocasiones ocupa toda la luz. Diagnóstico histológico |
| Linfoma rectal | Lesiones ulceradas, ulcerofungoides o ulceroinfiltrativas. Diagnóstico histológico |
| Inflamatorias | |
| Colitis ulcerosa | Afectación difusa, en continuidad, simétrica. Granularidad. Úlceras pequeñas y grandes. En ocasiones con denudación. Exudados mucopurulentos. Seudopólipos. Biopsias para estudio histológico |
| Enfermedad de Crohn | Afectación colorrectal parcheada, asimétrica. Úlceras aftoides. Úlceras grandes, serpiginosas, profundas. Fisuras longitudinales. Aspecto en “empedrado”. Lesiones crónicas: puentes mucosos. Disminución del calibre de la luz y estenosis. Afectación perianal. Biopsias: granulomas (30–50%) |
| Idiopáticas | |
| Síndrome de la úlcera solitaria rectal | Cara anterior rectal a 4–10cm del margen anal. Úlceras superficiales de 1–1,5cm de diámetro, rodeada de mucosa hiperémica. Asociada a prolapso rectal. El 25% de los casos simula lesión polipoide. El 30% tiene lesiones múltiples. Histología característica |
| Úlcera estercorácea | Estreñimiento pertinaz. Encamamiento prolongado. Úlcera solitaria redondeada en área rectosigmoidea asociada a fecaloma en contigüidad. Histología con cambios isquémicos. Riesgo de perforación |
| Infecciosas | |
| Tuberculosis rectal | Excepcional sin afectación pulmonar u otras locaciones gastrointestinales (más frecuente ileocecal). Úlceras circunferenciales rodeadas de mucosa inflamada. En ocasiones, hay lesiones estenosantes ulceroinfiltrativas de consistencia dura. Diagnóstico: granulomas caseificantes con intensa inflamación submucosa. Tinción de Ziehl Nielsen. Cultivo. PCR para micobacterias |
| Proctitis por CMV | Ulceraciones profundas, circulares o serpiginosas, múltiples, asociada a eritema. Diagnóstico influenciado por biopsias múltiples, profundas y experiencia del patólogo. Histología con cambios citopáticos y detección de CMV (hibridación in situ, PCR) |
| Otras infecciosas (amebiasis, linfogranuloma venéreo o sífilis secundaria) | Según sospecha clínica: biopsias, estudio de muestras en fresco o serología |
| Otras | |
| Traumática | Anamnesis: enemas previos. Trastornos de conducta sexual, etc. |
| Endometriosis | Mujeres en edad fértil, clínica intestinal no siempre relacionada con ciclo menstrual. Más frecuente como masa submucosa no circunferencial en área rectosigmoidea. De forma excepcional, nódulos friables con úlceras |
| Colitis isqúemica | Factores precipitantes: choque, hipovolemia, cirugía cardiovascular. Lesiones con edema y eritema con/sin ulceraciones evidentes |
| Miscelánea | |
| Medicación tópica: ergotamina, AINE, etc. | |
| Colitis cística profunda, etc. | |
CMV: citomegalovirus; OMED: Organización Mundial de Endoscopia Digestiva; PCR: reacción de cadena de la polimerasa.
La colitis asociada a la infección por CMV se suele presentar clínicamente como un síndrome constitucional, además se relaciona con síntomas digestivos tales como diarrea, hematoquecia, dolor abdominal y tenesmo rectal19. Aunque es más frecuente en pacientes inmunodeprimidos (infección por VIH, trasplantes de órganos sólidos y médula ósea, empleo de inmunosupresores, etc.) también se han reportado casos en pacientes inmunocompetentes20, incluso en forma de úlceras rectales gigantes21,22.
Cuando la enfermedad se limita al recto y el sigma, los hallazgos endoscópicos pueden ser indistinguibles de la colitis ulcerosa o de la enfermedad de Crohn, y precisan para el diagnóstico de estudios serológicos e histológicos. La seroprevalencia del CMV en la población adulta es elevada (40–100%)23. La evaluación serológica ha demostrado que sólo un pequeño porcentaje de los pacientes presenta anticuerpos IgM (+) para CMV24. Además, la presencia de estos anticuerpos no es específica de colitis por CMV. En nuestro caso, la IgM para CMV fue negativa y la IgG fue positiva, por lo que dados los hallazgos endoscópicos, sumados a la detección de genoma de CMV por PCR en las biopsias de colon, nos hicieron pensar en la posibilidad de que se tratara de una reactivación a consecuencia de la situación basal del paciente (edad y neoplasia pulmonar en estudio). La PCR de CMV en sangre fue negativa. En nuestro caso no se detectaron inclusiones intranucleares basófilas rodeadas por un halo (“en ojo de búho”) que son el patrón oro para el diagnóstico de colitis por CMV25, si bien existen estudios que señalan que este método es poco sensible, debido a que depende del número de biopsias y de la profundidad de éstas26.
En un metaanálisis de 44 pacientes inmunocompetentes afectados de colitis asociada a infección por CMV se pudo observar que la mortalidad era muy superior en los pacientes mayores de 55 años, atribuible a una disfunción de la inmunidad celular y humoral, así como a otras comorbilidades frecuentes en estos grupos etarios, tales como diabetes mellitus, insuficiencia renal y neoplasias. El sexo masculino y la necesidad de realizar una colectomía urgente también influían negativamente, con una menor supervivencia27. Por tanto, en estos casos el diagnóstico y el tratamiento precoz con ganciclovir o foscarnet es esencial para reducir la mortalidad. En nuestro caso la ausencia de respuesta a ganciclovir tras 14 días de tratamiento intravenoso nos llevó a pensar en otros posibles diagnósticos alternativos.
La confirmación diagnóstica del LPC se realiza con el estudio inmunohistoquímico de las biopsias obtenidas por colonoscopia o de la pieza quirúrgica. De acuerdo con la clasificación de Ann-Arbor los tipos más frecuentes son linfomas de tipo B difuso de células grandes, linfomas de células del manto y los tipos Burkitt. Se ha descrito que aunque el linfoma no hodgkiniano de tipo B de células grandes es el más frecuente, el linfoma de células T tiene un comportamiento más intensivo28,29.
El diagnóstico de extensión requiere de un estudio de sangre periférica, una TAC toracoabdominal y una punción de médula ósea que permita diferenciar un LPC de la afectación colónica de un linfoma sistémico. Dawson30 propone unos criterios diagnósticos estrictos para diferenciar la afectación primaria de los linfomas ganglionares: ausencia de linfadenopatías periféricas, ausencia de linfadenopatías mediastínicas en la radiografía de tórax, frotis de sangre periférica normal, durante la laparotomía el compromiso de sólo esófago, estómago e intestino o de sólo ganglios regionales y la ausencia de compromiso hepático y esplénico, salvo por la diseminación directa de la enfermedad a partir de un foco contiguo.
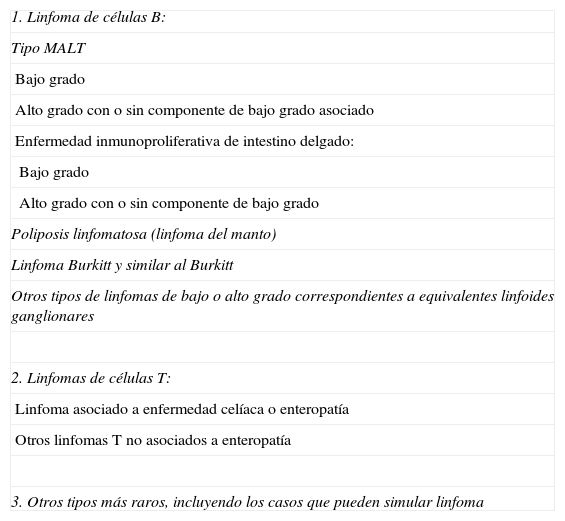
En la actualidad, los linfomas gastrointestinales se clasifican de acuerdo con Isaacson31 (tabla 2). Para la estadificación tumoral no existen criterios uniformes; se han propuesto diversas clasificaciones: Ann Arbor, Musshoff, Lugano y más recientemente la de París32,33. La clasificación anatomoclínica de Ann Arbor fue inicialmente diseñada en 1971 para la enfermedad de Hodgkin, basándose en el concepto del origen unifocal de la enfermedad y en su propagación progresiva por contigüidad, conceptos que no siempre pueden aplicarse a los linfomas no hodgkinianos, sin embargo, al ser el sistema más aceptado internacionalmente y a pesar de sus limitaciones pronósticas (utilidad relativa para discriminar entre los estadios I y II, así como entre los estadios III y IV), define las principales pautas terapéuticas para seguir (tabla 3). Posteriormente, Musshoff y Schmidt-Vollmer proponen una modificación de la clasificación de Ann Arbor, y diferencian el estadio II según la afectación ganglionar intraabdominal sea regional o a distancia, ya que permite una mejor correlación con el pronóstico del paciente, y es en el momento actual el sistema de estadificación más comúnmente empleado34 (tabla 4).
Clasificación de Isaacson
| 1. Linfoma de células B: |
| Tipo MALT |
| Bajo grado |
| Alto grado con o sin componente de bajo grado asociado |
| Enfermedad inmunoproliferativa de intestino delgado: |
| Bajo grado |
| Alto grado con o sin componente de bajo grado |
| Poliposis linfomatosa (linfoma del manto) |
| Linfoma Burkitt y similar al Burkitt |
| Otros tipos de linfomas de bajo o alto grado correspondientes a equivalentes linfoides ganglionares |
| 2. Linfomas de células T: |
| Linfoma asociado a enfermedad celíaca o enteropatía |
| Otros linfomas T no asociados a enteropatía |
| 3. Otros tipos más raros, incluyendo los casos que pueden simular linfoma |
MALT: tejido linfoide asociado a mucosas.
Clasificación de Ann Arbor (1971)
| Estadio I | Afectación de una sola región ganglionar (I), de un solo órgano o de una única localización extralinfática (IE) |
| Estadio II | Afectación de 2 o más regiones ganglionares del mismo lado del diafragma (II), o afectación localizada de un órgano o localización extralinfática y de una o más regiones ganglionares del mismo lado del diafragma (IIE). Puede incluirse el bazo (IIS o IIES) |
| Estadio III | Afectación de regiones ganglionares situadas a ambos lados del diafragma (III). Puede incluir afectación de una localización extralinfática (IIIE), del bazo (IIIS) o de ambos (IIIES). |
| Estadio IV | Afectación diseminada o difusa de uno o más órganos extraganglionares, con o sin afectación ganglionar asociada (IV) |
Clasificación de Ann-Arbor de los linfomas extranodales. Modificación de Musshoff
| Estadio | Descripción |
| Estadio I | Linfoma limitado al tracto gastrointestinal, sin rebasar el diafragma |
| E I-1: | Infiltración tumoral limitada a la mucosa y submucosa |
| E I-2: | Infiltración tumoral que rebasa la submucosa |
| Estadio II | Linfoma que además infiltra los ganglios linfáticos, sin rebasar el diafragma |
| E II-1: | Infiltración de los ganglios linfáticos regionales |
| E II-2: | Infiltración de ganglios linfáticos a distancia |
| Estadio III | Linfoma con infiltración gastrointestinal o de los ganglios linfáticos a ambos lados del diafragma |
| Estadio IV | Infiltración localizada de ganglios linfáticos asociada a afectación diseminada de órganos no gastrointestinales |
En el año 2003 un grupo multidisciplinario de expertos europeos en linfoma gastrointestinal propuso una modificación del sistema TNM específicamente para este tipo de tumores que, a diferencia de los sistemas anteriores, delimitan la profundidad de la infiltración tumoral, la extensión de la afectación ganglionar intraabdominal y la diseminación específica del linfoma según su localización anatómica. En honor a la primera reunión del grupo en 1999 en la ciudad de París este sistema de estadificación tomó dicho nombre33.
En el caso de nuestro paciente se le asignó un estadio IV según la clasificación de Ann Arbor modificada de Musshoff, sin poder confirmarse la afectación histológica pulmonar.
El pronóstico de los LPC es en general peor que los de afectación gástrica o intestinal, con una supervivencia global tras cirugía y quimioterapia adyuvante a los 5 años entre el 27-55%1. Como factores de mal pronóstico se han descrito el estadio avanzado de la enfermedad, el tamaño y grado tumoral, la resección quirúrgica incompleta y la presentación clínica en forma de perforación abdominal35.
No existe un tratamiento uniformemente consensuado para el LPC, por lo que debe individualizarse a las características del paciente, y es en general una combinación de cirugía y quimioterapia. En general, el tratamiento inicial del LPC debe ser quirúrgico pues la resección da información pronóstica, al evaluar la afectación de los ganglios regionales, evita las complicaciones (hemorragia, perforación, etc.) y en algunos casos permite la curación de la enfermedad. Se aconseja la realización de una resección que incluya las estructuras linfovasculares, además de la toma de una biopsia hepática intraoperatoria para el estadificación2,35.
En el momento actual el empleo de la quimioterapia asociada o no al tratamiento quirúrgico es motivo de controversia, pues las series descritas en la literatura médica son cortas y la supervivencia global no parece ser superior a la de los pacientes que se les realiza exclusivamente una intervención quirúrgica. A pesar de estos datos, la tendencia actual es asociar un régimen poliquimioterapéutico con el esquema de ciclofosfamida, adriamicina, vincristina, prednisona y rituximab tras la resección quirúrgica, sobre todo en casos de enfermedad avanzada o diseminada, como es nuestro caso2,35,36.
En el caso de enfermedad limitada al recto, el tratamiento quirúrgico se puede complementar con radioterapia, que además de disminuir el dolor rectal puede mejorar la supervivencia3,12,35.
En resumen, presentamos el caso de un paciente con una enfermedad inusual, de diagnóstico difícil, establecido mediante colonoscopia y biopsias repetidas al sospecharse de forma inicial otras entidades clínicas, con resultado ominoso a pesar del tratamiento poliquimioterapéutico.