La colitis ulcerosa es una enfermedad crónica del tracto digestivo, y hasta el 20-30% de los pacientes sufren un brote grave durante su evolución. Aunque existen guías nacionales e internacionales sobre el tratamiento de la colitis ulcerosa aguda grave, desconocemos cómo se manejan en la práctica clínica estos pacientes en nuestro medio.
MétodosRealizamos una encuesta electrónica y anónima entre los miembros del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU), compuesta por 51 preguntas con respuestas predefinidas.
ResultadosParticiparon 164 miembros (20%), en su mayoría especialistas de aparato digestivo (95%). El 59% trabajaban en hospitales terciarios, atendiendo a una mediana de 5 pacientes al año (RIC: 3-8) con un brote grave de colitis ulcerosa. El 86% realizan un estudio endoscópico rutinario, habitualmente al ingreso (62%). El corticoide más empleado es la metilprednisolona, habitualmente a una dosis de 60mg/día, y se evalúa su respuesta pasados 3días (mediana, RIC: 3-5). El tratamiento de rescate usado con más frecuencia es infliximab, tanto en pacientes naïve como refractarios a tiopurinas. El 55% han indicado en alguna ocasión una dosis de infliximab mayor de 5mg/kg durante la inducción, y el 73% han adelantado alguna de las sucesivas infusiones.
ConclusionesEl manejo de la colitis ulcerosa aguda grave en nuestro entorno se ajusta en general a las recomendaciones de tratamiento actuales. El tratamiento de rescate más frecuentemente prescrito es el infliximab, y no es excepcional el empleo de pautas intensificadas o aceleradas de este biológico.
Ulcerative colitis (UC) is a chronic disease of the digestive tract and up to 20-30% of UC patients may suffer a severe flare-up during the course of the disease. Although there are national and international recommendations about its clinical management, there is not enough information about the treatment of acute severe UC in clinical practice.
MethodsAn electronic and anonymous survey with 51 multiple-choice questions was performed among all the members of the Spanish Crohn's Disease and Ulcerative Colitis Working Group (GETECCU).
ResultsOut of the 164 responders (20%), most were gastroenterologists (95%), with 59% from tertiary hospitals treating a median of 5 patients per year (IQR: 3-8) with a severe flare-up of ulcerative colitis. An endoscopic examination was routinely performed in 86% of patients (62% at admission). The most commonly used corticosteroid was methylprednisolone, usually at a dose of 60mg/day, and its response was assessed after a median of 3days (IQR: 3-5). Both in thiopurine-naïve and thiopurine-refractory patients, infliximab was the drug most frequently prescribed as rescue therapy. Half of responders (55%) had ever prescribed a first dose of infliximab higher than 5 mg/kg, and a higher proportion (73%) had ever prescribed an earlier dose of infliximab in the second or third infusion.
ConclusionsAcute severe UC is generally managed according to current treatment guidelines in our setting. The rescue therapy most commonly prescribed is infliximab, and the use of intensified or accelerated regimens with this biological drug is not unusual.
La colitis ulcerosa (CU) es una enfermedad crónica que afecta al colon y que cursa habitualmente en brotes con síntomas como diarrea y rectorragia1. Hasta el 20-30% de los pacientes con CU pueden llegar a sufrir un brote grave de esta enfermedad (colitis ulcerosa aguda grave [CUAG]) con necesidad de ingreso hospitalario2. El diagnóstico de estos brotes se basa en los criterios clásicos de Truelove-Witts, en los que se requiere la presencia de ≥6 deposiciones con sangre al día, además de alguno de los siguientes: frecuencia cardíaca >90latidos/min, temperatura corporal >37,8°C, hemoglobina <10,5g/dl o velocidad de sedimentación >30mm/h3. Antes de la implantación del tratamiento con corticoides intravenosos y la realización de colectomía de urgencia esta complicación se asociaba a una mortalidad de hasta el 70%, pero esta ha disminuido de forma drástica en los últimos años hasta encontrarse actualmente por debajo del 1%4. Los pilares del manejo de esta situación se basan en el diagnóstico precoz, seguido de hospitalización y el inicio sin demora de tratamiento médico con corticoides intravenosos. A pesar de estas medidas, hasta el 30-40% de los pacientes no presentan una mejoría y requieren otras alternativas de tratamiento médico o cirugía5.
Aún existen áreas de controversia sobre algunos aspectos de la CUAG, pero disponemos de guías y recomendaciones recientes que recogen cómo deben manejarse estos pacientes6-8. No obstante, no disponemos de información acerca de cómo es la práctica clínica habitual en nuestro medio. El objetivo del presente estudio fue evaluar los aspectos fundamentales del manejo de la CUAG en la práctica clínica en nuestro entorno.
MétodosDiseñamos una encuesta electrónica compuesta de 51 preguntas que cubrían los aspectos más importantes del manejo de la CUAG. La población encuestada estaba constituida por todos los miembros del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU), que en el momento de realizar la encuesta contaba con 810 socios. El proyecto siguió el proceso habitual de revisión establecido en GETECCU, finalizando con la aprobación de la versión final de la encuesta. Las preguntas se diseñaron para analizar las pautas habituales del tratamiento médico inicial con corticoides y aminosalicilatos, la búsqueda activa de algunas infecciones como el citomegalovirus (CMV), la profilaxis y el tratamiento de otras infecciones, los estudios endoscópicos realizados, las pautas de uso de los diferentes tratamientos de rescate disponibles y cómo se llevaba a cabo la valoración de la cirugía en esta situación.
Se enviaron tres invitaciones, entre febrero y abril de 2018, mediante correo electrónico. La encuesta se diseñó a través de la plataforma electrónica REDCap, proporcionada por la Asociación Española de Gastroenterología (AEG)9. La AEG es una asociación científica sin ánimo de lucro que proporciona este servicio de forma gratuita con el objetivo de favorecer la realización de investigaciones multicéntricas promovidas por investigadores independientes. La plataforma REDCap es una aplicación web diseñada para la recogida de información para estudios de investigación que consiste en una interfaz intuitiva, junto con herramientas para la monitorización de los datos y su exportación a los principales programas estadísticos, así como la capacidad de importar datos desde otras fuentes. La encuesta se diseñó en esta plataforma y se respondía en todos los casos de forma anónima.
Sobre un total de 810 miembros, teniendo en cuenta un 15% de pérdidas por errores en la entrega o recepción de las invitaciones, y con una participación estimada del 20%, el número de respuestas esperado era de 137. Los resultados se incluyeron en una base de datos electrónica, donde se llevó a cabo el análisis estadístico mediante el programa SPSS versión 20.0 (IBM Corp.; Armonk, NY, EE.UU.). Para las variables cuantitativas se calculó la media y la desviación estándar en caso de que estas siguieran una distribución normal, o la mediana y el rango intercuartílico (RIC) en caso contrario. Las respuestas se compararon mediante el test estadístico de la chi-cuadrado (χ2). Se consideraron diferencias estadísticamente significativas aquellas con un valor de p inferior a 0,05.
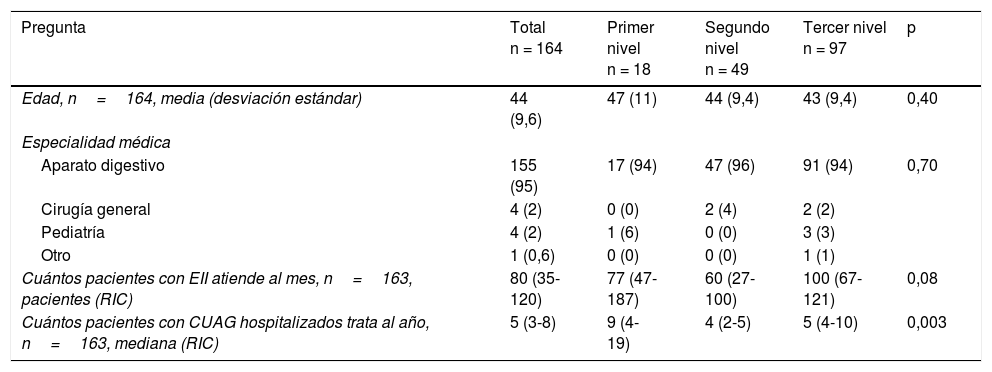
ResultadosParticiparon un total de 164 socios (20% del total). Los resultados de todas las respuestas referentes a los aspectos demográficos se recogen en la tabla 1. Los participantes tenían una edad media de 44años (desviación estándar: 9,6). En el 95% de los casos eran especialistas en aparato digestivo, y el 59% del total trabajaban en hospitales terciarios. Indicaron que atendían aproximadamente a 80 pacientes (RIC: 35-120) con enfermedad inflamatoria intestinal al mes. Además, cada año trataban a una mediana de 5 pacientes (RIC: 3-8) con un brote de CUAG.
Aspectos epidemiológicos
| Pregunta | Total n = 164 | Primer nivel n = 18 | Segundo nivel n = 49 | Tercer nivel n = 97 | p |
|---|---|---|---|---|---|
| Edad, n=164, media (desviación estándar) | 44 (9,6) | 47 (11) | 44 (9,4) | 43 (9,4) | 0,40 |
| Especialidad médica | |||||
| Aparato digestivo | 155 (95) | 17 (94) | 47 (96) | 91 (94) | 0,70 |
| Cirugía general | 4 (2) | 0 (0) | 2 (4) | 2 (2) | |
| Pediatría | 4 (2) | 1 (6) | 0 (0) | 3 (3) | |
| Otro | 1 (0,6) | 0 (0) | 0 (0) | 1 (1) | |
| Cuántos pacientes con EII atiende al mes, n=163, pacientes (RIC) | 80 (35-120) | 77 (47-187) | 60 (27-100) | 100 (67-121) | 0,08 |
| Cuántos pacientes con CUAG hospitalizados trata al año, n=163, mediana (RIC) | 5 (3-8) | 9 (4-19) | 4 (2-5) | 5 (4-10) | 0,003 |
CUAG: colitis ulcerosa aguda grave; EII: enfermedad inflamatoria intestinal; RIC: rango intercuartílico.
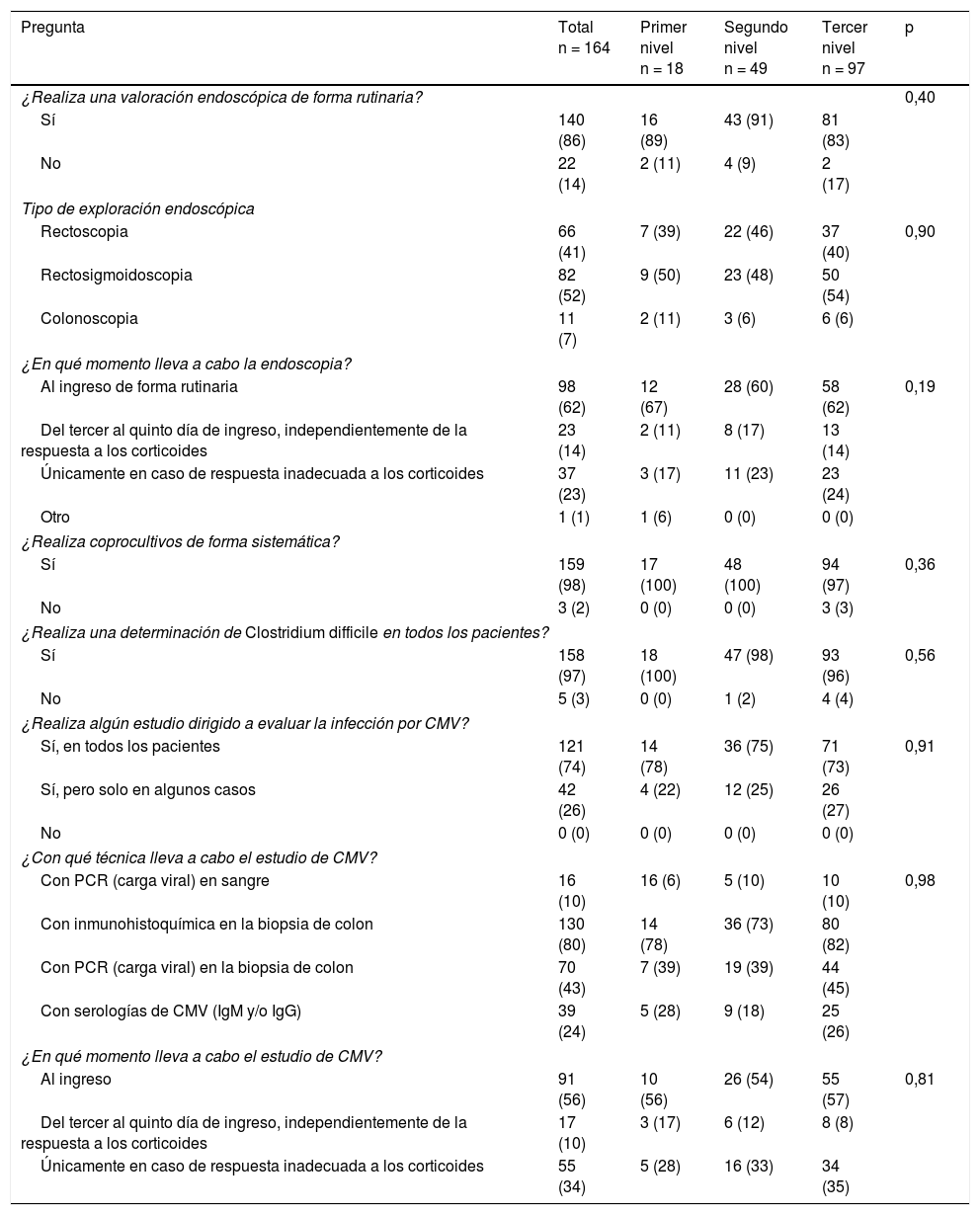
Los resultados obtenidos en las preguntas referentes a aspectos del diagnóstico se recogen en la tabla 2, y los referentes al tratamiento, en la tabla 3. Al ingreso, el 98% de los participantes realizaban un coprocultivo o determinación de toxina de Clostridium difficile (97%). El 99% de los participantes administraban profilaxis tromboembólica con heparina de bajo peso molecular. El 27% indicaban antibioterapia empírica. El estudio de la infección por CMV se realizaba de forma rutinaria por el 74% de los participantes, con frecuencia al ingreso (56%) o en caso de una respuesta inadecuada a los corticoides (34%). La técnica más empleada para estudiar esta infección era la inmunohistoquímica (80%), y con menos frecuencia la PCR en la biopsia colónica (43%). El 86% realizaban un estudio endoscópico de forma rutinaria, siendo en el 62% la actitud tomada al ingreso. La exploración realizada con más frecuencia era la rectosigmoidoscopia (52%), seguida de la rectoscopia (41%), mientras que en el 7% se realizaba una colonoscopia. Dentro del tratamiento inicial con corticoides en estos casos, la mayoría de participantes elegían la metilprednisolona (85%), a una dosis de 60mg/día, administrada en bolos intravenosos (97%).
Diagnóstico
| Pregunta | Total n = 164 | Primer nivel n = 18 | Segundo nivel n = 49 | Tercer nivel n = 97 | p |
|---|---|---|---|---|---|
| ¿Realiza una valoración endoscópica de forma rutinaria? | 0,40 | ||||
| Sí | 140 (86) | 16 (89) | 43 (91) | 81 (83) | |
| No | 22 (14) | 2 (11) | 4 (9) | 2 (17) | |
| Tipo de exploración endoscópica | |||||
| Rectoscopia | 66 (41) | 7 (39) | 22 (46) | 37 (40) | 0,90 |
| Rectosigmoidoscopia | 82 (52) | 9 (50) | 23 (48) | 50 (54) | |
| Colonoscopia | 11 (7) | 2 (11) | 3 (6) | 6 (6) | |
| ¿En qué momento lleva a cabo la endoscopia? | |||||
| Al ingreso de forma rutinaria | 98 (62) | 12 (67) | 28 (60) | 58 (62) | 0,19 |
| Del tercer al quinto día de ingreso, independientemente de la respuesta a los corticoides | 23 (14) | 2 (11) | 8 (17) | 13 (14) | |
| Únicamente en caso de respuesta inadecuada a los corticoides | 37 (23) | 3 (17) | 11 (23) | 23 (24) | |
| Otro | 1 (1) | 1 (6) | 0 (0) | 0 (0) | |
| ¿Realiza coprocultivos de forma sistemática? | |||||
| Sí | 159 (98) | 17 (100) | 48 (100) | 94 (97) | 0,36 |
| No | 3 (2) | 0 (0) | 0 (0) | 3 (3) | |
| ¿Realiza una determinación de Clostridium difficile en todos los pacientes? | |||||
| Sí | 158 (97) | 18 (100) | 47 (98) | 93 (96) | 0,56 |
| No | 5 (3) | 0 (0) | 1 (2) | 4 (4) | |
| ¿Realiza algún estudio dirigido a evaluar la infección por CMV? | |||||
| Sí, en todos los pacientes | 121 (74) | 14 (78) | 36 (75) | 71 (73) | 0,91 |
| Sí, pero solo en algunos casos | 42 (26) | 4 (22) | 12 (25) | 26 (27) | |
| No | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| ¿Con qué técnica lleva a cabo el estudio de CMV? | |||||
| Con PCR (carga viral) en sangre | 16 (10) | 16 (6) | 5 (10) | 10 (10) | 0,98 |
| Con inmunohistoquímica en la biopsia de colon | 130 (80) | 14 (78) | 36 (73) | 80 (82) | |
| Con PCR (carga viral) en la biopsia de colon | 70 (43) | 7 (39) | 19 (39) | 44 (45) | |
| Con serologías de CMV (IgM y/o IgG) | 39 (24) | 5 (28) | 9 (18) | 25 (26) | |
| ¿En qué momento lleva a cabo el estudio de CMV? | |||||
| Al ingreso | 91 (56) | 10 (56) | 26 (54) | 55 (57) | 0,81 |
| Del tercer al quinto día de ingreso, independientemente de la respuesta a los corticoides | 17 (10) | 3 (17) | 6 (12) | 8 (8) | |
| Únicamente en caso de respuesta inadecuada a los corticoides | 55 (34) | 5 (28) | 16 (33) | 34 (35) | |
CMV: citomegalovirus; PCR: reacción en cadena a la polimerasa.
Resultados expresados como frecuencia (%).
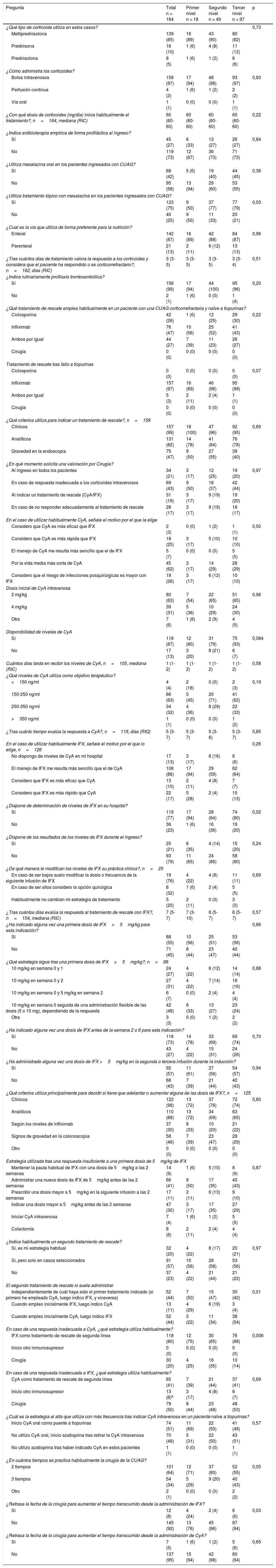
Tratamiento
| Pregunta | Total n = 164 | Primer nivel n = 18 | Segundo nivel n = 49 | Tercer nivel n = 97 | p |
|---|---|---|---|---|---|
| ¿Qué tipo de corticoide utiliza en estos casos? | 0,73 | ||||
| Metilprednisolona | 139 (85) | 16 (89) | 43 (90) | 80 (82) | |
| Prednisona | 16 (10) | 1 (6) | 4 (8) | 11 (12) | |
| Prednisolona | 8 (5) | 1 (6) | 1 (2) | 6 (6) | |
| ¿Cómo administra los corticoides? | |||||
| Bolos intravenosos | 158 (97) | 17 (94) | 48 (98) | 93 (97) | 0,83 |
| Perfusión continua | 4 (2) | 1 (6) | 1 (2) | 2 (2) | |
| Vía oral | 1 (1) | 0 (0) | 0 (0) | 1 (1) | |
| ¿Con qué dosis de corticoides (mg/día) inicia habitualmente el tratamiento?, n=164, mediana (RIC) | 60 (60-60) | 60 (60-60) | 60 (60-60) | 60 (60-60) | 0,22 |
| ¿Indica antibioterapia empírica de forma profiláctica al ingreso? | |||||
| Sí | 45 (27) | 6 (33) | 13 (27) | 26 (27) | 0,84 |
| No | 119 (73) | 12 (67) | 36 (73) | 71 (73) | |
| ¿Utiliza mesalazina oral en los pacientes ingresados con CUAG? | |||||
| Sí | 68 (42) | 5 (6) | 19 (40) | 44 (45) | 0,36 |
| No | 95 (58) | 13 (94) | 29 (60) | 53 (55) | |
| ¿Utiliza tratamiento tópico con mesalazina en los pacientes ingresados con CUAG? | |||||
| Sí | 123 (75) | 9 (50) | 37 (77) | 77 (79) | 0,03 |
| No | 40 (25) | 9 (50) | 11 (33) | 20 (21) | |
| ¿Cual es la vía que utiliza de forma preferente para la nutrición? | |||||
| Enteral | 142 (87) | 16 (89) | 42 (88) | 84 (87) | 0,96 |
| Parenteral | 21 (13) | 2 (11) | 6 (12) | 13 (13) | |
| ¿Tras cuántos días de tratamiento valora la respuesta a los corticoides y considera que el paciente ha respondido o es corticorrefractario?, n=162, días (RIC) | 3 (3-5) | 3 (3-5) | 3 (3-5) | 3 (3-4) | 0,51 |
| ¿Indica rutinariamente profilaxis tromboembólica? | |||||
| Sí | 156 (99) | 17 (94) | 44 (100) | 95 (96) | 0,20 |
| No | 2 (1) | 1 (6) | 0 (0) | 1 (4) | |
| ¿Qué tratamiento de rescate emplea habitualmente en un paciente con una CUAG corticorrefractaria y naïve a tiopurinas? | |||||
| Ciclosporina | 42 (26) | 1 (6) | 12 (25) | 29 (30) | 0,22 |
| Infliximab | 76 (47) | 10 (56) | 25 (52) | 41 (43) | |
| Ambos por igual | 44 (27) | 7 (39) | 11 (23) | 26 (27) | |
| Cirugía | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| Tratamiento de rescate tras fallo a tiopurinas | |||||
| Ciclosporina | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0,07 |
| Infliximab | 157 (97) | 16 (89) | 46 (96) | 95 (99) | |
| Ambos por igual | 5 (3) | 2 (11) | 2 (4) | 1 (1) | |
| Cirugía | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| ¿Qué criterios utiliza para indicar un tratamiento de rescate?, n=159 | |||||
| Clínicos | 157 (99) | 18 (100) | 47 (96) | 92 (95) | 0,89 |
| Analíticos | 131 (82) | 14 (78) | 41 (84) | 76 (78) | |
| Gravedad en la endoscopia | 75 (47) | 9 (50) | 27 (55) | 39 (40) | |
| ¿En qué momento solicita una valoración por Cirugía? | |||||
| Al ingreso en todos los pacientes | 34 (21) | 3 (17) | 12 (25) | 19 (20) | 0,97 |
| En caso de respuesta inadecuada a los corticoides intravenosos | 69 (43) | 9 (50) | 18 (37) | 42 (44) | |
| Al indicar un tratamiento de rescate (CyA/IFX) | 31 (19) | 3 (17) | 9 (19) | 19 (20) | |
| En caso de no responder adecuadamente al tratamiento de rescate | 28 (17) | 3 (17) | 9 (19) | 16 (17) | |
| En el caso de utilizar habitualmente CyA, señale el motivo por el que la elige | |||||
| Considero que CyA es más eficaz que IFX | 2 (3) | 0 (0) | 1 (2) | 1 (1) | 0,50 |
| Considero que CyA es más rápida que IFX | 18 (25) | 3 (17) | 5 (10) | 10 (10) | |
| El manejo de CyA me resulta más sencillo que el de IFX | 5 (7) | 0 (0) | 0 (0) | 5 (5) | |
| Por la vida media más corta de CyA | 45 (62) | 3 (17) | 14 (29) | 28 (29) | |
| Considero que el riesgo de infecciones posquirúrgicas es mayor con IFX | 19 (26) | 3 (17) | 6 (12) | 10 (10) | |
| Dosis inicial de CyA intravenosa | |||||
| 2 mg/kg | 80 (63) | 7 (54) | 22 (65) | 51 (65) | 0,96 |
| 4 mg/kg | 39 (31) | 5 (38) | 10 (29) | 24 (30) | |
| Otra | 7 (6) | 1 (8) | 2 (9) | 4 (5) | |
| Disponibilidad de niveles de CyA | |||||
| Sí | 118 (87) | 12 (80) | 31 (79) | 75 (93) | 0,084 |
| No | 17 (13) | 3 (20) | 8 (21) | 6 (7) | |
| Cuántos días tarda en recibir los niveles de CyA, n=105, mediana (RIC) | 1 (1-2) | 1 (1-2) | 1 (1-2) | 1 (1-2) | 0,58 |
| ¿Qué niveles de CyA utiliza como objetivo terapéutico? | |||||
| <150 ng/ml | 4 (4) | 2 (18) | 0 (0) | 2 (3) | 0,19 |
| 150-250 ng/ml | 66 (63) | 5 (45) | 20 (71) | 41 (62) | |
| 250-350 ng/ml | 34 (32) | 4 (36) | 8 (29) | 22 (33) | |
| >350 ng/ml | 1 (1) | 0 (0) | 0 (0) | 1 (2) | |
| ¿Tras cuánto tiempo evalúa la respuesta a CyA?, n=119, días (RIQ) | 5 (3-7) | 5 (3-7) | 5 (3-6) | 5 (3-7) | 0,85 |
| En el caso de utilizar habitualmente IFX, señale el motivo por el que lo elige, n=126 | 0,26 | ||||
| No dispongo de niveles de CyA en mi hospital | 17 (13) | 3 (17) | 8 (16) | 6 (6) | |
| El manejo de IFX me resulta más sencillo que el de CyA | 108 (86) | 17 (94) | 29 (59) | 62 (64) | |
| Considero que IFX es más eficaz que CyA | 13 (10) | 2 (11) | 4 (8) | 7 (7) | |
| Considero que IFX es más rápido que CyA | 22 (17) | 5 (28) | 2 (4) | 15 (15) | |
| ¿Dispone de determinación de niveles de IFX en su hospital? | |||||
| Sí | 119 (77) | 17 (94) | 28 (64) | 74 (80) | 0,02 |
| No | 36 (23) | 1 (6) | 16 (36) | 19 (20) | |
| ¿Dispone de los resultados de los niveles de IFX durante el ingreso? | |||||
| Sí | 25 (21) | 6 (35) | 4 (14) | 15 (20) | 0,24 |
| No | 93 (79) | 11 (65) | 24 (86) | 58 (80) | |
| ¿De qué manera le modifican los niveles de IFX su práctica clínica?, n=25 | |||||
| En caso de ser bajos suelo modificar la dosis o frecuencia de la siguiente infusión de IFX | 19 (76) | 4 (22) | 4 (8) | 11 (11) | 0,69 |
| En caso de ser altos considero la opción quirúrgica | 8 (32) | 1 (6) | 2 (4) | 5 (5) | |
| Habitualmente no cambian mi estrategia de tratamiento | 5 (20) | 2 (11) | 0 (0) | 3 (3) | |
| ¿Tras cuántos días evalúa la respuesta al tratamiento de rescate con IFX?, n=154, mediana (RIC) | 7 (5-7) | 7 (3-10) | 6 (5-7) | 6 (5-7) | 0,57 |
| ¿Ha indicado alguna vez una primera dosis de IFX>5mg/kg para esta indicación? | 0,86 | ||||
| Sí | 88 (55) | 10 (56) | 25 (51) | 53 (56) | |
| No | 71 (45) | 8 (44) | 23 (47) | 40 (44) | |
| ¿Qué estrategia sigue tras una primera dosis de IFX>5mg/kg?, n=88 | |||||
| 10 mg/kg en semana 0 y 1 | 24 (27) | 4 (22) | 6 (12) | 14 (14) | 0,88 |
| 10 mg/kg en semana 0 y 2 | 27 (31) | 4 (22) | 7 (14) | 16 (16) | |
| 10 mg/kg en semana 0 y 5 mg/kg en semana 2 | 6 (7) | 0 (0) | 2 (4) | 4 (4) | |
| 10 mg/kg en semana 0 seguida de una administración flexible de las dosis (5 o 10 mg), dependiendo de la respuesta | 42 (48) | 6 (33) | 13 (27) | 23 (24) | |
| Otra | 3 (3) | 0 (0) | 1 (2) | 2 (2) | |
| ¿Ha indicado alguna vez una dosis de IFX antes de la semana 2 o 6 para esta indicación? | |||||
| Sí | 116 (73) | 14 (78) | 33 (69) | 69 (74) | 0,70 |
| No | 43 (27) | 4 (22) | 15 (31) | 24 (26) | |
| ¿Ha administrado alguna vez una dosis de IFX >5mg/kg en la segunda o tercera infusión durante la inducción? | |||||
| Sí | 92 (57) | 11 (61) | 27 (56) | 54 (57) | 0,94 |
| No | 68 (43) | 7 (39) | 21 (44) | 40 (43) | |
| ¿Qué criterios utiliza principalmente para decidir si tiene que adelantar o aumentar alguna de las dosis de IFX?, n=125 | |||||
| Clínicos | 122 (98) | 13 (72) | 37 (76) | 72 (74) | 0,80 |
| Analíticos | 110 (88) | 13 (72) | 34 (69) | 63 (65) | |
| Según los niveles de infliximab | 37 (30) | 6 (33) | 10 (20) | 21 (22) | |
| Signos de gravedad en la colonoscopia | 58 (46) | 7 (39) | 23 (47) | 28 (29) | |
| Otro | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| Estrategia utilizada tras una respuesta insuficiente a una primera dosis de 5mg/kg de IFX | |||||
| Mantener la pauta habitual de IFX con una dosis de 5mg/kg a las 2 semanas | 14 (9) | 1 (6) | 5 (10) | 8 (9) | 0,87 |
| Administrar una nueva dosis de IFX de 5mg/kg antes de las 2 semanas | 66 (41) | 9 (50) | 17 (35) | 40 (43) | |
| Prescribir una dosis mayor a 5mg/kg en la siguiente infusión a las 2 semanas | 17 (11) | 2 (11) | 6 (13) | 9 (10) | |
| Indicar una dosis mayor a 5mg/kg antes de las 2 semanas | 47 (30) | 3 (17) | 17 (35) | 27 (29) | |
| Iniciar CyA intravenosa | 7 (4) | 1 (6) | 1 (2) | 5 (5) | |
| Colectomía | 8 (6) | 2 (11) | 2 (4) | 4 (4) | |
| ¿Indica habitualmente un segundo tratamiento de rescate? | |||||
| Sí, es mi estrategia habitual | 32 (20) | 4 (22) | 8 (17) | 20 (21) | 0,97 |
| Sí, pero solo en casos seleccionados | 91 (57) | 10 (56) | 28 (58) | 53 (56) | |
| No | 37 (23) | 4 (22) | 21 (44) | 21 (22) | |
| El segundo tratamiento de rescate lo suele administrar | |||||
| Independientemente de cuál haya sido el primer tratamiento indicado (si primero he empleado CyA, luego indico IFX, y viceversa) | 52 (44) | 7 (50) | 15 (47) | 30 (42) | 0,01 |
| Cuando empleo inicialmente IFX, luego indico CyA | 13 (11) | 4 (29) | 6 (19) | 3 (4) | |
| Cuando empleo inicialmente CyA, luego indico IFX | 52 (44) | 3 (22) | 11 (34) | 38 (54) | |
| En caso de una respuesta inadecuada a CyA, ¿qué estrategia utiliza habitualmente? | |||||
| IFX como tratamiento de rescate de segunda línea | 118 (80) | 12 (75) | 30 (65) | 76 (86) | 0,006 |
| Inicio otro inmunosupresor | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| Cirugía | 30 (20) | 4 (25) | 16 (35) | 10 (14) | |
| En caso de una respuesta inadecuada a IFX, ¿qué estrategia utiliza habitualmente? | |||||
| CyA como tratamiento de rescate de segunda línea | 65 (41) | 7 (39) | 21 (44) | 37 (41) | 0,69 |
| Inicio otro inmunosupresor | 13 (8)a | 3 (17) | 4 (8) | 6 (7) | |
| Cirugía | 79 (50) | 8 (44) | 23 (48) | 48 (53) | |
| ¿Cuál es la estrategia al alta que utiliza con más frecuencia tras indicar CyA intravenosa en un paciente naïve a tiopurinas? | |||||
| Inicio CyA oral como puente a tiopurinas | 74 (51) | 11 (69) | 22 (50) | 41 (48) | 0,57 |
| No utilizo CyA oral, inicio azatioprina tras retirar la CyA intravenosa | 70 (48) | 5 (31) | 22 (50) | 43 (51) | |
| No utilizo azatioprina tras haber indicado CyA en estos pacientes | 1 (1) | 0 (0) | 0 (0) | 1 (1) | |
| ¿En cuántos tiempos se practica habitualmente la cirugía de la CUAG? | |||||
| 2 tiempos | 101 (64) | 12 (71) | 37 (80) | 52 (55) | 0,05 |
| 3 tiempos | 54 (34) | 5 (29) | 9 (20) | 40 (43) | |
| Otro | 2 (1) | 0 (0) | 0 (0) | 2 (2) | |
| ¿Retrasa la fecha de la cirugía para aumentar el tiempo transcurrido desde la administración de IFX? | |||||
| Sí | 12 (8) | 4 (24) | 2 (4) | 6 (6) | 0,03 |
| No | 145 (92) | 13 (76) | 45 (96) | 87 (94) | |
| ¿Retrasa la fecha de la cirugía para aumentar el tiempo transcurrido desde la administración de CyA? | |||||
| Sí | 7 (5) | 1 (6) | 1 (2) | 5 (6) | 0,65 |
| No | 137 (95) | 15 (94) | 42 (98) | 80 (94) | |
CyA: ciclosporina; CUAG: colitis ulcerosa aguda grave; IFX: infliximab; RIC: rango intercuartílico.
De forma consistente en los diferentes tipos de hospitales estudiados, observamos que la respuesta a los corticoides se realiza tras 3días de tratamiento (RIC: 3-5). En concreto, el 66% de los miembros analizan la respuesta a los corticoides intravenosos tras 3días de tratamiento. En los pacientes que no responden al tratamiento corticoideo y que no reciben tratamiento con tiopurinas, el 47% de los encuestados habitualmente iniciaban infliximab (IFX) y, con menor frecuencia, ciclosporina (CyA) (26%), mientras que el 27% no tenían preferencia por ninguno de los dos fármacos. En los pacientes que sufren un brote de CUAG y ya se encuentran en tratamiento con tiopurinas, los médicos encuestados utilizaban en la mayoría de casos IFX (97%), mientras que al 3% les resultaba indiferente el uso de IFX o CyA. Cuando se utilizaba CyA, esta se elige con más frecuencia por su vida media más corta (62%) o su mecanismo de acción más rápido (25%). La dosis de CyA inicial era habitualmente de 2mg/kg (63% de los participantes). Entre los participantes que utilizaban más habitualmente IFX, este se elegía fundamentalmente por su mayor facilidad de manejo (86%). La determinación de niveles de IFX estaba disponible en el 77% de los hospitales, pero a pesar de esto los resultados de dichos niveles no estaban disponibles habitualmente durante el ingreso por un brote de CUAG (79% de los casos).
Aproximadamente la mitad de los encuestados (55%) habían utilizado alguna vez una dosis inicial de IFX mayor de 5mg/kg. De entre los que la habían indicado, la estrategia posterior se seguía con más frecuencia de una administración flexible de las dosis (5 o 10mg/kg) de la segunda infusión, dependiendo de la respuesta (48%). Una proporción similar a lo observado con la dosis inicial (57%) había utilizado alguna vez una dosis más alta de IFX (>5mg/kg) en la segunda o tercera infusión. En el caso de no alcanzar los objetivos terapéuticos con IFX, el 41% de los participantes adelantaban la segunda o la tercera dosis de IFX, mientras que un tercio han administrado alguna vez una dosis adelantada y a dosis mayores durante la inducción.
El 20% de los participantes utilizaban un segundo tratamiento de rescate (IFX tras el fracaso de CyA, o viceversa) de forma rutinaria, mientras que el 23% nunca lo han indicado. Más encuestados preferían usar IFX tras CyA que al contrario (44% vs. 11%), aunque el 44% utilizaban un segundo tratamiento de rescate independientemente del primer fármaco indicado. Entre los participantes que utilizaban habitualmente IFX, tras una respuesta inadecuada a este indicaban habitualmente cirugía (50%) o CyA (41%).
CirugíaEn la mayoría de casos se solicitaba una valoración por parte de un cirujano una vez se había considerado que el brote de CUAG es corticorrefractario (43%) y, con menor frecuencia (21%), al ingreso de forma rutinaria. A la hora de realizar la cirugía, esta se llevaba a cabo habitualmente en dos tiempos (64%), y la administración previa de IFX (92%) o CyA (95%) no influía en el momento de llevar a cabo la intervención quirúrgica.
Resultados según el tipo de hospitalLos resultados de la encuesta se presentan en la tablas 1-3 divididos por el tipo de hospital de trabajo de los encuestados. Como se puede observar, los miembros cuyo centro de trabajo era un hospital de primer nivel atendían a un número ligeramente mayor de casos de CUAG (p=0,003). Con respecto al tratamiento de rescate en pacientes naïve a tiopurinas, en los centros terciarios se empleaba con más frecuencia la CyA, mientras que en los de primer o segundo nivel se empleaba con una frecuencia ligeramente mayor el IFX, si bien estas diferencias no alcanzaban la significación estadística (p=0,22). En cambio, en los casos refractarios a tiopurinas el uso de IFX era la actitud más frecuente, sin observarse diferencias según el tipo de centro (p=0,07). Aunque no observamos diferencias estadísticamente significativas (p=0,19), una proporción ligeramente mayor de participantes de hospitales de primer nivel tenían como objetivo unos niveles de CyA<150ng/ml, en comparación con aquellos en hospitales de segundo o tercer nivel (18% vs. 0% y 3%, respectivamente). Sobre el uso de pautas aceleradas o intensificadas de IFX, observamos que se empleaban con la misma frecuencia independientemente del tipo de hospital, y que la estrategia en las siguientes pautas durante la inducción era también similar. A pesar de que el uso de un segundo tratamiento de rescate era similar en los grupos analizados, en los hospitales terciarios se empleaba con más frecuencia IFX tras CyA, mientras que en los de primer o segundo nivel se empleaba más habitualmente el tratamiento de rescate en el orden inverso (p=0,01).
DiscusiónLa CUAG es una complicación con una importante morbimortalidad que en nuestro medio se maneja, en general, de acuerdo con las recomendaciones de práctica clínica actuales6-8. Sin embargo, como indican los resultados de la presente encuesta, todavía existe una considerable variabilidad en su manejo en la práctica habitual. En la CUAG refractaria a esteroides el IFX es la alternativa más utilizada en comparación con la CyA. Además, hasta la mitad de los encuestados emplean una posología de IFX con estrategias intensificadas o aceleradas.
La evolución de la CU, en términos de actividad clínica, ha sido analizada recientemente en una revisión sistemática10. En este trabajo se observó que la mayoría de pacientes con CU tienen una actividad clínica leve-moderada, con un predominio de la actividad en el período más próximo al diagnóstico. De todas formas, hay que tener en cuenta que durante el curso de la enfermedad hasta el 20-30% de pacientes requieren hospitalización por un brote grave2. Además, de forma general, el riesgo de presentar nuevos brotes pasados 10años del diagnóstico es del 70-80%, y el de hospitalización, del 50%. Otro aspecto clínicamente muy relevante es que el 10-15% de pacientes requerirán una colectomía tras 5-10años desde el diagnóstico.
Recientemente se ha realizado una encuesta en Estados Unidos por la Crohn's and Colitis Foundation of American Clinical Research Alliance y miembros activos de la International Organization for Inflammatory Bowel Disease con el objetivo de evaluar el uso de pautas modificadas de IFX11. En esta encuesta se observó que en pacientes con CUAG solo el 24% de los médicos empleaban dosis habituales de IFX durante la inducción (5mg/kg en las semanas 0, 2 y 6). Los criterios que más se utilizaban para decidir el uso de una pauta acelerada de IFX se basaban en la sintomatología, la proteína C reactiva y los niveles de IFX. En los pacientes en los que se adelantaba la administración del fármaco esta decisión se basaba en la gravedad clínica (68%), pero en otras ocasiones (22%) se llevaba a cabo considerado de forma conjunta la proteína C reactiva, la albúmina y la gravedad de las lesiones endoscópicas. Dentro de las diferentes estrategias empleadas, el 25% de los encuestados empleaban una dosis inicial de 5mg/kg seguidos de una dosis de 10mg/kg en la semana 2 si no había una respuesta satisfactoria. La segunda estrategia más frecuente (18%) era el uso de 10mg/kg desde el inicio, con una administración flexible de las dosis.
En nuestro entorno, entre los miembros de GETECCU el manejo de los brotes de CUAG se ajusta en general a las recomendaciones actuales sobre el manejo en la práctica clínica de estos casos6-8. Se puede observar que los especialistas, en su mayoría gastroenterólogos, atienden a un elevado número de pacientes ambulatorios con enfermedad inflamatoria intestinal, aunque los casos de CUAG se mantienen en aproximadamente 5 al año. Uno de los aspectos fundamentales consiste en el establecimiento de unos objetivos terapéuticos claros, especialmente en los primeros 3 a 5días de tratamiento corticoideo. Hemos podido observar que en nuestro medio, y en los diferentes tipos de hospitales analizados, el período para considerar a un paciente como corticorrefractario se ajusta a las recomendaciones internacionales6-8. Otros aspectos también importantes, como la realización de cultivos de heces y la determinación de toxina de Clostridium difficile, se llevan a cabo de forma generalizada, aunque el 2-3% de los participantes no los realizan de forma rutinaria. Por otro lado, cabe destacar que tanto la realización de un estudio endoscópico como la evaluación de la infección por CMV no se realizan de forma sistemática (86 y 74%, respectivamente), a pesar de que existen recomendaciones que apoyan su evaluación en esta situación6,12. De entre los encuestados que estudian la infección por CMV, esta se analiza habitualmente al ingreso (56%), aunque una proporción relevante de los encuestados la estudia únicamente en caso de una respuesta inadecuada a los corticoides (34%). Este aspecto es importante en la práctica habitual, ya que recientemente se ha observado que el tratamiento con IFX o CyA en pacientes con CU activa hospitalizados por un brote moderado-grave y que reciben tratamiento por una infección por CMV no se asocia a una tasa mayor de colectomía13. Dentro del manejo general de los casos de CUAG hemos comprobado también que el uso de mesalazina, tanto oral (42%) como tópica (75%), es relativamente frecuente, a pesar de que no existe evidencia clara para su uso en este contexto.
En la presente encuesta hemos observado que el tratamiento de rescate más utilizado en la CUAG es el IFX, independientemente de si los pacientes están recibiendo azatioprina en el momento del brote. Un aspecto adicional que hemos evaluado es el uso de pautas de IFX diferentes a la habitual, ya que se ha sugerido que estos pacientes podrían necesitar una posología diferente de este fármaco debido a la propia fisiopatología de la CUAG14. En estos casos, además de existir un mayor aclaramiento del fármaco, favorecido por la mayor carga inflamatoria sistémica, puede existir un aumento de la permeabilidad intestinal, lo que condiciona una pérdida de fármaco por las heces15-17. Por este motivo se ha planteado que en determinadas situaciones podría ser necesaria una modificación de la pauta habitual de IFX, ya sea reduciendo el intervalo entre las dosis (pauta acelerada) o incrementando la dosis de cada infusión (pauta intensificada)14. Disponemos de pocos estudios que hayan evaluado el uso de pautas aceleradas o intensificadas de IFX, por lo que la evidencia sobre las dosis, los intervalos de administración y las decisiones sobre su manejo es aún muy limitada y no está recogida en las principales guías sobre el manejo de esta enfermedad. En el principal estudio realizado al respecto, la administración de tres dosis de IFX en un período de 24días (RIC: 21-29) se asoció a un menor riesgo de colectomía a los 3meses, en comparación con la pauta habitual de IFX18. Otros estudios no han objetivado claras diferencias en la tasa de colectomía tras 3 y 12meses con la administración de una pauta de inducción acelerada en 20días (RIQ: 1-26)19. En nuestro entorno, según los resultados de la encuesta, aproximadamente la mitad de los especialistas han utilizado alguna vez una dosis mayor a la habitual (pauta intensificada) durante la inducción en estos pacientes. Por otro lado, en los casos en que no se alcanzan los objetivos terapéuticos con una primera infusión de 5mg/kg, una proporción relevante de los encuestados (82%) ha utilizado una segunda o tercera dosis de IFX modificada. Por otro lado, un 20% utiliza de forma rutinaria un segundo tratamiento de rescate, mientras que la mayoría (57%) solo lo indican en casos seleccionados. Entre los participantes de la encuesta observamos que esta estrategia era más frecuente cuando el primer fármaco empleado había sido la CyA. Aunque en nuestra encuesta no evaluamos el intervalo de tiempo entre ambas medicaciones, la literatura al respecto recoge que la mediana de dicho intervalo oscila entre 2 y 19días, mientras que si el primer fármaco había sido IFX este período era de 19 a 21días20.
Los resultados del presente estudio tienen dos limitaciones principales. Por un lado, la participación limitada en la encuesta (20%) ha podido condicionar la generalización de los datos a la práctica clínica habitual. Además, los participantes podrían ser miembros con un mayor interés o conocimientos sobre el tema abordado, lo que conllevaría unos resultados mejores que en la vida real. En segundo lugar, ciertas variables analizadas se han obtenido directamente de los participantes, sin recurrir a datos objetivos sobre aspectos como el número de pacientes tratados, la dosis de los fármacos o el momento de evaluación de la respuesta a los corticoides. Esto debe ser tenido en cuenta, ya que puede añadir un sesgo a nuestros resultados al influir el recuerdo que tienen los participantes sobre estos aspectos.
En un estudio reciente, realizado también por GETECCU, se ha observado que la mortalidad en los casos de CUAG varía según el tipo de hospital que se analice21. Otros factores como la edad, la extensión de la enfermedad, la cirugía urgente y la presencia de complicaciones también se asocian a este desenlace21. En nuestra encuesta hemos analizado los resultados según el tipo de hospital de los participantes, sin observar diferencias importantes en el manejo de estos pacientes, lo que muestra que la práctica clínica en nuestro medio es homogénea en este contexto. Cabe destacar que existe una tendencia a un uso más frecuente de IFX en hospitales de primer nivel, que puede estar influenciado por una menor disponibilidad de niveles de CyA en estos hospitales, así como la consideración por parte de estos especialistas de que el IFX puede tener una mayor eficacia o ser más rápido, aunque no existen diferencias estadísticamente significativas en estas respuestas (p=0,26). El análisis general de los resultados de esta encuesta muestra que existe un manejo homogéneo de los casos de CUAG, independientemente del tipo de centro que se analice, lo que pone de relieve que existen unos criterios de tratamiento compartidos por la mayoría de especialistas de nuestro entorno.
ConclusionesA partir de los resultados obtenidos en la presente encuesta podemos concluir que el manejo de la CUAG en nuestro entorno se ajusta relativamente bien a las recomendaciones de tratamiento establecidas por las guías de consenso vigentes. El tratamiento de rescate empleado con más frecuencia en los casos refractarios al tratamiento corticoideo es el IFX, y las pautas modificadas de este biológico —aceleradas o intensificadas— se utilizan con una frecuencia creciente, aunque requieren una mayor evidencia que apoye su uso.
Conflicto de interesesIR-L. Financiación para asistencia a congresos, participación en actividades de formación o asesoramiento científico: MSD, Pfizer, Abbvie, Takeda, Janssen, Tillotts Pharma, Shire Pharmaceuticals, Ferring, Dr. Falk Pharma y Otsuka Pharmaceutical.
RF-I. Financiación para asistencia a congresos, participación en actividades de formación o asesoramiento científico: MSD, Abbvie, Takeda, Shire Pharmaceuticals, Dr. Falk Pharma, Otsuka Pharmaceutical y Casen Fleet.
PN. Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Pfizer, Kern Pharma, Biogen, Takeda, Janssen Ferring, Faes Farma, Shire Pharmaceuticals, Otsuka Pharmaceutical. Ninguna participación en asesorías durante la presidencia de GETECCU.
JPG. Asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Roche, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical y Vifor Pharma.
Este trabajo ha sido posible gracias a la participación de los miembros del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU).
Agradecemos además la colaboración de Urko Aguirre (Unidad de Investigación, Hospital de Galdakao) en el análisis estadístico.