El único tratamiento aceptado para la enfermedad celiaca es el seguimiento de forma estricta de la dieta sin gluten. Este tipo de dieta puede ocasionar una disminución de la calidad de vida de los pacientes, dificultades sociales y económicas. Por lo tanto, son frecuentes las transgresiones dietéticas que pueden perpetuar el daño intestinal. En los últimos años se han desarrollado numerosos tratamientos, dirigidos hacia diferentes dianas en la patogenia de la enfermedad celiaca: modificación del gluten para conseguir un gluten no inmunogénico, terapias endoluminales que degraden el gluten en la luz intestinal, favorecer la tolerancia al gluten, modulación de la permeabilidad intestinal o regulación de la respuesta inmune adaptativa. En esta revisión se evalúan estas líneas terapéuticas que se están investigando para la enfermedad celiaca y los tratamientos enfocados al control de las complicaciones de la enfermedad, como la enfermedad celiaca refractaria.
The only accepted treatment for coeliac disease is strict adherence to a gluten-free diet. This type of diet may give rise to reduced patient quality of life with economic and social repercussions. For this reason, dietary transgressions are common and may elicit intestinal damage. Several treatments aimed at different pathogenic targets of coeliac disease have been developed in recent years: modification of gluten to produce non-immunogenic gluten, endoluminal therapies to degrade gluten in the intestinal lumen, increased gluten tolerance, modulation of intestinal permeability and regulation of the adaptive immune response. This review evaluates these coeliac disease treatment lines that are being researched and the treatments that aim to control disease complications like refractory coeliac disease.
La enfermedad celiaca (EC) es una enteropatía desencadenada por la ingesta de gluten que afecta a sujetos genéticamente predispuestos1,2. El gluten es un polipéptido insoluble tanto en agua como en soluciones salinas diluidas con un alto contenido de prolaminas y gluteninas3. Esta proteína origina una inflamación crónica en el intestino delgado mediada por la participación del sistema HLA, específicamente el HLA DQ2 y DQ8. El proceso inflamatorio a nivel intestinal desencadena una malabsorción de diferentes nutrientes. Las manifestaciones clínicas varían según la edad de los pacientes4. En la edad pediátrica predominan síntomas clásicos caracterizados por diarrea, distensión abdominal y retraso del crecimiento. En adultos la sintomatología es más atípica y presenta síntomas oligosintomáticos5, como anemia, osteoporosis precoz, distensión abdominal o alteraciones del tránsito intestinal, que obliga a tener en cuenta esta enfermedad para poder diagnosticarla6.
La EC presenta una prevalencia en los países desarrollados en torno al 1% de la población7. Sin embargo, se estima que hay una proporción de pacientes que pueden no estar correctamente diagnosticados por los procedimientos habitualmente utilizados, basados en técnicas serológicas (principalmente anticuerpos antitransglutaminasa, antiendomisio y antigliadina)8. Por esta razón en los últimos años se están diseñando estrategias de optimización del reconocimiento precoz de la patología en los principales grupos de riesgo, como son los familiares de primer grado de los celiacos9-12.
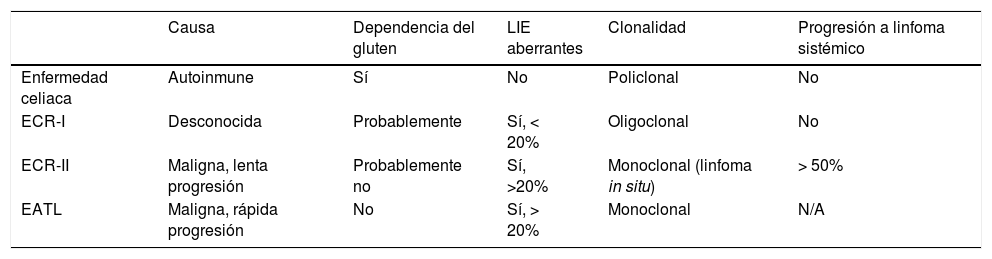
Actualmente el único tratamiento efectivo para la EC es el consumo estricto de la dieta sin gluten (DSG) durante toda la vida. Sin embargo, se ha demostrado que la recuperación de la mucosa no es inmediata, e incluso hay una proporción significativa (30-50%) de pacientes con persistencia de lesiones a nivel intestinal y síntomas recurrentes a pesar del seguimiento aparentemente correcto de la dieta (denominado EC resistente a la DSG o non-responsive celiac disease [NRCD])13,14. El seguimiento estricto de la DSG conlleva un enorme sacrificio personal, con influencia en la esfera psicológica y social de los pacientes que en muchas ocasiones dificulta el cumplimiento estricto15. Además, una pequeña proporción de pacientes celiacos (∼1%) no responden a la DSG en absoluto (EC refractaria [ECR]). Estos sujetos son diagnosticados fundamentalmente en la edad adulta tras consumo de gluten durante un prolongado periodo de tiempo y tienen el riesgo de desarrollar complicaciones como la ECR tipoii (ECR-II, un linfoma in situ intestinal) o su complicación más grave, el linfoma intestinal de células T asociado a enteropatía (EATL)16,17. En la tabla 1 se presentan las principales características que permiten diferenciar la EC, la ECR-I, la ECR-II y el EATL.
Características de la enfermedad celiaca, enfermedad celiaca refractaria (ERC) y linfoma intestinal de células T asociado a enteropatía (EATL)
| Causa | Dependencia del gluten | LIE aberrantes | Clonalidad | Progresión a linfoma sistémico | |
|---|---|---|---|---|---|
| Enfermedad celiaca | Autoinmune | Sí | No | Policlonal | No |
| ECR-I | Desconocida | Probablemente | Sí, < 20% | Oligoclonal | No |
| ECR-II | Maligna, lenta progresión | Probablemente no | Sí, >20% | Monoclonal (linfoma in situ) | > 50% |
| EATL | Maligna, rápida progresión | No | Sí, > 20% | Monoclonal | N/A |
Aunque la DSG estricta es el principal tratamiento para la EC, en los últimos años se están investigando diferentes medidas terapéuticas alternativas. A continuación describimos los distintos tratamientos que se están desarrollando y su mecanismo de acción relacionado con la etiopatogenia de la EC.
PatogeniaLa EC se manifiesta en sujetos genéticamente predispuestos como una respuesta inmune frente al gluten ingerido. Esta respuesta inmune contiene una parte innata (efecto tóxico directo del gluten sobre el epitelio) y otra adaptativa o específica (a través de los linfocitos T CD4+ de la lámina propia o tejido subyacente), y las dos parecen ser las responsables del daño histológico en la mucosa intestinal18.
Algunos fragmentos del gluten, como la α-gliadina, inducen una respuesta inmunológica innata, tóxica e inmediata, no relacionada con los linfocitos T ni con la presentación antigénica HLA-DQ2/819,20. Como consecuencia se desencadena un estrés oxidativo, mediado principalmente por la formación de óxido nítrico, que se origina por la inducción de óxido nítrico sintetasa (iNOS) en los enterocitos21-24 que provoca la expresión en estas mismas células de ligandos como MICA25. La gliadina también es capaz de debilitar las uniones intercelulares situadas entre los enterocitos26,27. Sin embargo, el principal mecanismo depende de la liberación de IL-15 por parte de estos enterocitos en situación de estrés28. Esta citoquina induce en los linfocitos intraepiteliales la expresión de NKG2D capaz de interactuar con su ligando, la molécula MICA de los enterocitos perpetuando el daño intestinal29,30. La unión entre NKG2D y MICA induce apoptosis de los enterocitos, llevando a la desaparición de microvellosidades y aplanamiento del epitelio intestinal. Todo este proceso lleva a la activación de fenómenos de citotoxicidad en el epitelio, que junto con el debilitamiento de las uniones intercelulares contribuye a un aumento de la permeabilidad intestinal y el paso del gluten hasta la lámina propia, donde se desencadena la respuesta adaptativa.
La respuesta inmune adaptativa está mediada por linfocitos T específicos, previa presentación antigénica por las células presentadoras de antígenos (CPA) portadoras de elementos de restricción HLA-DQ2/DQ8. Los macrófagos (20%) y sobre todo las células dendríticas (CD) (80%) son las principales CPA de la lámina propia y están incrementadas en la lesión celiaca en actividad31. Estas CPA son a su vez activadas como consecuencia de la inducción de IL-15 derivada de la respuesta innata32-34. Los linfocitos T CD4+ de la lámina propia reconocen fragmentos de gluten, como α-gliadina, presentados en el contexto de moléculas HLA-DQ2 o DQ831,35,36, y tras ser modificados por la enzima transglutaminasa2 (TTG2)37,38. Por tanto, el efecto final estará mediado por linfocitos T CD4+, responsables de una respuesta dominada por citoquinas proinflamatorias como IFN-γ, TNF-α, IL-18… y un descenso proporcional de citocinas reguladoras o antiinflamatorias (IL-10 y TGFβ)39,40. Este perfil proinflamatorio será el implicado en última instancia en los mecanismos de remodelación tisular como la hiperplasia de las criptas típica de la EC, la atrofia de las vellosidades intestinales y la activación de linfocitosB que estimulan la producción de anticuerpos41.
En resumen, se puede afirmar que la gliadina tiene un efecto dual en el intestino de los pacientes celiacos, siendo imprescindible la activación de la respuesta inmunológica innata para que se desencadene la respuesta adaptativa en individuos susceptibles42-47.
Necesidad de nuevas terapias no dietéticasEn la actualidad el único tratamiento disponible para la EC es la DSG estricta durante toda la vida. La restricción dietética ha demostrado ser una terapia segura y eficaz cuando el paciente la mantiene; sin embargo, no es ideal ni muy efectiva en la práctica. Un problema es que la legislación actual sobre el etiquetado de los productos sin gluten en Estados Unidos y en la Unión Europea solo incluye aquellos que tienen menos de 20ppm de gluten48, mientras que el umbral para desencadenar sintomatología tiene una variabilidad interindividual49. Por otro lado, la distribución de los alimentos sin gluten es cara y compleja y no es la adecuada en todos los países, y por esta razón puede afectar al valor nutricional de los alimentos, disminuir significativamente la adherencia a la dieta y afectar a la calidad de vida. En Inglaterra, un estudio relevaba que el 40% de los celiacos estaban descontentos con la supresión dietética del gluten50 debido a las restricciones dietéticas y sociales impuestas, y también a los mayores costes y en ocasiones a la disminución en la calidad del sabor de los alimentos. Todos los participantes tenían interés en otros tratamientos, considerando la vacuna la estrategia preferida50. Además, en muchas ocasiones, debido a que el cumplimiento de la DSG es dificultoso y bastante costoso en términos económicos, se realiza un inadecuado seguimiento de la dieta originando una respuesta clínica limitada, con persistencia de la sintomatología existente51.
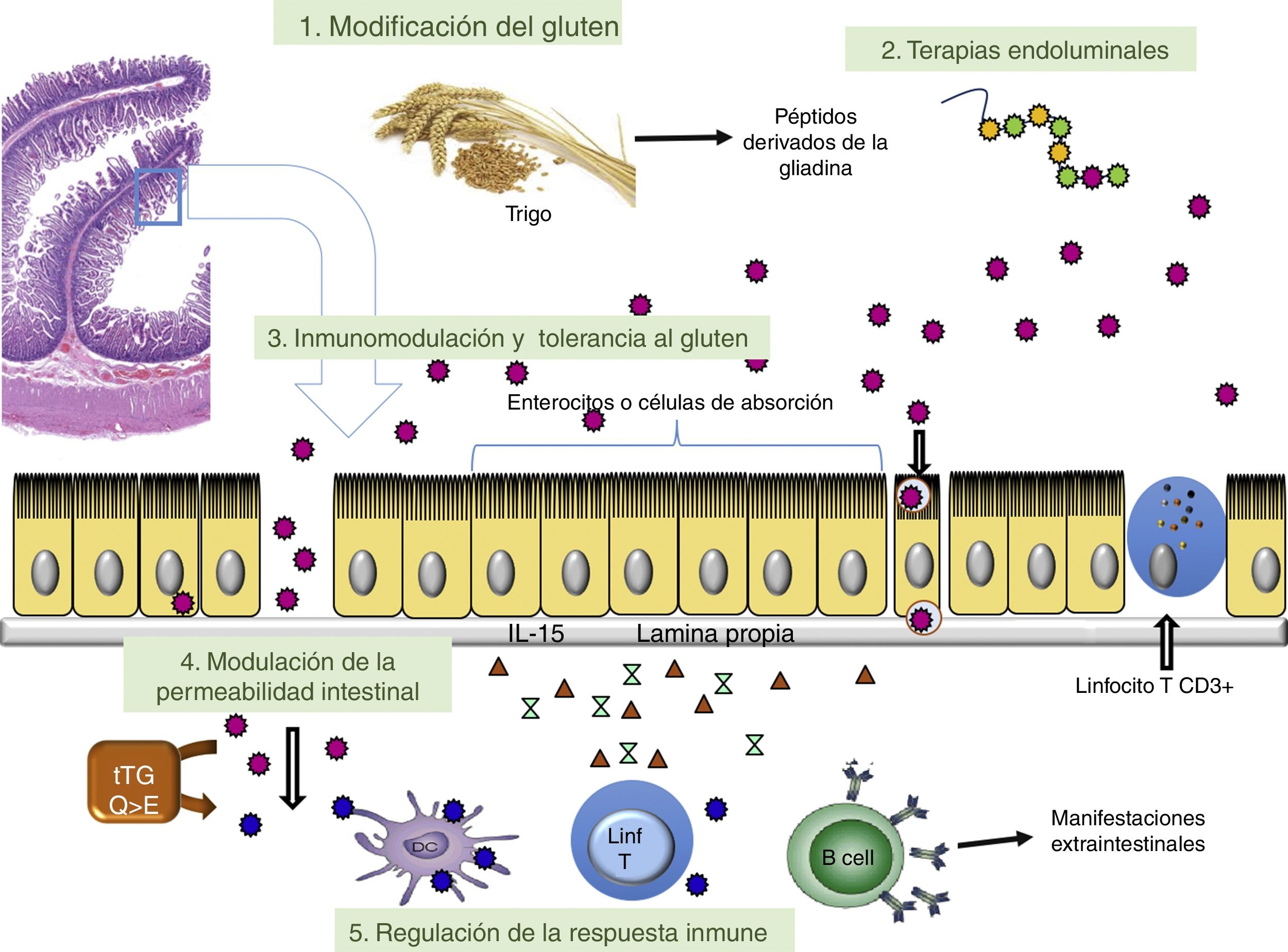
Este artículo analiza las estrategias terapéuticas que se han estudiado en preclínica, modelos de la EC y/o son prometedores en las fases i y ii de los ensayos clínicos. En la tabla 2 se presentan las diferentes terapias agrupadas en función del objetivo patogénico hacia el que van dirigidas. Los principales puntos de actuación de las diferentes modalidades de tratamiento en fase de investigación se observan en la figura 1. Se analizan también las terapias dirigidas hacia la EC refractaria tipoii (linfoma intestinal) y el EATL, que constituyen las complicaciones más graves de la EC.
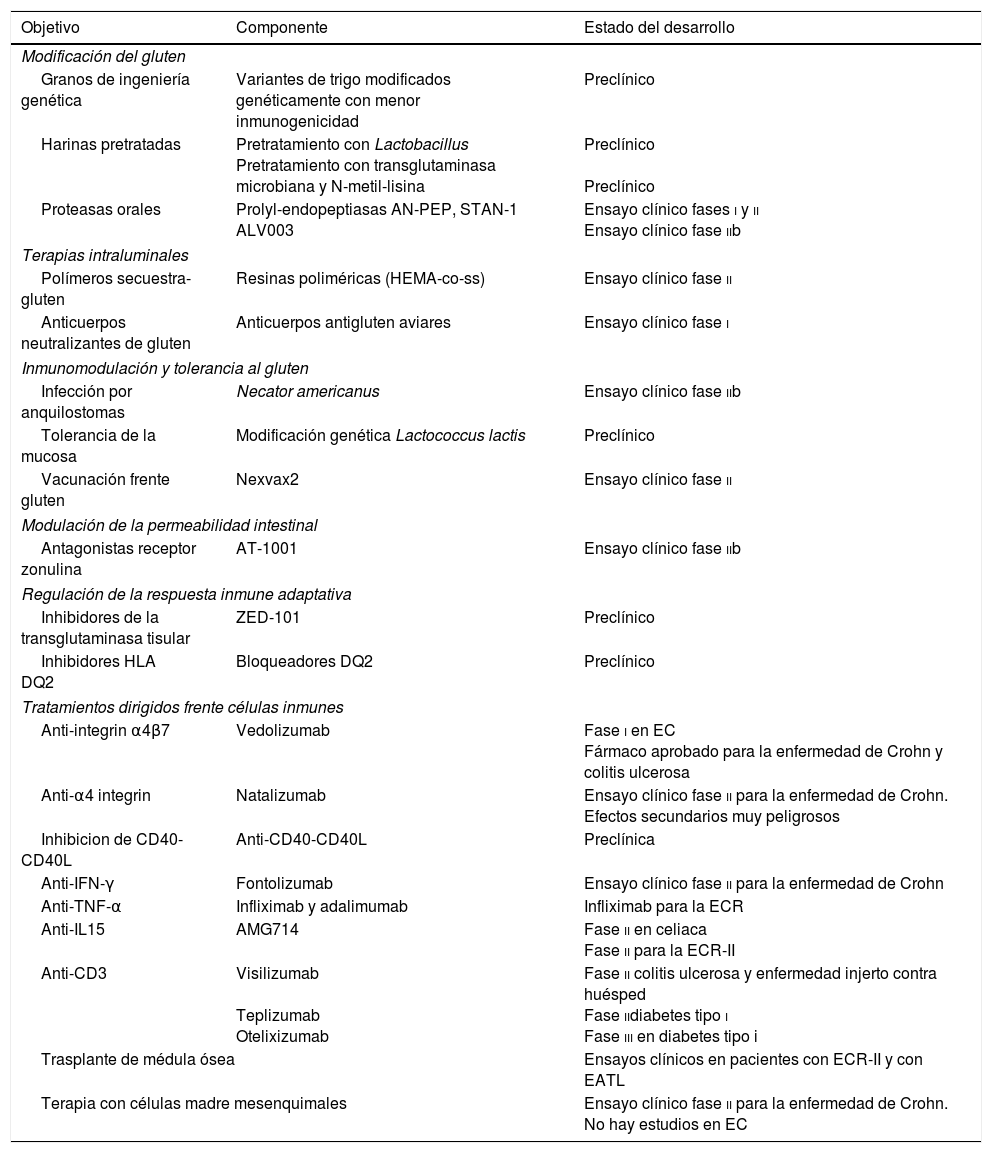
Terapias no dietéticas para la enfermedad celiaca (EC) agrupadas en función del objetivo patogénico hacia el que van dirigidas
| Objetivo | Componente | Estado del desarrollo |
|---|---|---|
| Modificación del gluten | ||
| Granos de ingeniería genética | Variantes de trigo modificados genéticamente con menor inmunogenicidad | Preclínico |
| Harinas pretratadas | Pretratamiento con Lactobacillus Pretratamiento con transglutaminasa microbiana y N-metil-lisina | Preclínico Preclínico |
| Proteasas orales | Prolyl-endopeptiasas AN-PEP, STAN-1 ALV003 | Ensayo clínico fases i y ii Ensayo clínico fase iib |
| Terapias intraluminales | ||
| Polímeros secuestra-gluten | Resinas poliméricas (HEMA-co-ss) | Ensayo clínico fase ii |
| Anticuerpos neutralizantes de gluten | Anticuerpos antigluten aviares | Ensayo clínico fase i |
| Inmunomodulación y tolerancia al gluten | ||
| Infección por anquilostomas | Necator americanus | Ensayo clínico fase iib |
| Tolerancia de la mucosa | Modificación genética Lactococcus lactis | Preclínico |
| Vacunación frente gluten | Nexvax2 | Ensayo clínico fase ii |
| Modulación de la permeabilidad intestinal | ||
| Antagonistas receptor zonulina | AT-1001 | Ensayo clínico fase iib |
| Regulación de la respuesta inmune adaptativa | ||
| Inhibidores de la transglutaminasa tisular | ZED-101 | Preclínico |
| Inhibidores HLA DQ2 | Bloqueadores DQ2 | Preclínico |
| Tratamientos dirigidos frente células inmunes | ||
| Anti-integrin α4β7 | Vedolizumab | Fase i en EC Fármaco aprobado para la enfermedad de Crohn y colitis ulcerosa |
| Anti-α4 integrin | Natalizumab | Ensayo clínico fase ii para la enfermedad de Crohn. Efectos secundarios muy peligrosos |
| Inhibicion de CD40-CD40L | Anti-CD40-CD40L | Preclínica |
| Anti-IFN-γ | Fontolizumab | Ensayo clínico fase ii para la enfermedad de Crohn |
| Anti-TNF-α | Infliximab y adalimumab | Infliximab para la ECR |
| Anti-IL15 | AMG714 | Fase ii en celiaca Fase ii para la ECR-II |
| Anti-CD3 | Visilizumab Teplizumab Otelixizumab | Fase ii colitis ulcerosa y enfermedad injerto contra huésped Fase iidiabetes tipo i Fase iii en diabetes tipo i |
| Trasplante de médula ósea | Ensayos clínicos en pacientes con ECR-II y con EATL | |
| Terapia con células madre mesenquimales | Ensayo clínico fase ii para la enfermedad de Crohn. No hay estudios en EC | |
Actualmente se plantea la hipótesis de que la reducción a la exposición alimentaria del contenido de gluten de los cereales consumidos puede disminuir el desencadenamiento de la EC52. Las variantes de trigo utilizadas actualmente se consideran más inmunogénicas que variantes ancestrales o salvajes como el tritordeum o el triticum53. Existen variables diploides de trigo modificadas mediante ingeniería genética que carecen por completo o presentan una cantidad limitada de péptidos inmunogénicos de gluten, pero son especies difíciles de cultivar y de desarrollar. Entre las estrategias utilizadas por ingeniería genética se encuentra la interferencia de ARN para silenciar genes de gluten que contienen epítopos para la EC54, o seleccionar variantes de trigo con un contenido reducido de epítopos inmunogénicos como cepas de trigo hexaploide generado a partir de especies de trigo diploide y tetraploide de más de miles de años de antigüedad. Se ha demostrado que estas cepas de trigo confieren inmunogenicidad, y además también presentan una menor proporción de gliadinas α, β, γ y ω. La gliadina psyllium55 ha sido estudiada recientemente como un posible reemplazo del gluten porque tiene mínimos efectos sobre el olor o la textura del trigo, al tiempo que conserva unas adecuadas propiedades de cocción56. El pan elaborado con psyllium fue altamente valorado tanto por celiacos como por controles no celiacos por su textura y su sabor. Otros estudios también han evaluado la modificación genética del trigo a través de la eliminación de los genes clave de gliadina. Específicamente, la deleción del locus a-gliadina en el cromosoma6 en el moderno hexaploide cepa de trigo Triticum aestivum producía una disminución en las células T epítopos estimulantes sin alteraciones significativas en las propiedades de cocción57. Los genes eliminados de gliadina probablemente necesitarán ser reemplazados por variantes de gliadina no inmunogénicas o aveninas para obtener una adecuada elasticidad.
Por otro lado, la utilización de diferentes probióticos, como Lactobacillus, se está considerando como medida terapéutica. Los Lactobacilli tienen peptidasas que al añadirlas a la masa madre para la fermentación son capaces de hidrolizar péptidos de gluten ricos en glutamina y prolina, incluyendo al péptido de gliadina altamente inmunogénico 33mer58. Un estudio doble ciego de 17 pacientes con EC evaluó la respuesta sintomática a dos tipos de pan que contenían 2g de gluten: uno elaborado con levadura tradicional y el otro con Lactobacillus. Los pacientes que consumían pan con levadura presentaron un incremento de la permeabilidad intestinal objetivado mediante el aumento de la excreción de los hidratos de carbono lactulosa y L-ramnosa. En cambio, los sujetos que consumieron pan previamente tratado con Lactobacillus no mostraron alteración de la permeabilidad intestinal. Sin embargo, la duración del estudio solo fue de 2días, tiempo insuficiente para evaluar la posible inactivación de las peptidasas, por lo que en ningún caso los resultados obtenidos son definitivos59. Otros autores han utilizado proteasas que degradan el gluten durante la fermentación del trigo60. El pan procedente de harinas previamente tratadas con estas proteasas elimina las principales proteínas de glutaminas y gliadinas, obteniendo un pan con un sabor desagradable y desmenuzable. Otro enfoque terapéutico, actualmente en fase de estudio preclínico, consiste en incubar gliadina con anticuerpos antitransglutaminasa y metil-ester-lisina. De esta manera, la gliadina con la lisina modificada pierde afinidad por el HLA DQ2 que conduce a una menor activación de los linfocitos T a nivel intestinal. El tratamiento previo de harina de trigo integral con lisina metil éster y transglutaminasa microbiana derivado de Streptomyces mobaraensis disminuye en gran medida el efecto estimulador de la harina sobre los linfocitos T61. El producto obtenido a través del tratamiento con antitransglutaminasa de origen microbiano mejora la textura y el volumen del pan. Sin embargo, el uso de transglutaminasa procedente de agentes microbianos en la preparación de alimentos sigue siendo un tema de debate. Se requieren más estudios para desarrollar y validar las harinas no inmunogénicas y para producir pan y otros productos horneados con buena consistencia y un valor nutritivo suficiente.
Detoxificación del gluten mediante proteasas oralesLas proteínas del gluten son moléculas de difícil digestión por su alto contenido en prolina y glutamina. Esta característica le confiere resistencia a la proteólisis gástrica y pancreática por las endopeptidasas del borde en cepillo intestinal o por las exopeptidasas62. Como resultado de esta resistencia se acumulan largos oligopéptidos, como el 33-mer o 26-mer, con alta afinidad por las moléculas HLA-DQ2 o DQ8. Estos complejos de péptidos deaminados-HLA-DQ pueden activar a los linfocitosT en sujetos celiacos. Una estrategia para impedir que estos péptidos alcancen la lámina propia es el uso de propil-endopeptidasas (PEP). Se trata de un grupo de proteasas con capacidad para hidrolizar las uniones peptídicas en las que participa el grupo carboxilo de un residuo interno de prolina que no se han sido detectados por las secreciones digestivas corporales63. De manera que la adicción de PEP a nivel gastrointestinal se contempla como un sistema terapéutico que complementaría la acción de las proteasas pancreáticas, degradando y evitando el acúmulo de estos péptidos ricos en glutamina y prolina. Se han caracterizado diversas PEP como candidatas para el tratamiento de la EC que pueden ser administradas por vía oral. Algunas de estas proteasas son de origen fúngico, como la PEP de Aspergillus niger, que digiere in vitro de manera eficiente las proteínas de gluten63,64. También se han estudiado PEP de origen bacteriano, como las PEP de Flavobacterium meningosepticum, Sphingomonas capsulata y Myxoxoxxus xanthus; estas proteasas son activas al pH del duodeno, son moderadamente resistentes al pH ácido y retienen la actividad enzimática al menos en el intestino delgado de ratas65. En un estudio doble ciego, aleatorizado y cruzado con 20 celiacos asintomáticos en DSG se administraron 5g de gluten durante 14días y posteriormente se cruzaron para consumir el gluten junto con PEP derivada de Flavobacterium meningosepticum durante otros 14días. El estudio demostró que la administración previa de PEP conseguía, a las 2semanas, una disminución de la malabsorción de hidratos de carbono y grasas66.
También se ha utilizado la combinación conjunta de dos proteasas que actúan sobre residuos aminoacídicos complementarios: la PEP de Sphingomonas capsulata, que reconoce residuos de prolina, y una cistein-proteasa, obtenida de semillas de cebada germinadas que reconoce residuos de glutamina; la acción conjunta detoxifica completamente el gluten67. Este sistema de dos enzimas es considerado como una actividad glutenásica y se denomina ALV00368. En un estudio, 20 pacientes celiacos se aleatorizaron para recibir 16g de gluten durante 3días, previa ingesta de ALV003 o de placebo. No se observaron diferencias significativas en la respuesta clínica entre ambos grupos. Sin embargo, los integrantes del grupo que recibió ALV003 no tenían lesión histológica en la mucosa intestinal, en comparación con el grupo que recibió placebo, y presentaron un incremento de los linfocitos intraepiteliales. Posteriormente se ha desarrollado un ensayo clínico en faseiib con el ALV003 cuyo objetivo era establecer su eficacia y seguridad en la prevención de síntomas relacionados con el gluten y la respuesta inmune en los pacientes con enfermedad celiaca. En este estudio se aleatorizó a pacientes celiacos adultos a recibir ALV003 (n=20) o placebo (n=21) y posteriormente se administraban 2g de gluten diarios durante 2meses. Los celiacos que recibieron el probiótico presentaban daño histológico en las biopsias duodenales en menor grado que los pacientes del grupo placebo. No se evidenciaron diferencias estadísticas en la sintomatología entre ambos grupos69. Por lo tanto, existen varios problemas relacionados con la terapia enzimática oral. Por un lado, la aparente falta de eficacia puede ser la mayor limitación para poder ser utilizada en la práctica clínica convencional. Por otro lado, es necesario determinar qué cantidad de suplemento enzimático se debe administrar y el tiempo necesario para la degradación de péptidos inmunotóxicos derivados del gluten.
Terapias intraluminalesPolímeros secuestra-glutenLa utilización de una resina polimérica oral para secuestrar a la gliadina intraluminal se sugirió como una estrategia para impedir el acceso de los péptido de gluten inmunotóxicos a la mucosa intestinal. Esta resina se denomina P-HEMA-co-ss (poli-hidroxietil-metacrilato-co-estireno-sulfonato)70. Estudios in vitro demostraron que este polímero atrapa de forma específica las moléculas de gliadina e impide su digestión a péptidos inmunogénicos. Estudios in vivo realizados sobre ratones transgénicos HLA-DQ81 previamente sensibilizados frente a la gliadina evidenciaron que la utilización de estas resinas disminuye el daño intestinal ocasionado71. Este procedimiento es una medida terapéutica que precisa estudios que permitan resolver múltiples interrogantes, como posibles problemas potenciales por falta de especificidad a la gliadina y posible unión a otros nutrientes, o conocer la dosis de gluten que puede ser secuestrado eficazmente in vivo con una cantidad establecida de esta resina. El ensayo en fasei mostró seguridad, aunque con efectos secundarios como diarrea.
Anticuerpos neutralizantes de glutenSe pueden administrar por vía oral anticuerpos IgG que pueden unirse específicamente a antígenos intraluminales e inactivarlos72. Inicialmente se evaluó el papel del calostro de las vacas como una fuente fácilmente disponible con una elevada concentración de anticuerpos. Sin embargo, este tipo de anticuerpos no consiguió alcanzar la fasei por ausencia de eficacia clínica. En contraposición, la producción a gran escala de anticuerpos con acción neutralizante del gluten IgY procedente de la yema de huevo de gallinas se ha propuesto como una opción terapéutica segura y eficaz para pacientes celiacos con DSG pero que presentan síntomas leves o moderados relacionados con transgresiones puntuales y que no tienen alergia al huevo73. Un ensayo clínico ha demostrado la utilidad de esta medida terapéutica (NCT01765647). Estos anticuerpos podrían ser etiquetados como aditivo alimentario y utilizarse como terapia adyuvante al consumo de alimentos con gluten, en circunstancias puntuales como viajes, reuniones, acontecimientos sociales o familiares, negocios… Sin embargo, no evita el consumo diario de la DSG pero permitiría realizar transgresiones puntuales. Actualmente en Estados Unidos se han iniciados ensayos en fasei para evaluar este tipo de tratamiento
Inmunomodulación y tolerancia al glutenInfección por anquilostomasLa desensibilización frente al gluten por inmunoterapia ha sido evaluada mediante diferentes estrategias. Una posible hipótesis consiste en que el exceso de higiene origina procesos inflamatorios de origen autoinmune. Entre la medidas utilizadas para controlar la actividad inmunorreguladora se encuentra la infección con helmintos, especialmente tricocéfalos del cerdo (Trichuris suis) y la anquilostomiasis humana (Necator americanus), con un éxito desigual74,75. Se ha propuesto que la infección crónica por helmintos como anquilostomiasis puede alterar la respuesta inmune Th1 y así controlar diferentes patologías, como la enfermedad inflamatoria intestinal y la enfermedad celiaca. Sin embargo, la utilización de anquilostomas en la enfermedad de Crohn no consigue controlar los síntomas para ser considerada como una estrategia terapéutica. Se ha realizado un estudio doble ciego, controlado con placebo durante 21semanas en celiacos con DSG, aleatorizados para ser infectados por Necator americanus y posteriormente expuestos al gluten. No se evidenciaron diferencias en la sintomatología manifestada entre ambos grupos, pero los sujetos con infección por anquilostoma tenían una reducción de la inflamación de la mucosa intestinal con disminución de INF-γ, IL-17, IL-23 e incremento de IL-10 y TGF-β75. En un estudio realizado durante 52semanas en 12 celiacos a los que se infectó con Necator americanus tras la introducción del gluten en la dieta se observó ausencia de lesiones histológicas llamativas e incluso disminución de los niveles de anticuerpos antitransglutaminasa a lo largo del tiempo76. Estos hallazgos sugieren que la prolongación de la infección por helmintos a nivel intestinal permite evitar la respuesta inmune contra el gluten sin importantes efectos adversos, aunque estos resultados precisan de estudios prospectivos que los confirmen.
Inducción de tolerancia de la mucosaLa inducción de la tolerancia de la mucosa intestinal ha sido estudiada en modelos de roedores con EC77. En ratones transgénicos HLA-DQ8, tras la inmunización periférica de la mucosa se administra por vía intranasal α-gliadina, observando posteriormente una disminución de los niveles de INF-γ y una menor proliferación de los linfocitos T y un incremento de los niveles de IL-1078,79. Los mecanismos para inducir la tolerancia específica al gluten se basan en la administración de péptidos de gliadina inmunogénicos previamente tratados por Lactococcus lactis. Como resultado se obtiene un epítopo inmunodominante de gliadina desaminada restringida para el HLA-DQ8. Esta estrategia tiene grandes interrogantes, como conocer si también puede suprimir la respuesta de los linfocitosT a otros epítopos de gluten. En cualquier caso, esta medida solo se ha aplicado en modelos con ratones y en ningún caso se ha validad en seres humanos.
Vacunación frente al glutenEl objetivo de la vacunación frente a las enfermedades de origen autoinmune es la inducción de célulasT reguladoras con la intención de suprimir la inflamación mediada por los linfocitosT. En la EC esta terapia se propone para cambiar la respuesta de las célulasT a partir de regular la actividad proinflamatoria cuando se ingiere gluten. Se intenta favorecer «la tolerancia al gluten»48. La vacunación se basa en la administración de péptidos 16-mer de α-gliadina, ω-gliadina y horneína, que representan el 60% del gluten. Esta vacuna frente al gluten ha sido estudiada en modelos murinos donde se administraban estos tres péptidos por vía subcutánea. Como respuesta a la vacunación se observó una reducción de la proliferación de los linfocitosT expuestos a los tres péptidos en cuestión y de los niveles de IL-2 y IFN-γ a través del incremento de las célulasT reguladoras80. La vacuna se denomina ImmusanT, Nexvax2 (Cambridge, MA) y ha sido desarrollado inicialmente en Australia, ha pasado la fasei de ensayos clínicos y actualmente se encuentra en ensayos clínicos en faseii en voluntarios para evaluar su eficacia clínica. La periodicidad de la administración de la vacuna no está establecida, pero posiblemente sea necesaria la inyección subcutánea semanal o mensual con objeto de permitir a los celiacos consumir alimentos con gluten sin desarrollar efectos adversos. Sin embargo, en la fasei los pacientes que recibieron la formulación a dosis altas experimentaron cuadros de dolor abdominal leves. La vacuna solo es adecuada para pacientes que poseen el haplotipo HLA-DQ2, que por otra parte son la mayoría de pacientes celiacos, debido a que los péptidos utilizados para la sensibilización se unen en la célula presentadora de antígenos únicamente a la molécula HLA-DQ2. De tal manera que otra vacuna separada debería ser investigada frente a los pacientes con el genotipado HLA-DQ8. La vacunación fue elegida como la opción preferida entre los tratamientos alternativos a la DSG por los pacientes con EC cuando se comparan con utilización de trigo modificado genéticamente, peptidasas o tratamientos que disminuyan la permeabilidad intestinal. Esto podría explicarse por el aspecto profiláctico de la inmunización, precisando una menor administración que otros procedimientos terapéuticos que son necesarios ingerir diariamente, y puede plantear problemas de cumplimiento. Sin embargo, pese a los aspectos atractivos para la autogestión del celiaco y aumentar su independencia alimentaria, la vacuna podría estar asociada a un mayor riesgo de activación del sistema autoinmune, provocando un posible progreso de la enfermedad a formas refractarias o el desarrollo de otras enfermedades de origen autoinmune. Este posible inconveniente debe ser evaluado en los estudios que se están llevando a cabo.
Modulación de la permeabilidad intestinalModulación de las uniones Tight Junctions entre los enterocitos. Antagonistas de los receptores zonulinaEn individuos sanos, las Tight Junctions entre las células epiteliales intestinales regulan el paso y la exposición a diferentes macromoléculas y componentes bacterianos a nivel subepitelial que pueden desencadenar la respuesta inmune. Una de estas moléculas afectadas son los péptidos derivados del gluten, que provocarían la estimulación de los linfocitosT a través de las células presentadoras de antígenos. Los pacientes con EC activa tienen un defecto en estos Tight Junctions que puede provocar un aumento de la permeabilidad intestinal a los péptidos del gluten inmunodominantes para alcanzar la lámina propia y originar la respuesta inmune81,82. La zonulina es un precursor de prehaptoglobina-2 que se considera un regulador de la permeabilidad epitelial y presenta una sobreexpresión en el tejido intestinal de los pacientes con enfermedad celiaca respecto a sujetos sanos83. Esta proteína tiene un efecto similar a la toxina Zonula Occludens Toxin (ZOT) expresada por Vibrio cholerae que ocasiona una alteración de la permeabilidad del epitelio secundario al daño de las Tight Junctions84. Lammers et al.85 han demostrado que la gliadina se une al receptor CXCR3 y origina la liberación de zonulina y posteriormente el incremento de la permeabilidad intestinal. El larazótido, o AT1001, es un octopéptido derivado de ZOT que antagoniza la acción de la zonulina a través del bloqueo del receptor CXCR3 y, por lo tanto, evita el daño epitelial86. En los estudios en fasei se evaluó la seguridad y la eficacia de este medicamento administrado por vía oral en un ensayo clínico aleatorizado doble ciego87. En este estudio se administraba una dosis de gluten asociado a AT1001 durante 4días consecutivos a 14 celiacos y se compararon los resultados a un grupo de 7 pacientes del grupo control que recibían placebo (sin gluten). La permeabilidad intestinal en ambos grupos se determinó mediante el cálculo fraccional de excreciones de lactulosa y manitol. Después de la estimulación con gluten, la permeabilidad intestinal permaneció intacta en los sujetos que recibieron el tratamiento, mientras que los efectos adversos, los síntomas gastrointestinales, los marcadores inflamatorios y citoquinas no fueron más frecuentes que en el grupo placebo. En un estudio de faseiib con incremento progresivo de dosis, el AT1001 fue administrado a 184 pacientes con EC en remisión, que posteriormente consumieron 3g de gluten diariamente durante 42días. Aunque los 61 pacientes a los que se administró AT1001 mostraron una mejoría significativa en los síntomas gastrointestinales y un menor título serológico, el objetivo primario de evaluar la permeabilidad intestinal determinada mediante la reducción de la lactulosa y el manitol en heces no se alcanzó88. Otros estudios en faseiib han evaluado la eficacia de diferentes dosis de larazótido89-91. En el primer ensayo clínico (CLIN1001-004)90 evaluaba diferentes dosis de AT1001 (0,25, 1, 4 u 8mg) en 86 celiacos en remisión que habían seguido una DSG los 6meses previos. Los pacientes eran aleatorizados a recibir larazótido o placebo. Los pacientes que recibieron el fármaco a dosis de 1mg mostraron menor cambio en la fracción excreción de lactulosa y manitol sin alcanzar significación estadística, mejor respuesta clínica, y el título de anticuerpos antitransglutaminasa IgA fue inferior a 10UI/ml. En el segundo ensayo realizado (CLIN 1001-006)89 fueron aleatorizados 186 celiacos en DSG los 6meses previos a recibir larazótido (1, 4, 8mg) o placebo. Las excreciones de lactulosa y manitol y las manifestaciones clínicas fueron menores en el grupo que recibió 1mg de AT1001, pero no fueron estadísticamente significativas. En el mayor estudio realizado (CLIN 1001-012) evalúa la eficacia del larazótido en 342 celiacos en DSG durante un periodo superior a un año con persistencia de sintomatología91. En este estudio no se realizó una sobrecarga con gluten y los participantes fueron aleatorizados a recibir larazótido (0,5, 1 y 2mg) o placebo. El tratamiento con 0,5mg disminuyó significativamente los síntomas digestivos y extradigestivos (principalmente cefalea y astenia) respecto al placebo. Está claro, a partir de estos estudios, que hay una relación inversa entre el efecto ocasionado y la dosis. Las dosis más bajas utilizadas fueron más eficaces que dosis superiores. Algunas explicaciones para esta relación dosis-respuesta pueden deberse a la desensibilización del receptor o la posible agregación de péptido a dosis más altas con la consecuente pérdida de su efecto. Por lo tanto, el larazótido puede ser un novedoso tratamiento que permita controlar los síntomas de los pacientes con EC con DSG y conseguir una mejoría en la calidad de vida88.
Regulación de la respuesta inmune adaptativaInhibidores de la enzima transglutaminasa tisularLa enzima transglutaminasa tisular tiene un papel fundamental en la patogenia de la EC. Los péptidos derivados del gluten están unidos a las moléculas HLA DQ2/8 de la superficie celular de las células presentadoras de antígenos, y posteriormente contactan con los linfocitosT. En esta situación los péptidos de gliadina precisan ser deaminados mediante la transglutaminasa tisular para aumentar la afinidad a las moléculas HLA, obteniendo un antígeno con una presentación más eficaz y con una capacidad de desarrollar una respuesta inmune más eficaz. La inhibición de la deaminación de los péptidos de gliadina mediante inhibidores de la transglutaminasa tisular2 reduce la afinidad de la unión de los péptidos con las células presentadoras de antígenos43. Varios tipos de inhibidores competitivos, reversibles e irreversibles de transglutaminasa se han propuesto como un potencial de compuestos para el tratamiento de la EC, los trastornos neurológicos y algunos tipos de cáncer92. La cistamina es un inhibidor competitivo de la transglutaminasa que se ha evaluado en cultivos de tejido duodenal de pacientes celiacos, evidenciando un bloqueo de la capacidad proliferativa de los linfocitosT93. Un derivado del dihidroisoxazol es un inhibidor irreversible de la transglutaminasa tisular2 que ha sido estudiado en roedores. Tras su administración en ratones no se objetivaron efectos adversos, obteniendo una buena biodisponibilidad oral, una vida media corta y la inhibición a nivel intestinal de la transglutaminasa94. Sin embargo, a pesar de su eficacia en ensayos preclínicos, los inhibidores de transglutaminasa se deben utilizar con precaución debido a la expresión ubicua de la transglutaminasa, ocasionando posibles deficiencias biológicas. Recientemente se está investigando una nueva generación de inhibidores selectivos de la transglutaminasa2 con un enlace de alta afinidad con un grupo tiol que incrementa la especificidad frente a la enzima. Se administra por vía oral, actúan inhibiendo a la transglutaminasa tisular2 a nivel intestinal y puede neutralizar la inmunogenicidad de los péptidos de gluten ingeridos18. Sin embargo, esta nueva terapia está en fases iniciales de investigación.
Inhibidores de HLA-DQ2El bloqueo de las moléculas HLA-DQ2 y DQ8 es una atractiva diana terapéutica para prevenir la activación de la respuesta inmune por parte del gluten. Este método se ha explorado previamente para otras enfermedades asociadas al sistema HLA pero ha sido ineficaz, principalmente debido a la dificultad para depositar los fármacos encargados de realizar el bloqueo en los órganos afectados. Sin embargo, la administración a través de la vía oral permite alcanzar el epitelio intestinal en celiacos95. Varios péptidos con alta afinidad por HLA-DQ2 han sido diseñados mediante la sustitución de aminoácidos y la dimerización o la colocación de grupos aldehído18. Estos antagonistas peptídicos han demostrado eficacia moderada inhibiendo la producción de IFN-γ en cultivos de células de celiacos, lo que demuestra un potencial para disminuir la activación de los linfocitosT inducida por el gluten. El principal inconveniente de estos inhibidores se debe a la capacidad de conservar efectos agonistas parciales sobre linfocitosT estimulados con gliadina, ocasionando una respuesta inmune exacerbada. Además, la afinidad de la unión para la mayoría de los péptidos antagonistas no es lo suficientemente fuerte para bloquear completamente el acceso de los péptidos de gliadina estimulantes a HLA-DQ2. Como consecuencia, se ha intensificado el esfuerzo para identificar antagonistas óptimos del HLA-DQ2, principalmente basados en péptidos pose, con 50 veces mayor afinidad de unión al HLA-DQ2 que los péptidos de gluten inmunodominante. Sin embargo, se desconoce si este tipo de bloqueadores del HLA-DQ2 son capaces de alcanzar su objetivo en la lámina propia o si son capaces de competir a nivel luminal con los péptidos derivados del gluten. También se desconoce qué efectos secundarios pueden ocasionar principalmente reacciones de hipersensibilidad o el potencial de inmunosupresión para ocasionar infecciones secundarias. Actualmente se están desarrollando estudios que investigan la inhibición del HLA-DQ2 para identificar un antagonista no tóxico, con alta afinidad por el HLA DQ2, altamente específico y no inmunogénico para poder evaluar su eficacia y su utilidad.
Antagonista de la integrina α4β7Los leucocitos circulantes son reclutados de forma selectiva a través de tejido intestinal por citoquinas y moléculas de adhesión específicos de tejido. Los linfocitosT intestinales expresan la integrina α4β7⋅ Los linfocitosT alcanzan el medio intestinal mediante la unión de la integrina α4β7 que facilita la fijación a la mucosa intestinal a través de la adhesina vascular de la mucosa MADCAM-196. La inhibición del MAdCAM-1 también es una potencial diana terapéutica. Un anticuerpo monoclonal humanizado cuya diana terapéutica es la integrina α4β7 es el vedolizmab, un fármaco actualmente utilizado en la enfermedad inflamatoria intestinal con menos efectos adversos que otros tratamientos biológicos. Actualmente se está desarrollando un ensayo clínico que evalúa el beneficio de bloquear la migración y adhesión a la mucosa intestinal (NCT02929316)97-99.
El CXCL10 es otra citoquina que se expresa principalmente por células Th1 y se une a su receptor CXCR3, potenciando la respuesta inmune de la EC. Diferentes estudios han determinado que la estimulación mediante gliadina de los monocitos provoca un incremento de la expresión de CXCL10100. Este hallazgo sugiere que CXCL10 puede jugar un papel en el reclutamiento de los linfocitosT como parte de la respuesta inmune innata. La capacidad de bloquear CXCL10 puede representar un objetivo terapéutico futuro en la enfermedad celiaca.
Tratamientos dirigidos contra células inmunes: enfermedad celiaca refractaria y enteropatía asociada a linfoma de células TEn este apartado se revisan los nuevos tratamientos dirigidos hacia dos de las complicaciones más graves de la EC: la EC refractaria (ECR) tiposi yii, y el linfoma intestinal de célulasT asociado a enteropatía (EATL).
Inhibición de la interacción CD40-CD40LLa interacción entre las moléculas CD40, localizadas en la célula presentadora de antígenos, y su ligando CD40L, situado en los linfocitosT, constituye una señal fundamental para la activación de los linfocitosT. El efecto y la actividad de la interacción CD40 y CD40L han sido estudiados en biopsias duodenales en pacientes celiacos con y sin gluten, y en sujetos sanos. La expresión fue superior en celíacos con dieta con gluten y muy inferior en sujetos sanos. Además, cuando se añadía el anticuerpo anti-CD40L en las biopsias de los celíacos se observaba una disminución de la producción de IFN-γ y otras citoquinas implicadas en la EC que en último término ocasionaba una inhibición de la respuesta inmune101. Estos hallazgos sugieren que el bloqueo de la interacción entre CD40 y CD40L puede ser una prometedora opción terapéutica en el futuro en la ECR.
Terapias anti-IFN-γ y anti-TNF-αLas citoquinas proinflamatorias IFN-γ y TNF-α son importantes moléculas implicadas en la patogenia de la EC secretadas por las célulasT en respuesta al gluten. Estas citoquinas estimulan la secreción de metaloproteinasas de la matriz de los miofibroblastos intestinales (MMP), las cuales originan una remodelación de la arquitectura intestinal favoreciendo la atrofia vellositaria102. El bloqueo intestinal de estas moléculas proinflamatorias podría ayudar a controlar la cascada inflamatoria y prevenir la activación de MMP proteolíticas. El anticuerpo monoclonal anti-INF-γ, fontolizumab, fue desarrollado inicialmente para el tratamiento de la enfermedad inflamatoria intestinal (EII); sin embargo, aunque era bien tolerado por los pacientes, su desarrollo parece detenido actualmente y no se han previsto ensayos clínicos para su uso en la EC103. Los anticuerpos monoclonales contra el TNF-α (infliximab y adalimumab) son usados en la práctica clínica en la EII, y diferentes publicaciones establecen que pueden ser útiles en la ECR104.
Antagonistas de la IL-15La molécula IL-15 es una de las principales citoquinas proinflamatorias implicadas en el desarrollo de la y su evolución hacia la ECR o EATL. Los anticuerpos monoclonales anti-IL-15 han demostrado revertir el daño intestinal en modelos animales con ratones transgénicos que presentaban la enteropatía inmune ocasionada por una sobreexpresión de IL-15105. La neutralización de la IL-15 es una opción terapéutica potencial para la EC y para la ECR-II, dado que la expansión de los linfocitos premalignos y malignos es condicionada por la IL-15. Un ensayo clínico de faseii ha evaluado la utilidad de un anticuerpo monoclonal anti-IL-15 (AMG714) en pacientes con artritis reumatoide (con gran éxito) y en la psoriasis62. Recientemente los ensayos clínicos en faseiia de AMG 714 para EC (NCT02637141) y ECR-II (NCT02633020) han concluido y se esperan resultados en un futuro próximo que apoyen el uso de un antagonista de IL-15 como tratamiento de la ECR o EATL. En ambos estudios se evaluaba el efecto de IL-15 frente a placebo durante 12semanas en la EC y 2semanas en la ECR-II.
Agonistas de la IL-10La IL-10 inhibe la secreción de las citoquinas proinflamatorias secretadas por los linfocitos Th1. Por lo tanto, en teoría un agonista de IL-10 podría ser utilizado para tratar los trastornos autoinmunes mediados por Th1, como la EC o la EII. En un ensayo clínico en fasei en pacientes con enfermedad de Crohn se evaluó el uso de bacterias que sobreexpresan IL-10 sin demostrar beneficio clínico106. En otro estudio se observó que la adhesión de IL-10 a cultivos de biopsias de celíacos inhibía la activación de los linfocitosT107. Sin embargo, al evaluar la eficacia de la IL-10 administrada por vía subcutánea en pacientes con ECR no se demostraba una mejoría de las lesiones intestinales108. Los agonistas IL-10 son un posible tratamiento a tener en cuenta, pero son necesarios más estudios que determinen cuál es su potencial papel terapéutico109.
CladribinaLa cladribina (2-CdA) es un nucleósido sintético de purina; es citotóxico y útil en procesos linfoproliferativos. Al metabolizarse se obtiene cladribina trifosfato, metabolito que induce la apoptosis110. La cladribina se utiliza como tratamiento de enfermedades hematológicas malignas y procesos autoinmunes, como la esclerosis múltiple. Además, es un posible tratamiento para la ECR-II, junto con la azatioprina y los corticoides. En un estudio prospectivo sobre una cohorte de 32 pacientes con ECR-II se evaluó la tasa de supervivenc, el desarrollo de EATL, el curso clínico, histológico e inmunológico y la tasa de respuesta tras la administración de cladribina y un seguimiento medio de 31meses111. Dieciocho de los 32 pacientes respondieron favorablemente presentando un incremento supervivencia; sin embargo, 16 pacientes progresaron a EATL y todos ellos fallecieron. Además, otra limitación de este estudio es la ausencia de grupo control que permita aumentar la validez interna del estudio. La cladribina parece ser una prometedora medida terapéutica, pero precisa más estudios que determinen su eficacia terapéutica en la EC.
Trasplante de médula óseaEl tratamiento clásico de los procesos linfoproliferativos con doxorubicina, ciclofosfamida, vincristina y prednisona (CHOP) obtiene malos resultados en la EATL y la supervivencia es baja. Por esta razón es fundamental desarrollar nuevas estrategias que mejoren los resultados obtenidos. El trasplante autólogo de células hematopoyéticas ha sido utilizado en la ECR-II y en el EATL112. En 18 pacientes con ECR-II que no respondieron a la cladribina, tras la administración de altas dosis de fludarabina y melfalán se realizó trasplante autólogo de células hematopoyéticas. Trece pacientes fueron trasplantados con éxito, con una tasa de supervivencia a 4años del 66%. Un paciente desarrolló EATL después de 4años de seguimiento. El trasplante autólogo después del acondicionamiento con dosis altas de quimioterapia en pacientes con ECR-II tras la falta de respuesta a la cladribina puede ser una estrategia terapéutica prometedora. Desafortunadamente, las recaídas son frecuentes debido a la presencia de células residuales en la médula ósea113,114. Por lo tanto, el trasplante alogénico de células madre puede tener un mayor potencial terapéutico, pero también un mayor riesgo de complicaciones. Actualmente hay estudios en marcha que evalúan el trasplante alogénico de médula ósea para el tratamiento de ECR-II o EATL.
Terapia con células madre mesenquimalesLas células madre mesenquimales tienen un bajo potencial inmunogénico porque carecen de complejos de la histocompatibilidad de clasei oii y también carecen de moléculas coestimuladoras. Por esta razón, esta terapia es una opción segura y prometedora para los pacientes que no responden al trasplante de médula ósea autólogo115. El trasplante de células madre mesenquimales ha sido investigado en diversas enfermedades inflamatorias gastrointestinales, como EII refractaria al tratamiento médico convencional, o la fibrosis hepática. Esta modalidad terapéutica tiene aplicaciones potenciales para el manejo y el tratamiento de los pacientes con ECR-II y EATL. Sin embargo, actualmente no existen ensayos clínicos que investiguen este tratamiento.
ConclusionesEn la figura 1 se representan de forma esquemática los diferentes puntos de la etiopatogenia de la EC sobre los que se dirigen las actuales líneas de investigación terapéuticas. Las limitaciones que ocasiona la restricción de gluten en la dieta y su falta de eficacia en la práctica en el 30-50% de los pacientes en DSG plantea la necesidad de aportar otras medidas terapéuticas. Actualmente se están desarrollando avances en diferentes fármacos o modalidades de tratamiento no dietético que pueden ser una opción útil a medio o a largo plazo en la EC. En esta revisión se describen las principales líneas de investigación desarrolladas, reflejando que ninguno de los ensayos clínicos se encuentra en faseiii. Además, la mayoría de los agentes que se están estudiando actualmente tienen la intención de servir como un complemento de la DSG. Las terapias que inducen tolerancia inmune al gluten tienen el potencial de permitir la reinstauración del gluten en la dieta. Sin embargo, hasta que podamos disponer de más estudios en este ámbito para introducir nuevas terapias en la práctica clínica habitual, el cumplimiento estricto de la DSG sigue siendo la base fundamental del tratamiento.
FinanciaciónEste estudio ha sido financiado en parte con proyectos del Instituto de Salud CarlosIII, Fondo de Investigación Sanitaria (Ref. PI13/01133 y PI16/01574), cofinanciado por FEDER (Fondo Europeo de Desarrollo Regional).
Conflicto de interesesLos autores declaran no presentar ningún conflicto de intereses relacionado con el presente artículo.