La pancreatitis enfisematosa (PE) es una complicación grave y rara de la pancreatitis aguda. El diagnóstico se basa en los datos clínicos y en el hallazgo radiológico de gas en el retroperitoneo. La necrosis pancreática infectada es potencialmente letal, con una tasa de mortalidad superior al 35%. La cirugía en estos pacientes asocia una alta morbimortalidad. La ultrasonografía endoscópica, el tratamiento quirúrgico laparoscópico y el drenaje percutáneo ofrecen una modalidad de tratamiento alternativo a la cirugía, seguro y eficaz. Sin embargo, se requieren más estudios para definir el lugar que ocupan estas técnicas en el tratamiento de estos pacientes, que debe ser individualizado, dinámico y multidisciplinario. Presentamos 2 casos de PE con distinto tratamiento terapéutico.
Emphysematous pancreatitis is a severe and rare complication of acute pancreatitis. This entity is diagnosed on clinical grounds and on the basis of the radiologic finding of gas in the retroperitoneum. Infected pancreatic necrosis is potentially lethal, with mortality rates of more than 35%. Surgery is associated with significant morbidity and mortality in these critically ill patients. Endoscopic ultrasonography techniques, laparoscopic surgery and percutaneous drainage have the potential to offer a safe and effective alternative treatment modality. However, the precise role of these procedures requires further investigation. The treatment of these patients should be individualized, dynamic and multidisciplinary. We present two cases of emphysematous pancreatitis with distinct therapeutic management.
La pancreatitis enfisematosa (PE) es una complicación grave y poco frecuente de la pancreatitis aguda (PA) que se caracteriza por la presencia de gas en el parénquima pancreático o peripancreático que junto con la presencia de necrosis indica infección bacteriana. La necrosis pancreática infectada presenta tasas de mortalidad elevadas, por encima del 35%. El germen más frecuentemente aislado en la PE es Escherichia coli1. La tomografía computarizada (TC) es la prueba diagnóstica de elección con una alta sensibilidad y especificidad2. Las causas más frecuentes de gas en la celda pancreática son los seudoquistes infectados y abscesos, seguido de fístulas benignas y procesos malignos3. Una vez diagnosticada, debe cambiarse el tratamiento terapéutico de estos pacientes y considerarse una PA grave. Wig1 et al estudiaron retrospectivamente 57 pacientes que recibieron necrosectomía por necrosis infectada entre 2002 y 2006, que se dividieron en 2 grupos: pacientes con PE y aquéllos con necrosis infectada sin presencia de gas en la TC. No obtuvieron diferencias en cuanto a la incidencia de fallo orgánico, estancia hospitalaria o mortalidad ni tampoco al comparar por separado la incidencia de fístula entérica, hemorragia, formación de colecciones intraabdominales o complicaciones de la pared abdominal.
La disfunción tardía de órganos como el sistema renal o respiratorio aparece a las 2–3 semanas del ingreso del paciente y suele ser el resultado de la infección secundaria de la necrosis pancreática o peripancreática. El algoritmo actual de la PE como manifestación de la PA tiende a tratar la fase inicial de forma conservadora, mientras que la cirugía debe considerarse en la segunda fase del proceso pancreático o en casos seleccionados durante las 2 primeras semanas del proceso. Las opciones terapéuticas en la PE van del tratamiento conservador a la cirugía de la necrosis infectada sin que exista un consenso claro de cuándo se debe indicar cada una de éstas. El factor más importante para indicar el tratamiento médico conservador es la situación clínica del paciente, más que los hallazgos bacteriológicos o radiológicos, mientras que la cirugía se debe reservar para aquellos pacientes con deterioro importante del estado general o fallo orgánico4. Sin embargo, otros autores concluyen que la PE por sí sola es una indicación de cirugía1. En los nuevos algoritmos de actuación el tratamiento conservador o endoscópico cobra cada vez más protagonismo aunque el desbridamiento quirúrgico sigue siendo el tratamiento gold-standard de la necrosis infectada5.
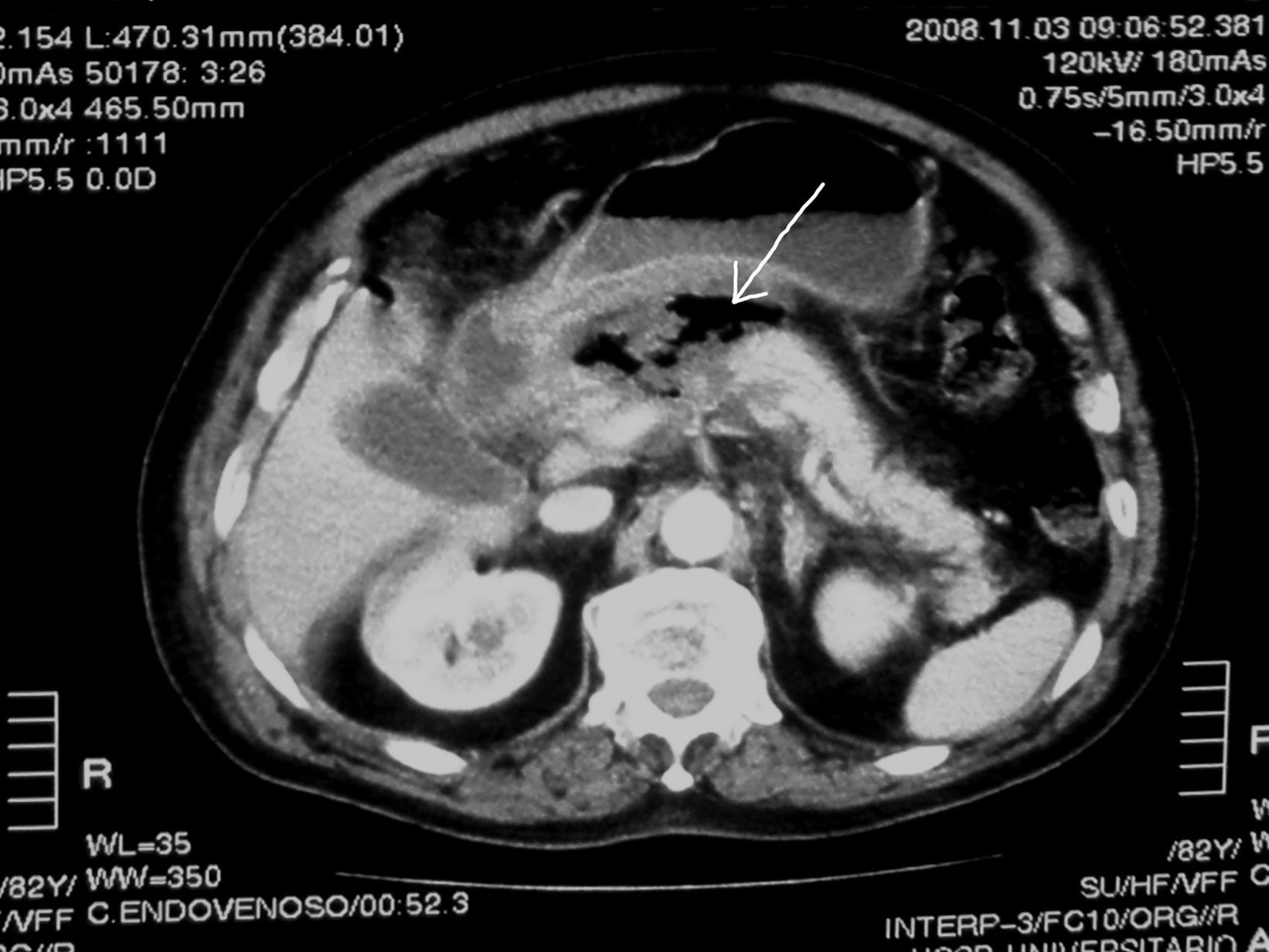
Observación clínicaCaso 1Paciente varón de 82 años de edad, exfumador de un paquete al día hace 20 años y bebedor de más de 40g de alcohol diarios, hipertenso, diagnosticado de carcinoma de próstata en tratamiento con bicalutamida y análogo de la hormona liberadora de la hormona luteinizante, asma bronquial en tratamiento con montelukast, con un performance status de 1 (WHO score) y un índice de masa corporal (IMC) de 27, que acudió a urgencias por dolor abdominal en epigastrio irradiado “en cinturón” de 5 días de evolución y vómitos alimenticios, sin fiebre ni otra sintomatología acompañante. En la exploración física destacaba sudoración profusa, presión arterial de 240/90mmHg, frecuencia cardíaca de 105lpm, saturación de O2 del 92% y dolor a la palpación del epigastrio e hipocondrio derecho. Presentaba signos de síndrome de respuesta inflamatoria sistémica en el ingreso. La analítica mostraba una glucemia de 233mg/dl, función renal e iones normales, incluido el calcio, bilirrubina (1,4mg/dl), aspartato-aminotransferasa (AST) (145 U/l), alanina-aminotransferasa (ALT) (66 U/l), fosfatasa alcalina (FA) ((256 U/l), gamma-glutamil transferasa (GGT) (556 U/l), lactato deshidrogenasa (LDH) (601U/l), amilasa sérica (3.956U/l) y proteina C reactiva (PCR) (0,7mg/dl). Los marcadores cardíacos fueron normales. En el hemograma se observó: hemoglobina (Hb) (14,8g/dl), hematocrito (43,9%), volumen corpuscular medio (VCM) (97 fl), leucocitos (16.400/μl [neutrófilos del 84,5%]) y plaquetas (303.000/μl). En el ingreso se realizó una ecografía abdominal donde se observaba el hígado, la vesícula biliar, las vías biliares y los riñones sin alteraciones detectables y el páncreas aumentado de tamaño edematoso. No se apreció líquido libre intraabdominal. Con el diagnóstico de PA grave (según criterios de Ramson y de Glasgow) de probable origen enólico se inició un tratamiento con sueroterapia, analgesia y reposo digestivo con buena evolución inicial y reintroducción de la dieta a las 72h. Ante la buena evolución clínica se decidió no realizar la TC en las primeras 48h. Al 4.° día del ingreso el paciente comenzó con fiebre, dolor y distensión abdominal por lo que se le realizó una TC abdominal que mostraba un cuerpo del páncreas que no se realzaba tras la administración del contraste intravenoso (CIV), lo que indicaba un área de necrosis de la glándula (fig. 1). En la región gastropancreática se observó una zona mal definida con un aumento de la densidad y con presencia de gas (flecha) que se extendía inferiormente hacia la raíz del mesenterio, alcanzó 10cm de diámetro transverso y era compatible con el área flemonosa en relación con probable PE con área de necrosis. Asimismo, destacó ausencia de líquido libre intraperitoneal y se observó derrame pleural bilateral en pequeña cantidad. Ante estos hallazgos de la TC (7 puntos según la escala de Balthazar) y la estabilidad clínica del paciente (sin signos de fallo orgánico) y tras la valoración por el servicio de cirugía se decidió iniciar un tratamiento empírico con imipenem (1g por vía i.v./8h) y realizar una ultrasonografía endoscópica (USE) con punción aspirativa con aguja fina (PAAF) de la lesión pancreática con el resultado de colección mal definida y heterogénea en cuerpo pancreático con escaso contenido de líquido y aire. La cabeza pancreática presentaba ecogenicidad homogénea sin afectación de vasos. La vesícula y la vía biliar estaban normales. Se realizó una PAAF con aguja de 25G obteniéndose escaso material semilíquido y parcialmente hemático. En el cultivo del material obtenido se aisló Citrobacter freundii sensible a imipenem, mientras que la anatomía patológica mostró celularidad normal sin signos de malignidad. Tras cumplir 15 días del tratamiento antibiótico el paciente mejoró progresivamente y se le dio el alta hospitalaria. Posteriormente, se realizó una TC de control y se observó la resolución del absceso.
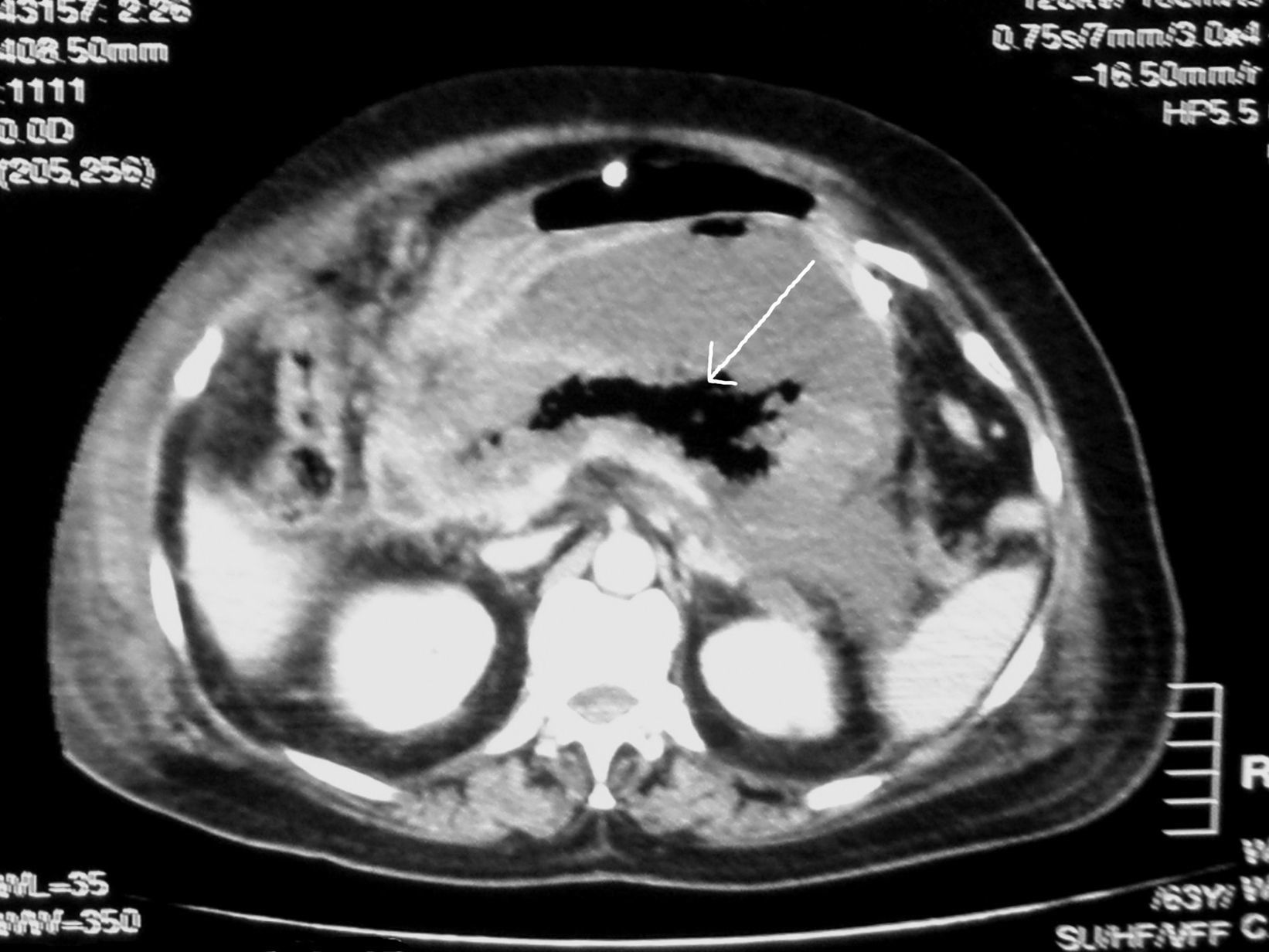
Caso 2Paciente mujer de 64 años de edad sin hábitos tóxicos de interés, hipertensa en tratamiento con indapamida y enalapril y trastorno bipolar en tratamiento con valproato sódico que acudió a urgencias por cuadro de 24h de evolución de dolor abdominal generalizado acompañado de vómitos alimentarios y malestar general sin fiebre ni otra sintomatología. Presentaba presión arterial de 95/75mmHg, temperatura de 37,3°C, frecuencia cardíaca de 122lpm y saturación de O2 del 93% con signos de respuesta inflamatoria sistémica. En la exploración física destacaba mal estado general, IMC de 25, sudoración profusa, una palpación abdominal dolorosa que era más intensa en el epigastrio, sin signos de irritación peritoneal. En la analítica presentaba glucemia (216mg/dl), urea (88mg/dl), creatinina (1,39mg/dl), iones y calcio normales, bilirrubina total (4,8mg/dl) a expensas de directa, AST (594U/l), ALT (815U/l), GGT (540U/l), LDH (968U/l), amilasa (889U/l), Hb (14,6g/dl), htco (41%), leucocitos (29.100/mm3), plaquetas (243.000/mm3) y gasometría con acidosis metabólica. Se realizó una ecografía abdominal que descartó la presencia de colelitiasis y dilatación de la vía biliar. Ingresó en la unidad de vigilancia intensiva (UVI) con el diagnóstico de PA grave (según criterios de Ramson y de Glasgow) de origen desconocido donde presentó distress respiratorio que precisó ventilación mecánica no invasiva. Se inició un tratamiento empírico con imipenem (1g i.v./8h), sueroterapia, analgesia y reposo digestivo con buena evolución clínica inicial. Se realizó una TC abdominal a las 48h observándose alteración pancreática difusa con aumento de tamaño e hipodensidad difusa con escasas zonas captantes y afectación de planos de grasa mesentérica en relación con la PA. Se observaban 2 zonas de menor atenuación y aspecto focal con burbujas aéreas en su interior que indicaban áreas absecificadas de 2,5cm en la cabeza pancreática y 2,2cm en la cola. Se observó líquido libre en el retroperitoneo y Douglas. En este momento no se indicó cirugía urgente dado la estabilidad clínica de la paciente y la mejoría progresiva. Al 10.º día del ingreso la paciente comenzó con fiebre, dolor abdominal intenso en epigastrio y distress respiratorio por lo que se le realizó una TC abdominal urgente (fig. 2) donde se apreció necrosis de la mayor parte de la glándula pancreática con presencia de gas (flecha) en celda pancreática, colección retrogástrica con pared incompleta de 13×6×14cm, líquido libre intraabdominal en gotiera izquierda y pelvis y derrame pleural bilateral (9 puntos según la escala de Balthazar). Valorado por el Servicio de Cirugía General se decidió realizar una intervención quirúrgica, en ésta se observó necrosis de toda la glándula pancreática con colecciones peripancreáticas abscesificadas. La mayor retrogástrica fue de 14cm de diámetro mayor, por lo que se realizó un desbridamiento, colecistectomía y se colocaron 2 drenajes abdominales y una sonda Foley de triple luz para realizar lavados. Se cultivó parte de la necrosis y líquido purulento aislándose E. coli, y en cultivos posteriores del drenaje Candida albicans y Staphylococcus epidermidis, por lo que se pautó un tratamiento según antibiograma por persistencia de fiebre. Posteriormente se observó hemorragia intraabdominal con drenaje hemático e inestabilidad hemodinámica, por lo que se realizó una intervención quirúrgica urgente donde se apreció gran hematoma en la celda pancreática y hemorragia activa en la zona de la cabeza pancreática. Se realizó hemostasia, drenaje y lavado de celda pancreática y colocación de bolsa de Bogotá que posteriormente se retiró. Como complicaciones posteriores la paciente presentó una polineuropatía del paciente crítico que le ocasionó una tetraplejía y una sepsis por Acinetobacter baumannii multirresistente únicamente sensible a colistina. En los meses posteriores la paciente tuvo un deterioro clínico progresivo y falleció a los 3 meses del ingreso por sepsis grave.
DiscusiónEl tratamiento de la PA grave debe realizarse en función de muchos parámetros (clínicos, radiológicos y bacteriológicos) y debe individualizarse al paciente. Existen 2 objetivos primarios en el tratamiento inicial de la PA grave. El primero se basa en el tratamiento de soporte y tratar las posibles complicaciones que pueden surgir y, el segundo, en limitar tanto la gravedad de la inflamación pancreática como la formación de la necrosis y frenar la respuesta de inflamación sistémica interrumpiendo de forma específica su patogénesis6. En estos pacientes, la mortalidad es superior al 30%, y más del 80% de las defunciones en estos pacientes con pancreatitis se debe a complicaciones sépticas7. En centros especializados en cirugía del páncreas, la mortalidad se ha logrado disminuir hasta un 10–20% gracias a la correcta elección del tratamiento quirúrgico apropiado8.
Ante el hallazgo radiológico de PE y, por consiguiente, de necrosis pancreática infectada, se nos plantean 2 opciones terapéuticas: tratamiento conservador (punción de la necrosis por vía percutánea o endoscópica y tratamiento antibiótico dirigido) o bien, desbridamiento quirúrgico. La PAAF de la necrosis permite realizar un tratamiento conservador según antibiograma y, de este modo, programar la cirugía de manera diferida, lo que permite la organización de la necrosis y reducir la morbimortalidad asociada a la intervención9.
Según el único estudio aleatorizado que compara la cirugía de la necrosis pancreática precoz versus tardía, se obtuvo una mortalidad mayor en la necrosectomía precoz (el 56 versus el 27%)10. Aunque parece importante conocer si la necrosis está infectada o no, varios grupos han demostrado que es el tiempo de la cirugía (precoz o tardía), y no el estatus bacteriológico del páncreas, el que determina la mortalidad de la cirugía8,11. El tratamiento quirúrgico de la necrosis pancreática infectada puede realizarse mediante la técnica abierta (taponamiento abierto, laparotomía de repetición con lavados, lavado continuo del retroperitoneo y de la transcavidad de los epiplones y taponamiento cerrado)12 o mediante laparoscópica. La vía laparoscópica (necrosectomía más colocación de drenajes amplios) puede ser una opción menos intensiva que la cirugía abierta en los casos en que se requiera cirugía en la fase precoz del proceso13. La aplicación de las distintas opciones de tratamiento quirúrgico abierto o mínimamente invasivo debe ir en función de la localización anatómica de la colección, ratio entre componente sólido y líquido, tiempo de evolución desde el diagnóstico y evolución clínica del paciente.
Han aparecido en los últimos años casos de PE tratados con éxito de forma conservadora14,15. Recientemente se ha presentado un estudio comparativo entre tratamiento conservador de la necrosis infectada (tratamiento antibiótico según antibiograma y drenaje percutáneo en caso necesario) frente a un control histórico tratado quirúrgicamente. La supervivencia de los pacientes con tratamiento conservador (76,9%) fue mayor en comparación con los pacientes intervenidos quirúrgicamente (46,4%)16.
Si la necrosis pancreática está organizada, la necrosectomía transgástrica endoscópica (NTE) parece ser un método efectivo y relativamente seguro en determinados pacientes aunque requiere de varias sesiones para la resolución de la infección17,18. Esta técnica no se ha comparado prospectivamente con el tratamiento quirúrgico convencional. Un reciente estudio ha comparado la NTE con el drenaje endoscópico estándar sin necrosectomía, obteniendo una tasa de resolución de la pancreatitis del 88% con la NTE frente al 45% en los que recibieron drenaje estándar (p<0,01), con similares tasas de complicaciones en ambos grupos19.
Otra posibilidad terapéutica es el drenaje mediante la colocación percutánea de catéteres para lavado. Se ha utilizado como forma única de tratamiento o como medida temporal hasta lograr la estabilización clínica necesaria para realizar la necrosectomía quirúrgica20.
El desarrollo de nuevas técnicas endoscópicas nos permite un tratamiento conservador de estos pacientes. La USE permite obtener material para cultivo y el drenaje de colecciones líquidas de manera segura en caso de que existan. La aplicación de las distintas opciones del tratamiento quirúrgico abierto o mínimamente invasivo (laparoscópico y endoscópico) debe ir en función de la localización anatómica de la colección, ratio entre componente sólido y líquido, tiempo de evolución desde el diagnóstico y evolución clínica del paciente. El tratamiento de estos pacientes debería ser individualizado, dinámico y multidisciplinario, con la participación de intensivistas, cirujanos, gastroenterólogos y radiólogos.