Las primeras semanas del tratamiento triple contra el VHC son el período en el que se producen la mayoría de suspensiones por falta de respuesta virológica. Un mejor conocimiento de los factores basales del paciente y de su correlación con los puntos de decisión en el tratamiento con boceprevir (BOC) pueden ayudar a predecir el éxito de la terapia.
MétodosEstudio observacional retrospectivo para describir el período de lead-in como herramienta de decisión clínica en pacientes con VHC genotipo 1 tratados con BOC. Se recopilaron datos de las historias clínicas de 186 pacientes consecutivos en 20 hospitales generales españoles.
ResultadosSe incluyeron 171 pacientes. El 80% tenían fibrosis F3/F4, el 74% habían sido tratados previamente y el 26% eran naïve. Después del lead-in, el 54,5% mostraron una reducción ≥1 log10; el 52,5% en aquellos F3/F4. El 94% de pacientes empezaron tratamiento con BOC, las suspensiones del tratamiento en semana 4 se limitaron a pacientes cirróticos con respuesta nula. Algunos factores basales se asociaron a respuesta en semana 4: IL28B, respuesta previa y grado de fibrosis. En semana 8, el 48,8% de los pacientes presentaban ARN-VHC indetectable. La correlación entre las respuestas de las semanas 8 y 12 fue del 88%.
ConclusionesEn la práctica clínica en España, el lead-in se utilizó como factor de decisión en pacientes cirróticos no respondedores. La alta correlación entre las reglas de parada en semanas 8 y 12 indica que se podría anticipar la suspensión del tratamiento, evitando así acontecimientos adversos y costes asociados.
Most discontinuations due to lack of virological response occur during the first few weeks of hepatitis C virus (HCV) triple therapy. Improved knowledge of baseline factors and their correlation with boceprevir decision points may predict treatment success.
MethodsAn observational, retrospective study was conducted to describe the lead-in period as a clinical decision tool in HCV genotype 1 patients treated with boceprevir. Data were collected from the medical records of 186 consecutive patients distributed across 20 Spanish general hospitals.
ResultsThis study included 171 patients. A total of 80% had fibrosis F3/F4, 74% were previously treated, and 26% were treatment-naïve. After the lead-in period, 54.5% of the patients had a reduction of ≥1 log10; this reduction occurred in 52.5% of those with advanced fibrosis. Boceprevir therapy was started in 94% of the patients. Discontinuations at week 4 were limited to null responders with cirrhosis. The baseline factors associated with virological response at week 4 were IL28B, previous response, and fibrosis score. At week 8, HCV-RNA was undetectable in 48.8% of the patients. The correlation between responses at weeks 8 and 12 was 88%.
ConclusionIn the Spanish clinical setting, lead-in was mainly used as a clinical decision point for non-responders with cirrhosis. The good correlation between stopping rules at weeks 8 and 12 could be used to anticipate discontinuation, thus saving adverse events and costs.
Se calcula que en todo el mundo hay entre 130-170 millones de personas infectadas por hepatitis C crónica (HCC), lo que supone una morbimortalidad significativa, así como una importante carga económica para la asistencia sanitaria1. La combinación de peginterferón y ribavirina (PR) ha sido el tratamiento de referencia contra el virus de la hepatitis C (VHC) durante casi 2 decenios, a la cual se ha añadido en los últimos años boceprevir, un inhibidor de la proteasa (IP) del VHC indicado para el tratamiento del genotipo 1 en combinación con PR en pacientes adultos con hepatopatía compensada2,3. En ensayos clínicos de fase III, el tratamiento triple con boceprevir demostró alta actividad antiviral, logrando un aumento de las tasas de respuesta virológica sostenida (RVS) del 25-28% y del 38-45% respecto a la terapia doble en pacientes naïve y que habían fracasado a tratamiento previo4–6.
Para evaluar y controlar el tratamiento del VHC se utiliza principalmente la medición de su ARN7, aunque para predecir el éxito del mismo también se tienen en cuenta parámetros basales, como el genotipo del virus, la respuesta virológica previa y el grado de fibrosis del paciente. Un alto grado de fibrosis o una respuesta previa nula a interferón son factores bien conocidos que influyen negativamente en las tasas de RVS. Es importante señalar que el número de pacientes con hepatopatía avanzada incluidos en los estudios de registro de boceprevir era escaso y que apenas se disponía de datos sobre su control clínico en el momento de la introducción de los IP. Además, los pacientes cirróticos con respuesta nula previa presentaban tasas de curación bajas, lo que cuestionaba el valor real del tratamiento triple actual en esta población5,8,9.
El tratamiento triple con boceprevir incluye un período de lead-in de 4 semanas con PR antes de su administración2. Este esquema permite la cuantificación de la respuesta virológica que, como se observó en los ensayos clínicos, es un importante factor predictor de las tasas de RVS4,5. En los estudios de registro se obtuvieron tasas bajas de RVS, de solo el 34 y el 33%, en los pacientes naïve y con fracaso previo al tratamiento que mostraron una mala respuesta a interferón en la semana 4 (descenso<1 log10). Por el contrario, en aquellos pacientes con un descenso de la carga viral>1 log10 en semana 4 se observaron altas tasas de RVS, del 82 y el 76% respectivamente4,5,10.
Además, el tratamiento con boceprevir debe suspenderse si el ARN del VHC es>1.000UI/ml en la semana 8,>100UI/ml en la semana 12 o detectable en la semana 242,13. Análisis post-hoc de estas reglas de parada han demostrado claramente que su utilización y combinación favorece una suspensión precoz del tratamiento que no conduce a RVS, con la consiguiente reducción de costes y de acontecimientos adversos asociados13,14. Recientes análisis han señalado también que pueden servir como herramientas clínicas para predecir de forma individualizada la probabilidad de éxito del tratamiento y que son de utilidad en la toma de decisiones clínicas, en la posible duración de la terapia, y para informar al paciente a lo largo del curso de la terapia15. De esta manera, un mejor conocimiento de los factores basales capaces de predecir el éxito o fracaso del tratamiento y de su relación con estos puntos de decisión de boceprevir, podría servir de ayuda a la hora decidir la suspensión del tratamiento, especialmente en aquellos pacientes para los que se prevé una relación beneficio-riesgo desfavorable17,18.
MétodosDiseño del estudio y pacientesEstudio retrospectivo observacional del tratamiento clínico habitual de los pacientes con HCC infectados por G1 tratados con boceprevir, centrado en las 12 primeras semanas de tratamiento y, especialmente, en el período de lead-in. Para su realización se recopilaron datos de las historias clínicas de 186 pacientes distribuidos en 20 hospitales generales españoles.
La población apta para este estudio estuvo formada por todos los pacientes adultos infectados por el VHC-G1 de forma crónica tratados consecutivamente con boceprevir conforme a su ficha técnica, desde el momento de la inclusión del fármaco en el formulario del hospital hasta el 28 de febrero de 2013, y que cumplieran con el resto de criterios de inclusión/exclusión: haber otorgado su consentimiento informado, no estar coinfectados con VIH o VHB, no presentar hepatitis autoinmune o embarazo, no haber recibido trasplante hepático y no estar recibiendo tratamiento en el contexto de un ensayo clínico. Con la intención de recopilar también datos de aquellos pacientes que no hubieran comenzado con boceprevir por decisión clínica (p. ej., periodo de lead-in utilizado como instrumento de decisión clínica), se incluyó a todos los pacientes con VHC-G1 que habían empezado un tratamiento de 4 semanas con PR como parte de un esquema de tratamiento con boceprevir, con independencia de que finalmente lo recibieran o no.
El seguimiento se limitó a las primeras 12 semanas de tratamiento (4 semanas de lead-in con PR más 8 semanas de tratamiento triple), aunque se recopiló la RVS cuando se disponía de estos datos en los pacientes que ya habían finalizado el tratamiento.
Se recogieron las concentraciones de ARN del VHC según se habían determinado mediante práctica habitual, basalmente, tras el periodo de lead-in con PR, y en las semanas 8 y 12 de tratamiento con boceprevir. El fracaso virológico en las semanas 8 y 12 se definió según ficha técnica (ARN del VHC>1.000UI/ml en la semana 8 y ARN del VHC>100UI/ml en la semana 12). La fibrosis se evaluó mediante bipsia y/o fibroscan, tomando para el estudio la prueba más reciente. Los puntos de corte del fibroscan fueron los siguientes: F0-F1=menor de 7,6kPa; F2=7,7-9,4kPa; F3=9,5-14kPa; F4=superior a 14kPa.
El principal objetivo del estudio fue calcular la proporción de pacientes con HCC de genotipo 1 para los cuales el médico había decidido iniciar el tratamiento triple con boceprevir 800mg basándose en el resultado del período de lead-in de 4 semanas (es decir, ARN del VHC indetectable, descenso ≥1 log10 o descenso<1 log10 con respecto a la carga viral basal).
ResultadosSe revisaron 186 historias clínicas consecutivas de pacientes infectados por el VHC tratados con boceprevir. Ciento setenta y un pacientes cumplieron los criterios de inclusión y exclusión y fueron recogidos en el análisis.
El 80% de los pacientes presentaban fibrosis F3/F4, además la mayoría (74%) habían fracasado el tratamiento antiviral previo con PR (recidiva 24%, respuesta parcial 12,3%, respuesta nula 29,8%, breakthrough 2,9%, respuesta desconocida 4,7%). Solo el 26% de los pacientes eran naïve (tabla 1).
Características basales de los pacientes incluidos en el estudio
| Número de pacientes (n=171) | Porcentaje (%) | |
|---|---|---|
| Sexo | ||
| Varones | 114 | 71,7 |
| Mujeres | 45 | 28,3 |
| Raza | ||
| Blanca | 167 | 97,66 |
| Otra | 0 | 0 |
| No disponible | 4 | 2,34 |
| Genotipo | ||
| 1a | 36 | 21,05 |
| 1b | 124 | 72,51 |
| 1c | 1 | 0,58 |
| 1a/b | 2 | 1,17 |
| 1 no clasificado | 8 | 4,68 |
| Tratamiento previo | ||
| No | 45 | 26,32 |
| Sí | 126 | 73,68 |
| Tratamientos anteriores | ||
| Recidiva | 41 | 23,98 |
| Respuesta parcial | 21 | 12,28 |
| Respuesta nula | 51 | 29,82 |
| Breakthrough | 5 | 2,92 |
| Respuesta desconocida | 8 | 4,68 |
| Sin tratamiento previo | 45 | 26,32 |
| Genotipo IL28B | ||
| CC | 28 | 16,37 |
| CT | 84 | 49,12 |
| TT | 20 | 11,70 |
| No disponible | 39 | 22,81 |
| Fibrosis | ||
| F0-F1 | 13 | 7,60 |
| F2 | 14 | 8,19 |
| F3 | 50 | 29,24 |
| F4 | 87 | 50,88 |
| No disponible | 7 | 4,09 |
| Varices esofágicas | ||
| Sí | 33 | 19,30 |
| No | 136 | 79,53 |
| No disponible | 2 | 1,17 |
| Plaquetas y albúmina sérica basales | ||
| Plaquetas<100.000/mm3 | 95 | 55,56 |
| y albúmina<35mg/dl | ||
| Plaquetas ≥100.000/mm3 | 37 | 21,64 |
| y albúmina ≥35mg/dl | ||
Fibrosis: las puntuaciones de la escala Metavir se basaron en la clasificación del paciente en su historia clínica, así como última biopsia hepática y/o medición por Fibroscan disponible. F0: ausencia de fibrosis; F1: fibrosis portal sin tabiques; F2: fibrosis portal con algunos tabiques; F3: numerosos tabiques sin cirrosis; F4: cirrosis.
Se administró boceprevir a 160 pacientes (93,5%) y como interferón se utilizó predominantemente peginterferón alfa-2a (66,1%), seguido por peginterferón alfa-2b (33,9%).
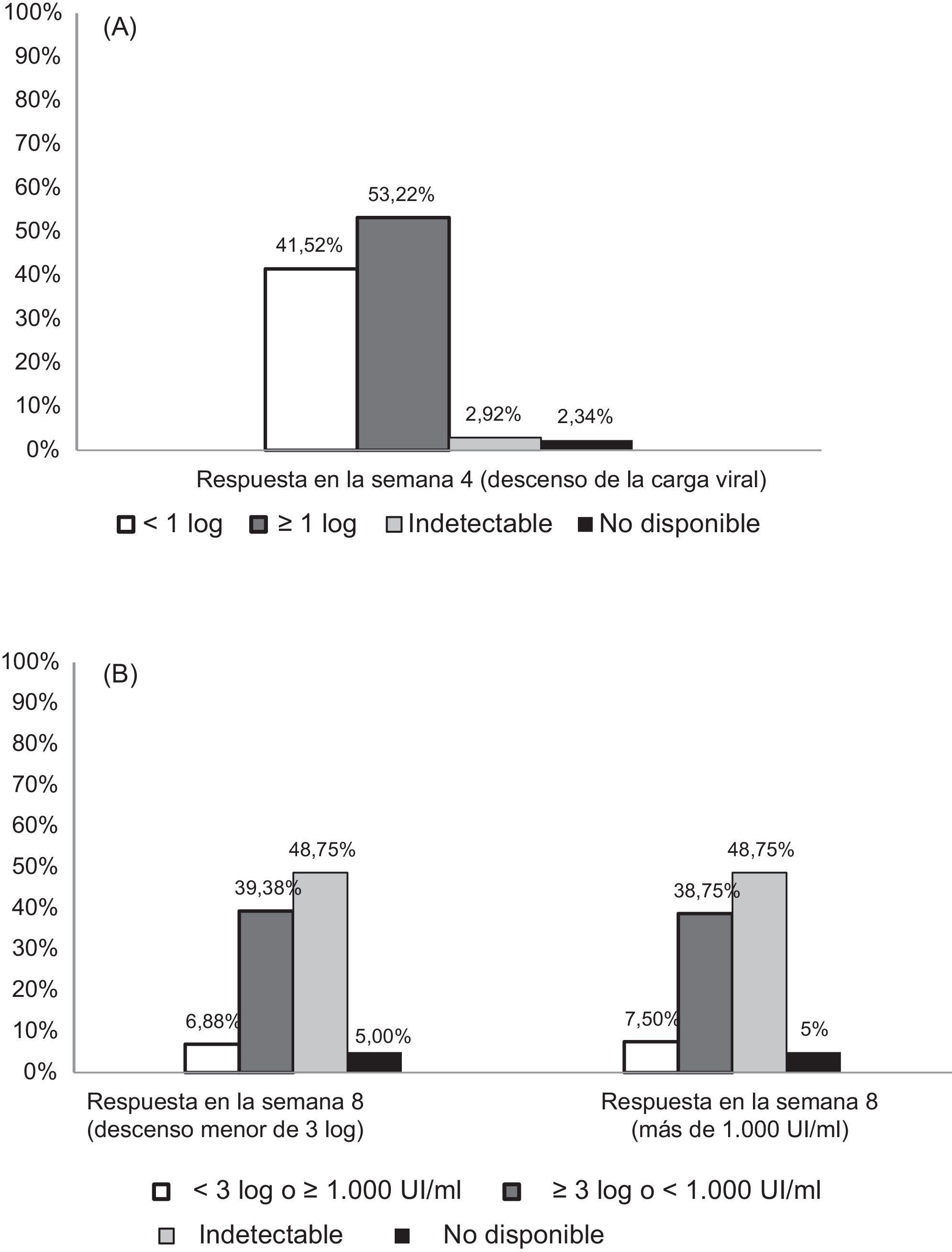
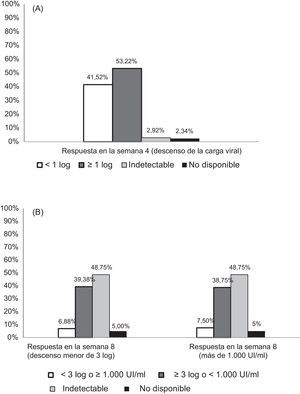
El efecto del período de lead-in se representa en la figura 1A. Noventa y seis pacientes (56%) mostraron una buena respuesta a interferón, con un descenso ≥1 log10 del valor de ARN del VHC después del período de lead-in de 4 semanas con PR. Entre los pacientes con fibrosis avanzada (F3/F4), el 43% tuvieron un descenso de menos de 1log10 después del lead-in y el 52,5% mostraron una buena respuesta, con un descenso mayor a 1 log10.
Respuesta en diferentes semanas de tratamiento. (A) Respuesta en la semana 4. Reducción de la carga viral desde el momento basal hasta el final del período de lead-in (4 semanas con PR). (B) Respuesta en la semana 8. La tasa de respuesta virológica en la semana 8 se analizó bajo dos condiciones: descenso de la carga viral inferior a 3 log10 o persistencia de una carga viral ≥1.000UI/ml.
Después de las primeras 4 semanas de tratamiento, 160 pacientes (94%) continuaron con el tratamiento y recibieron boceprevir. En cuanto a los pacientes que no comenzaron con boceprevir, los principales motivos para suspender el tratamiento fueron la no obtención de un descenso de 1 log10 después del lead-in (54,5%) y la mala tolerabilidad del tratamiento (36,4%). Cabe destacar que todos los pacientes que no llegaron a recibir boceprevir debido a una mala respuesta eran pacientes previamente tratados y 10 de 11 presentaban fibrosis F3/F4.
Algunos factores basales se relacionaron con una respuesta virológica en el período de lead-in y podrían desempeñar una función importante en la decisión terapéutica (tabla 2). El genotipo IL28B guardó una estrecha relación con una buena respuesta; el 80,8% de los pacientes con el genotipo IL28B-CC mostraron una respuesta virológica después del período de lead-in, en comparación con el 47,5% de los pacientes con un genotipo no-CC. Otros factores importantes son la respuesta al tratamiento previo (el 47,4% de los pacientes con recidiva mostraron respuesta virológica, en comparación con el 25,5% de los pacientes con respuesta nula) o el estadio de fibrosis (67,2% con fibrosis F0-3 frente al 48,5% con fibrosis F4).
Modelo de respuesta en la semana 4. Tasas de respuesta virológica en la semana 4 según las características basales
| Respuesta virológica (ST4) | ||||
|---|---|---|---|---|
| Sí | No | |||
| Pacientes | % | Pacientes | % | |
| Genotipo | ||||
| 1a | 23 | 63,9 | 13 | 36,1 |
| 1b | 68 | 56,2 | 53 | 43,8 |
| Tratados previamente* | ||||
| No | 33 | 75,0 | 11 | 25,0 |
| Sí | 63 | 50,8 | 61 | 49,2 |
| Respuesta al tratamiento** | ||||
| Recidiva | 29 | 74,4 | 10 | 25,6 |
| Parcial | 11 | 52,4 | 10 | 47,6 |
| Nula | 13 | 25,5 | 38 | 74,5 |
| Rebote | 5 | 100,0 | 0 | 0,0 |
| Sin tratamiento previo | 33 | 75,0 | 11 | 25,0 |
| Fibrosis*** | ||||
| F0-1 | 6 | 66,7 | 3 | 33,3 |
| F2 | 10 | 76,9 | 3 | 23,1 |
| F3 | 23 | 63,9 | 13 | 36,1 |
| F4 | 32 | 48,5 | 34 | 51,5 |
| F0-3 | 39 | 67,2 | 19 | 32,8 |
| F4 | 32 | 48,5 | 34 | 51,5 |
| Varices esofágicas | ||||
| No | 81 | 60,4 | 53 | 39,6 |
| Sí | 14 | 43,8 | 18 | 56,3 |
| Subtipo IL28b**** | ||||
| CC | 21 | 80,8 | 5 | 19,2 |
| CT | 42 | 50,0 | 42 | 50,0 |
| TT | 9 | 45,0 | 11 | 55,0 |
| Peginterferón | ||||
| 2a | 64 | 58,2 | 46 | 41,8 |
| 2b | 32 | 55,2 | 26 | 44,8 |
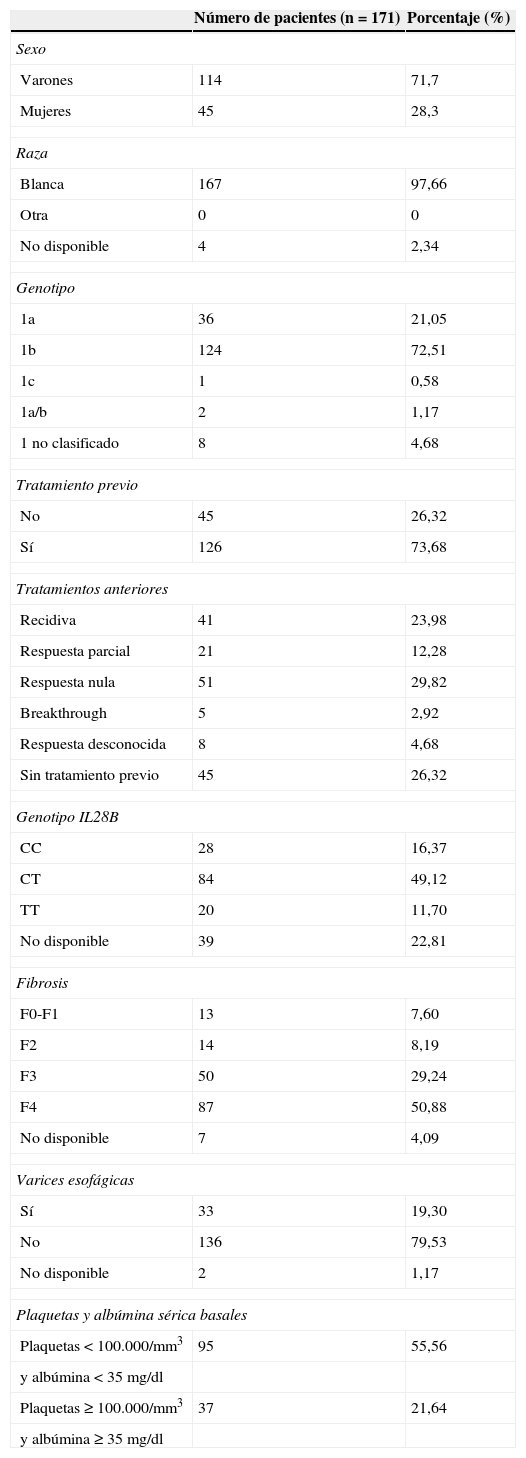
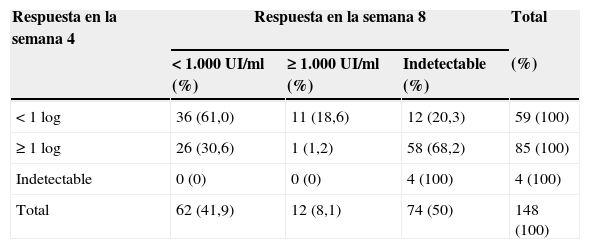
En la semana 8 de tratamiento se analizó el descenso del ARN del VHC utilizando 2 condiciones diferentes: descenso de menos de 3 log10 respecto a la carga viral basal o carga viral de más de 1.000UI/ml. El 39,4% de los pacientes presentaron una reducción ≥3 log10 con respecto al momento basal y el 48,8% presentaron valores indetectables (fig. 1B). Teniendo en cuenta la regla de parada recientemente añadida en ficha técnica europea, el 7,5% tenían más de 1.000UI/ml en la semana 8. En la tabla 3 se muestra la relación entre el número de pacientes con un descenso menor de 3 log y una carga viral ≥1.000UI/ml. Otro punto interesante es la relación entre la respuesta en la semana 4 y la semana 8 (tabla 4). El 68,2% de los pacientes que alcanzaron un descenso ≥1 log10 en la semana 4 mostraron una carga viral indetectable en la semana 8.
Relación entre la respuesta en la semana 4 y en la semana 8
| Respuesta en la semana 4 | Respuesta en la semana 8 | Total | ||
|---|---|---|---|---|
| <1.000UI/ml (%) | ≥1.000UI/ml (%) | Indetectable (%) | (%) | |
| <1 log | 36 (61,0) | 11 (18,6) | 12 (20,3) | 59 (100) |
| ≥1 log | 26 (30,6) | 1 (1,2) | 58 (68,2) | 85 (100) |
| Indetectable | 0 (0) | 0 (0) | 4 (100) | 4 (100) |
| Total | 62 (41,9) | 12 (8,1) | 74 (50) | 148 (100) |
En la semana 12, un 9,7% de los pacientes presentó carga viral superior a 100UI/ml, cumpliendo así la regla de parada. La mayoría de ellos (12/15) suspendieron el tratamiento. Tres pacientes continuaron tratamiento, probablemente en un intento de agotar toda alternativa existente, sin embargo, ninguno alcanzó RVS, corroborando la alta validez predictiva de esta regla.
Finalizaron el tratamiento 131 pacientes. En la población por intención de tratar, la RVS fue del 42,7% (73/171), ascendiendo al 45,6% si se tienen en cuenta solo aquellos que recibieron boceprevir (73/160). Sin embargo, hubo 37 pacientes con datos no disponibles en el momento del análisis, por lo que se espera que la tasa global de RVS real sea algo mayor. Los datos disponibles muestran que 21 de los 131 pacientes (16%) que completaron el tratamiento no lograron RVS por presentar recidiva después del final del tratamiento.
Teniendo en cuenta a todos los pacientes que suspendieron el tratamiento durante las primeras 12 semanas (n=31), el 64,5% lo hicieron por falta de eficacia en uno de los momentos de decisión del tratamiento con boceprevir (semanas 4, 8 y 12) y el 29% por mala tolerabilidad.
Los perfiles de efectos secundarios en la práctica clínica fueron muy similares a los observados en los ensayos clínicos y en otras cohortes en la práctica clínica. El acontecimiento adverso más frecuente fue la anemia, que se reflejó en las historias clínicas como un acontecimiento adverso grave en el 2,4% de los pacientes. Ocho pacientes de los 13 que habían experimentado un acontecimiento adverso grave suspendieron el tratamiento.
DiscusiónEsta experiencia multicéntrica de tratamiento triple con IP para la infección por genotipo 1 del VHC muestra cómo se utilizaron el periodo de lead-in y otros factores de decisión para el tratamiento con boceprevir en la fase de adopción inicial del fármaco después de su introducción en el ámbito clínico en España. El 94% de pacientes que continuaron el tratamiento después del lead-in, y especialmente el elevado número de pacientes (88,7%) que lo hicieron a pesar de presentar una mala respuesta (<1 log10), indican que el periodo de lead-in se utilizó como instrumento de decisión para pacientes cirróticos sin respuesta previa principalmente, debido probablemente, a la falta de alternativas en el momento del estudio y a la disponibilidad de puntos posteriores de decisión en las semanas 8 y 12, que permitían evaluar la eficacia una vez el paciente había sido expuesto al antiviral directo. Parece por tanto cuestionable, que los pacientes con mala respuesta a interferón asociada con otros factores de mal pronóstico, cuya posibilidad aproximada de curación es del 30% o menor4,5, deban ser tratados con un IP de primera generación. No obstante, la decisión de suspender el tratamiento puede retrasarse hasta la semana 8 debido al elevado poder de predicción de RVS de este punto, donde en diversos análisis se ha observado que los pacientes con carga viral indetectable logran tasas de RVS superiores al 80% y aquellos con una carga viral de 1.000UI/ml alcanzan tasas por debajo del 10%10–12,16,17.
La tasa de indetectabilidad del 48,75% en la semana 8 es similar a la observada en otras cohortes de la práctica clínica compuestas por pacientes con fibrosis F3/F414,17,18 y podría ser un buen factor de predicción de una RVS global en torno al 50% que, por desgracia, no pudo evaluarse en el momento del estudio, ya que algunos pacientes todavía no habían alcanzado la semana de seguimiento de su RVS. La tasa de RVS calculada en la población por intención de tratar se sitúa, en cualquier caso, en los valores observados en otras cohortes en las que se incluyó un gran número de pacientes cirróticos y sin respuesta previa.
Atendiendo a la regla de parada de 1.000UI/ml en la semana 8 recientemente incorporada en la ficha técnica de boceprevir, encontramos una correlación del 87,5% con la regla de parada en la semana 12, lo que significa que la mayoría de pacientes con más de 100UI/ml en la semana 12 podrían haberse identificado en semana 8. Este nuevo punto de corte, podría por tanto desempeñar una importante función en el seguimiento del tratamiento, ahorrando 4 semanas de posibles acontecimientos adversos y costes.
La seguridad del tratamiento triple con boceprevir en el ámbito real se ha descrito perfectamente en otras cohortes de práctica clínica real4,5,16–18. Al igual que en dichos trabajos, hemos observado que la anemia es un efecto secundario frecuente e importante en el tratamiento del VHC, donde tanto peginterferón como ribavirina producen mielodepresión, que se ve aumentada al añadir el IP y que es especialmente alta en los pacientes cirróticos3–5. No obstante, este estudio no tenía por objetivo evaluar la seguridad, ya que habría sido necesario un período de seguimiento más prolongado para identificar los efectos secundarios aparecidos después de la semana 12.
A pesar de las limitaciones mencionadas debido a su corto período de seguimiento y a su carácter retrospectivo, este estudio es, según nuestro conocimiento, el primero en el que se pregunta a los hepatólogos por sus decisiones clínicas basadas en los resultados del periodo de lead-in y de las reglas de parada del tratamiento con boceprevir, en un ámbito con elevadas proporciones de pacientes difíciles de tratar y con restricciones de acceso a la terapia triple.
En resumen, el estudio muestra que el conocimiento de las características basales y de la respuesta a interferón evaluada en diferentes momentos durante el tratamiento con boceprevir han sido instrumentos de decisión importantes en el tratamiento del VHC en España. Aunque el tratamiento con boceprevir ha dejado de ser una pauta recomendada en nuestro entorno, esta información se añade a la ya existente sobre reglas de parada en tratamientos basados en interferón y complementa su conocimiento con aspectos de uso real en práctica clínica.
Conflicto de interesesMSD ha sido promotor y financiador del estudio.
JC ha participado como ponente y consultor para Abbvie, BMS, Gilead, Janssen, MSD, y Roche. MB ha sido ponente y consultora de Janssen, MSD, BMS, Abbvie y Roche. FP ha sido consultor de Janssen, Abbvie y participado como ponente para MSD, Janssen, Gilead y BMS. IF ha sido ponente de Roche, MSD, Janssen y Gilead y consultora para MSD, Janssen, Abbvie y Gilead. OG no ha tenido conflictos de interés con la industria farmacéutica durante la duración del estudio. RF ha sido consultor y ponente de MSD, MB ha sido consultora y ponente de MSD, Janssen, Gilead y Abbvie, JL trabaja para el departamento médico de MSD España y JLC ha sido ponente y consultor de MSD, BMS, Janssen, Gilead y Abbvie.
MSD ha sido promotor y financiador del estudio. Los autores agradecen a la Dra. Cristina Fernández por su soporte estadístico, Dra. Verónica Barrioluengo por la elaboración del manuscrito y a todos los investigadores del estudio por su participación, reclutamiento de pacientes y contribución en la recogida de datos: Dra. María Luisa García Buey, Dr. Francisco Jorquera, Dr. Diego Rincón, Dra. María Dolores Antón Conejero, Dr. Ramón Planas, Dr. Moisés Diago, Dra. María Londoño, Dra. Esther Molina, Dr. Juan Ramón Larrubia, Dr. Antonio Olveira, Dr. Miguel Angel Serra y Dr. Isidoro Narváez.