INTRODUCCION
El plasmocitoma extramedular (PEM) es una de las formas más raras de presentación de la amplia patología tumoral de las células plasmáticas, ya que representa menos del 4% del total1. Su localización más habitual es la cabeza y el cuello2, en cerca del 90% de los casos. La afectación del tracto digestivo ocurre en menos del 10% de los casos. Presentamos un caso de afectación del colon sigmoide y llevamos a cabo una revisión de la literatura médica en relación con esta infrecuente enfermedad.
OBSERVACION CLINICA
Paciente varón de 68 años de edad, sin alergias medicamentosas conocidas ni antecedentes familiares de relevancia, pero con antecedentes personales de espondilitis anquilosante, sin tratamiento, e hipertensión arterial que requería tratamiento con 2 fármacos hipotensores (metoprolol y lecardipino). Fue intervenido previamente de una hernia inguinal izquierda.
Acude a la consulta de gastroenterología por un cuadro de rectorragia de varios meses de evolución, sin repercusión analítica, hemodinámica ni de su estado general. En la exploración física no se detectó nada destacable; la palpación abdominal y el tacto rectal fueron normales.
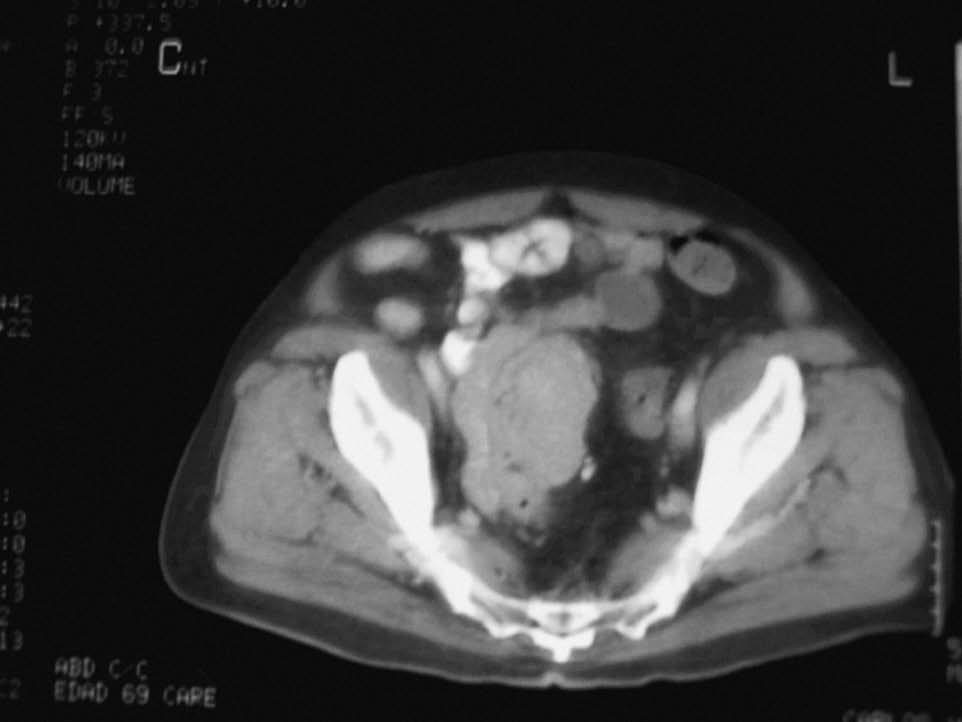
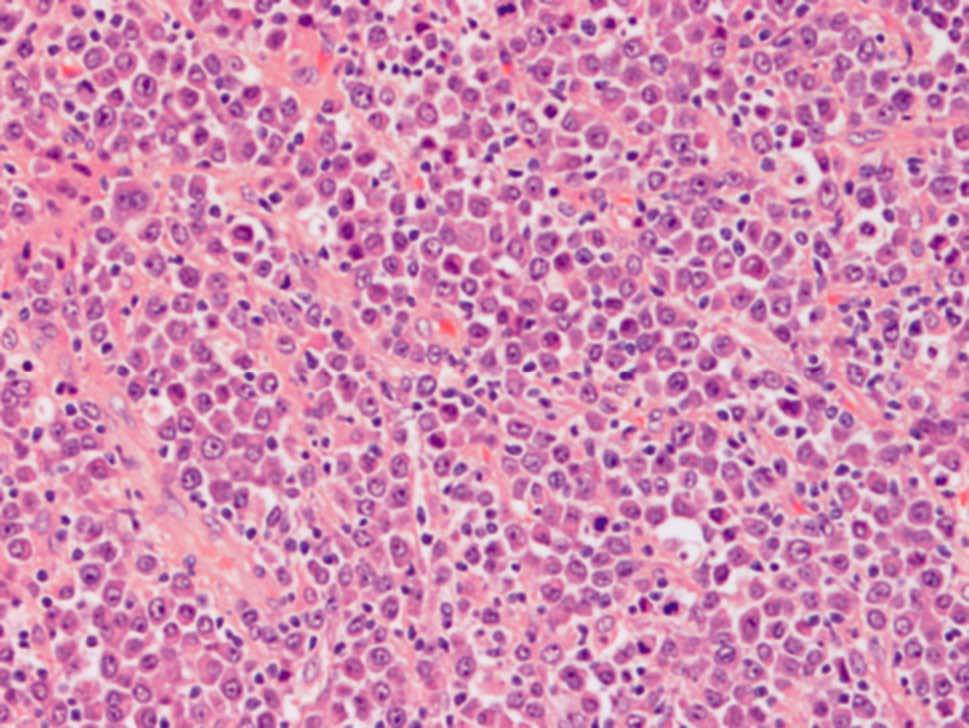
Se realizó una colonoscopia hasta el ciego, que puso de manifiesto la presencia de hemorroides externas-internas, diverticulosis en el colon izquierdo y una zona eritematosa algo sobreelevada, localizada a 25 cm, de unos 4-5 cm de extensión, con exudación de un líquido blanquecino de escasa cuantía, de la que se toman múltiples biopsias para estudio histológico. Ante la sospecha de una posible diverticulosis complicada se amplió el estudio con una analítica general, en la que destacaban los siguientes parámetros: hemoglobina 14,1 g/dl, hematocrito 43%, VCM 93 fl, plaquetas 334.000, leucocitos 7.460 (69% N, 19% L) TP 105%, velocidad de sedimentación globular 25 mm, proteína C reactiva (PCR) 42 mg/l, glucosa 107 mg/dl, creatinina 0,8 mg/dl, urea 29 mg/dl, BT 0,4 mg/dl, GOT 17 U/l, GPT 32 U/l, GGT 28 U/l, fosfatas alcalina 80 U/l, hierro 46 µg/dl, ferritina 183 ng/ml, albúmina 3,8 g/dl, CEA 2,3 ng/ml, Ca 9,5 mg/dl, IgA 205 mg/dl, IgG 1.340 mg/dl, IgM 68 mg/dl, proteínas totales 7 g/dl y B2 microglobulina 2,4 mg/l. Se realizó una tomografía computarizada (TC) abdominal, en la que llamaba la atención la presencia de una gran masa (fig. 1) de unos 10 cm de diámetro mayor, en contacto con el colon sigmoide y una ligera infiltración de la grasa circundante. El estudio histológico de las biopsias identificó una población clonal de células B IgG-K, y se diagnosticó un tumor de células plasmáticas IgG-K poco diferenciado (fig. 2). Con posterioridad, se completó el estudio por parte del servicio de hematología, que descartó una afección mielomatosa generalizada (mapa óseo sin focos líticos, ausencia de hipercalcemia, insuficiencia renal ni anemia, pequeño pico monoclonal en banda gamma. En los resultados de la biopsia de médula ósea, las células plasmáticas estaban por debajo del 1,2%. Se programó una posterior intervención quirúrgica, en la que se llevó cabo una sigmoidectomía. El estudio anatomopatológico de la pieza identificó una tumoración que derivaba desde la submucosa infiltrando las capas musculares y serosa hasta la grasa pericolónica, con escasa repercusión sobre la luz intestinal. Mediante un estudio microscópico se confirmó el diagnóstico previo establecido.
Fig. 1. Tomografía computarizada abdominopélvica: una masa de 10 cm dependiente de la pared sigmoidea infiltra la grasa pericolónica.
Fig. 2. Extensión de células plasmáticas de aspecto maduro procedentes de la tumoración colónica (tinción de HE).
La evolución clínica posterior del paciente fue satisfactoria, hasta que unos 2 meses después de la intervención presentó decaimiento, anorexia y, en los últimos días previo a su ingreso, fiebre. Ante la sospecha de una recidiva tumoral se ingresó al paciente, y se llevó a cabo un estudio analítico, en el que destacaba B2 microglobulina 9 mg/l, LDH 1.122 U/l, PCR 35,7 mg/l junto con una infección urinaria secundaria a Proteus mirabilis y de imagen. En la TC abdominal se identificaron imágenes compatibles con una recidiva tumoral en las cadenas ganglionares retroperitoneales y en el meso intestinal, confirmada mediante una biopsia de una de las lesiones. Se instauró tratamiento antibiótico y se inició tratamiento con melfalán y corticoides, con escasa resultado, por lo que el paciente falleció poco tiempo después.
DISCUSION
En la afección digestiva secundaria a una enfermedad derivada de células plasmáticas, hemos de diferenciar entre las lesiones benignas el denominado granuloma de células plasmáticas3, caracterizado por la proliferación policlonal de células plasmáticas, y las lesiones malignas, donde destacamos el PEM, la afección extramedular por mieloma múltiple4-6 (MM) y los procesos linfoproliferativos de estirpe B, en ocasiones difícilmente diferenciables de los anteriores.
El PEM se define por la existencia de un foco clonal de células plasmáticas fuera de la medula ósea7, generalmente de tipo IgA o IgG y cadenas ligeras K, sin evidencia de afección orgánica (ausencia de lesiones óseas, anemia, hipercalcemia o insuficiencia renal), de componente M (aunque hasta en un 25% de los casos puede estar presente en valores bajos) ni de afección medular (recuento de células plasmáticas tras la biopsia de médula ósea < 10%). Suele aparecer con mayor frecuencia en varones, la mayor parte de los casos entre la cuarta y la séptima décadas de la vida. Su localización más habitual es la zona aerodigestiva alta1 (cavidad nasal, senos paranasales, hipofaringe...) y representa cerca del 90% de los casos. El 10% restante presenta una gran variabilidad de localizaciones1, principalmente cutáneas, urológicas y, sobre todo, digestivas.
La afección digestiva por PEM, aunque de escasa frecuencia, es muy extensa en cuanto a su localización. Se han descrito casos en casi cualquier órgano (esófago8, páncreas9, hígado...), aunque la afección gástrica10 (relacionada en algunas publicaciones con la infección por Helicobacter pylori11) y la afección colónica son las más habituales. Al llevar a cabo una revisión de la literatura médica (Medline y Pubmed) en relación con esta patología, no identificamos más de una treintena de casos desde que se llevó a cabo la primera publicación sobre esta patología, en 190512, hasta la actualidad. La mayor parte de los casos están publicados como casos clínicos únicos. El estudio de Alexiou et al1 es el más extenso publicado hasta el momento en cuanto al número de casos recogidos. En él se incluyen todas las publicaciones en relación con el PEM entre 1905 y 1999, y se revisan 400 publicaciones que incluyen un total de 895 casos, de los cuales 155 eran PEM fuera de la zona areodigestiva alta, y de éstos, 24 afectaban al colon. En dicha búsqueda hemos localizado un único caso publicado en nuestro país de un PEM mesentérico en un paciente trasplantado hepático13, por lo que según nuestros conocimientos, éste podría tratarse del primero publicado de localización colónica.
Desde el punto de vista clínico, su presentación es muy variable: desde formas completamente asintomáticas hasta otras que se presentan como hemorragias digestivas o dolor abdominal14, e incluso como una obstrucción intestinal15,16. Endoscópicamente, la situación es similar: oscila entre un hallazgo endoscópico17 (o más bien histológico) y formas que asemejan un adenocarcinoma colónico18,19.
Una vez diagnosticado, es importante descartar que se trate de una manifestación de MM, lo cual puede ocurrir en un 4-5% de los casos. Para ello, hemos de realizar un conjunto de estudios encaminados a descartarlo7 (analítica general, mapa óseo, inmunoelectroforesis en suero y orina, biopsia de médula ósea). Ello es importante, tanto desde el punto de vista del tratamiento ya que como veremos a continuación en el PEM el tratamiento en la mayor parte de los casos es local, mientras en el caso de MM es necesario añadir tratamiento sistémico con quimioterapia siempre como del pronóstico, mucho peor en los casos de MM con afección extramedular (inferior a 24 meses tras el diagnóstico4).
El tratamiento del PEM20 depende de su localización, tamaño y grado histológico. En los localizados en la zona aerodigestiva superior se recomienda el tratamiento radioterápico (40-50 Gy divididos en 20-25 sesiones en relación con un tamaño tumoral superior o no a 5 cm), obteniéndose respuestas cercanas al 100% y una escasa frecuencia de recidivas21,22. Cuando se localizan fuera de esta zona, el tratamiento de elección generalmente es quirúrgico1, siempre que sea posible la extirpación completa del tumor, añadiendo tratamiento radioterápico (si márgenes afectados) y/o quimioterapia (si es mayor de 5 cm, se produce una recidiva o hay refractariedad tumoral). El tratamiento con quimioterapia es idéntico al utilizado en el MM20, corticoides asociados a melfalán o ciclofosfamida; se reserva la talidomida23 para casos refractarios, aunque ésta ha presentado escasos resultados hasta el momento.
El pronóstico de estos tumores suele ser bueno, y se consiguen supervivencias superiores al 65% a los 10 años. La recidiva, si se produce, suele localizarse en los ganglios linfáticos o localmente; son raras las metástasis a distancia. Suelen aparecer generalmente tras 2-3 años de seguimiento. Además de por su posible aparición, es importante el seguimiento de por vida de estos pacientes, ya que cerca de un 15% desarrollarán un MM7 (en el plasmocitoma óseo solitario esto ocurre hasta en un 50% de los casos), incluso hasta 15 años después de su diagnóstico24.
El cuadro clínico presentado nos llamó la atención tanto por su rareza (supuesto primer caso en nuestro centro) como por su evolución tras la intervención, ya que la recidiva tumoral apareció de forma muy precoz, produciendo una afectación generalizada de los ganglios retroperitoneales y el mesenterio, sin repuesta a la quimioterapia, que fue la causa del fallecimiento del paciente. Es posible que, dadas las dimensiones del tumor (según las guías un tumor de mas de 5 cm es de alto riesgo), dicho tratamiento debería haberse instaurado tras la cirugía, con lo cual dicha recidiva posiblemente se hubiera controlado.