La alteración en la expresión nuclear de proteínas de los genes reparadores del ADN valorada mediante inmunohistoquímica (IHQ) en el tejido tumoral es una técnica útil como cribado de síndrome de Lynch (SL). Una revisión reciente propone realizar este cribado no solo sobre todos los cánceres colorrectales (CCR) diagnosticados, sino también sobre adenomas avanzados (AA), especialmente en pacientes jóvenes.
ObjetivoEvaluación de la prevalencia de IHQ alterada realizada sobre todos los adenomas con displasia de alto grado (DAG) diagnosticados en nuestra comunidad durante 2011, y descripción de las variables asociadas a su alteración.
MétodosSe incluyeron todos los casos de pólipos adenomatosos con DAG diagnosticados desde los 3 laboratorios de anatomía patológica públicos de Navarra durante el año 2011, y se realizó un estudio estadístico para medir la asociación de diferentes variables, tanto de los pacientes como de las lesiones con la presencia de IHQ alterada.
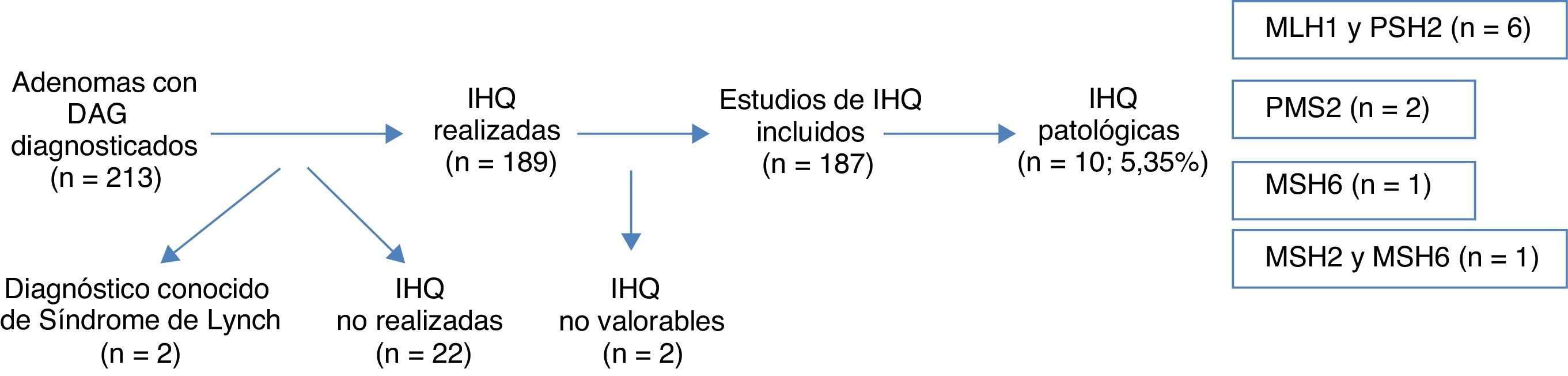
ResultadosSe diagnosticaron 213 adenomas de colon con DAG, excluyéndose del análisis posterior 26 (12,2%) casos (2 SL ya diagnosticados, 22 casos sin estudio IHQ y 2 casos con IHQ no valorable), siendo el número final 187. Se encontraron hallazgos patológicos en 10 casos, suponiendo el 5,35%: 6 casos en MLH1 y PMS2, 2 casos en PMS2, un caso en MSH6 y un caso en MSH2 y MSH6. La presencia sincrónica de CCR, la presencia de un único AA, la localización proximal de la DAG y la edad <50 años resultaron estadísticamente significativos en la asociación de dichas variables, con la expresión anómala de proteínas nucleares.
ConclusionesEl porcentaje de expresión nuclear patológica hallado en la IHQ es elevado, por lo que podría estar indicado realizar screening de rutina con IHQ en todas las DAG diagnosticadas, especialmente en pacientes jóvenes, con un único AA y con DAG proximal.
Alteration of mismatch repair system protein expression detected by immunohistochemistry (IHQ) in tumoural tissue is a useful technique for Lynch Syndrome (LS) screening. A recent review proposes LS screening through immunohistochemical study not only in all diagnosed cases of colorectal cancer (CRC) but also in advanced adenomas, especially in young patients.
ObjectiveTo assess the prevalence of altered IHQ carried out in all adenomas with high-grade dysplasia (HGD) diagnosed in our community in 2011, as well as the variables associated with this alteration.
MethodsWe included all the cases of adenomatous polyps with HGD diagnosed in the three public pathology laboratories of Navarre during 2011 and performed a statistical study to assess the association between different patient and lesion characteristics and altered IHQ results.
ResultsA total of 213 colonic adenomas with HGD were diagnosed, and 26 (12.2%) cases were excluded from the final analysis (2 known LS, 22 without IHQ study and 2 with inconclusive IHQ studies). The final number of adenomas included was 187. Pathologic results were found in 10 cases (5.35%)–6 cases in MLH1 and PMS2, 2 cases in PMS2, 1 case in MSH6 and 1 case in MSH2 and MSH6. The factors showing a statistically significant association with the presence of abnormal proteins were the synchronous presence of CRC, the presence of only one advanced adenoma, proximal location of HGD and age <50 years.
ConclusionsThe percentage of pathologic nuclear expression found in IHQ is high. Consequently, screening of all diagnosed HGD could be indicated, especially in young patients, with a single AA and proximal HGD.
El síndrome de Lynch es la forma hereditaria de cáncer colorrectal (CCR) más común, llegando a suponer el 2-5% del total de CCR diagnosticados1,2. El riesgo a lo largo de la vida en pacientes con dicho síndrome de desarrollar cáncer de colon o de otras localizaciones relacionadas (endometrio, estómago, intestino delgado, hepatobiliar, uréter y pelvis renal) se sitúa en torno al 70-80%, por lo que es importante la detección de los sujetos afectos. Se transmite de forma autosómica dominante y es causado por una mutación germinal en los genes de reparación del ADN (mismatch repair system, cuyo acrónimo en inglés es MMR) que provoca el cúmulo de errores en la replicación de ADN. Los genes más frecuentemente implicados son MLH1, MSH2, MSH6 y PMS2. El diagnóstico definitivo de esta entidad se realiza mediante secuenciación genética, pero dada la complejidad y el coste de dicho procedimiento se recomienda la realización previa de una técnica molecular de cribado sobre tejido tumoral: el estudio de inestabilidad de microsatélites (IMS) y/o la tinción mediante inmunohistoquímica (IHQ) de los productos de los genes responsables sobre las muestras de tejido tumoral3.
En los últimos años, gracias a los avances realizados en la detección y estudio molecular y genético, tanto de las lesiones preneoplásicas como del CCR, se considera el CCR como una enfermedad heterogénea, tanto en su patogénesis como en su manifestación clínica y respuesta al tratamiento4. Respecto a la tumorogénesis, en la actualidad se acepta la existencia de 3 vías de carcinogénesis: la vía de la inestabilidad cromosómica, la vía de la inestabilidad en microsatélites y la vía serrada.
Respecto a esta última se ha sugerido que puede ser la responsable de entre el 15% al 30% de los CCR, y se consideran como lesiones precursoras a los pólipos serrados (pólipos hiperplásicos, adenomas sésiles serrados [ASS] y adenomas serrados tradicionales)5. En algunos casos las alteraciones moleculares subyacentes a esta vía afectan a la región promotora de los genes MMR, especialmente al gen MLH-1, que conduce a una alteración de la expresión nuclear de MLH1 y PMS2 en la IHQ, y al desarrollo de IMS, de manera similar a la que se observa en un sujeto que presentara una mutación germinal en dicho gen. Por ello, es importante tenerlo en cuenta a la hora de interpretar la expresión nuclear patológica de MLH-1 y la IMS cuando se realiza un cribado molecular de SL. También recientemente se ha descrito un aumento del riesgo de presencia de IMS en los ASS, con un gradiente distal-proximal6. En la actualidad desconocemos si la presencia sincrónica de estos pólipos serrados se asocia con un aumento de riesgo de presentar expresión nuclear patológica de las proteínas MMR en los adenomas con displasia de alto grado (DAG).
En el año 2009 el grupo de trabajo de la Evaluation of Genomic Applications in Practice and Prevention incluyó en sus recomendaciones la realización de screening universal de SL con IMS o IHQ a todos los CCR diagnosticados7. Dicha estrategia ha sido implementada de forma irregular en los hospitales, presentando en diferentes estudios datos de IHQ/IMS anormales en torno al 12-21%2,8,9 aunque los porcentajes de inclusión en el screening están lejos de ser óptimos.
Más recientemente se ha abierto el debate sobre la utilidad de realizar este mismo cribado sobre lesiones preneoplásicas, es decir, sobre los adenomas convencionales. Algunos grupos han reportado resultados desalentadores acerca del estudio mediante IMS sobre adenomas de reciente instauración10. Sin embargo, estudios dirigidos a pacientes con mutación conocida para SL, a los cuales se les realiza estudio con IHQ y/o IMS sobre pólipos adenomatosos resecados, presentan porcentajes de alteración en dichos estudios de entre el 50% y 80%11–14. Estos últimos estudios señalan que no todos los adenomas tienen el mismo riesgo de presentar alteraciones en IHQ/IMS, sugiriendo realizar dicho estudio sobre adenomas con determinadas características (tamaño >10mm o presencia de DAG).
En una revisión de 2015, en la que se repasan los puntos clave para mejorar la detección precoz y prevención del CCR en familias de alto riesgo, se pone de relieve que no existen estudios en la actualidad que hayan evaluado la realización de una estrategia de cribado universal de SL en lesiones preneoplásicas, y sugieren como posible estrategia la realización de IHQ o IMS sobre adenomas avanzados (>1cm, componente velloso o DAG) en pacientes menores de 40 o 50 años15. Una vez revisada la bibliografía, que describe porcentajes cercanos al 100% de expresión patológica de proteínas MMR en adenomas con DAG en pacientes portadores de dicha mutación11,12, decidimos realizar nuestro estudio sobre este tipo concreto de pólipos.
El objetivo de este estudio es valorar la prevalencia de alteración de expresión nuclear de las proteínas reparadoras mediante la realización de un estudio inmunohistoquímico a todos los adenomas con DAG diagnosticadas en la Red Pública de la Comunidad Foral de Navarra, así como valorar las características de los pacientes con expresión patológica de estas proteínas y la posible asociación con PS sincrónicos.
Material y métodosSe trata de un estudio observacional, multicéntrico, retrospectivo de base poblacional, en el que se analizaron los datos correspondientes a todos los pacientes a los que se les detectó un adenoma avanzado con DAG mediante colonoscopia, pieza quirúrgica o autopsia realizada en el Servicio Público de Salud de Navarra en el año 2011.
InmunohistoquímicaRecogimos todos los casos de adenomas avanzados (AA) con DAG diagnosticados entre el 1 de enero y el 31 de diciembre de 2011 de los archivos de los 3 laboratorios de anatomía patológica. Se consideró como DAG los adenomas que presentaban displasia severa, adenocarcinoma in situ o adenocarcinoma intramucoso.
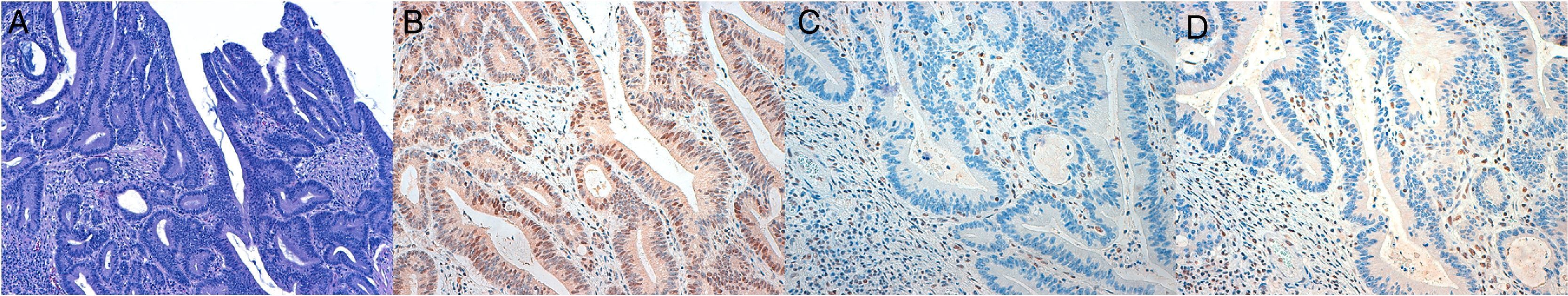
Se realizó estudio inmunohistoquímico para MLH1, MSH2, PMS2, MSH6 utilizando anticuerpos monoclonales prediluídos y concentrados de Leica-Biocare sobre tejido fijado en formol e incluido en parafina en cortes a 3μ. La tinción nuclear en las células tumorales se informó como presencia de expresión, y la negatividad de la misma como ausencia de expresión. Se utilizó de control interno positivo los linfocitos del tejido colónico no tumoral. Las tinciones inmunohistoquímicas fueron interpretadas por 4 patólogos con amplia experiencia en patología del tracto gastrointestinal.
Recogimos además datos epidemiológicos de los pacientes diagnosticados (edad, sexo), así como las características de la colonoscopia o de la pieza (presencia sincrónica de CCR, otros AA o pólipos serrados, morfología, localización y tamaño del pólipo a estudio). Consideramos localización proximal los pólipos que se encontraban proximales al colon descendente.
El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica de Navarra en 2011 (Proyecto 70/11) permitiendo la recogida anónima de los datos incluidos en el estudio.
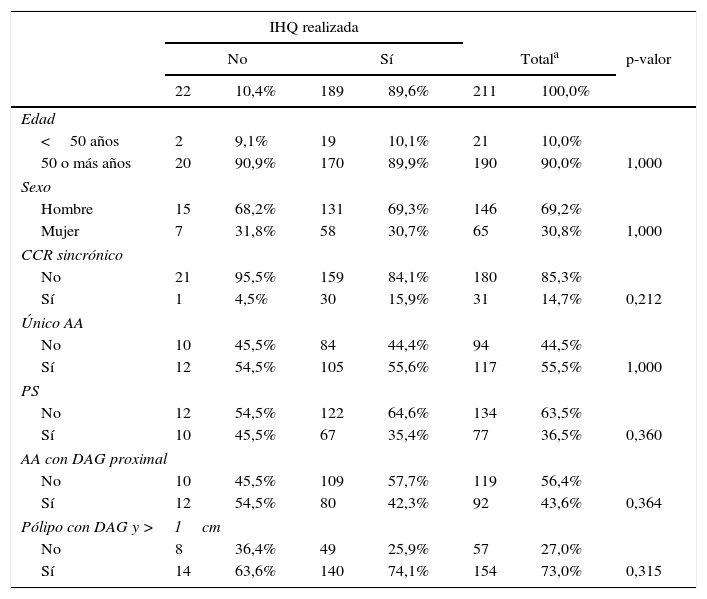
Estudio estadísticoTodos los registros de AA con DAG obtenidos fueron analizados con el programa estadístico SPSS versión 22.0. Inicialmente comprobamos que los pacientes a los que no se les había realizado el estudio con IHQ presentaban las mismas características en las variables de interés que los pacientes a los que sí se les había realizado, confirmando que los criterios de realización de la IHQ no seguían un patrón concreto (tabla 1).
Análisis descriptivo del total de la muestra del estudio y comparación de los casos con IHQ realizada y no realizada
| IHQ realizada | |||||||
|---|---|---|---|---|---|---|---|
| No | Sí | Totala | p-valor | ||||
| 22 | 10,4% | 189 | 89,6% | 211 | 100,0% | ||
| Edad | |||||||
| <50 años | 2 | 9,1% | 19 | 10,1% | 21 | 10,0% | |
| 50 o más años | 20 | 90,9% | 170 | 89,9% | 190 | 90,0% | 1,000 |
| Sexo | |||||||
| Hombre | 15 | 68,2% | 131 | 69,3% | 146 | 69,2% | |
| Mujer | 7 | 31,8% | 58 | 30,7% | 65 | 30,8% | 1,000 |
| CCR sincrónico | |||||||
| No | 21 | 95,5% | 159 | 84,1% | 180 | 85,3% | |
| Sí | 1 | 4,5% | 30 | 15,9% | 31 | 14,7% | 0,212 |
| Único AA | |||||||
| No | 10 | 45,5% | 84 | 44,4% | 94 | 44,5% | |
| Sí | 12 | 54,5% | 105 | 55,6% | 117 | 55,5% | 1,000 |
| PS | |||||||
| No | 12 | 54,5% | 122 | 64,6% | 134 | 63,5% | |
| Sí | 10 | 45,5% | 67 | 35,4% | 77 | 36,5% | 0,360 |
| AA con DAG proximal | |||||||
| No | 10 | 45,5% | 109 | 57,7% | 119 | 56,4% | |
| Sí | 12 | 54,5% | 80 | 42,3% | 92 | 43,6% | 0,364 |
| Pólipo con DAG y >1cm | |||||||
| No | 8 | 36,4% | 49 | 25,9% | 57 | 27,0% | |
| Sí | 14 | 63,6% | 140 | 74,1% | 154 | 73,0% | 0,315 |
AA: adenoma avanzado; CCR: cáncer colorrectal; DAG: displasia de alto grado; PS: pólipo serrado.
Posteriormente realizamos el estudio univariante, considerando como variable principal la alteración o no de la IHQ en el estudio mediante el test exacto de Fisher en el caso de variables dicotómicas (de 2 categorías) y el estadístico Chi cuadrado si se trataba de una variable categórica con más de 2 categorías y con valores esperados mayores de 5.
Finalmente, se realizó un análisis multivariante mediante regresión logística, siendo la alteración o no de la IHQ la variable dependiente. El modelo final seleccionado incluyó las variables que mejor discriminaban los casos de IHQ alterada.
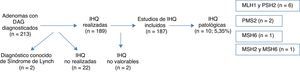
ResultadosA lo largo de 2011 se identificaron 213 pacientes con adenomas con DAG en los laboratorios de anatomía patológica de la red pública de la Comunidad Foral de Navarra. Dos de los casos se eliminaron del análisis por estar previamente diagnosticados de SL. Se realizó el estudio con IHQ en 189 casos (la realización de esta técnica aún no está completamente sistematizada para las DAG en nuestra comunidad), y comprobamos que la realización o no realización de la IHQ en la muestra no se asociara a ninguna característica concreta (tabla 1). Los resultados de la IHQ no fueron valorables en 2 casos, por lo que también fueron eliminados posteriormente del análisis (fig. 1).
De los 187 (87,8%) pacientes que finalmente fueron incluidos en el análisis el 69,0% (129) de los pacientes eran varones, mientras que el 31,0% (58) restante eran mujeres. La edad media de los pacientes estudiados fue de 67,4 años (DE: 11,89), con un rango que iba de 27 a 88 años. El 9,6% (18) de los casos eran pacientes <50 años, mientras que el 90,4% (169) restante eran mayores de esa edad.
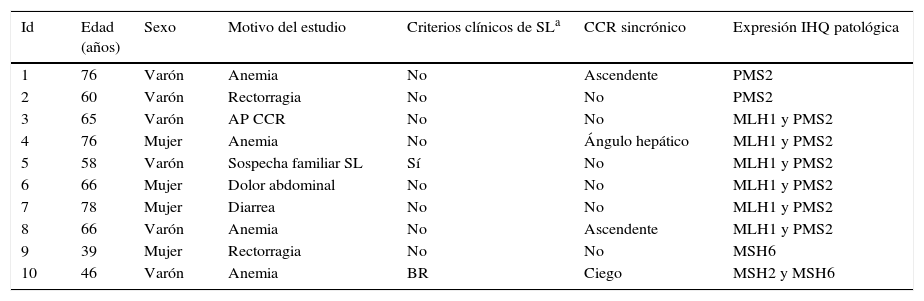
La expresión inmunohistoquímica nuclear fue patológica en 10 casos (5,35%), presentando alteración en MLH1 y PMS2 en 6 casos, 2 casos en PMS2 de manera aislada, un caso en MSH6 y un caso en MSH2 y MSH6 (figs. 1 y 2). Las características de los 10 pacientes con estudio alterado se recogen en la tabla 2. De los 10 casos con proteínas anómalas, 6 eran varones y 4 mujeres. En 4 de los casos se asoció un CCR de forma sincrónica. En 8 casos el motivo de realización de la colonoscopia fue la presencia de síntomas (4 por anemia, 2 por rectorragia, uno por dolor abdominal y otro por diarrea), mientras que en los 2 casos restantes los pacientes eran sometidos a programas de seguimiento (uno perteneciente a familia que cumplía criterios de SL y uno por seguimiento de CCR). El paciente perteneciente a la familia con dicho síndrome cumplía criterios clínicos de sospecha (Amsterdam II/Bethesda revisados), mientras que del resto de pacientes con IHQ patológicos (9 casos) únicamente uno de ellos cumplía los criterios de Bethesda revisados.
Descripción individualizada de los casos con IHQ alterada
| Id | Edad (años) | Sexo | Motivo del estudio | Criterios clínicos de SLa | CCR sincrónico | Expresión IHQ patológica |
|---|---|---|---|---|---|---|
| 1 | 76 | Varón | Anemia | No | Ascendente | PMS2 |
| 2 | 60 | Varón | Rectorragia | No | No | PMS2 |
| 3 | 65 | Varón | AP CCR | No | No | MLH1 y PMS2 |
| 4 | 76 | Mujer | Anemia | No | Ángulo hepático | MLH1 y PMS2 |
| 5 | 58 | Varón | Sospecha familiar SL | Sí | No | MLH1 y PMS2 |
| 6 | 66 | Mujer | Dolor abdominal | No | No | MLH1 y PMS2 |
| 7 | 78 | Mujer | Diarrea | No | No | MLH1 y PMS2 |
| 8 | 66 | Varón | Anemia | No | Ascendente | MLH1 y PMS2 |
| 9 | 39 | Mujer | Rectorragia | No | No | MSH6 |
| 10 | 46 | Varón | Anemia | BR | Ciego | MSH2 y MSH6 |
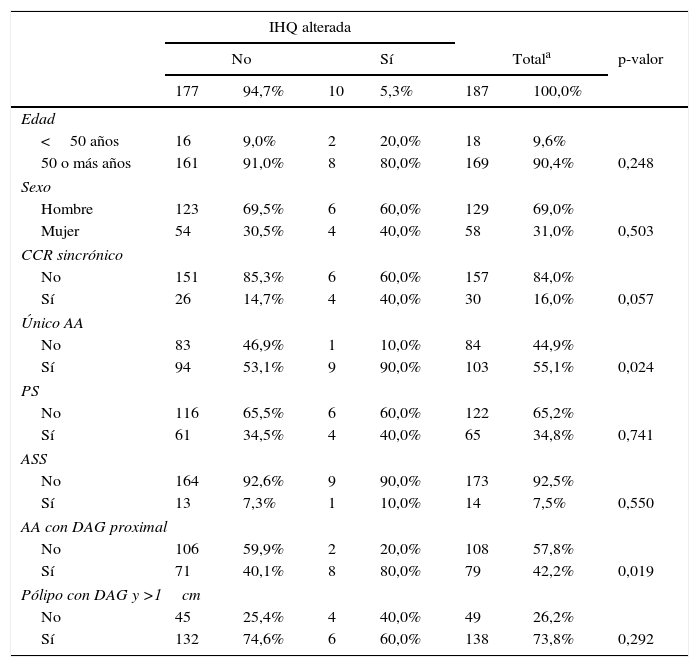
En el análisis univariante se observó una asociación significativa entre la alteración nuclear IHQ y la presencia de un único AA, así como la localización proximal de los pólipos con DAG. La presencia de CCR sincrónico mostraba resultados próximos a la significación estadística, por lo que se añadió posteriormente en el modelo multivariante. Por el contrario, la edad, el sexo, la presencia de pólipos serrados en general, y de manera específica los ASS y el tamaño del pólipo mayor a 1cm, no resultaron significativos (tabla 3).
Análisis univariante de la alteración en la IHQ
| IHQ alterada | |||||||
|---|---|---|---|---|---|---|---|
| No | Sí | Totala | p-valor | ||||
| 177 | 94,7% | 10 | 5,3% | 187 | 100,0% | ||
| Edad | |||||||
| <50 años | 16 | 9,0% | 2 | 20,0% | 18 | 9,6% | |
| 50 o más años | 161 | 91,0% | 8 | 80,0% | 169 | 90,4% | 0,248 |
| Sexo | |||||||
| Hombre | 123 | 69,5% | 6 | 60,0% | 129 | 69,0% | |
| Mujer | 54 | 30,5% | 4 | 40,0% | 58 | 31,0% | 0,503 |
| CCR sincrónico | |||||||
| No | 151 | 85,3% | 6 | 60,0% | 157 | 84,0% | |
| Sí | 26 | 14,7% | 4 | 40,0% | 30 | 16,0% | 0,057 |
| Único AA | |||||||
| No | 83 | 46,9% | 1 | 10,0% | 84 | 44,9% | |
| Sí | 94 | 53,1% | 9 | 90,0% | 103 | 55,1% | 0,024 |
| PS | |||||||
| No | 116 | 65,5% | 6 | 60,0% | 122 | 65,2% | |
| Sí | 61 | 34,5% | 4 | 40,0% | 65 | 34,8% | 0,741 |
| ASS | |||||||
| No | 164 | 92,6% | 9 | 90,0% | 173 | 92,5% | |
| Sí | 13 | 7,3% | 1 | 10,0% | 14 | 7,5% | 0,550 |
| AA con DAG proximal | |||||||
| No | 106 | 59,9% | 2 | 20,0% | 108 | 57,8% | |
| Sí | 71 | 40,1% | 8 | 80,0% | 79 | 42,2% | 0,019 |
| Pólipo con DAG y >1cm | |||||||
| No | 45 | 25,4% | 4 | 40,0% | 49 | 26,2% | |
| Sí | 132 | 74,6% | 6 | 60,0% | 138 | 73,8% | 0,292 |
AA: adenoma avanzado; ASS: adenoma sésil serrado; CCR: cáncer colorrectal; DAG: displasia de alto grado; PS: pólipo serrado.
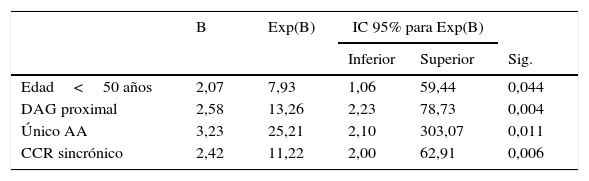
En la tabla 4 se muestran los resultados del análisis multivariante mediante regresión logística. El modelo incluyó todas las variables que resultaron ser estadísticamente significativas en el estudio univariante, así como la presencia de CCR sincrónico y la edad (a pesar de no alcanzar significación en el estudio univariante su asociación con el SL es bien conocida). Se incluyeron en el modelo final las variables edad menor de 50 años, la presencia de CCR sincrónico, presencia de un único AA y la localización proximal de los pólipos con DAG.
Regresión logística con IHQ alterada o no como variable dependiente
| B | Exp(B) | IC 95% para Exp(B) | |||
|---|---|---|---|---|---|
| Inferior | Superior | Sig. | |||
| Edad<50 años | 2,07 | 7,93 | 1,06 | 59,44 | 0,044 |
| DAG proximal | 2,58 | 13,26 | 2,23 | 78,73 | 0,004 |
| Único AA | 3,23 | 25,21 | 2,10 | 303,07 | 0,011 |
| CCR sincrónico | 2,42 | 11,22 | 2,00 | 62,91 | 0,006 |
AA: adenoma avanzado; CCR: cáncer colorrectal; DAG: displasia de alto grado.
En nuestra población observamos una prevalencia del 5,35% de expresión nuclear patológica de proteínas de los genes reparadores de ADN en los casos de nuevo diagnóstico de adenoma avanzado con DAG. Aunque es una cifra inferior a la descrita en los casos incidentales de cáncer colorrectal (12-21%)2,8,9, supone un porcentaje considerable, dado que nosotros solo analizamos casos con adenomas con displasia de alto grado.
Este es el primer estudio de base poblacional que valora la prevalencia de alteración de la expresión nuclear de IHQ en los adenomas con DAG. Los estudios previamente realizados sobre lesiones precancerosas se ceñían únicamente a pacientes ya diagnosticados de SL11–14, a adenomas en general sin ningún criterio de selección16, a subgrupos de pacientes jóvenes (<40 años)17,18 o el estudio se realizaba sin el panel completo de los 4 marcadores inmunohistoquímicos19. En la revisión publicada en 2015 por Patel et al.15, para mejorar la detección precoz y la prevención de CCR, se sugiere realizar cribado de SL en adenomas avanzados cuya probabilidad pretest sea alta (población menor de 40 o 50 años).
En nuestro estudio observamos que la edad temprana de aparición de la displasia (<50 años, coincidiendo con el punto de corte que postulan los criterios de Amsterdam II y Bethesda revisados), la presencia sincrónica de CCR y la presencia de un único AA se asocian de forma significativa con expresión nuclear anormal de proteínas reparadoras. Se conoce que la aparición de adenomas es relativamente infrecuente en pacientes menores de 50 años, tanto en la población general como en portadores de SL13,20, aunque en el caso del SL estos evolucionan de manera rápida y agresiva hacia la displasia y el cáncer. De este modo, microadenomas que pueden aparecer esporádicamente a edades tempranas y permanecer quiescentes durante años en la población general, presentan una malignización acelerada y agresiva en el caso de estar afecto de SL11. El hecho de que en los pacientes afectos de SL la malignización sea más rápida puede explicar el hecho de que encontremos alteración IHQ en pacientes más jóvenes. Asimismo, el hecho de encontrar un único adenoma o un CCR sincrónico como factor de riesgo se entiende en el contexto de que no es el número de lesiones el que está alterado en el SL, sino la rapidez de su evolución. Un paciente que no presentara dicho síndrome podría permanecer años con uno o 2 microadenomas quiescentes, pero el hecho de tener alterado el sistema MMR puede hacer que dichas lesiones vayan evolucionando hacia la DAG y el CCR. Sin embargo, dado que desconocemos el estudio genético de estos 10 pacientes con alteración IHQ y el estado del gen BRAFV600 no podemos llegar a conclusiones estrictas, sino tomar estos hallazgos con cautela y esperar a estudios más contundentes.
Otro factor de riesgo para presentar una IHQ nuclear patológica en nuestra serie fue la localización en el colon derecho de los pólipos con DAG. Estos resultados concuerdan con un estudio indio realizado en 201116 sobre adenomas en la población general, estudiados mediante IHQ, que reporta mayor tendencia a presentar resultados patológicos si el pólipo se localiza en el colon derecho. Este hecho, asimismo, concuerda con la evidencia científica conocida hasta el momento, que describe una mayor tendencia a presentar CCR en el colon derecho en los pacientes afectos de SL11, por lo que es lógico que sus lesiones precursoras también lo hagan.
A pesar de encontrar asociación entre la presencia de CCR sincrónico y la alteración de IHQ en los adenomas con DAG, este dato no es muy relevante para la práctica diaria, ya que se ha demostrado que dicho análisis es más sensible en los CCR, por lo que no supone ningún cambio en las recomendaciones actuales.
Otro hallazgo a destacar en nuestro estudio fue la realización rutinaria de IHQ para proteínas reparadoras de ADN en casi el 90% de los casos con displasia de alto grado. Aunque se pone de relieve que la adherencia a dicha práctica fue incompleta, sí alcanzó porcentajes superiores a los descritos previamente en otros estudios realizados en muestras tumorales, superando ampliamente al mejor de los resultados obtenidos por Marquez et al.2, que se sitúa en torno al 76%.
Un punto fuerte de nuestro estudio fue el diseño poblacional del estudio, que permitió reclutar un amplio número de casos.
Entre las limitaciones de nuestro estudio cabe destacar la existencia de un posible sesgo interobservador de interpretación de la IHQ, a pesar de la experiencia de los patólogos que la realizaron. Otra de las limitaciones es que el número de casos en nuestra serie con alteración de la IHQ es escaso, por lo que los resultados deben ser interpretados con cautela. Finalmente, la carencia de los resultados del estudio genético y molecular (IMS, estado CIMP, mutación BRAFV600) de nuestros casos en el momento actual no nos permiten describir el rendimiento diagnóstico del cribado de SL mediante IHQ, ni la distinción de expresión patológica de proteínas reparadoras de ADN por otras causas. En este sentido sería interesante la realización de nuevos estudios enfocados a dicha confirmación diagnóstica para conocer el rendimiento de la estrategia universal del cribado de SL mediante IHQ en los casos de adenoma con DAG en la práctica habitual.
ConclusiónLa prevalencia de expresión nuclear patológica de las proteínas de los genes reparadores de ADN en pacientes con adenomas que presentan DAG en nuestra serie fue elevada (5,35%). Estos datos sugieren una posible estrategia de detección precoz de SL mediante estudio IHQ en determinados pacientes diagnosticados de AA con DAG (jóvenes, localización proximal de la DAG y/o un único AA en la colonoscopia). Sería interesante desarrollar nuevos estudios que aportaran más datos para confirmar la indicación de la realización de dicho cribado en los casos descritos.
Conflicto de interesesLos autores declaran que no hay ningún conflicto de intereses.