No hay datos sistemáticos sobre cuáles son las tasas de resistencia a antibióticos tras el fracaso de un primer tratamiento erradicador. El objetivo del estudio es determinar la prevalencia de las resistencias secundarias a los antibióticos mediante una revisión sistemática de estudios que evaluaban las resistencias secundarias de Helicobacter pylori. Se identificaron 31 estudios (2.787 pacientes). Se determinaron resistencias en 1.764 pacientes. El 99,1% de los pacientes recibieron claritromicina como tratamiento de primera línea, y un 58,7% desarrollaron resistencias. El 24,3% de los pacientes recibieron metronidazol, desarrollando resistencias el 89,7%. La resistencia secundaria a amoxicilina fue excepcional. Las resistencias secundarias tras un primer tratamiento son muy elevadas. Estos hallazgos dan soporte a la recomendación de no repetir claritromicina o metronidazol tras el fracaso de un primer tratamiento erradicador.
There are no systematic data on the rates of antibiotic resistance after the failure of a first eradication treatment. The objective of this study was to determine the prevalence of secondary resistance to antibiotics by conducting a systematic review of studies evaluating the secondary resistance of Helicobacter pylori. We identified 31 studies (2,787 patients). Resistance was determined in 1,764 patients. A percentage of 99.1 of patients received clarithromycin as first-line treatment and 58.7% developed resistance. A percentage of 24.3 received metronidazole and 89.7% developed resistance. Secondary resistance to amoxicillin was extremely rare. Secondary resistance after first-line treatment was very common. These findings support the recommendation not to repeat clarithromycin or metronidazole after the failure of a first eradication treatment.
Helicobacter pylori es una de las infecciones humanas más frecuentes. Se estima que aproximadamente el 50% de la población mundial está infectada de forma crónica por H. pylori. La infección se asocia con enfermedades gastrointestinales significativas, como la úlcera péptica, la gastritis crónica, la dispepsia funcional, el linfoma del tejido linfoide asociado a la mucosa gástrica y el cáncer gástrico1,2. Desde el descubrimiento de la infección por H. pylori en 19823, se han descrito múltiples opciones terapéuticas. Hasta hace poco, el tratamiento estándar ha sido la terapia triple que incluía 2 antibióticos (claritromicina, y amoxicilina o metronidazol) y un inhibidor de la bomba de protones4. Sin embargo, la eficacia de este tratamiento ha disminuido, principalmente debido a la resistencia a claritromicina y metronidazol. En este sentido, la tasa de resistencia a la claritromicina ha aumentado a más del 20% en muchos países5. Debido a los malos resultados de la triple terapia, las directrices actuales han cambiado sus recomendaciones a terapias cuádruples más largas y complejas6–9. Aunque los nuevos tratamientos logran mejores tasas de curación que la triple terapia, el tratamiento de primera línea para H. pylori todavía fracasa en aproximadamente el 10-20% de los pacientes4.
En la mayoría de los consensos se afirma que la resistencia de H. pylori a los antibióticos es muy elevada tras el fracaso de un primer tratamiento erradicador4,9. Sin embargo, este dato se basa en pocos estudios, que combinan la evaluación de resistencias primarias y secundarias8,10–12. En nuestro conocimiento, no se ha realizado ninguna revisión sistemática en la que se analice la tasa de resistencias secundarias tras el fracaso de una primera línea de tratamiento erradicador (inhibidor de la bomba de protones, amoxicilina y claritromicina). Conocer exactamente estas tasas de resistencia puede ser extremadamente útil para diseñar tratamientos de segunda y tercera línea.
En una revisión sistemática realizada recientemente por nuestro grupo, se evaluó la efectividad de las terapias de segunda línea para la erradicación de H. pylori13. El estudio mostró que pocos tratamientos logran tasas de curación de más del 90%. Además, ningún tratamiento individual alcanzó resultados excelentes de manera consistente. Una parte de los estudios incluidos en la revisión sistemática citada reportan las resistencias a los antibióticos tras el fracaso del tratamiento inicial y permiten estimar las tasas de resistencias secundarias para los antibióticos más comúnmente utilizados.
El objetivo de este estudio es, por lo tanto, realizar una evaluación sistemática para determinar la prevalencia de resistencias a los antibióticos tras el fracaso del tratamiento de primera línea de la infección por H. pylori.
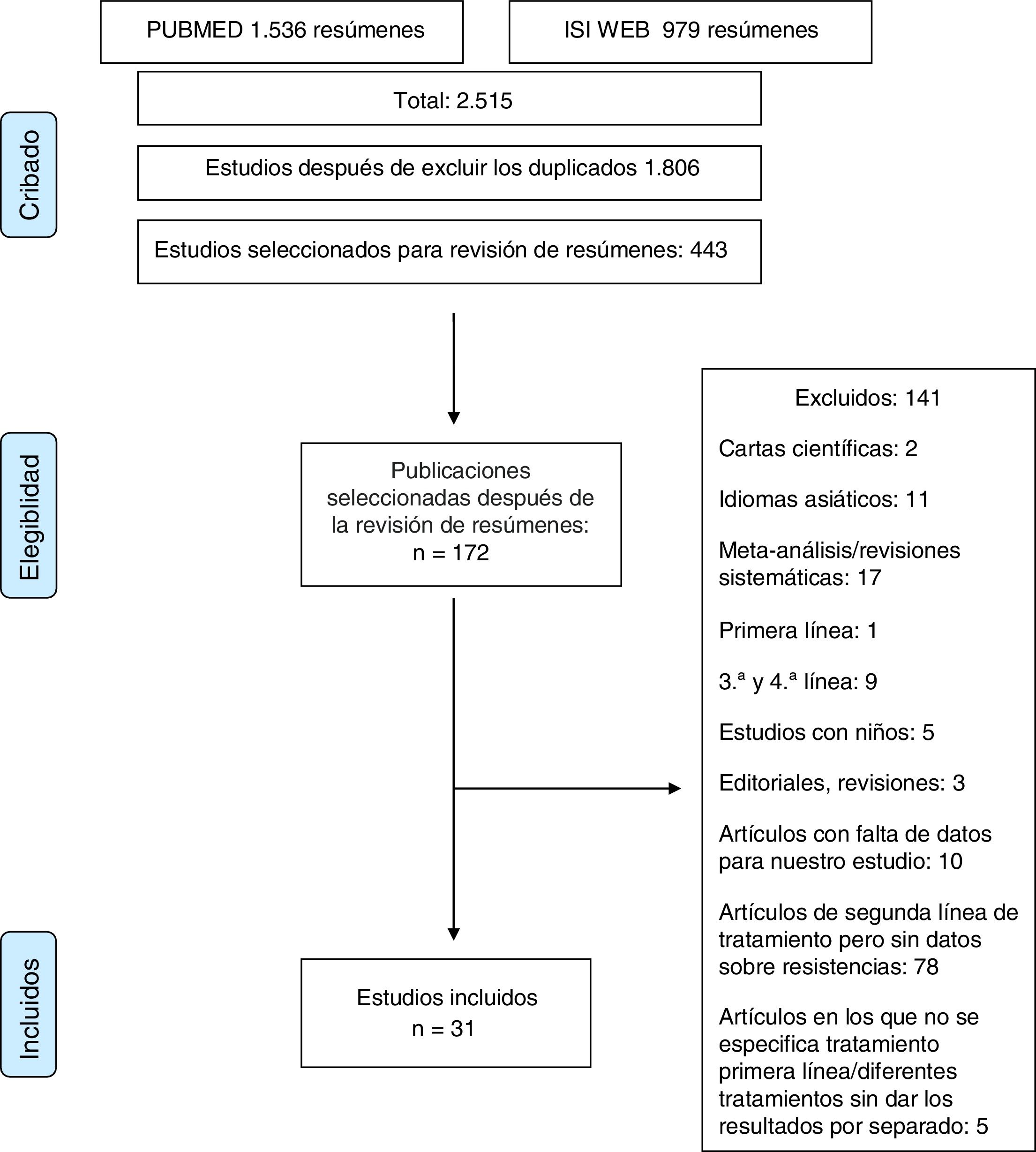
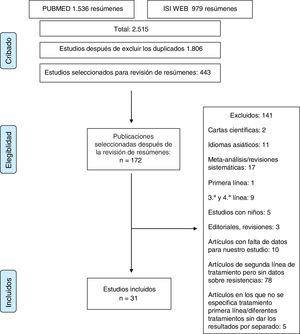
Material y métodosEl estudio se realizó de acuerdo con las normas de las declaraciones PRISMA14 y MOOSE15 para revisiones sistemáticas y metaanálisis. La lista de verificación de MOOSE se muestra en el anexo 1 y el diagrama de flujo de PRISMA en la figura 1.
Se realizó una búsqueda sistemática de la literatura limitada a artículos publicados en texto completo en PubMed y el ISI Web of Knowledge de 1996 a junio de 2015. Las referencias en los artículos seleccionados, las revisiones sistemáticas y las bases de datos personales de los autores también se revisaron. Las estrategias de búsqueda fueron ((second line OR rescue OR failure) AND pylori)) en PubMed, y Title=(pylori) y Title=(second line or rescue) en el ISI Web of Knowledge.
Criterios de inclusiónSe incluyeron artículos publicados de texto completo que cumplían los siguientes criterios: a) ensayos clínicos aleatorizados o casi aleatorizados o estudios observacionales; b) que evaluaran el tratamiento de rescate después de un primer fracaso del tratamiento para H. pylori, y c) estudios que realizaban determinación de resistencias. Solo se incluyeron artículos publicados en español, italiano, francés e inglés.
Criterios de exclusiónLos criterios de exclusión fueron: artículos en idiomas asiáticos, publicaciones duplicadas, cartas al editor, opiniones de expertos y reseñas.
Extracción de datosLos datos fueron extraídos de forma independiente por 2 de los autores (NM y XC). La decisión de incluir o excluir los estudios la tomaron los 2 autores por separado. Las disconformidades se resolvieron por consenso. El acuerdo entre los 2 autores que seleccionaron los artículos relevantes fue superior al 90%. La extracción de datos se estandarizó utilizando una tabla de extracción de datos y se realizó de forma independiente para cada estudio por los 2 autores. Los datos se revisaron en caso de desacuerdo y, de ser necesario, se consensuaron. Las variables compiladas para el presente estudio fueron: año de publicación, país donde se realizó el estudio, número de pacientes, número de cultivos y método para determinar resistencias y tasas de resistencia según el tratamiento previo administrado y las de resistencia a los antibióticos tras el fracaso de primera línea.
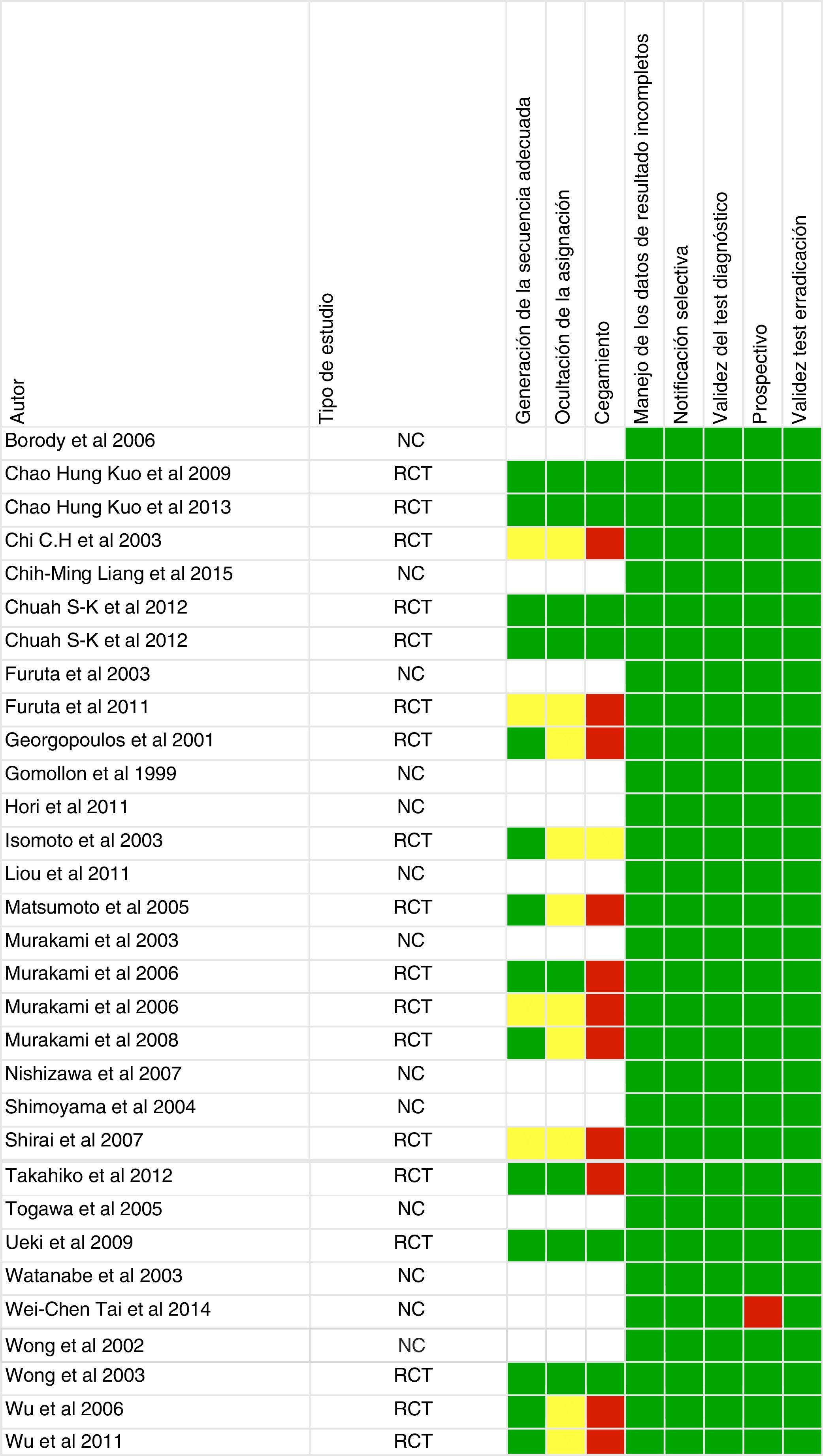
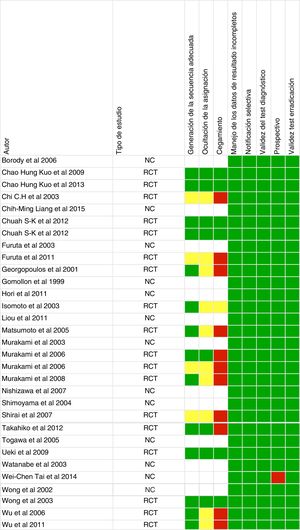
Riesgo de sesgoDos revisores (NM y JSD) evaluaron de forma independiente el riesgo de sesgo de acuerdo con las recomendaciones actuales de la Colaboración Cochrane para ensayos clínicos aleatorizados y las sugerencias de la Guía de Métodos para la Efectividad y las Revisiones comparativas de efectividad para estudios observacionales16. Las discrepancias en la interpretación se resolvieron con un tercer revisor (XC).
ResultadosSe obtuvieron más de 2.000 artículos con la búsqueda original. Después de la revisión de los resúmenes, se evaluaron 172 artículos en texto completo para determinar su elegibilidad. Los estudios duplicados fueron excluidos. Tras una evaluación cuidadosa, se seleccionaron 31 artículos17–47 (2.787 pacientes) que realizaban determinaciones de sensibilidad y analizaban tasas de resistencia.
Estudios excluidosCiento cuarenta y un estudios fueron finalmente excluidos, por las siguientes razones: 1) estudios que incluyeron pacientes pediátricos; 2) artículos que informaron solo resultados para pacientes en tratamiento de primera, tercera o cuarta línea; 3) artículos en idiomas asiáticos; 4) cartas al editor o editoriales o revisiones del tratamiento de H. pylori; 5) artículos en los que los datos proporcionados no permitieron la evaluación de la elegibilidad del estudio o la extracción de datos, y 6) artículos sobre tratamientos de segunda línea sin datos sobre resistencias o sin datos sobre el tratamiento de primera línea (anexo 2).
Estudios incluidosTreinta y un artículos que describían la tasa de resistencia tras el fracaso de un primer tratamiento erradicador (2.787pacientes) se incluyeron en la revisión sistemática.
Calidad de los estudiosLa evaluación del riesgo de sesgo se proporciona en la figura 2. De los 31 artículos, 18 fueron ensayos controlados aleatorizados, 12 fueron observacionales y uno fue retrospectivo.
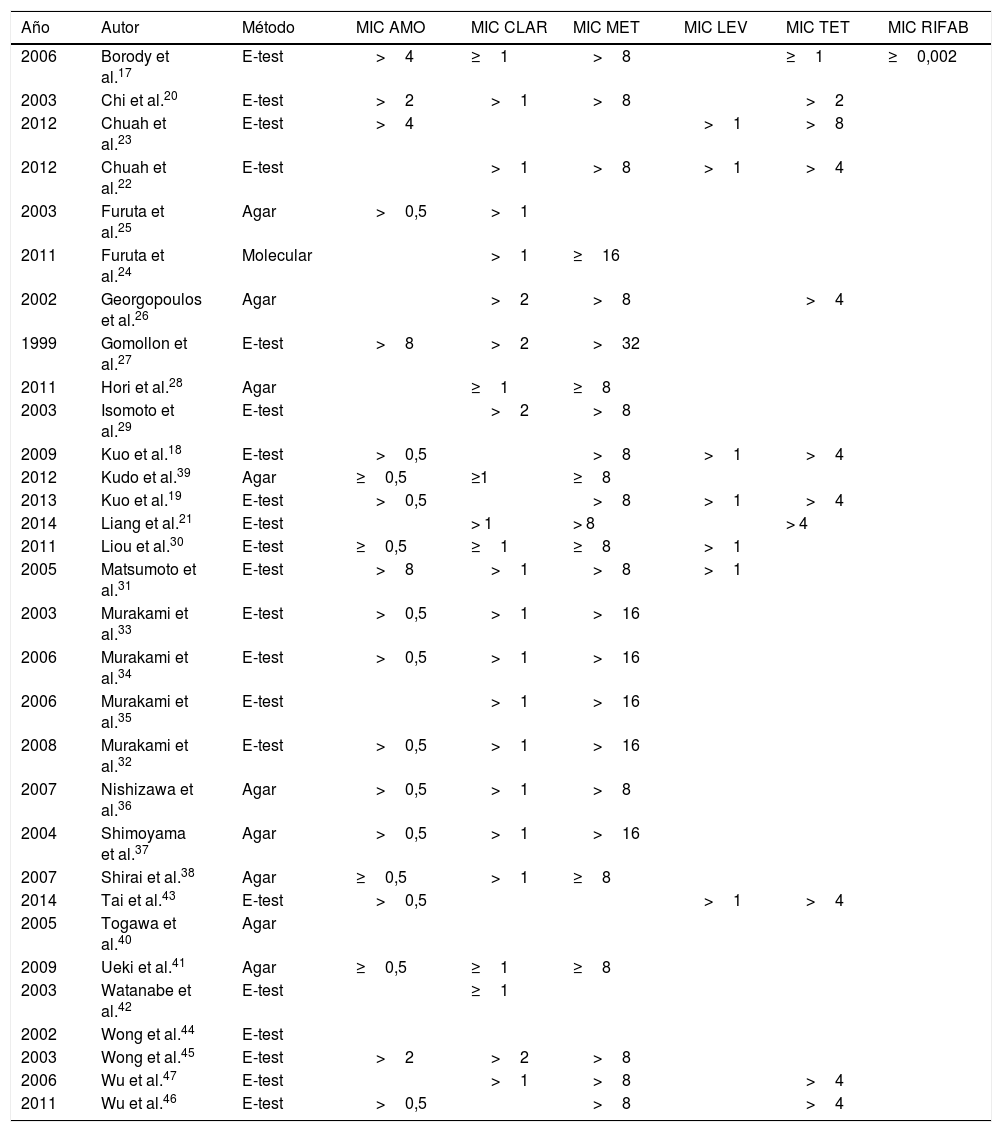
Tasas de resistencia a antibióticos utilizados en primera líneaEn total, se analizaron en nuestra revisión 2.787 pacientes; de estos, se determinaron las resistencias antes del segundo tratamiento en 1.764 (63,3%). Se muestran detalles adicionales en el método para determinar las resistencias y MIC evaluadas en la tabla 1.
Artículos de la revisión. Métodos de determinación de resistencias
| Año | Autor | Método | MIC AMO | MIC CLAR | MIC MET | MIC LEV | MIC TET | MIC RIFAB |
|---|---|---|---|---|---|---|---|---|
| 2006 | Borody et al.17 | E-test | >4 | ≥1 | >8 | ≥1 | ≥0,002 | |
| 2003 | Chi et al.20 | E-test | >2 | >1 | >8 | >2 | ||
| 2012 | Chuah et al.23 | E-test | >4 | >1 | >8 | |||
| 2012 | Chuah et al.22 | E-test | >1 | >8 | >1 | >4 | ||
| 2003 | Furuta et al.25 | Agar | >0,5 | >1 | ||||
| 2011 | Furuta et al.24 | Molecular | >1 | ≥16 | ||||
| 2002 | Georgopoulos et al.26 | Agar | >2 | >8 | >4 | |||
| 1999 | Gomollon et al.27 | E-test | >8 | >2 | >32 | |||
| 2011 | Hori et al.28 | Agar | ≥1 | ≥8 | ||||
| 2003 | Isomoto et al.29 | E-test | >2 | >8 | ||||
| 2009 | Kuo et al.18 | E-test | >0,5 | >8 | >1 | >4 | ||
| 2012 | Kudo et al.39 | Agar | ≥0,5 | ≥1 | ≥8 | |||
| 2013 | Kuo et al.19 | E-test | >0,5 | >8 | >1 | >4 | ||
| 2014 | Liang et al.21 | E-test | > 1 | > 8 | > 4 | |||
| 2011 | Liou et al.30 | E-test | ≥0,5 | ≥1 | ≥8 | >1 | ||
| 2005 | Matsumoto et al.31 | E-test | >8 | >1 | >8 | >1 | ||
| 2003 | Murakami et al.33 | E-test | >0,5 | >1 | >16 | |||
| 2006 | Murakami et al.34 | E-test | >0,5 | >1 | >16 | |||
| 2006 | Murakami et al.35 | E-test | >1 | >16 | ||||
| 2008 | Murakami et al.32 | E-test | >0,5 | >1 | >16 | |||
| 2007 | Nishizawa et al.36 | Agar | >0,5 | >1 | >8 | |||
| 2004 | Shimoyama et al.37 | Agar | >0,5 | >1 | >16 | |||
| 2007 | Shirai et al.38 | Agar | ≥0,5 | >1 | ≥8 | |||
| 2014 | Tai et al.43 | E-test | >0,5 | >1 | >4 | |||
| 2005 | Togawa et al.40 | Agar | ||||||
| 2009 | Ueki et al.41 | Agar | ≥0,5 | ≥1 | ≥8 | |||
| 2003 | Watanabe et al.42 | E-test | ≥1 | |||||
| 2002 | Wong et al.44 | E-test | ||||||
| 2003 | Wong et al.45 | E-test | >2 | >2 | >8 | |||
| 2006 | Wu et al.47 | E-test | >1 | >8 | >4 | |||
| 2011 | Wu et al.46 | E-test | >0,5 | >8 | >4 |
AMO:amoxicilina; CLAR: claritromicina; LEV: levofloxacino; MET: metronidazol; MIC: concentración mínima inhibitoria; RIFAB: rifabutina.
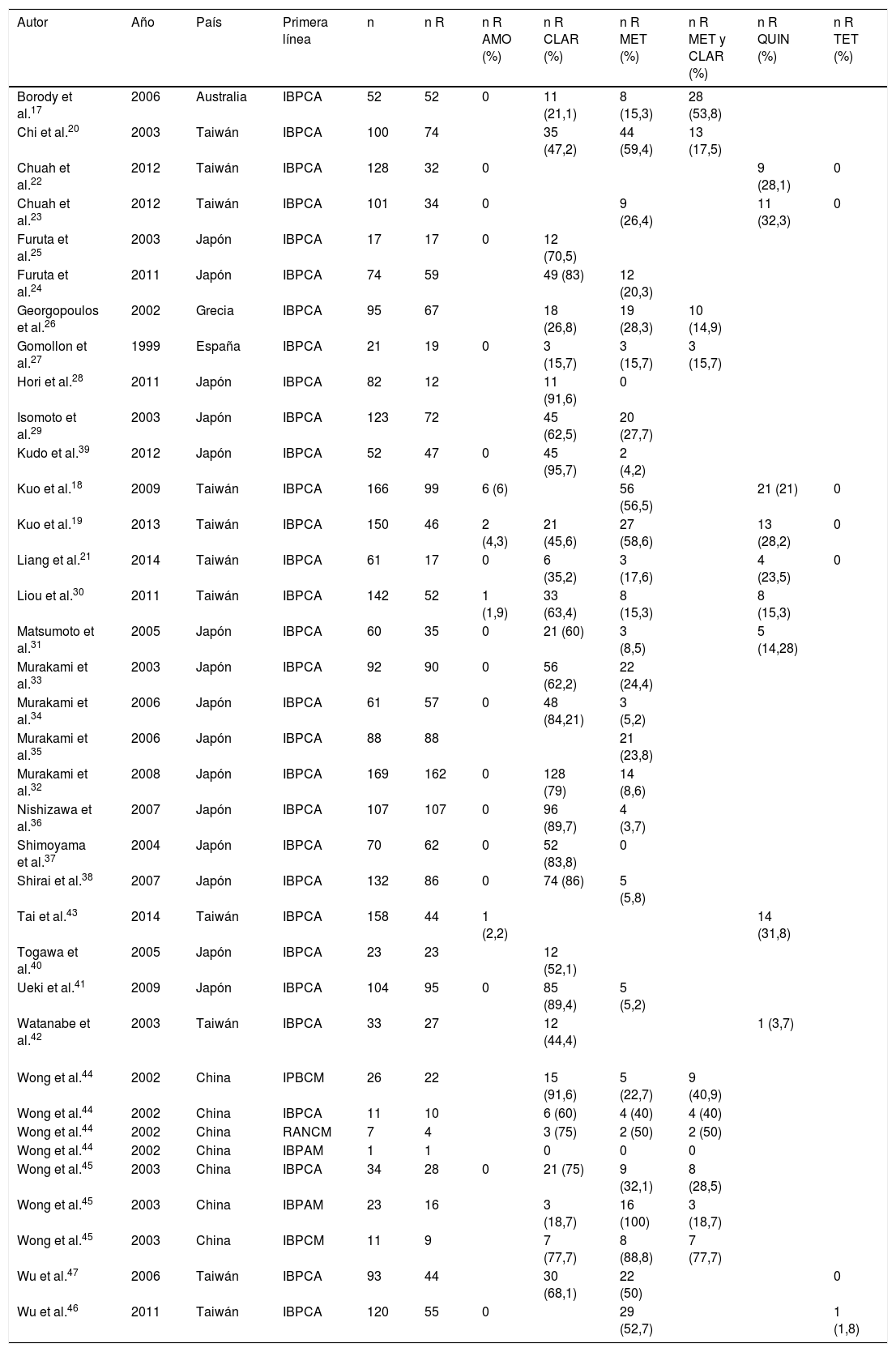
Se analizó la prevalencia de las resistencias secundarias a los diferentes antibióticos:
- a)
Amoxicilina: se analizaron 1.729 pacientes. Solo 10 (0,36%) desarrollaron resistencia secundaria.
- b)
Claritromicina: se obtuvieron 1.747 cultivos para resistencias, de los cuales 1.026 (58,72%) presentaron resistencias a esta.
- c)
Metronidazol: de 68 pacientes evaluados, 61 (89,7%) presentaron resistencia secundaria al fármaco.
- d)
Finalmente, de 35 pacientes que recibieron conjuntamente claritromicina y metronidazol como primera línea de tratamiento, 18 (40,9%) fueron resistentes a ambos antibióticos (tabla 2).
Tabla 2.Artículos incluidos en la revisión. Tratamientos de primera línea recibidos y prevalencia de resistencias secundarias
Autor Año País Primera línea n n R n R
AMO (%)n R
CLAR
(%)n R
MET
(%)n R
MET y CLAR
(%)n R
QUIN
(%)n R
TET
(%)Borody et al.17 2006 Australia IBPCA 52 52 0 11 (21,1) 8 (15,3) 28 (53,8) Chi et al.20 2003 Taiwán IBPCA 100 74 35 (47,2) 44 (59,4) 13 (17,5) Chuah et al.22 2012 Taiwán IBPCA 128 32 0 9 (28,1) 0 Chuah et al.23 2012 Taiwán IBPCA 101 34 0 9 (26,4) 11 (32,3) 0 Furuta et al.25 2003 Japón IBPCA 17 17 0 12 (70,5) Furuta et al.24 2011 Japón IBPCA 74 59 49 (83) 12 (20,3) Georgopoulos et al.26 2002 Grecia IBPCA 95 67 18 (26,8) 19 (28,3) 10 (14,9) Gomollon et al.27 1999 España IBPCA 21 19 0 3 (15,7) 3 (15,7) 3 (15,7) Hori et al.28 2011 Japón IBPCA 82 12 11 (91,6) 0 Isomoto et al.29 2003 Japón IBPCA 123 72 45 (62,5) 20 (27,7) Kudo et al.39 2012 Japón IBPCA 52 47 0 45 (95,7) 2 (4,2) Kuo et al.18 2009 Taiwán IBPCA 166 99 6 (6) 56 (56,5) 21 (21) 0 Kuo et al.19 2013 Taiwán IBPCA 150 46 2 (4,3) 21 (45,6) 27 (58,6) 13 (28,2) 0 Liang et al.21 2014 Taiwán IBPCA 61 17 0 6 (35,2) 3 (17,6) 4 (23,5) 0 Liou et al.30 2011 Taiwán IBPCA 142 52 1 (1,9) 33 (63,4) 8 (15,3) 8 (15,3) Matsumoto et al.31 2005 Japón IBPCA 60 35 0 21 (60) 3 (8,5) 5 (14,28) Murakami et al.33 2003 Japón IBPCA 92 90 0 56 (62,2) 22 (24,4) Murakami et al.34 2006 Japón IBPCA 61 57 0 48 (84,21) 3 (5,2) Murakami et al.35 2006 Japón IBPCA 88 88 21 (23,8) Murakami et al.32 2008 Japón IBPCA 169 162 0 128 (79) 14 (8,6) Nishizawa et al.36 2007 Japón IBPCA 107 107 0 96 (89,7) 4 (3,7) Shimoyama et al.37 2004 Japón IBPCA 70 62 0 52 (83,8) 0 Shirai et al.38 2007 Japón IBPCA 132 86 0 74 (86) 5 (5,8) Tai et al.43 2014 Taiwán IBPCA 158 44 1 (2,2) 14 (31,8) Togawa et al.40 2005 Japón IBPCA 23 23 12 (52,1) Ueki et al.41 2009 Japón IBPCA 104 95 0 85 (89,4) 5 (5,2) Watanabe et al.42 2003 Taiwán IBPCA 33 27 12 (44,4) 1 (3,7) Wong et al.44 2002 China IPBCM 26 22 15 (91,6) 5 (22,7) 9 (40,9) Wong et al.44 2002 China IBPCA 11 10 6 (60) 4 (40) 4 (40) Wong et al.44 2002 China RANCM 7 4 3 (75) 2 (50) 2 (50) Wong et al.44 2002 China IBPAM 1 1 0 0 0 Wong et al.45 2003 China IBPCA 34 28 0 21 (75) 9 (32,1) 8 (28,5) Wong et al.45 2003 China IBPAM 23 16 3 (18,7) 16 (100) 3 (18,7) Wong et al.45 2003 China IBPCM 11 9 7 (77,7) 8 (88,8) 7 (77,7) Wu et al.47 2006 Taiwán IBPCA 93 44 30 (68,1) 22 (50) 0 Wu et al.46 2011 Taiwán IBPCA 120 55 0 29 (52,7) 1 (1,8) AMO:amoxicilina; CLAR: claritromicina; IBPAM: inhibidor de la bomba de protones, amoxicilina y metronidazol; IBPCA: inhibidor de la bomba de protones, claritromicina y amoxicilina; IBPCM: inhibidor de la bomba de protones, claritromicina y metronidazol; MET: metronidazol; QUIN: quinolonas; R: resistentes; RANCM: ranitidina, claritromicina y metronidazol; TET: tetraciclinas.
En nuestra revisión se analizaron también la prevalencia de otros antibióticos no utilizados en el tratamiento de primera línea. Se obtuvo un 4,9% de resistencias a quinolonas y un 0,05% a tetraciclinas. De los pacientes que no recibieron metronidazol (2.719), 405 (14,9%) eran resistentes.
DiscusiónLa OMS ha catalogado H. pylori como una de las infecciones donde la resistencia a los antibióticos es alta y puede representar un problema de salud pública48. Los resultados de nuestra revisión muestran una elevada prevalencia de resistencias secundarias a claritromicina (>50%), valores que coinciden con otros estudios publicados49–52. Las tasas de resistencia secundaria al metronidazol son incluso más elevadas (89,7%). Por el contrario, las resistencias secundarias a amoxicilina son excepcionales. Es interesante destacar que hasta el 40,9% presentan resistencia doble a metronidazol y claritromicina tras el fracaso del tratamiento. Estas cifras coinciden con los datos de estudios previos donde las resistencias secundarias oscilaron entre el 46,9 y 83,3% para claritromicina, el 16,7 y 43,8% para metronidazol y el 16,7 y 50% para quinolonas53.
Se analizaron también la prevalencia de resistencias a otros antibióticos que no fueron administrados como primera línea. Es interesante resaltar que se obtuvieron tasas de resistencia bajas (4,9%) a quinolonas y excepcionales a tetraciclinas (0,05%). En el caso de las quinolonas, esta baja tasa de resistencia podría reflejar tanto una selección de cepas sensibles al antibiótico como una baja prevalencia de base. En el caso de metronidazol la tasa «basal» de resistencia fue del 14,9%, mucho menor que el 89% observado tras el fracaso del tratamiento.
Según nuestro conocimiento, este es el primer estudio que evalúa de manera sistemática la tasas de resistencias secundarias a antibióticos. Llaman la atención los escasos datos disponibles en países occidentales, una de las limitaciones del estudio. Por otro lado, el reducido número de estudios detectados no permite realizar ningún análisis de subgrupos.
Nuestro estudio confirma que es recomendable evitar la readministración de claritromicina tras un primer fracaso de tratamiento erradicador. Por otro lado, los datos sobre metronidazol son más discutibles. Aunque distintos estudios y revisiones evidencian que el tratamiento con metronidazol a dosis altas y durante 10 días o más podría revertir las resistencias in vitro54, un reciente estudio observacional multicéntrico muestra que la repetición del antibiótico se asocia a tasas de curación muy bajas en el contexto del fracaso de un tratamiento con metronidazol previo55.
De los artículos incluidos en nuestra revisión sistemática, un tercio no presentan una adecuada ocultación de la asignación y cegamiento de los investigadores (fig. 2), por lo tanto, el riesgo de sesgo es mayor y los resultados de la revisión sistemática, así como la calidad de los mismos, podrían verse afectados. También hay que destacar que la mayoría de los estudios incluidos se han desarrollado con población asiática, y tan solo 3 en población mediterránea, por lo que la aplicabilidad en la práctica clínica en nuestro medio es menor.
En conclusión, nuestro estudio apunta a que las resistencias secundarias tras un tratamiento inicial a metronidazol y claritromicina son muy elevadas. Por el contrario, las resistencias a amoxicilina son extremadamente raras, incluso después de un fracaso del tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.