La reservoritis es una complicación frecuente en los pacientes con colitis ulcerosa tratados mediante una proctocolectomía total. Consiste en una inflamación inespecífica del reservorio ileo-anal, cuya etiología no se conoce aún por completo. Esta inflamación induce la aparición de síntomas como urgencia, diarrea, rectorragia y dolor abdominal, alterando la calidad de vida de los pacientes que la padecen. Para su diagnóstico, además de los síntomas, es necesario realizar una endoscopia con toma de biopsias. El índice recomendado para valorar su actividad es el Pouchitis Disease Activity Index (PDAI), aunque puede emplearse su forma modificada (PDAIm). De acuerdo con la duración de los síntomas, la reservoritis se clasifica en aguda (< 4 semanas) o crónica (> 4 semanas). Según su curso evolutivo, se clasifica en infrecuente (< 4 episodios/año), recurrente (> 4 episodios/año) o de curso continuo.
Pouchitis is a common complication in ulcerative colitis patients after total proctocolectomy. This is an unspecific inflammation of the ileo-anal pouch, the aetiology of which is not fully known. This inflammation induces the onset of symptoms such as urgency, diarrhoea, rectal bleeding and abdominal pain. Many patients suffering from pouchitis have a lower quality of life. In addition to symptoms, an endoscopy with biopsies is mandatory in order to establish a definite diagnosis. The recommended index to assess its activity is the Pouchitis Disease Activity Index (PDAI), but its modified version (PDAIm) can be used in clinical practice. In accordance with the duration of symptoms, pouchitis can be classified as acute (<4 weeks) or chronic (>4 weeks), and, regarding its course, pouchitis can be infrequent (<4 episodes per year), recurrent (>4 episodes per year) or continuous.
En los últimos años hemos presenciado un cambio drástico en los tratamientos médicos disponibles para el manejo de la colitis ulcerosa (CU). Su objetivo final es el control de la actividad inflamatoria y con ellos se espera restaurar la calidad de vida y llegar a modificar la historia natural de la enfermedad. Esto implica también evitar la cirugía en los pacientes con enfermedad refractaria al tratamiento médico o incluso las complicaciones como el desarrollo de neoplasias a nivel colónico. A pesar de los múltiples avances en el tratamiento médico de la CU en los últimos años, entre el 10 y el 35% de estos pacientes requieren cirugía por respuesta inadecuada al tratamiento o por la presencia de displasia o neoplasia. La proctocolectomía total (realizada en 3tiempos) con anastomosis ileo-anal y creación de un reservorio es el procedimiento quirúrgico de elección1. Este procedimiento se describió en 1978 por el doctor Parks y Nicholls2. El objetivo de esta intervención es resecar el colon, preservando la continencia y evitando una ostomía definitiva. Actualmente, se realiza con más frecuencia en 2tiempos, pero es posible realizarla también en 3. A pesar de que, tras la realización de esta cirugía, un gran número de pacientes mejora su calidad de vida y, como es lógico se reduce el riesgo de neoplasia de colon, no podemos decir que en todos los pacientes una CU operada es una CU «curada». La razón para esta afirmación es que son múltiples la complicaciones que pueden ocurrir tras el procedimiento quirúrgico, incluyendo sepsis, obstrucción por estenosis, incontinencia fecal, isquemia del reservorio, cuffitis o inflamación del manguito rectal, fistulización que puede acompañarse o no de la aparición de una enfermedad de Crohn (EC) de novo o, la más frecuente, reservoritis3.
La reservoritis consiste en una inflamación del reservorio ileo-anal, cuya etiología no se conoce aún por completo. Esta inflamación induce la aparición de síntomas como urgencia, diarrea, rectorragia y dolor abdominal. A pesar de que es una situación frecuente en la práctica habitual, no existen unos criterios definidos para su diagnóstico y correcta clasificación. De todas formas, en los pacientes que presentan síntomas indicativos de esta complicación debe llevarse a cabo un estudio endoscópico para demostrar los cambios inflamatorios endoscópicos o histológicos, sin los cuales no puede establecerse el diagnóstico definitivo de reservoritis.
¿Por qué se realizan los reservorios?La base del tratamiento quirúrgico de la CU es la resección del órgano diana de la enfermedad: el colon y el recto. Esto se traduce en la realización de una proctocolectomía total. Si bien hay autores que defienden la posibilidad de utilizar un procedimiento más conservador, como es la colectomía total con anastomosis ileo-rectal4, esta técnica solo se realiza en un reducido número de pacientes, por el elevado riesgo de que la enfermedad se mantenga activa en el recto. Una vez completada la proctocolectomía total, se puede restaurar el tránsito intestinal de 2maneras: una ileostomía terminal o la realización de una anastomosis ileo-anal en forma de reservorio ileal. Desde hace unas décadas se han publicado numerosos artículos en los que se demuestra que la realización de un reservorio ileal en lugar de una ostomía terminal sería la mejor opción, especialmente en pacientes jóvenes. Los resultados funcionales son en general muy aceptables, con un número de deposiciones cuya media oscila de 4 a 6 durante el día y 1-2 por la noche, urgencia defecatoria prácticamente inexistente y sin los problemas derivados del uso permanente de una ileostomía. Se han diseñado diferentes tipos de reservorios ileales, siendo el más frecuentemente empleado el reservorio en J (doble asa ileal), pero también se puede utilizar en S (triple asa ileal) y en W (cuádruple asa ileal). La indicación del tipo de reservorio dependerá de ciertas variables, como la indicación de la colectomía, la realización de mucosectomía y la posibilidad técnica de llevar a cabo cada uno de ellos según las características del paciente (principalmente, según el índice de masa corporal, la longitud del mesenterio y la histología de las muestras obtenidas previamente). La evidencia ha demostrado que siempre que sea posible se debe realizar, por su simplicidad y buenos resultados, el reservorio en J5.
Los resultados de la proctocolectomía total con reservorio son excelentes y más de un 90% de los pacientes intervenidos con dicha técnica refieren que volverían a operarse al encontrarse mejor que con la CU activa; hay que reconocer y advertir a los pacientes de que esta técnica quirúrgica se ha asociado a unos índices de complicaciones agudas del 28 al 58% y crónicas del 52%6, así como a una cifra de hasta el 15% de fracaso del reservorio7. De todas maneras, en una población generalmente joven, es habitual que los pacientes prefieran la opción de ser tratados con un reservorio ileal y así no ser portadores de una ileostomía definitiva.
¿Es frecuente la reservoritis?La incidencia de la reservoritis varía entre el 7 y el 45% de los pacientes tratados mediante proctocolectomía total con anastomosis ileo-anal y construcción de reservorio6,8. La incidencia anual puede alcanzar un 40%9. Este riesgo parece aumentar progresivamente desde el momento de la intervención, con una prevalencia del 25, el 32%, el 36, el 40 y el 45% tras 1, 2, 3, 4 y 5 años de la intervención, respectivamente8. Este riesgo está aumentado en aquellos pacientes con una colangitis esclerosante primaria (CEP) asociada, en los que puede alcanzar un 80% tras 10 años de la intervención10.
Se ha identificado múltiples factores de riesgo, tanto clínicos, serológicos y endoscópicos, para desarrollar una reservoritis6,11-17. Los principales se enumeran en la tabla 1.
Factores de riesgo para el desarrollo de reservoritis
| Factores de riesgo |
|---|
| CEP |
| No fumadores |
| Consumo de antiinflamatorios no esteroideos |
| Presencia de anticuerpos anticitoplasma de neutrófilos |
| CU extensa previa a la creación del reservorio |
| Ileítis por reflujo |
| Trombocitosis previa a la intervención |
| Coexistencia de otras enfermedades autoinmunes asociadas en el caso del riesgo de reservoritis crónica refractaria a antibióticos |
Por tanto, podemos concluir que la reservoritis es una complicación frecuente, pudiendo ocurrir hasta en un 45% de los pacientes a los 5 años de la cirugía.
¿Cuál es la fisiopatología de la reservoritis?Tras la construcción del reservorio ileal la mucosa adquiere progresivamente un aspecto más parecido al de la mucosa cólica (metaplasia cólica). Este proceso implica el aplanamiento de las vellosidades y la hipertrofia de las criptas. Es habitual, además, encontrar un infiltrado inflamatorio crónico en el reservorio asociado al proceso de metaplasia18,19, pero se considera solo la presencia de reservoritis en el caso de encontrar cambios inflamatorios agudos, como es el infiltrado de polimorfonuclerares20. La etiología exacta de la reservoritis se desconoce, pero, de forma consistente, los estudios que han analizado su etiopatogenia han encontrado alteraciones como la disbiosis o el sobrecrecimiento bacteriano, por lo que la microbiota intestinal parece desempeñar un papel esencial en la aparición de esta complicación20. Estos hallazgos están apoyados por la respuesta a los antibióticos y probióticos, tanto en la reservoritis aguda como crónica, y en el hecho de que la inflamación aparezca principalmente cuando se reconstruye el tránsito intestinal21.
IsquemiaSe ha postulado que puede existir cierto grado de isquemia que puede contribuir a la aparición de la reservoritis. Esta se debe a que se ha observado que el reservorio tiene un menor aporte sanguíneo comparado con el colon en condiciones normales22. A pesar de esto, probablemente la isquemia no sea el mecanismo principal de la reservoritis, ya que el procedimiento es el mismo que se lleva a cabo en los pacientes con poliposis adenomatosa familiar (PAF), con un riesgo muy diferente de aparición de esta complicación entre ambos grupos.
Factores genéticosLa etnia parece que influye también sobre el riesgo de desarrollo de reservoritis, aunque los datos son muy limitados. Tanto los judíos askenazis como los sujetos originarios del sur de Asia parecen tener un riesgo aumentado23. Las asociaciones genéticas más relevantes se han encontrado con variantes de NOD2 (rs2066847, NOD2insC y 1007fsCins), aunque es posible que otros polimorfismos genéticos como IL-1RN*2, IL-1RN*1, TNF*1, ATG16L1, U6, JAK2, TNFSF15, NOD2, S100Z, TLR9 y CD14 influyan también en su patogénesis24-29.
Factores inmunológicosLa inmunidad innata muestra alteraciones que son secundarias posiblemente al aumento de la exposición a antígenos bacterianos, que pueden estar en relación con cambios que se han observado en la secreción de moco intestinal en estos pacientes. Al analizar la expresión genética en reservorios de pacientes con CU y PAF sin signos de inflamación se encontraron importantes diferencias que afectaban principalmente a moléculas involucradas en la respuesta inmunitaria innata30. Entre los posibles genes implicados en la fisiopatología de esta complicación se encuentran la proteína de los cristales de Charcot-Leyden (galectina-10), ITPRIPL2 y COG530.
Se han descrito niveles aumentados de linfocitos CD4+, linfocitos T reguladores CD4+/CD25+y linfocitos CD8+/HLA-DR+en la mucosa del reservorio31. Además, parece que los linfocitos B pueden estar involucrados en su patogénesis, al haberse encontrado también leucocitos CD40+ y CD40L+, así como células plasmáticas CD19+CD138+32,33.
En resumen, en la patogenia de la reservoritis se implica una respuesta inmunitaria alterada del reservorio en sujetos con cierta predisposición genética, pero en la que está estrechamente implicada la microbiota.
¿Cómo se debe diagnosticar una reservoritis?Tras una proctocolectomía total y la reconstrucción de un reservorio, la media de deposiciones en los pacientes sin reservoritis es entre 4 y 8, con alrededor de 700ml de deposiciones semilíquidas por día, cifras muy superiores a la media en los sujetos sanos34. Para establecer el diagnóstico de una reservoritis es necesaria una combinación de síntomas clínicos, hallazgos endoscópicos e histológicos, así como establecer el diagnóstico diferencial con otras entidades que se revisarán más adelante35.
¿Qué síntomas nos deben hacer sospechar una reservoritis?Los síntomas característicos de un paciente con reservoritis son la presencia de diarrea, dolor abdominal, urgencia defecatoria y tenesmo, fiebre, incontinencia y en ocasiones puede acompañarse de manifestaciones extraintestinales36. Cuando los pacientes presentan sangrado rectal, a pesar de que puede estar presente en algunas reservoritis, debemos pensar en una cuffitis o inflamación del rodete del recto remanente tras la cirugía. Estos síntomas, sin embargo, no son específicos de la reservoritis, por lo que es necesaria la presencia de hallazgos endoscópicos e histológicos compatibles para establecer el diagnóstico definitivo y así poder descartar, por ejemplo, un síndrome del reservorio irritable. La gravedad de los síntomas no se correlaciona siempre con el grado de inflamación endoscópica e histológica.
¿Cuál es el papel de la endoscopia en el diagnóstico de la reservoritis?La endoscopia del reservorio es una técnica fundamental para establecer el diagnóstico de una reservoritis. Es básico identificar, describir y documentar en imagen durante la misma todas las estructuras del reservorio: asa aferente y eferente, reservorio, anastomosis y remanente rectal o cuff. Se recomienda que, de forma general, se debe realizar la primera revisión endoscópica a los 6-12 meses del cierre de la ileostomía para evaluar el reservorio con el fin de descartar estenosis y tomar biopsias, examinar ambas asas ileales y la mucosa rectal preservada o cuff en caso de existir. Los hallazgos endoscópicos del paciente con reservoritis incluyen: edema, granularidad, friabilidad, pérdida de patrón vascular, hemorragia y ulceración37.
Se ha de tener en cuenta que la presencia de úlceras de pequeño tamaño en las líneas de sutura es frecuentes y no traduce reservoritis o EC. En los procesos inflamatorios es importante describir la distensibilidad y la extensión de la inflamación, así como la existencia de ileítis prerreservorio, cuffitis, estenosis o fístulas. La distribución de las lesiones en el reservorio nos puede orientar acerca de la etiología de las mismas. Los trastornos autoinmunes y las reservoritis asociadas a IgG4 a menudo presentan un largo segmento inflamado en el asa aferente además de la afectación difusa del reservorio. La distribución asimétrica de la inflamación presente solo en la mitad distal del cuerpo del reservorio con una demarcación marcada con la zona no inflamada es sugestiva de etiología isquémica38.
Se recomienda la toma de entre 4 a 6 biopsias del reservorio, tanto si se observa inflamación macroscópica (de cara a un realizar diagnóstico diferencial) como si no (en formas leves la apariencia endoscópica puede ser normal), y, aunque no hay consenso al respecto, algunos autores también recomiendan realizar 4-6 biopsias del íleon prerreservorio a pesar de que su apariencia endoscópica sea normal. La toma de biopsias permite detectar presencia de granulomas, isquemia, inclusiones por citomegalovirus y displasia, debiéndose evitar biopsiar las úlceras localizadas en las líneas de sutura, dado que los granulomas de cuerpo extraño pueden ser confundidos con datos de EC39.
HistologíaLos hallazgos histológicos más típicos de la reservoritis activa son: inflamación aguda con infiltración de neutrófilos, abscesos crípticos o ulceración mucosa a menudo asociados a cambios crónicos como atrofia vellositaria, distorsión críptica e infiltrado inflamatorio crónico19.
Estudios de laboratorioLos coprocultivos pueden ayudar a la hora de detectar sobreinfecciones como por ejemplo por Clostridium difficile (C. difficile). Por otra parte, el papel de los marcadores fecales como la calprotectina también se ha estudiado como medida para diagnosticar una reservoritis40,41. Por tanto, estos biomarcadores fecales pueden ser útiles en el diagnóstico precoz de la reservoritis, recomendándose su medición anualmente en los pacientes asintomáticos.
¿Qué índice de actividad debemos utilizar?Una vez diagnosticada la reservoritis, para evaluar la respuesta a los tratamientos será necesario conocer y cuantificar la actividad de la enfermedad. El Pouchitis Disease Activity Index (PDAI) es el índice más utilizado en los ensayos clínicos; consiste en una escala numérica que cuantifica la gravedad de la reservoritis y consta de 3subíndices: clínico, endoscópico e histológico42. El diagnóstico de reservoritis se corresponde con una puntuación ≥ 7. El PDAI, sin embargo, no se utiliza habitualmente en la práctica clínica dada la complejidad de su cálculo. Así, para intentar simplificar los cálculos, se ha desarrollado un índice modificado, el mPDAI, que solo incluye criterios clínicos y endoscópicos, con buena correlación con el PDAI, de tal forma que un mPDAI ≥ 5 sería diagnóstico de reservoritis (tabla 2)43.
Pouchitis Disease Activity Index
| Criterios clínicos | Puntuación |
| Número de deposiciones/día por encima de lo habitual | |
| Igual | 0 |
| 1 o 2 | 1 |
| 3 o más | 2 |
| Sangre en heces | |
| No u ocasional | 0 |
| Diaria | 1 |
| Urgencia defecatoria o dolor cólico | |
| Ausente | 0 |
| Ocasional | 1 |
| Habitual | 2 |
| Fiebre (> 38°C) | |
| No | 0 |
| Sí | 1 |
| Criterios endoscópicos | |
| Edema | 1 |
| Granularidad | 1 |
| Friabilidad | 1 |
| Pérdida del patrón vascular | 1 |
| Exudado mucoso | 1 |
| Ulceración | 1 |
| Criterios histológicos | |
| Infiltrado polimorfonuclear | |
| Leve | 1 |
| Moderado+abscesos en criptas | 2 |
| Grave+abscesos en criptas | 3 |
| Úlceras por campo de gran aumento | |
| <25% | 1 |
| 25-50% | 2 |
| > 50% | 3 |
Tomado de Sandborn et al.42.
Podemos concluir que para establecer el diagnóstico de reservoritis se precisa la presencia de síntomas clínicos, hallazgos endoscópicos e histológicos compatibles.
¿Con qué entidades debemos hacer el diagnóstico diferencial de la reservoritis?El diagnóstico de reservoritis con frecuencia no es sencillo, por lo que todos los especialistas involucrados en el manejo de estos pacientes deben ser capaces de reconocer las diferentes entidades que pueden afectar al reservorio y causar una reservoritis. A continuación, se enumeran las que se consideran más importantes:
- –
EC del reservorio.
- –
Reservoritis infecciosa.
- 1.
C. difficile: esta complicación puede ocurrir hasta en un 2,6% de los casos de reservoritis, y el riesgo se encuentra aumentado con respecto a aquellos pacientes con un reservorio indicado por un síndrome polipósico44.
- 2.
Citomegalovirus: considerar especialmente en aquellos pacientes bajo tratamiento inmunosupresor, aunque su frecuencia no sea muy elevada45.
- 3.
Otros microorganismos como Clostridium perfringens, Campylobacter y algunos Enterococcus o Escherichia coli.
- –
Consumo de antiinflamatorios no esteroideos (AINE).
- –
Reservoritis eosinofílica: aunque los eosinófilos se asocian a una respuesta inmunitaria de tipo alérgico o frente a parásitos, en algunos pacientes es posible observar una inflamación en la que predominan los eosinófilos en la mucosa del reservorio en ausencia de otros desencadenantes conocidos.
- –
Reservoritis autoinmune: en aquellos casos de reservoritis crónica refractaria a antibióticos debe realizarse una determinación de IgG4, ya que se han descrito situaciones de inflamación del reservorio que podrían encuadrarse dentro del espectro de la enfermedad asociada a IgG446,47.
- –
Isquemia: es característica la inflamación asimétrica del reservorio y suele asociarse a refractariedad a los antibióticos38. Debe considerarse en pacientes reintervenidos tras la construcción del reservorio y con antecedentes de trombosis portal postoperatoria.
- –
Cuffitis, causada por una inflamación del remanente de mucosa rectal.
- –
Síndrome del reservorio irritable.
- –
Sobrecrecimiento bacteriano.
- –
Estenosis del reservorio.
- –
Dificultad para el vaciado del reservorio.
- –
Disfunción del suelo pélvico.
- –
Síndrome del asa aferente.
- –
Otros síndromes de malabsorción como la enfermedad celíaca o la malabsorción de sales biliares.
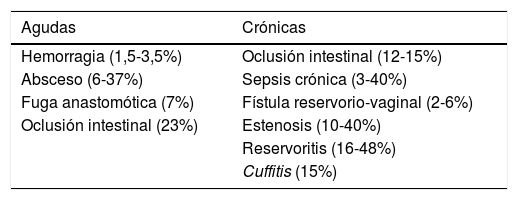
La realización de un reservorio ileal es un procedimiento complejo pero estandarizado. El índice de complicaciones quirúrgicas no es desdeñable (15%)48. Este alto índice de complicaciones puede ser derivado en sí por el procedimiento, quirúrgico, o bien por la propia CU. En cuanto a la complejidad del procedimiento, se pueden mejorar los resultados y disminuir las complicaciones si la cirugía es indicada y realizada por cirujanos entrenados y dedicados a la cirugía colorrectal y con alto volumen de procedimientos por año: por estas razones se recomienda realizarla en centros con un equipo con experiencia en tratamiento de pacientes con enfermedad inflamatoria intestinal. Por otra parte, los resultados a corto y a largo plazo son muy diferentes en pacientes con diagnóstico de base de CU al compararlo con indicaciones no inflamatorias como la PAF49. Las complicaciones del reservorio se pueden dividir en 2grupos: agudas y crónicas (tabla 3).
Complicaciones más frecuentes del reservorio ileal
| Agudas | Crónicas |
|---|---|
| Hemorragia (1,5-3,5%) | Oclusión intestinal (12-15%) |
| Absceso (6-37%) | Sepsis crónica (3-40%) |
| Fuga anastomótica (7%) | Fístula reservorio-vaginal (2-6%) |
| Oclusión intestinal (23%) | Estenosis (10-40%) |
| Reservoritis (16-48%) | |
| Cuffitis (15%) |
Sin duda, las complicaciones sépticas son las más frecuentes en la cirugía del reservorio ileal, excluyendo la reservoritis. Estas complicaciones pueden ser agudas (absceso, fallo de sutura, fístula) o crónicas (fístulas, sinus crónico). En el periodo inmediato, la sepsis aparece entre el 5 y 19% de los pacientes50. La incidencia de complicaciones sépticas aumenta con la presencia de factores de riesgo, como son el diagnóstico de EC, mayor gravedad de la CU, uso de esteroides, tratamiento con biológicos, desnutrición, hipoalbuminemia, anemia, hipoxemia y poca experiencia del cirujano, entre otros51. Siguen siendo motivo de controversia algunos aspectos técnicos en cuanto a su relación con el aumento de la incidencia de complicaciones sépticas: mucosectomía, anastomosis manual vs. mecánica, ileostomía derivativa o intubación del reservorio en el postoperatorio inmediato. Por otra parte, sí que se ha demostrado que la presencia de complicaciones sépticas en el postoperatorio afecta de forma adversa a la función del reservorio a largo plazo, ya sea con o sin fallo final del reservorio52.
¿Cuál es el pronóstico del paciente portador de reservorio?La probabilidad acumulada de fracaso del reservorio y necesidad de ileostomía definitiva y escisión del reservorio oscila entre el 3 y 15% en las grandes series53,54.
Diversos estudios se han focalizado en encontrar los factores de riesgo de mal pronóstico evolutivo de los pacientes portadores de reservorio ileo-anal. Incluso algún grupo, como el de Cleveland, ha creado un nomograma aplicable en práctica clínica para estimar el riesgo de fracaso del reservorio a largo plazo; los factores considerados fueron tabaquismo, duración del reservorio, reservoritis basal y uso pre y postoperatorio de biológicos55.
Otra circunstancia a considerar respecto al pronóstico de los pacientes es la presencia de ileítis prerreservorio. Este hallazgo se ha asociado al diagnóstico de EC del reservorio y este a su vez a riesgo de fracaso del mismo. Esta entidad es infrecuente, afectando a un 6% de los pacientes56. Inicialmente se consideró diagnóstica o factor de riesgo para desarrollo de EC del reservorio; sin embargo, en un estudio de 31 pacientes diagnosticados de ileítis prerreservorio y solo 2 pacientes fueron diagnosticados de EC del reservorio57. En conclusión, esta rara entidad parece asociada a reservoritis, a riesgo de fracaso de reservorio a largo plazo y no tiene por qué ser precursora de EC.
¿Mejora la calidad de vida de los pacientes tras la realización del reservorio?El objetivo de la cirugía en la CU ha evolucionado con el paso del tiempo de reducir la mortalidad a reducir la morbilidad y mejorar la calidad de vida del paciente. No obstante, la realización de una proctocolectomía con reservorio no supone la restauración completa de la función intestinal.
Existen diversos estudios que evalúan los resultados funcionales del reservorio ileo-anal. La frecuencia defecatoria considerada normal en los pacientes con reservorio suele oscilar entre 4-7 deposiciones diurnas y 1-2 nocturnas58. En general, los datos de los estudios publicados concluyen que la función intestinal con el reservorio puede ser adecuada59,60; sin embargo, otros estudios encuentran una incidencia considerable de disfunción intestinal asociada a la creación del reservorio61. Algunos de los factores que se han relacionado con una peor evolución funcional del reservorio son la edad mayor de 50 años, la existencia de manifestaciones extraintestinales, estenosis y dolor anal62. Además, con el paso del tiempo, la posibilidad de incontinencia fecal aumenta hasta acercarse al 21% de afectación nocturna a los 2 años de operar58.
Este tipo de intervención puede asociarse a disfunción sexual y problemas de fertilidad tanto en varones como en mujeres. Se ha descrito la presencia de impotencia y eyaculación retrógrada en el 0-3% de los varones intervenidos63. En las mujeres, la descarga vaginal excesiva (58%), la dispareunia (38%) y la disminución de la propiocepción vaginal (25%) son algunos de los trastornos descritos. Un metaanálisis de complicaciones asociadas al reservorio concluyó que la incidencia global de disfunción sexual era de un 3,6%3.
La infertilidad asociada a la cirugía del reservorio viene determinada por problemas estructurales o funcionales en los órganos reproductivos. Se estima que la posibilidad de embarazo de estas pacientes es un 20% inferior a la de las pacientes con CU que reciben tratamiento médico64; por tanto, este es un aspecto relevante a tratar con las mujeres en edad fértil sin descendencia previamente a la cirugía.
La mayoría de los estudios que valoran calidad de vida tras la cirugía de CU tienen una calidad metodológica moderada o baja. Una revisión al respecto incluyó 33 estudios con un total de 4.790 pacientes y de ellos solo 3 estudios podían considerarse de calidad alta65. La calidad de vida en relación con la salud de los pacientes valorados a los 12 meses de la cirugía mejoró y fue comparable con la de la población general, si bien la heterogeneidad de los estudios fue elevada. Por otra parte, la mayoría de los estudios que valoran la calidad de vida postoperatoria han empleado instrumentos de medición como el SF36. Un estudio dirigido específicamente a valorar calidad de vida halló que un 61% de los pacientes tenían peor calidad de vida que la población general66. Además, encontró que la edad preoperatoria mayor de 35 años fue el mejor predictor de mala calidad de vida tras la cirugía.
Podemos concluir respecto a la calidad de vida que disponemos de datos que apoyan que es similar a la de la población general, pero esto se mantiene solo en los pacientes con una función adecuada del reservorio.
¿Cómo debemos controlar a los pacientes portadores de reservorio?Existen diferentes formas de clasificar la reservoritis en función de diversos parámetros. De acuerdo con la duración de los síntomas, la reservoritis se clasifica en aguda (menos de 4 semanas) y crónica (más de 4 semanas). Según la respuesta a los antibióticos la clasificamos como: sensible a antibióticos, antibiótico-dependiente o antibiótico-refractaria. Según su curso evolutivo, la clasificamos en infrecuente (menos de 4 episodios/año), recurrente (más de 4 episodios/año) o de curso continuo.
La historia natural de la enfermedad es variable. Un 39% de los pacientes que presentan una reservoritis aguda nunca experimentaran recurrencia, mientras que un 61% de los pacientes tendrán al menos una recurrencia36. Se estima que entre un 5-19% de los pacientes con reservoritis aguda desarrollarán reservoritis refractaria o una forma de enfermedad frecuentemente recurrente. En cuanto al seguimiento de los pacientes, debe ser clínico, analítico y endoscópico.
La prueba de laboratorio recomendada para el seguimiento de un paciente con reservorio es la calprotectina fecal, por su valor predictivo, comprobándose su elevación 2 meses antes de la aparición clínica de la reservoritis. En el caso de la calprotectina el punto de corte de 56μg/g mostró una sensibilidad del 100% y especificidad del 84% para predecir reservoritis67.
Sin duda, la endoscopia del reservorio es la técnica de imagen de elección en el seguimiento del paciente con reservorio. Disponemos de datos que muestran una pobre correlación entre los síntomas y los hallazgos endoscópicos e histológicos en los pacientes con reservoritis. Por lo tanto, el seguimiento endoscópico del reservorio también es importante en pacientes asintomáticos; nos permite detectar inflamación mantenida que puede condicionar a largo plazo el fracaso del reservorio68, diagnosticar precozmente reservoritis o EC del reservorio, facilitando la prevención de la progresión a reservoritis crónica o al desarrollo de estenosis o fístulas.
El otro aspecto por el que el seguimiento endoscópico del paciente con reservorio es recomendable es la posibilidad de desarrollo de displasia o neoplasia. Se ha descrito la aparición de adenocarcinoma, mayoritariamente, pero también de linfomas y carcinoma de células escamosas en el reservorio. En la serie de Fazio en Cleveland69, el análisis de seguimiento de 3.707 portadores con reservorio encontró una incidencia de cáncer/displasia del 2,6% (97 pacientes), con una incidencia acumulada de neoplasia a los 5, 10, 15, 20 y 25 años del 0,9, el 1,3, el 1,9, el 4,2 y 5,1%, respectivamente. La localización del adenocarcinoma del reservorio suele ser en la zona de transición anal (65%), y con menos frecuencia en el cuerpo del reservorio (19%), ambos (5%) o en las asas intestinales aferente y eferente (2%). Respecto a la displasia, algunas series describen una prevalencia de un 1,9% en la zona de transición anal y del 4,2% en el cuerpo del reservorio. Este dato llama la atención pues, la zona donde más frecuentemente asientan las neoplasias es en la zona de transición anal. Estos datos sugieren que la displasia del reservorio tiene consecuencias menos claras que la de la zona transicional, siendo además los datos de su prevalencia muy variables entre los distintos estudios70,71.
Se ha discutido si la técnica quirúrgica de la creación del reservorio tiene influencia en el riesgo de desarrollo posterior de neoplasia. La sutura manual con mucosectomía de la zona de transición anal es técnicamente más difícil pero disminuye, sin eliminar completamente, el riesgo de neoplasia. De hecho, el 18% de las neoplasias del reservorio (zona de transición anal) recogidas en una serie tenían historia previa de mucosectomía72. En cuanto a otros factores de riesgo descritos destacan: el diagnóstico preoperatorio de displasia o cáncer asociados a CU, estimándose un aumento de riesgo de cáncer de reservorio de 4,4 y 15 veces, respectivamente, CU de larga evolución (> 10 años), CEP73, historia familiar del cáncer de colon e ileítis por reflujo. Se ha estimado que el riesgo de desarrollar displasia en la zona de transición es el 10% si había displasia y del 25% si había cáncer en la pieza de colectomía74. El diagnóstico de la neoplasia del reservorio se efectúa por reservorioscopia, recomendándose 4-6 biopsias de la zona transicional y 2-6 del asa aferente y del cuerpo del reservorio. La displasia o cáncer puede ser detectada en mucosa plana, lesiones ulceradas o en masas75.
El pronóstico del cáncer de reservorio es en general malo, con una tasa de supervivencia a los 5 años del 49%, lo que apoya la necesidad de seguimiento para intentar diagnosticarlo precozmente. Sin embargo, la prevalencia e incidencia de este tipo de tumores es baja, por lo que algunos autores no están a favor de la vigilancia de rutina en todos los pacientes, sino solo en los pacientes con factores de riesgo. El posicionamiento de distintas sociedades al respecto varía. La Sociedad Británica de Gastroenterología en sus guías publicadas en 2010 considera pacientes de alto riesgo a aquellos con displasia rectal previa, displasia o cáncer en el momento de la cirugía o CEP y para ellos recomienda endoscopia anual; el resto de los pacientes deberían ser revisados endoscópicamente cada 5 años. Las guías ECCO de 2017 estratifican como pacientes de alto riesgo a aquellos con displasia o cáncer en el momento de la cirugía, CEP o reservoritis que no remite, recomendando en estas situaciones vigilancia con endoscopia del reservorio anual; mientras que en los pacientes sin estos factores de riesgo no considera que exista evidencia que apoye el seguimiento endoscópico1.
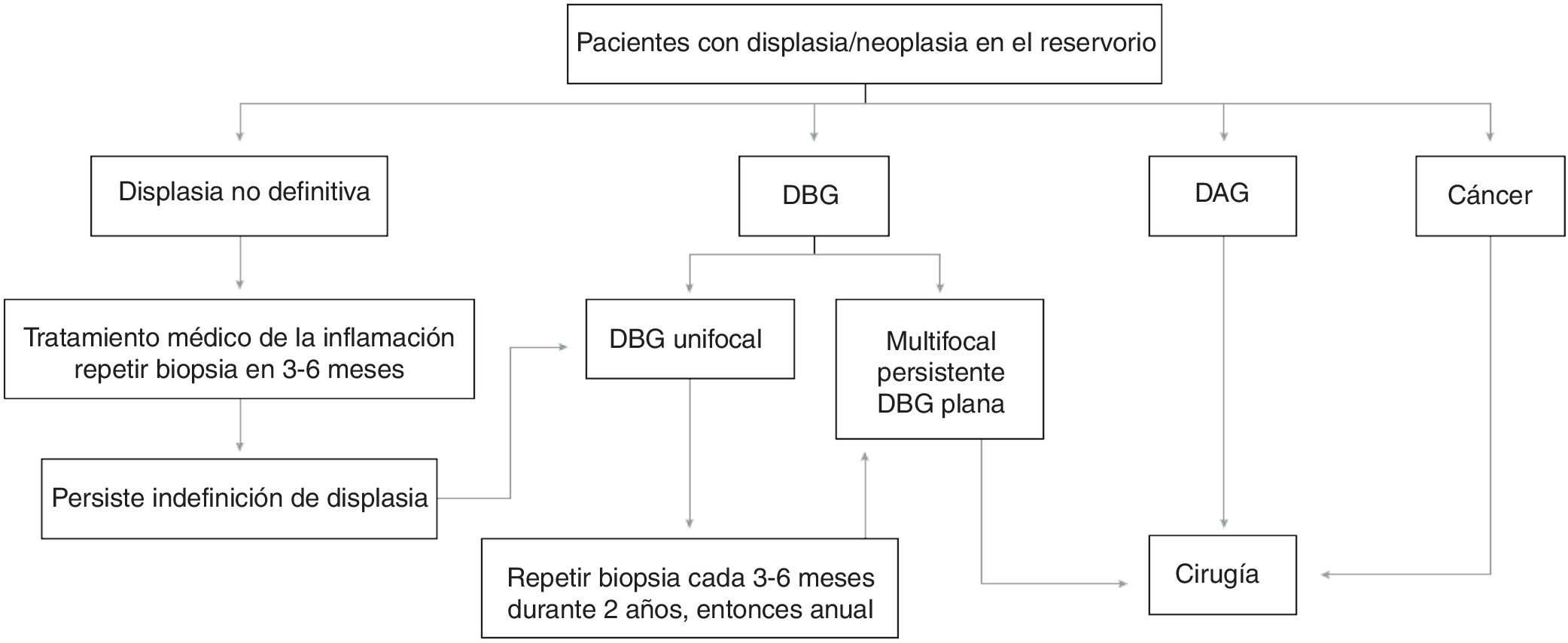
De todo lo anterior podemos concluir que el seguimiento endoscópico en los pacientes portadores de reservorio es recomendable y se debe iniciar a los 10 años del diagnóstico de la CU, independientemente de cuándo se creó el reservorio. Sugerimos que los pacientes de alto riesgo (antecedente de neoplasia o displasia antes de la cirugía) deben ser seguidos endoscópicamente con carácter anual, los de riesgo intermedio (resto de factores de riesgo: reservoritis crónica, cuffitis, CEP, antecedente familiar de neoplasia de colon) entre 1-3 años y los que carecen de factores de riesgo, cada 5 años. En el caso de detección de displasia en las endoscopias del reservorio de control, sugerimos el algoritmo de seguimiento de la figura 1, basado en las recomendaciones del grupo de Cleveland76.
CuffitisLas 2técnicas quirúrgicas empleadas en la creación de un reservorio pueden ser la mucosectomía de la zona de transición anal con sutura manual o la sutura mecánica preservando la zona de transición anal. En esta segunda técnica el remanente rectal o cuff de 1,5 -2cm de epitelio columnar persiste en una localización proximal a la zona de transición anal. Ello implica menor dificultad técnica para el cirujano y mejor funcionalidad para el paciente; sin embargo, conlleva riesgo de desarrollo de inflamación de la zona (cuffitis) o displasia de la mucosa rectal residual o de la zona de transición anal77,78. No obstante, la cuffitis también se ha descrito en pacientes con sutura manual y mucosectomía, dado que es muy difícil asegurar que esta sea completa y no queden islotes residuales de mucosa79.
Por cuffitis, por tanto, entendemos la inflamación o recurrencia de la CU en la mucosa rectal remanente. Algunos pacientes con inflamación endoscópica e histológica en el cuff se hallan asintomáticos. Los síntomas pueden ser superponibles a los de la reservoritis, EC del reservorio o síndrome del reservorio irritable: diarrea, dolor abdominal, urgencia e incontinencia, si bien la hematoquecia es más frecuente en los pacientes con cuffitis80. Además, la cuffitis y reservoritis pueden coexistir en el mismo enfermo. No existen muchos estudios acerca de la incidencia y la prevalencia de esta entidad, si bien alguno de ellos estima su prevalencia en un 7% de los pacientes portadores de reservorio ileo-anal81. El diagnóstico se establece mediante endoscopia e histología, que muestra inflamación de la mucosa rectal residual, con eritema, friabilidad, ulceración, nodularidad e infiltrado neutrofílico. Algunos autores han propuesto un índice de actividad de la cuffitis adaptado del PDAI82.
Conflicto de interesesMBA: asesoramiento científico, soporte para investigación o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
AGC: asesoramiento científico, soporte para investigación o actividades formativas: MSD, Abbvie, Takeda, Janssen, Ferring, Faes Farma, Otsuka Pharmaceutical, Vifor Pharma.
IRL: asesoramiento científico o actividades formativas MSD, Pfizer, Abbvie, Takeda, Janssen, Tillotts Pharma, Shire Pharmaceuticals, Ferring, Dr. Falk Pharma y Otsuka.
IMJ: asesoramiento científico, soporte para investigación o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Biogen, Takeda, Janssen, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
MC: Aasesoramiento científico, soporte para investigación o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Takeda, Janssen, Ferring, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma.
JPG: asesoramiento científico, soporte para investigación o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Roche, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
BB: asesoramiento científico, soporte para investigación o actividades formativas: MSD, Abbvie, Pfizer, Takeda, Ferring, Otsuka, Amgen.
PNM: soporte para investigación o actividades formativas: MSD, Abbvie, Pfizer, Takeda, Janssen, Kern, Faes, Ferring, Tillots, Otsuka.